高产色素和洛伐他汀红曲菌株的筛选、鉴定及发酵条件研究






摘要: 红曲色素(Monascus pigments, MPs)和洛伐他汀(Lovastatin)是两种具有极高营养、保健和药用价值的红曲菌代谢产物,寻找挖掘高产MPs和洛伐他汀的红曲菌,具有重要实践意义。从土样中分离得到红曲菌A1和A2,在对其进行分类鉴定的基础上,采用分光光度法对MPs的色价和洛伐他汀含量进行测定,并通过单因素和正交试验对发酵培养基进行了优化。结果表明:菌株A1和A2隶属于紫色红曲菌(Monascus purpureus)。在基础培养基中,菌株A1和A2的MPs色价分别为3287.11、2561.30 U/g,洛伐他汀含量为31.35、33.74 μg/mL。通过L16(45)正交试验优化培养基,获得产MPs最优配方为乳糖20 g/L、KNO3 5 g/L、KH2PO4 4 g/L、KCl 2 g/L、Na3C6H5O7 2 g/L,产洛伐他汀最优配方为乳糖20 g/L、KNO3 15 g/L、KH2PO4 2 g/L、KCl 6 g/L、Na3C6H5O7 4 g/L。在最优培养基中A1菌株总色价可达15851.98 U/g,提高了3.82倍,洛伐他汀含量为122.96 μg/mL,提高了2.92倍;A2菌株总色价为8933.58 U/g,提高了2.49倍,洛伐他汀含量达198.26 μg/mL,提高了4.88倍。该文为红曲菌资源库提供了优秀潜力菌株,为工业上大规模生产MPs和洛伐他汀奠定了理论基础并提供了实际方案。
关键词: 红曲菌;红曲色素;洛伐他汀;鉴定;发酵条件
中图分类号: Q939.9文献标志码: A文章编号: 1673-3851 (2024)09-0725-09
Research on the screening, identification, and fermentation
conditions of high-yield Monascus strains for
pigments and lovastatin
GAO Ting, REN Keyao, ZHANG Shuting, ZHANG Jingya, ZHAO Hongxin
(a.College of Life Sciences and Medicine; b.Key Laboratory of Plant Secondary Metabolism and
Regulation of Zhejiang Province, Zhejiang Sci-Tech University, Hangzhou 310018, China)Abstract:" Monascus pigments (MPs) and lovastatin are two highly valuable metabolites of Monascus with significant nutritional, healthcare and medicinal benefits, and exploring high-yield Monascus strains for MPs and lovastatin is of significant practical importance. Strains A1 and A2 of Monascus were isolated from soil samples. Based on their classification and identification, spectrophotometry was employed to quantify the pigment value and lovastatin content of MPs and lovastatin. Subsequently, single-factor and orthogonal experiments were conducted to optimize the fermentation medium for these two strains. Results indicated that strains A1 and A2 belonged to Monascus purpureus. In the basal medium, the MPs pigment value produced by strains A1 and A2 reached 3287.11 U/g and 2561.30 U/g, respectively, while lovastatin content was 31.35 μg/mL and 33.74 μg/mL, respectively. The medium was optimized by L16(45) orthogonal experiments, and the optimal medium formulation for MPs production required lactose of 20 g/L, KNO3 of 5 g/L, KH2PO4 of 4 g/L, KCl of 2 g/L, and Na3C6H5O7 of 2 g/L, while the optimal formulation for lovastatin production required lactose of 20 g/L, KNO3 of 15 g/L, KH2PO4 of 2 g/L, KCl of 6 g/L, and Na3C6H5O7 of 4 g/L. In the optimal medium, the MPs pigment value of strain A1 reached 15851.98 U/g, an increase of 3.82 times, and the lovastatin yield was 122.96 μg/mL, an increase of 2.92 times. For strain A2, the MPs pigment value was 8933.58 U/g, an increase of 2.49 times, and the lovastatin yield reached 198.26 μg/mL, an increase of 4.88 times. This study provides potential high-yield strains for the Monascus strain repository and lays a theoretical foundation and offers practical solutions for the industrial-scale dual production of MPs and lovastatin.
Key words: Monascus; Monascus pigment; lovastatin; identification; fermentation condition
0引言
红曲霉(Monascus)又称红曲菌,是重要的药食两用微生物资源之一,该菌的发酵产品——红曲在中国已有近两千年的应用历史[1-2]。红曲菌隶属于真菌门、真子囊菌纲、散囊菌目、红曲科、红曲霉属,是一种典型的丝状真菌,用于生产的主要种类有安卡红曲菌(M.anka)、丛毛红曲菌(M.pilosus)、红色红曲菌(M.ruber)和紫色红曲菌(M.purpureus)[3]。红曲菌可以合成多种对人体有益的次生代谢产物,如红曲色素(M.pigments, MPs)、洛伐他汀(Lovastatin,又名Monacolin K)和γ-氨基丁酸(γ-Aminobutyric acid,GABA)等[4-5]。
MPs是多种聚酮化合物的混合物,主要分为红、橙、黄三类色素[5],已被证明具有多种生物学功能[6]。MPs具有广谱的抗菌活性[7-8]。Tan等[9]发现水溶性天然红曲菌黄色素具有显著改善的抗氧化活性,Choe等[10]通过胺化反应合成了具有抗炎活性的各种橙色色素衍生物;Su等[11]研究发现,红曲黄色素Ankaflavin可以诱导人体的肝癌细胞HepG2和肺癌细胞A549凋亡。因此,MPs不仅仅作为一种着色剂,还拥有多种生物学功能,如抗菌、抗氧化、抗炎以及抗癌作用等,已经在食品、化妆品、医药、纺织、染料、化工等领域被广泛应用[12],是一种极具开发价值的天然色素。
洛伐他汀最初是从红色红曲菌和土曲霉(Aspergillus terreus)代谢产物中分离出来的一种物质,有酸型和内脂型两种结构形态,具有多种对人体有益的功效和作用[13]。红曲菌产生的洛伐他汀具有良好的降胆固醇、降血脂、抗炎和神经保护等作用[14-19],众多体外研究证明,洛伐他汀对结直肠癌、乳腺癌、胃癌和肺癌等种类的癌细胞均展现显著的抑制效果[20-22]。因此,洛伐他汀具有多重功效,除了作为降脂治疗的首选药物,具有较大的潜在价值和良好的应用前景。
近年来,有不少关于红曲菌发酵条件优化的报道,如:蒋冬花等[23]从红曲米中分离筛选得到1株红曲菌,对其进行发酵条件优化,红曲米色价达5340.4 U/g。袁天慧等[24]优化了紫色红曲菌FDSJA-01的液态发酵生产工艺参数,发酵后红、橙、黄色素含量分别为3454.9、3746.7 U/g和3295.8 U/g,分别比优化前提高了4.6、4.7和3.4倍,总色价提高了4.2倍。唐旭等[25]和毛继龙等[26]通过优化液态发酵条件后,洛伐他汀产量分别达到79.83、173.60 mg/L。目前市面上红曲菌发酵生产的MPs和洛伐他汀产量不高,且能够同时高产MPs和洛伐他汀的红曲菌较少。因此,继续寻找在生产应用中性能更好的菌株,并提高其发酵生产水平一直是研究者关注的一个重要研究方向。
本文采用菌落形态观察和ITS rDNA序列分析对分离得到的红曲菌进行分类鉴定,再对筛选出的目标菌株通过单因素和正交试验进行培养基成分的优化,旨在为MPs和洛伐他汀的大规模工业化生产提供优秀菌株和发酵工艺参考。
1材料与方法
1.1材料
1.1.1出发菌种从自然土样中分离得到的4株红曲菌A1、A2、B2和B4,由浙江理工大学微生物实验室保藏。
1.1.2主要培养基配方本文所用部分培养基的配制参考Agboyibor[27]的配方,具体如下:
1.2方法
1.2.1红曲菌的分离纯化将采集的土壤样品通过10倍稀释法梯度稀释后,取100 μL涂布接种于PDA培养基上,30 ℃培养5~7 d,取单菌落经3次纯化得到纯菌株,编号并保存于甘油管中。
1.2.2培养方法液体种子培养:用PDA上培养5~7 d的红曲菌制作浓度控制在107个/mL浓度的孢子悬液,按5%的接种量接种于100 mL/250 mL种子培养基中,置于恒温摇床上,于30 ℃、200 r/min培养3 d。
液体发酵培养:在100 mL三角瓶中装入40 mL发酵培养基和8颗5 mm玻璃珠,按5%的接种量将种子液接入发酵培养基,于30 ℃、200 r/min振荡培养7 d。
1.2.3红曲菌目的菌株的鉴定a)形态特征。将菌接种于PDA培养基,在30 ℃条件下培养5 d,观察菌落特征,包括大小、颜色、表面质地、边缘等。采用载片培养法在30 ℃条件下菌株培养7 d,高倍镜下观察菌株的菌丝、孢子和闭囊壳等结构。
b)ITS 区域序列和系统发育树。将红曲菌接种到种子培养基中30 ℃、200 r/min培养5 d,发酵液经过滤获得菌丝球用液氮冷冻后磨碎。采用真菌DNA试剂盒提取其基因组DNA,再利用真菌通用引物对ITS1和ITS4扩增ITS rDNA基因,送上海生物工程公司测序。最后通过BLAST程序与GenBank核酸数据库分析ITS rDNA序列的同源性,MEGA11构建系统发育树,确定红曲菌目的菌株的分类地位[28]。
1.2.4高产色素红曲菌的筛选
1.2.5高产洛伐他汀红曲菌的筛选 a)洛伐他汀标准曲线的制备:参考文镜等[31]采用的方法配制洛伐他汀标准品溶液,绘制洛伐他汀标准曲线。称取3.2 mg洛伐他汀标准品溶于50.0 mL 70%乙醇,配制成质量浓度为64.0 μg/mL溶液,分别量取0.5、1.0、2.0、3.0、4.0、5.0、6.0、8.0 mL和9.0 mL定容到10.0 mL,使其质量浓度分别为3.2、6.4、12.8、19.2、25.6、32.0、38.4、51.2、57.6 μg/mL和64.0 μg/mL,根据标准曲线方程求出对应ΔA(OD246-OD254)的洛伐他汀含量。
b)洛伐他汀含量测定:采用双波长紫外分光光度法测定洛伐他汀含量[31],具体如下:量取发酵液6.25 mL至50.00 mL离心管中,用70%乙醇定容至25.00 mL,颠倒均匀后置于55 ℃恒温水浴锅中1 h,最后冷却至室温。发酵液经定性滤纸过滤,滤液用70%乙醇稀释适当倍数,并以70%乙醇为对照,用分光光度法在对应波长下测定OD值。
1.2.6单因素优化碳源、氮源和无机盐对色素和洛伐他汀产量的影响
a)碳源。以基础培养基为对照,分别加入质量浓度20 g/L的蔗糖、乳糖、麦芽糖、甘油、淀粉代替基础培养基中的葡萄糖,每个处理设置3个重复,进行液体发酵培养,测定MPs色价和洛伐他汀含量,分析碳源种类对MPs和洛伐他汀合成的影响。确定最优碳源后,采用不同碳源质量浓度的培养基进行液体发酵培养,每个处理设置3个重复,测定MPs色价和洛伐他汀含量,考察碳源质量浓度对MPs和洛伐他汀合成的影响。
1.2.7正交试验通过碳源、氮源和无机盐的单因素试验筛选出最佳碳源、氮源和无机盐,并通过正交试验,确定各因素的最佳配比。正交实验设计表如表1,采用5因素4水平L16(45)的正交表,以总色价和洛伐他汀产量为效应值,每个处理设置3个重复。
1.2.8统计分析所有数据都是以平均值±SD表示3个独立实验的平均值,采用SPSS 26.0软件进行单因素方差ANOVA检验、Duncan检验和LSD检验。当plt;0.05时,差异显著,plt;0.01时,差异为极显著。采用Origin 2022进行作图,ImageJ 进行图片处理。
2结果与讨论
2.1高产色素和洛伐他汀红曲菌的分离纯化与筛选
2.2红曲菌目的菌株的分类鉴定
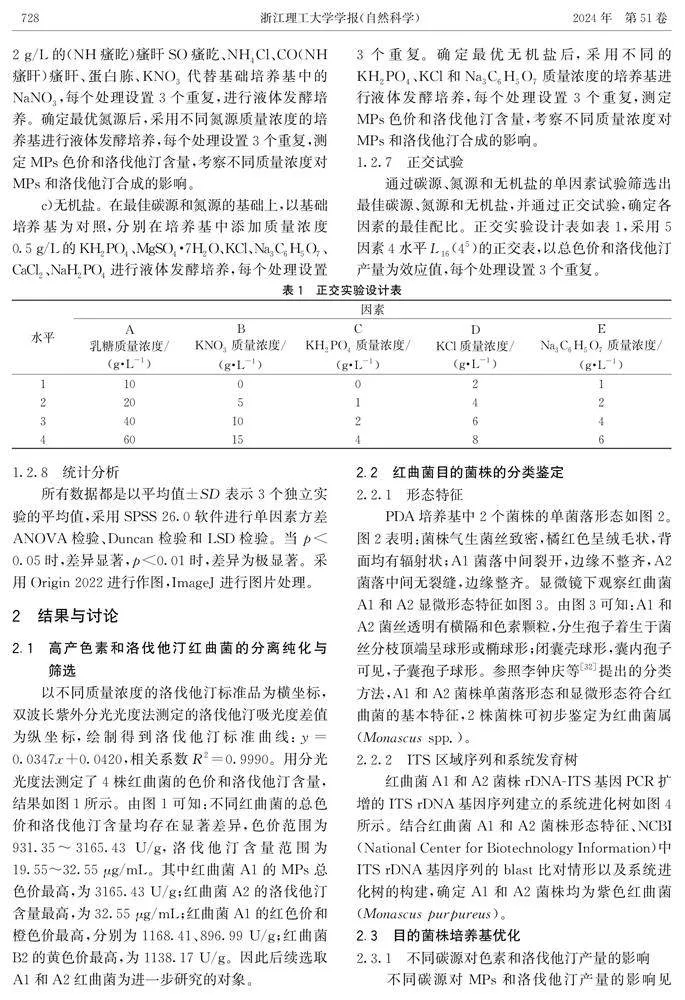
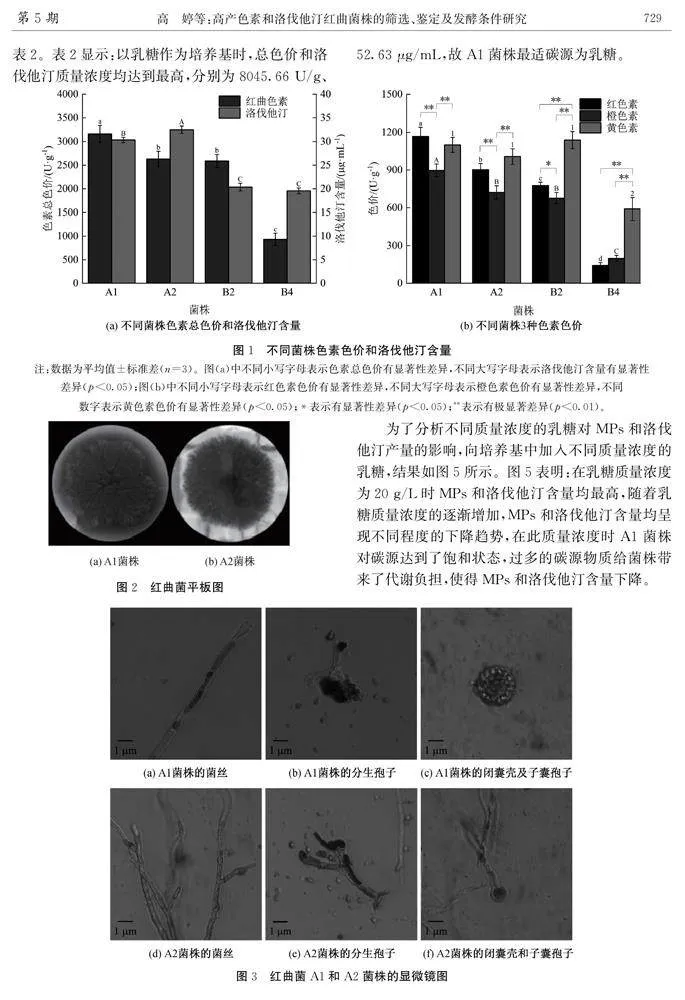
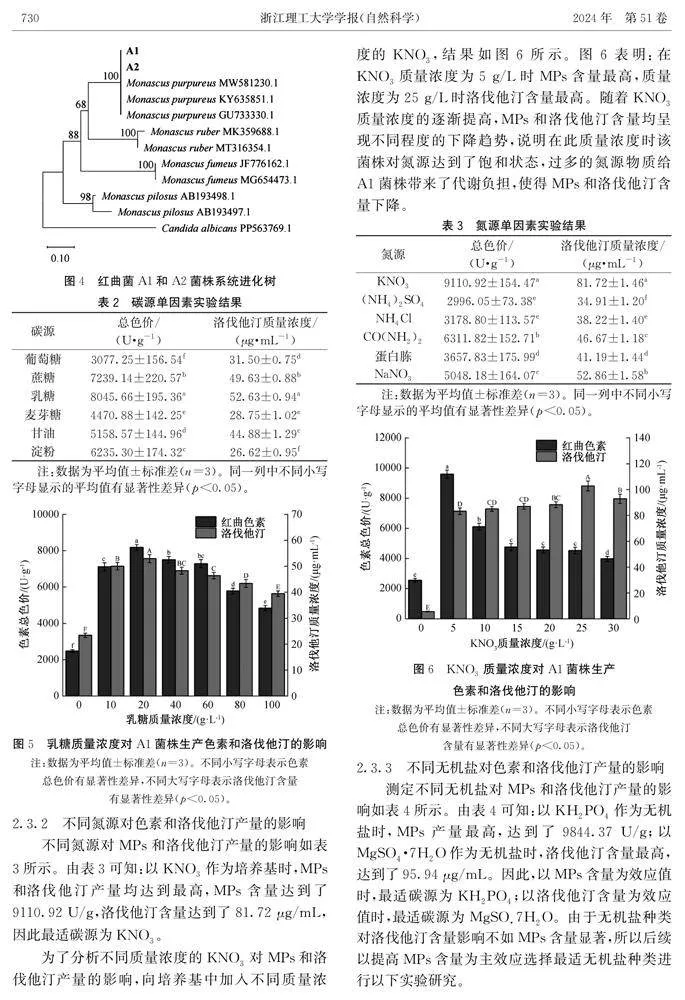
2.2.1形态特征PDA培养基中2个菌株的单菌落形态如图2。图2表明:菌株气生菌丝致密,橘红色呈绒毛状,背面均有辐射状;A1菌落中间裂开,边缘不整齐,A2菌落中间无裂缝,边缘整齐。显微镜下观察红曲菌A1和A2显微形态特征如图3。由图3可知:A1和A2菌丝透明有横隔和色素颗粒,分生孢子着生于菌丝分枝顶端呈球形或椭球形;闭囊壳球形,囊内孢子可见,子囊孢子球形。参照李钟庆等[32]提出的分类方法,A1和A2菌株单菌落形态和显微形态符合红曲菌的基本特征,2株菌株可初步鉴定为红曲菌属(Monascus spp.)。
2.2.2ITS 区域序列和系统发育树红曲菌A1和A2菌株rDNA-ITS基因PCR扩增的ITS rDNA基因序列建立的系统进化树如图4所示。结合红曲菌A1和A2菌株形态特征、NCBI(National Center for Biotechnology Information)中ITS rDNA基因序列的blast比对情形以及系统进化树的构建,确定A1和A2菌株均为紫色红曲菌(Monascus purpureus)。
2.3目的菌株培养基优化
2.3.1不同碳源对色素和洛伐他汀产量的影响不同碳源对MPs和洛伐他汀产量的影响见表2所示。表2显示:以乳糖作为培养基时,总色价和洛伐他汀质量浓度均达到最高,分别为8045.66 U/g、52.63 μg/mL,故A1菌株最适碳源为乳糖。
数字表示黄色素色价有显著性差异(plt;0.05);*表示有显著性差异(plt;0.05);**表示有极显著差异(plt;0.01)。图2红曲菌平板图为了分析不同质量浓度的乳糖对MPs和洛伐他汀产量的影响,向培养基中加入不同质量浓度的乳糖,结果如图5所示。图5表明:在乳糖质量浓度为20 g/L时MPs和洛伐他汀含量均最高,随着乳糖质量浓度的逐渐增加,MPs和洛伐他汀含量均呈现不同程度的下降趋势,在此质量浓度时A1菌株对碳源达到了饱和状态,过多的碳源物质给菌株带来了代谢负担,使得MPs和洛伐他汀含量下降。
2.3.2不同氮源对色素和洛伐他汀产量的影响不同氮源对MPs和洛伐他汀产量的影响如表3所示。由表3可知:以KNO3作为培养基时,MPs和洛伐他汀产量均达到最高,MPs含量达到了9110.92 U/g,洛伐他汀含量达到了81.72 μg/mL,因此最适碳源为KNO3。
为了分析不同质量浓度的KNO3对MPs和洛伐他汀产量的影响,向培养基中加入不同质量浓度的KNO3,结果如图6所示。图6表明:在KNO3质量浓度为5 g/L时MPs含量最高,质量浓度为25 g/L时洛伐他汀含量最高。随着KNO3质量浓度的逐渐提高,MPs和洛伐他汀含量均呈现不同程度的下降趋势,说明在此质量浓度时该菌株对氮源达到了饱和状态,过多的氮源物质给A1菌株带来了代谢负担,使得MPs和洛伐他汀含量下降。
2.3.3不同无机盐对色素和洛伐他汀产量的影响
根据正交试验结果,得出最佳产MPs培养基和产洛伐他汀培养基配方,以基础培养基为对照,进行正交试验验证,试验结果见表6。表6显示:采用色素培养基分别发酵培养A1和A2菌株,总色价分别高达15851.98、11724.07 U/g。其中色素培养基中A1菌株红、橙、黄色价分别为5076.08、4065.81和6710.09 U/g,相比基础培养基A1菌株红、橙、黄色价分别提高了3.08、3.57和4.82倍,总色价提高了3.82倍。色素培养基中A2菌株红、橙、黄色价分别为4663.58、2967.72、4092.77 U/g,相比基础培养基A2菌株红、橙、黄色价分别提高了3.52、3.78和3.51倍,总色价提高了3.58倍。采用他汀培养基分别发酵培养A1和A2菌株,洛伐他汀含量分别高达156.30、198.26 μg/mL。相比基础培养基A1和A2菌株洛伐他汀含量分别提高了3.99、4.88倍。
3结论
本文对自然界中分离获得的红曲新菌株进行了鉴定,并分析了发酵培养基中碳源、氮源、无机盐及其质量浓度对紫色红曲菌产MPs和洛伐他汀的影响,进而对培养基的组分进行了优化,获得产MPs和洛伐他汀最佳培养基配方,主要结论如下:
高产菌株一直是红曲发酵追求的目标,本文结果将为红曲发酵工业提供新的高性价比菌株,为新型食品、保健品和药品的开发提供理论依据。
参考文献:
[1]张婵, 程颖, 秦昱晖, 等. 红曲霉合成莫纳克林K的研究进展[J]. 食品科学技术学报, 2023, 41(5): 24-33.
[2]李牧, 李利, 冯艳丽, 等. 古老而充满魅力的红曲菌[J]. 科学通报, 2023, 68(5): 479-494.
[3]徐晓飞, 何瑞琪, 宗敏华, 等. 红曲霉代谢产物的调控及在酿酒中的应用研究进展[J]. 中国酿造, 2023, 42(4): 8-13.
[4]Shi J, Qin X L, Zhao Y R, et al. Strategies to enhance the production efficiency of Monascus pigments and control citrinin contamination[J]. Process Biochemistry, 2022, 117(6): 19-29.
[5]Feng Y, Shao Y, Chen F. Monascus pigments[J]. Applied Microbiology and Biotechnology, 2012, 96(6): 1421-1440.
[6]Long P C, Zhu L S, Lai H F, et al. Red Pigment Liposomes: Microstructural Characteristics, Stability, and Anticancer Activity[J]. Foods, 2023, 12(3): 447.
[7]El-Sayed E R, Abdelhakim H K, Zakaria Z. Extracellular biosynthesis of cobalt ferrite nanoparticles by and their antioxidant, anticancer and antimicrobial activities: Yield enhancement by gamma irradiation[J]. Materials Science and Engineering C-Materials for Biological Applications, 2020, 107(5):110318.
[8]Kim C, Jung H, Kim Y O, et al. Antimicrobial activities of amino acid derivatives of Monascus pigments[J]. Fems Microbiology Letters, 2006, 264(1): 117-24.
[9]Tan H L, Xing Z Y, Chen G, et al. Evaluating Antitumor and Antioxidant Activities of Yellow Pigments from Fermentation[J]. Molecules, 2018, 23(12): 3242.
[10]Choe D, Song S M, Shin C S, et al. Production and Characterization of Anti-Inflammatory Monascus Pigment Derivatives[J]. Foods, 2020, 9(7): 858.
[11]Su N W, Lin Y L, Lee M H, et al. Ankaflavin from Monascus-fermented red rice exhibits selective cytotoxic effect and induces cell death on Hep G2 cells[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 1949-1954.
[12]He J, Jia M, Li W, et al. Toward improvements for enhancement the productivity and color value of Monascus pigments: A critical review with recent updates[J]. Critical Reviews In Food Science and Nutrition, 2022, 62(26): 7139-7153.
[13]Xiong Z, Cao X, Wen Q, et al. An overview of the bioactivity of monacolin K/lovastatin[J]. Food Chem Toxicol, 2019, 131: 110585.
[14]Liu X, Zeng X, Mahe J, et al. The Effect of Nattokinase-Monascus Supplements on Dyslipidemia: A Four-Month Randomized, Double-Blind, Placebo-Controlled Clinical Trial[J]. Nutrients, 2023, 15(19): 4239.
[15]Endo A. Monacolin K, a new hypocholesterolemic agent produced by a Monascus species[J]. Journal of Antibiotics, 1979, 32(8): 852-854.
[16]丁亚光, 任怀松. 红曲地龙蛋白片对高脂血症大鼠的降脂作用[J]. 工业微生物, 2023, 53(4): 104-106.
[17]王岚. 红曲对高脂大鼠降脂作用的实验研究[J]. 心血管外科杂志, 2019, 8(4): 50-51.
[18]蒋沅岐, 董玉洁, 周福军, 等. 红曲的化学成分、药理作用及临床应用研究进展[J]. 中草药, 2021, 52(23): 7379-7388.
[19]Abdanipour A, Deheshjo F, Sohrabi D, et al. Neuroprotective effect of lovastatin through down-regulation of pro-apoptotic gene expression in rat model pilocarpine epilepsy[J]. Neurological Research, 2018, 40(10): 874-882.
[20]王天莹, 姜瑶, 褚慧, 等. 洛伐他汀肿瘤治疗的研究进展[J]. 中国药剂学杂志, 2019, 17(6): 260-265.
[21]Wang T Y, Jiang Y, Chu H, et al. Doxorubicin and Lovastatin co-delivery liposomes for synergistic therapy of liver cancer[J]. Journal of Drug Delivery Science and Technology, 2019, 52: 452-459.
[22]Zhang K L, Zhu W W, Wang S H, et al. Organ-specific cholesterol metabolic aberration fuels liver metastasis of colorectal cancer[J]. Theranostics, 2021, 11(13): 6560-6572.
[23]蒋冬花, 孙蕾, 陈璨, 等. 高产色素红曲霉菌株的筛选、鉴定和固体发酵条件优化[J]. 浙江农业学报, 2015, 27(9): 1639-1645.
[24]袁天慧, 陈景智, 郭天龙, 等. 红曲色素液态发酵生产工艺研究[J]. 福州大学学报, 2020, 48(5): 667-672.
[25]唐旭, 赵淼, 刘洪, 等. 产洛伐他汀紫红色红曲霉的发酵罐补料液体发酵的研究[J]. 化学研究与应用, 2017, 29(8): 1207-1210.
[26]毛继龙, 张建辉, 王璨, 等. 一株高产洛伐他汀红曲霉的筛选与液态发酵条件优化[J]. 微生物学通报, 2022, 49(6): 2221-2232.
[27]Agboyibor C. 一株紫色红曲霉液态发酵产红曲色素的特性研究[D].兰州: 西北师范大学, 2019: 22-26.
[28]Marey R, 谷佳欢, 许楚旋, 等. 高产色素低产桔霉素红曲霉菌株的筛选、鉴定和抑菌性分析[J]. 湖南农业科学, 2018(1): 1-6.
[29]Zhen Z X, Xiong X Q, Liu Y B, et al. NaCl Inhibits Citrinin and Stimulates Monascus Pigments and Monacolin K Production[J]. Toxins, 2019, 11(2): 118.
[30]黄艳. 红曲菌液态发酵生产红、橙、黄色素的研究[D].无锡: 江南大学, 2014: 10-11.
[31]文镜, 顾晓玲, 常平, 等. 双波长紫外分光光度法测定红曲中洛伐他汀(Lovastatin)的含量[J]. 中国食品添加剂, 2000(4): 11-17.
[32]李钟庆,郭芳. 红曲菌的形态与分类学 [M]. 北京: 中国轻工业出版社, 2003: 12-16.(责任编辑:张会巍)

