猪萨佩罗病毒聚合酶链式反应检测方法的建立及应用



摘要: 猪萨佩罗病毒(Porcine sapelovirus,PSV)是引发猪腹泻的重要病毒之一。为开发一种能快速、准确检测PSV的聚合酶链式反应检测方法,针对PSV的保守区3D基因设计了一对特异性引物,优化了聚合酶链式反应退火温度,分析聚合酶链式反应检测方法特异性和灵敏度,并应用于猪场样品检测。结果表明:建立的聚合酶链式反应检测方法可特异性扩增出PSV目的片段,对其他非靶标猪腹泻病毒则无条带产生,检测低限为5拷贝/μL;在浙江地区采集的88个健康猪粪便样本中检测PSV阳性率为7.95%。该PSV聚合酶链式反应检测方法特异性强、灵敏度高,可应用于PSV前期诊断和防控。
关键词: 猪萨佩罗病毒;3D基因;聚合酶链式反应;特异性;灵敏度;阳性率
中图分类号: TS195.644文献标志码: A文章编号: 1673-3851 (2024)09-0718-07
Establishment and application of a polymerase chain
reaction detection method for porcine sapelovirus
ZHANG Wei, HAN Yinzhuo, JIANG Yonghou
(College of Life Sciences and Medicine, Zhejiang Sci-Tech University, Hangzhou 310018, China)Abstract:" Porcine sapelovirus (PSV) is one of the main viruses that cause diarrhea in pig herds. To establish a fast and accurate polymerase chain reaction (PCR) detection method for PSV, specific primers were designed targeting the 3D conserved region sequence of PSV, and the PCR annealing temperature was optimized. The specificity and sensitivity of the established PCR detection method were analyzed and applied to field samples on pig farms. According to the results, the established PCR detection method could specifically amplify the PSV target virus, while it produced no bands for other non-target pig diarrhea viruses, and the lower detection limit was 5 copies/μL. The positive rate of PSV was 7.95% in 88 healthy pig fecal stool samples collected in Zhejiang province. This PSV PCR detection method demonstrates excellent specificity and sensitivity, and can be applied in the early diagnosis and prevention of PSV.
Key words: porcine sapelovirus; 3D gene; polymerase chain reaction; specificity; sensitivity; positive rate
0引言
猪萨佩罗病毒(Porcine sapelovirus, PSV)是一种微球颗粒小RNA病毒,为萨佩罗病毒属(Sapelovirus)成员[1-2]。因为PSV最早是从腹泻猪的肠道中分离出来,被称作猪肠道病毒8型(Porcine enterovirus 8, PEV8)[1,3]。PSV基因组全长7~8 kb,由5′非编码区、一个大的开放阅读框、3′非编码区组成[2]。开放阅读框主要编码12个成熟的大蛋白[2-3],包括1个先导蛋白(L)、4个结构蛋白(VP1-4)和7个非结构蛋白(2A、2B、2C、3A、3B、3C和3D)。PSV的宿主仅为猪,不同年龄的猪都可感染该病毒[3-4],新生仔猪的免疫系统尚未发育完全,更容易感染PSV[1,3]。猪感染PSV后可能会引起腹泻、肺炎和生殖系统障碍等症状,也可能伴随着无明显特征的亚临床症状。自1960年英国最早报道PSV以来,全球多个地区和国家都有PSV检出报道[5-9],并且PSV常与猪捷申病毒(Porcine teschvoirus, PTV)、猪圆环病毒(Porcine circovirus, PCV)和猪环曲病毒(Porcine torovirus, PToV)等病原混合感染,以致患病猪的临床症状更加复杂,也增大了分类诊断和防控难度[10]。因此,建立一种简便、精准、高效的诊断方法,是预防和控制PSV的主要措施。
PSV诊断方法主要有病毒分离鉴定、免疫荧光法、酶联免疫吸附法、环介导等温扩增技术、聚合酶链式反应扩增技术[11-14]。由于病毒纯化难度大、实验周期长、成本高和传代培养成功率较低,所以病毒分离鉴定不适合用于大规模临床样本诊断检测[15]。免疫荧光法的检测结果可能会受到样品的采集时间、储存和转运等因素的影响,并且该方法存在非特异性染色和耗时长等缺点[16]。酶联免疫吸附法是一种经典的检测方法,但也存在交叉反应污染和耗材昂贵等缺点[17]。环介导等温扩增技术需要高特异性引物,且实验过程中极容易产生气溶胶污染实验环境,从而导致发生假阳性结果,也不适用于大批量样品检测。目前检测猪腹泻病毒最常用的手段是聚合酶链式反应技术,聚合酶链式反应技术主要分为常规聚合酶链式反应和实时荧光定量聚合酶链式反应。与实时荧光定量聚合酶链式反应比较,常规聚合酶链式反应不需要价格高昂的耗材和仪器,可通过琼脂糖凝胶电泳显示结果,更加简便快速低廉[18-19]。关于PSV的常规聚合酶链式反应检测方法已有报道[6,18,20],但检测的灵敏度并不高。
本文针对PSV的保守区3D基因设计特异性引物,探索建立一种特异性好、灵敏性强的常规聚合酶链式反应检测方法,为PSV初期控制和临床检测提供新的技术方法。
1材料与方法
1.1模板与样品来源PSV、PEDV、PTV、PCV2、PToV、PBoV、TGEV、PAstV、RVA病毒和含目的片段的PSV质粒由本实验室保存,88个健康猪粪便样本源于浙江省部分地区的猪场,样品均保存于-80 ℃超低温冰箱。
1.2主要仪器及试剂紫外分光仪Nanodrop 2000、-80 ℃超低温冰箱和聚合酶链式反应仪器(美国Thermo公司)、-25 ℃低温冰箱(南京创维电器公司)、Fresco 21离心机(德国Eppendorf公司)、Adventurer高精度电子天平(上海奥豪斯仪器公司)和PowerPac电泳仪和电泳槽(美国Bio-Rad公司)。
聚合酶链式反应产物纯化回收试剂盒(美国Axygen公司)、琼脂糖(美国Invitrogen公司)、2×Taq Master混合酶和FastPure病毒核酸小型试剂盒(诺唯赞生物科技股份有限公司)、6×甘油凝胶上样缓冲液(生工生物工程(上海)股份有限公司)、cDNA第一链合成试剂盒(碧云天生物科技公司)以及DL1000 DNA Marker和DL2000 DNA Marker(宝日医生物技术(北京)有限公司)。
1.3样品核酸提取称取0.15 g猪粪便样本加入到1.5 mL的1×PBS缓冲液中,振荡搅匀2 min,4 ℃静置10 min,再以12000 r/min离心8 min获得上清液。参照FastPure Viral DNA/RNA小量试剂盒说明书,取200 μL上层清液加入500 μL的Buffer VL,然后用移液枪轻轻混合均匀,转移上述实验的混合液至配套过滤柱中,12000 r/min离心1 min,弃除滤液;加入600 μL的Buffer RW,12000 r/min离心30 s进行洗脱弃滤液;重复上一步洗脱离心弃滤液,随后12000 r/min离心3 min,将过滤柱转移至1.5 mL的专用收集管中,向过滤膜中央加入50 μL DEPC处理的ddH2O,迅速盖上收集管,常温3 min,最后12000 r/min离心90 s洗脱获得病毒核酸。
1.4反转录依照碧云天cDNA第一链合成试剂盒说明书,取5 μL病毒核酸,加入1 μL随机引物和6 μL DEPC处理的ddH2O,用移液枪轻轻混匀后低速离心,65 ℃孵育5 min在聚合酶链式反应仪器进行;结束反应后,静置冰上冷却2~4 min,随后加入4 μL反应Buffer、1 μL的RNase抑制剂、2 μL的dNTP混合物和1 μL碧云天M-MLV反转录酶,混合均匀再微离心;最后放进聚合酶链式反应仪器,通过25 ℃孵育10 min、50 ℃孵育60 min和80 ℃孵育10 min获得病毒cDNA。
1.5引物设计从NCBI(National center for biotechnology information)数据库中下载PSV病毒目前所有的全基因组序列,使用Lasergene 7软件进行序列比对与同源性分析,选出该病毒保守性高的3D基因,采用Primer Premier 5.0软件设计检测病毒的特异性引物。上游引物PSV-F: 5′-TTATTGGTTGCCT-
ATCCYT-3′,下游引物PSV-R: 5′-CYTCATARA-
CCTCCTCACC-3′,目的条带为307 bp,引物合成来自金唯智(苏州)生物公司。
1.6质粒模板定量及稀释待PSV质粒解冻后,使用紫外分光仪Nanodrop 2000测量浓度,根据质粒拷贝数计算方法,将PSV质粒模板浓度调整为5×109拷贝/μL,再以10倍浓度进行梯度稀释,直至稀释为0.5拷贝/μL,稀释后的PSV质粒模板放-25 ℃冰箱保存备用。
1.7聚合酶链式反应优化参考本课题组先前建立的聚合酶链式反应体系和反应参数[21-22],循环数为40次具有较好的扩增效率,后续主要优化反应程序的退火温度(45~70 ℃)。聚合酶链式反应体系为:2×Taq Master混合酶7.5 μL,1.0 μL病毒质粒模板(5×104拷贝/μL),0.5 μL上/下游引物(浓度10 μmol/L),加5.5 μL ddH2O。将混合液用移液枪轻轻混匀后低速离心,反应程序:95 ℃ 3 min;95 ℃ 30 s,45~70 ℃ 30 s,72 ℃ 30 s,40次循环;72 ℃ 5 min,聚合酶链式反应扩增产物通过1.5%琼脂糖凝胶电泳进行分析。
1.8特异性实验分析根据优化后的聚合酶链式反应体系和反应参数,对PSV和非靶标病毒(PEDV、PTV、PCV2、PToV、PBoV、TGEV、PAstV和RVA)进行特异性实验分析,阴性对照用ddH2O作为模板。
1.9灵敏度分析将不同浓度PSV质粒模板(5×10-1~5×106拷贝/μL)分别加入反应体系中,ddH2O为模板用作阴性对照,通过最低检测浓度的结果判断灵敏度。
1.10样品检测应用上述建立的聚合酶链式反应方法检测88个健康猪粪便样本,检测阳性的聚合酶链式反应产物由生工生物工程(上海)股份有限公司测序验证。
2结果与分析2.1退火温度优化对PSV质粒模板(5×104拷贝/μL)进行退火温度优化,结果如图1所示。从图1中可以看出:在45.0~59.9 ℃条件下均能特异性地扩增目的片段产生,而45.0、46.8、49.8 ℃与54.4 ℃温度下目的片段最亮。从引物特异性、灵敏度和二聚体形成等因素考虑,最终选择49.8 ℃作为最佳退火温度。
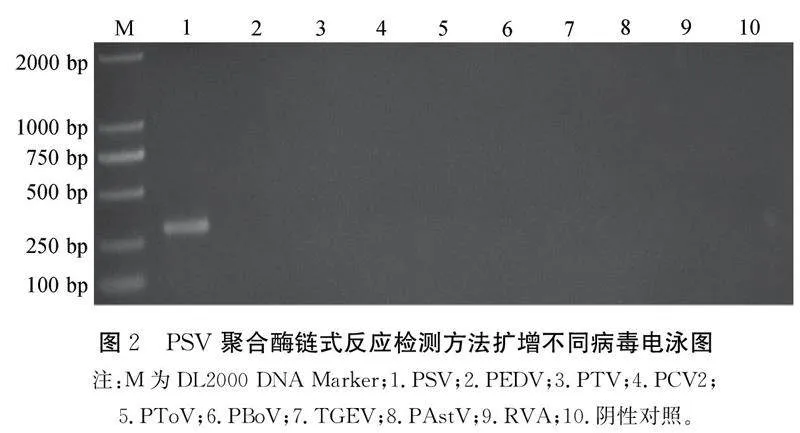
2.2特异性分析根据上述已优化聚合酶链式反应循环参数,分别将PSV质粒、其他非靶标猪腹泻病毒(PEDV、PTV、PCV2、PToV、PBoV、TGEV、PAstV和RVA)和ddH2O作为模板进行反应,检测PSV聚合酶链式反应方法的特异性(见图2)。图2显示:以PSV质粒为模板可扩增出清晰单一的目的条带,而另外8种非靶标猪腹泻病毒(PEDV、PTV、PCV2、PToV、PBoV、TGEV、PAstV和RVA)和ddH2O中均无条带产生,表明建立的PSV聚合酶链式反应方法具有良好的特异性。
2.3灵敏性分析将不同浓度(5×10-1~5×106拷贝/μL)的PSV质粒作为模板,按照优化的聚合酶链式反应条件进行扩增,通过凝胶成像结果判断最低检测浓度,结果如图3所示。由图3可知:目的片段的亮度随着PSV质粒模板浓度的降低而逐渐减弱,检测低限为5拷贝/μL,条带清晰单一且阴性对照中无条带产生,表明建立的PSV聚合酶链式反应方法灵敏性较高。
2.4样品检测利用上述建立的PSV聚合酶链式反应方法对88个健康猪粪便样品cDNA进行检测,通过琼脂糖凝胶电泳结果判断是否为PSV阳性(见图4)。图4表明:从88个样品中共检出7个阳性,阳性率为7.95%;7个阳性样品的聚合酶链式反应扩增产物测序验证,经BLAST对比均为PSV病毒的靶标序列。
3讨论
PSV是一种可引起猪腹泻的主要猪肠道病毒,常与其他猪腹泻病毒混合感染,导致感染猪的临床症状较为复杂;而且,怀孕母猪一旦感染该病毒可能导致胎儿流产或产下死胎,对养殖业危害较大[11]。因此,本文针对PSV建立了快捷高效、准确可靠、成本低廉的聚合酶链式反应检测方法,对PSV早期临床诊断具有重要意义。
引物设计对聚合酶链式反应检测方法的建立极其重要,往往可以决定该方法的特异性、灵敏性和广泛适用性。近年来,随着越来越多的PSV变异株序列被发现公开[5,23-24],早期针对PSV检测的引物可能存在扩增效率或灵敏度不高的情况。本文建立了一种可检测高变异株在内的高特异性PSV聚合酶链式反应方法,首先根据已报道的PSV全基因组序列,通过对PSV全基因组序列比对与同源性分析,选择保守性高的3D基因序列设计一对特异性引物,并针对个别多态性位点进行了简并碱基处理,理论上可检测所有已知的PSV;同时优化了退火温度。本文建立的聚合酶链式反应方法可特异性扩增PSV,产生清晰单一的目的条带,并且对非靶标猪腹泻病毒(PEDV、PTV、PCV2、PToV、PBoV、TGEV、PAstV和RVA)未产生交叉反应。该检测方法灵敏性较强,检测最低极限为5拷贝/μL,高于杨涛涛[25]建立的PSV常规聚合酶链式反应和李倩倩等[11]建立的TaqMan实时荧光定量聚合酶链式反应灵敏度(分别为58.9拷贝/μL和38.8拷贝/μL),远高于孙杰等[18]和Wang等[26]建立的PSV常规聚合酶链式反应灵敏度(4×103拷贝/μL和103拷贝/μL),略高于张路文[27]和Wang等[26]分别建立的SYBR Green Ⅰ荧光定量聚合酶链式反应(13.4拷贝/μL和10拷贝/μL)。
近年来,PSV在腹泻猪群中的阳性检出率高达17.7%~34.0%[19,28-30],已成为导致猪群腹泻的重要病毒之一。此外,也有不少关于健康猪群中检出PSV的报道。兰道亮等[31]检测了中国华东地区的960个健康猪粪便样本,PSV阳性率为17.2%。杨涛涛[25]对湖南地区362头健康猪的临床样品进行PSV检测,发现阳性率为19.06%。张备等[20]对国内部分省市的42个健康猪粪便样本进行检测,PSV阳性率为2.38%。Buitrago等[9]对西班牙206份健康猪粪便样品进行检测,PSV阳性率为9%。采用本文建立的PSV聚合酶链式反应方法检测浙江地区采集的88个健康猪粪便样本,发现健康猪群中PSV的阳性率为7.95%,腹泻猪群和健康猪群均可出现PSV感染,并且健康猪群中的PSV阳性率并不低;这需要引起重视,及早进行诊断与防控。
4结论
本文针对PSV保守性高的3D基因建立了一种聚合酶链式反应检测方法,分析了该方法的特异性和灵敏度,应用该方法检测了浙江地区的88个健康猪粪便样本,并对比分析了其他地区的腹泻猪群或健康猪群中PSV感染情况,为PSV流行病学调查研究提供了技术借鉴,主要结论如下:
a)该方法可特异性扩增PSV,最低极限为5拷贝/μL,灵敏度远高于报道的PSV常规聚合酶链式反应,可用于检测早期低浓度样品中的PSV。
b)PSV不仅在腹泻猪群中的阳性检出率较高,而且某些地区健康猪群中的阳性检出率也较高。
参考文献:
[1]Tseng C H, Tsai H J. Sequence analysis of a duck picornavirus isolate indicates that it together with porcine enterovirus type 8 and simian picornavirus type 2 should be assigned to a new picornavirus genus[J]. Virus Research, 2007, 129(2): 104-114.
[2]Ibrahim Y M, Zhang W, Werid G M, et al. Isolation, characterization, and molecular detection of porcine sapelovirus[J]. Viruses, 2022, 14(2): 349.
[3]Prodělalov J. The survey of porcine teschoviruses, sapeloviruses and enteroviruses B infecting domestic pigs and wild boars in the Czech Republic between 2005 and 2011[J]. Infection, Genetics and Evolution, 2012, 12(7): 1447-1451.
[4]Arruda P H, Arruda B L, Schwartz K J, et al. Detection of a novel sapelovirus in central nervous tissue of pigs with polioencephalomyelitis in the USA[J]. Transboundary and Emerging Diseases, 2017, 64(2): 311-315.
[5]Chen Q Y, Sun Z H, Che Y L, et al. High prevalence, genetic diversity, and recombination of porcine sapelovirus in pig farms in Fujian, southern China[J]. Viruses, 2023, 15(8): 1751.
[6]Chelli E, De Sabato L, Vaccari G, et al. Detection and characterization of porcine sapelovirus in Italian pig farms[J]. Animals (Basel), 2020, 10(6): 966.
[7]Li Y, Du L, Jin T, et al. Characterization and epidemiological survey of porcine sapelovirus in China[J]. Veterinary Microbiology, 2019, 232: 13-21.
[8]Lan D, Ji W, Yang S, et al. Isolation and characterization of the first Chinese porcine sapelovirus strain[J]. Archives of Virology, 2011, 156(9): 1567-1574.
[9]Buitrago D, Cano-Gmez C, Agüero M, et al. A survey of porcine picornaviruses and adenoviruses in fecal samples in Spain[J]. Journal of Veterinary Diagnostic Investigation, 2010, 22(5): 763-766.
[10]赵婷婷, 李晶娇, 沈小娟, 等. 猪萨佩罗病毒研究进展[J]. 上海交通大学学报(农业科学版), 2017, 35(6): 62-66.
[11]李倩倩, 赵福杰, 丁庆文, 等. 猪萨佩罗病毒TaqMan实时荧光定量PCR检测方法的建立[J]. 西北农林科技大学学报(自然科学版), 2021, 49(11): 10-16.
[12]李娜娜, 陶洁, 李本强, 等. 猪萨佩罗病毒VP1蛋白的原核表达及其间接ELISA方法的建立[J]. 中国兽医科学, 2021, 51(4): 435-440.
[13]彭旺. 猪萨佩罗病毒抗体检测方法的建立与初步应用[D]. 长沙: 湖南农业大学, 2017: 27-53.
[14]彭旺, 唐小明, 葛猛, 等. 猪萨佩罗病毒间接免疫荧光方法的建立与初步应用[J]. 湖南农业大学学报(自然科学版), 2017, 43(4): 423-426.
[15]Chen Q, Li G W, Stasko J, et al. Isolation and characterization of porcine epidemic diarrhea viruses associated with the 2013 disease outbreak among swine in the United States[J]. Journal of Clinical Microbiology, 2014, 52(1): 234-243.
[16]Duan Y, Miao L, Ye H, et al. A faster immunofluorescence assay for tracking infection progress of human cytomegalovirus[J]. Acta Biochimica et Biophysica Sinica, 2012, 44(7): 597-605.
[17]Soltan M A, Tsai Y-L, Lee P-Y A, et al. Comparison of electron microscopy, ELISA, real time RT-PCR and insulated isothermal RT-PCR for the detection of Rotavirus group A (RVA) in feces of different animal species[J]. Journal of Virological Methods, 2016, 235: 99-104.
[18]孙杰, 刘畅, 朱琳, 等. 猪萨佩罗病毒RT-PCR检测方法的建立与应用[J]. 畜牧与兽医, 2018, 50(7): 118-121.
[19]丁庆文, 闫晓光, 张红垒, 等. 猪δ冠状病毒、猪流行性腹泻病毒和猪萨佩罗病毒多重RT-PCR检测方法的建立及初步临床应用[J]. 中国预防兽医学报, 2021, 43(6): 615-620.
[20]张备, 李春秋, 苏明俊, 等. 中国几省市猪萨佩罗病毒巢式RT-PCR检测与遗传进化分析[J]. 黑龙江八一农垦大学学报, 2019, 31(3): 32-37.
[21]刘芹, 张秋桠, 姜永厚. 白斑综合征病毒PCR检测方法的建立及初步应用[J]. 浙江理工大学学报(自然科学), 2023, 49(5): 645-650.
[22]张秋桠, 刘高鹏, 刘芹, 等. 猪流行性腹泻病毒RT-PCR检测方法的建立[J]. 浙江理工大学学报(自然科学), 2022, 47(4): 629-634.
[23]Ibrahim Y M, Zhang W, Wang X, et al. Molecular characterization and pathogenicity evaluation of enterovirus G isolated from diarrheic piglets[J]. Microbiology Spectrum, 2023, 11(6): e0264323.
[24]Li C, Lu H, Geng C, et al. Epidemic and evolutionary characteristics of swine enteric viruses in South-Central China from 2018 to 2021[J]. Viruses, 2022, 14(7): 1420.
[25]杨涛涛. 湖南地区猪捷申病毒和猪萨佩罗病毒的分子流行病学和基因特性研究[D]. 长沙: 湖南农业大学, 2018: 15-39.
[26]Wang C, Yu D, Cui L, et al. Rapid and real-time detection of porcine sapelovirus by reverse transcription loop-mediated isothermal amplification assay[J]. Journal of Virological Methods, 2014, 203: 5-8.
[27]张路文. 猪萨佩罗病毒四川株CHN-SCMY-2021的分离鉴定及荧光定量PCR方法建立[D]. 成都: 四川农业大学, 2022: 34-45.
[28]Son K Y, Kim D S, Matthijnssens J, et al. Molecular epidemiology of Korean porcine sapeloviruses[J]. Archives of Virology, 2014, 159(5): 1175-1180.
[29]李雨濛, 郭博, 徐逸飞, 等. 四川省腹泻病猪的猪萨佩罗病毒检测及1B基因序列比较分析[J]. 浙江农业学报, 2016, 28(12): 1992-1999.
[30]李本强, 刘惠莉, 刘佳佳, 等. 上海地区猪萨佩罗病毒的检测及遗传进化分析[J]. 上海农业学报, 2023, 39(2): 64-70.
[31]兰道亮, 吉文汇, 王长松, 等. 华东部分地区猪群中猪萨佩罗病毒分子流行病学调查[J]. 动物医学进展, 2012, 33(12): 116-121.
(责任编辑:张会巍)

