胰体尾切除术后胰漏风险预测模型的构建及验证

Construction and validation of a risk prediction model for postoperative pancreatic fistula after distal pancreatectomy
Abstract" Objective:To explore the risk factors of postoperative pancreatic fistula(POPF) after distal pancreatectomy(DP), and to establish a risk prediction model.Methods:Clinical data of 366 patients who underwent DP in the pancreatic cancer department, Tianjin Medical University Cancer Institute and Hospital from March 2020 to September 2022 were collected retrospectively, and were randomly assigned to a training group (n=276) and a verification group (n=90) according to the ratio of 3∶1.Firstly, based on the training group, the risk factors of POPF were screened through multivariate Logistic regression, and Nomogram was constructed.Then, the discrimination, calibration and clinical applicability of the model were tested by the training group and the verification group.Results:Among the 276 cases in the training group, 61 had POPF, the incidence rate was 22.1%. The results of multivariate Logistic regression showed that male,preoperative haemoglobin≥133.5 g/L, open surgery, intraoperative radiotherapy, operation time≥237.5 min, drain fluid amylase on postoperative day 1 (DFA1)≥2 424.0 U/L were influencing factors for POPF after DP. According to the multivariate Logistic regression, the Nomogram prediction model was constructed. The AUC of ROC in the training group and the verification group were 0.791(95%CI 0.725⁃0.858) and 0.755(95%CI 0.637⁃0.872), respectively. The clinical decision curve showed that the threshold probability interval of the maximum net benefit value of the POPF predicted by the model in the training group and the verification group were 7%⁃70% and 6%⁃61%,respectively.Conclusions:Male, preoperative haemoglobin≥133.5 g/L, open surgery, intraoperative radiotherapy,operation time≥237.5 min, DFA1≥2 424 U/L were risk factors for POPF after DP. The Nomogram constructed based on the above variables can provide reference for clinical prevention of POPF.
Keywords""" distal pancreatectomy, DP; postoperative pancreatic fistula, POPF; risk factors; prediction model; Nomogram
摘要" 目的:探讨胰体尾切除术后病人发生术后胰漏的风险因素,并构建风险预测模型。方法:回顾性分析2020年3月—2022年9月在天津医科大学肿瘤医院胰腺肿瘤科行胰体尾切除术366例病人的临床资料,并按照3∶1的比例分为建模集(276例)和验证集(90例)。基于建模集分析术后胰漏的风险因素并绘制列线图,再利用建模集和验证集对模型的区分度、准确度和临床实用性进行分析。结果:建模集276例病人中61例发生术后胰漏,发生率为22.1%。多因素Logistic回归分析显示,男性、术前血红蛋白≥133.5 g/L、开腹手术、术中放疗、手术时间≥237.5 min、术后第1天腹腔引流液淀粉酶浓度(DFA1)≥2 424.0 U/L是发生术后胰漏的影响因素,利用上述变量绘制列线图。建模集和验证集受试者工作特征曲线下面积分别为0.791[95%CI(0.725,0.858)]和0.755[95%CI(0.637,0.872)]。决策曲线分析显示,建模集和验证集中模型预测术后胰漏的最大净获益值阈值概率区间分别为7%~70%和6%~61%。结论:男性、术前血红蛋白≥133.5 g/L、开腹手术、术中放疗、手术时间≥237.5 min、DFA1≥2 424.0 U/L为胰体尾切除术后病人发生术后胰漏的风险因素,基于上述变量构建的预测模型可为临床预防术后胰漏提供参考。
关键词" 胰体尾切除术;术后胰漏;影响因素;预测模型;列线图
doi:10.12102/j.issn.1009-6493.2024.17.005
胰体尾切除术(distal pancreatectomy,DP)是目前治疗胰腺体尾部肿瘤的常见术式。随着诊疗技术的不断进步,其术后死亡率已降低至3.0%~3.9%[1⁃2],但术后并发症发生率仍高达72.6%[3],其中术后胰漏(postoperative pancreatic fistula,POPF)是最常见的并发症之一,发生率高达34.3%[4]。POPF的发生不仅会增加术后管理难度,延长术后住院时间,严重者甚至危及病人生命。因此,筛选POPF的风险因素,早期识别高危病人,积极采取预防措施,降低POPF的发生风险对病人的术后康复具有重要的临床意义。本研究旨在通过收集病人术前、术中及术后第1天的相关资料筛选POPF发生的风险因素,并建立临床预测模型识别POPF的高危病人,为胰体尾切除术病人术后管理提供决策参考。
1" 资料与方法
1.1 临床资料
回顾性分析2020年3月—2022年9月天津医科大学肿瘤医院胰腺肿瘤科收治的366例行胰体尾切除术病人的临床资料。通过SPSS 26.0软件使用随机抽样的方法将病人按照3∶1的比例分为建模集(276例)和验证集(90例)。纳入标准:年龄≥18岁;经影像学评估诊断为胰腺体尾部占位;行择期胰体尾切除术。排除标准:既往有胰腺手术史;主要数据缺失。本研究已通过天津医科大学肿瘤医院伦理委员会审批(审批号:bc2022255)。
1.2 术后胰漏的定义及诊断标准
本研究采用国际胰腺外科研究组2016年修订的定义和诊断标准[5]。定义:胰漏是术后第3天或以后腹腔引流液淀粉酶值超过正常上限的3倍,同时出现了相关的临床症状,且进行了积极治疗。诊断标准:1)生化漏,术后第3天或以后腹腔引流液淀粉酶值超过正常上限的3倍即可诊断。2)B级漏,在生化漏的基础上出现相关的临床症状,并且需要更改治疗方案,即出现以下情况之一可诊断:a)腹腔引流管留置时间超过3周;b)因胰瘘而更改了临床治疗方案;c)胰瘘需经皮或内镜穿刺引流;d)胰瘘相关出血,需介入治疗止血;e)胰瘘导致感染,但无脏器功能衰竭。3)C级漏,需手术处理或导致病人脏器功能衰竭或死亡的胰漏均可诊断。本研究中将B级漏和C级漏纳入胰漏组,将生化漏纳入非胰漏组。
1.3 观察指标
在既往研究和专家经验的基础上,通过电子病历系统收集病人的资料。1)基本资料:性别、年龄、体质指数(body mass index,BMI)、糖尿病病史、高血压病史。2)术前资料:中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血红蛋白、胆碱酯酶、预后营养指数(prognostic nutritional index,PNI)、病理诊断。3)术中资料:手术方式、肿瘤最大径、术中是否放疗、术中是否输血、胰腺断端处理方法、主胰管是否结扎、是否联合切除脾脏、是否联合其他脏器切除、手术时间、术中失血量、是否淋巴扩大清扫。4)术后第1天资料:总胆红素、肌酐、胆碱酯酶、NLR、腹腔引流管引流量、腹腔引流液淀粉酶浓度(drain fluid amylase on postoperative day 1,DFA1)、白蛋白差异(术前白蛋白水平减去术后第1天白蛋白水平)。
1.4 统计学处理
采用SPSS 26.0及Stata 15.0对数据进行统计分析。定量资料采用Kolmogorov⁃Smimovz进行正态性检验,对服从正态分布的定量资料采用均数±标准差(x±s)描述,两组间比较采用两独立样本t检验;不服从正态分布的定量资料采用中位数、四分位数[M(P25,P75)]描述,组间比较采用Mann⁃Whitney 秩和检验。定性资料采用例数、百分比(%)描述,组间比较采用χ2检验或Fisher确切概率法。单因素分析中Plt;0.10的指标纳入多因素Logistic回归分析,定量资料通过基于最大Youden指数的受试者工作特征曲线(receiver operating characteristic curve,ROC)确定最佳界值而转化为定性资料。根据多因素分析结果绘制列线图预测模型,并用ROC曲线下面积(area under curve,AUC)检验模型的区分度;用Hosmer⁃Lemeshow检验评估模型的校准度,用决策曲线分析(decision curve analysis,DCA)检验模型的临床实用性。
2" 结果
2.1 POPF的发生情况
本研究共纳入276例病人,其中非胰漏组215例,胰漏组61例(均为B级漏),胰漏发生率为22.1%。61例POPF病人经积极、有效的临床治疗,均顺利康复出院。
2.2 发生POPF的风险因素
2.2.1 单因素分析
单因素分析结果显示,两组性别、术前血红蛋白、病理诊断、手术方式、术中放疗、手术时间、淋巴扩大清扫、术后第1天肌酐、DFA1比较差异均有统计学意义(Plt;0.10),见表1。
2.2.2 确定最佳界值
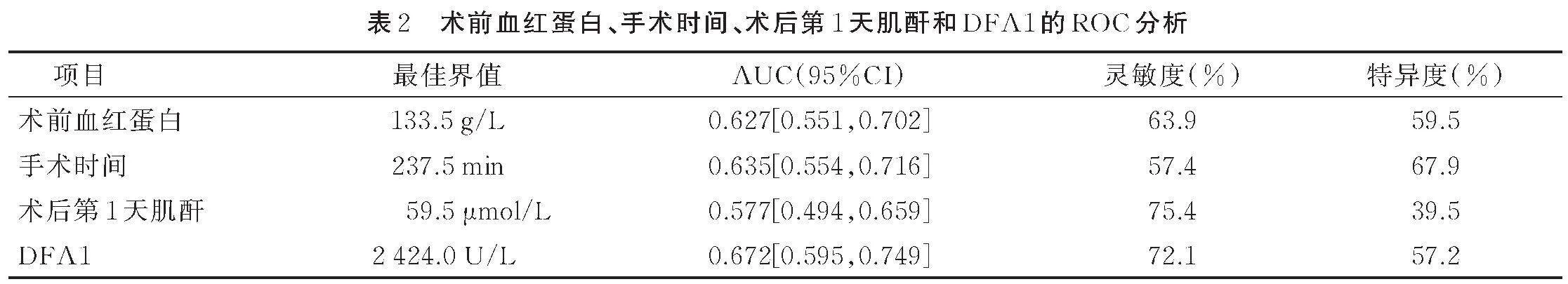
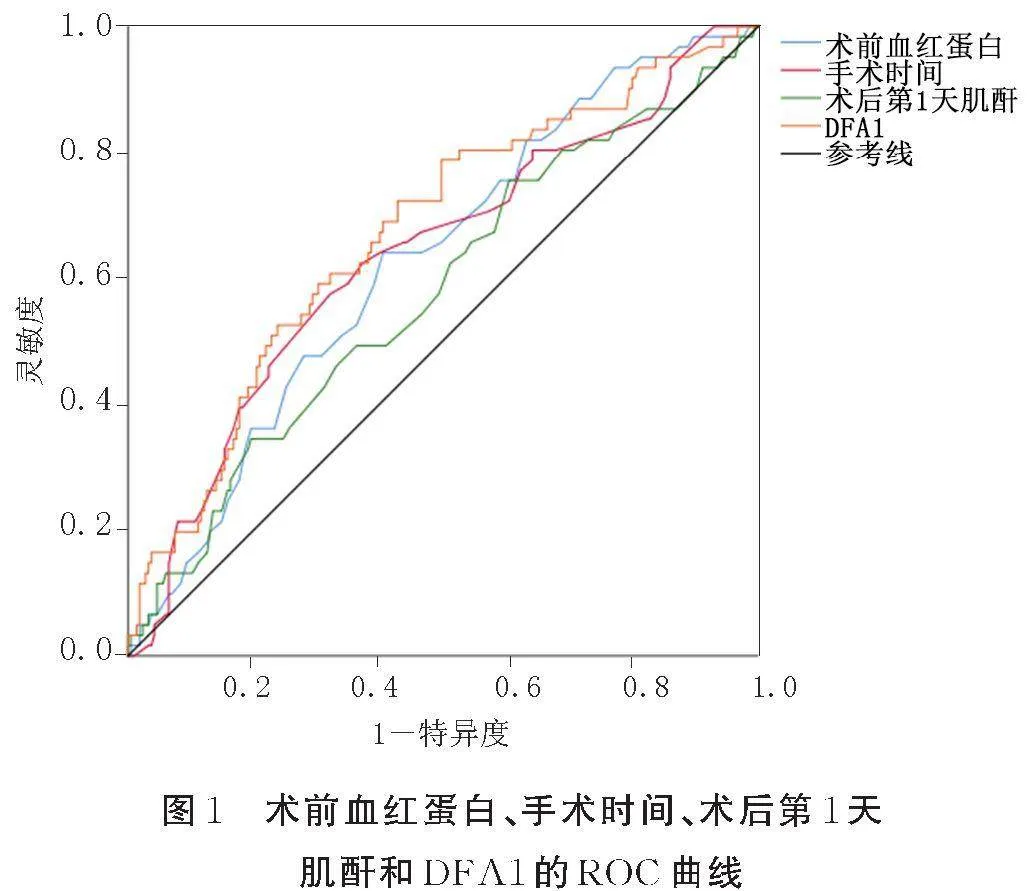
以术前血红蛋白、手术时间、术后第1天肌酐和DFA1为检验变量,以胰瘘的发生情况为结局变量,绘制ROC曲线(见图1)。结果表明,术前血红蛋白、手术时间、术后第1天肌酐和DFA1的AUC分别是0.627,0.635,0.577,0.672,并根据最大Youden指数计算出各指标的最佳界点分别为133.5 g/L、237.5 min、59.5 μmol/L、2 424.0 U/L。见表2。
2.2.3 多因素分析
以建模集是否发生胰瘘为因变量,性别、术前血红蛋白、手术方式、术中放疗、手术时间、淋巴扩大清扫、DFA1等为自变量进行Logistic多因素分析,结果显示,男性、术前血红蛋白≥133.5 g/L、开腹手术、术中放疗、手术时间≥237.5 min、DFA1≥2 424.0 U/L均是胰体尾切除后发生POPF的风险因素(Plt;0.05)。见表3。
2.3 列线图预测模型的建立与验证
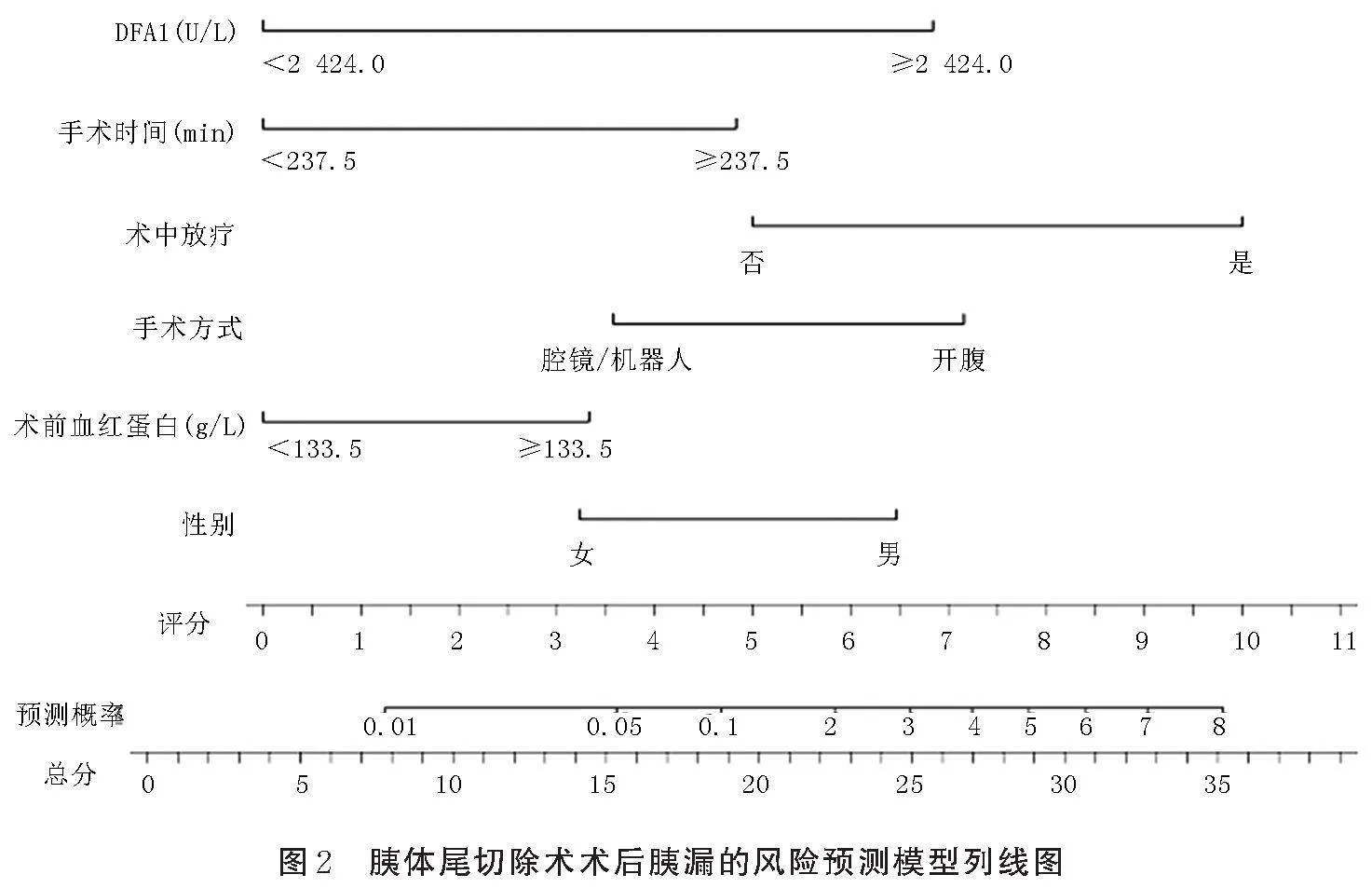
根据多因素分析结果建立POPF发生风险的列线图预测模型,此外,按照赤池信息量(AIC)准则,将术中放疗也放入列线图中。具体见图2。根据每个风险因素所对应列线图上方的标尺,从而得到该因素的单项评分,所有风险因素单项评分相加得到总分,便可得到对应病人POPF发生率,总分越高,POPF的发生风险越高。
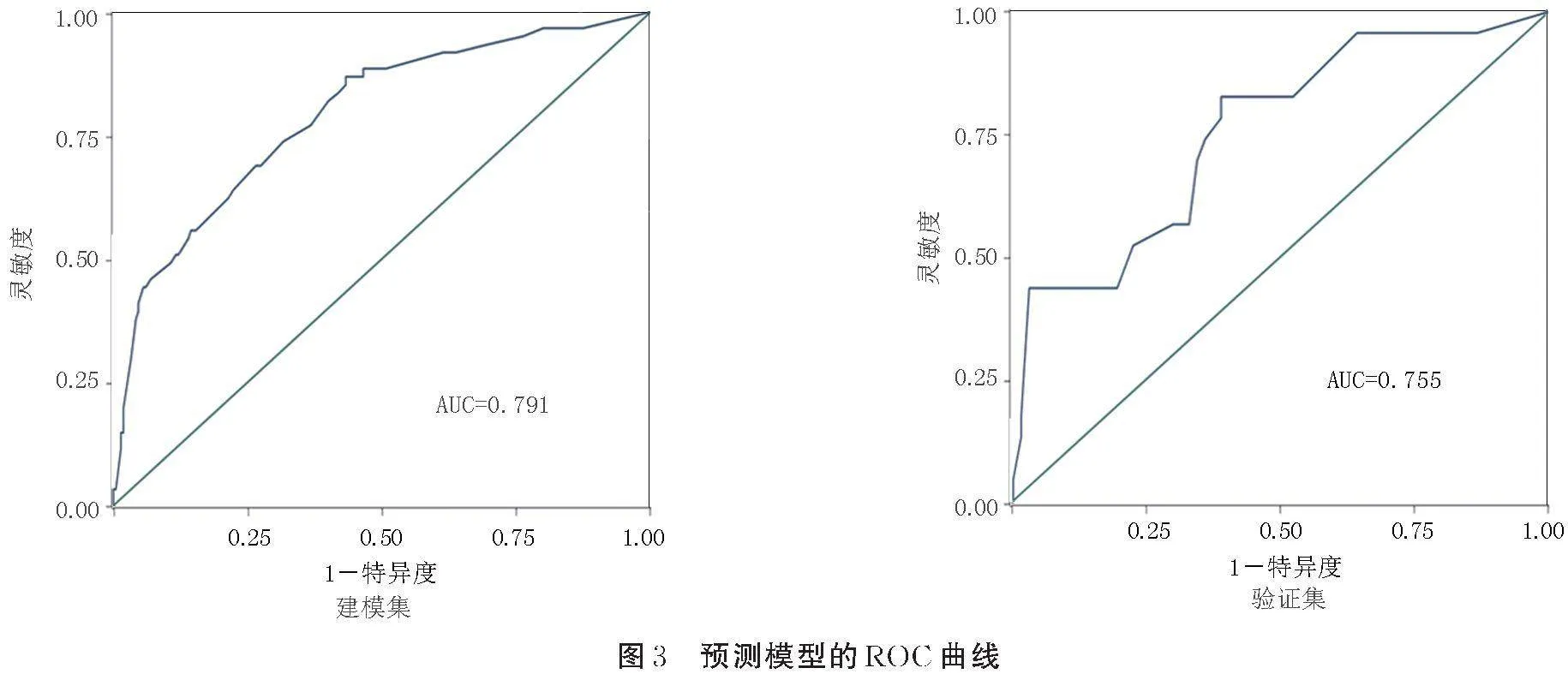
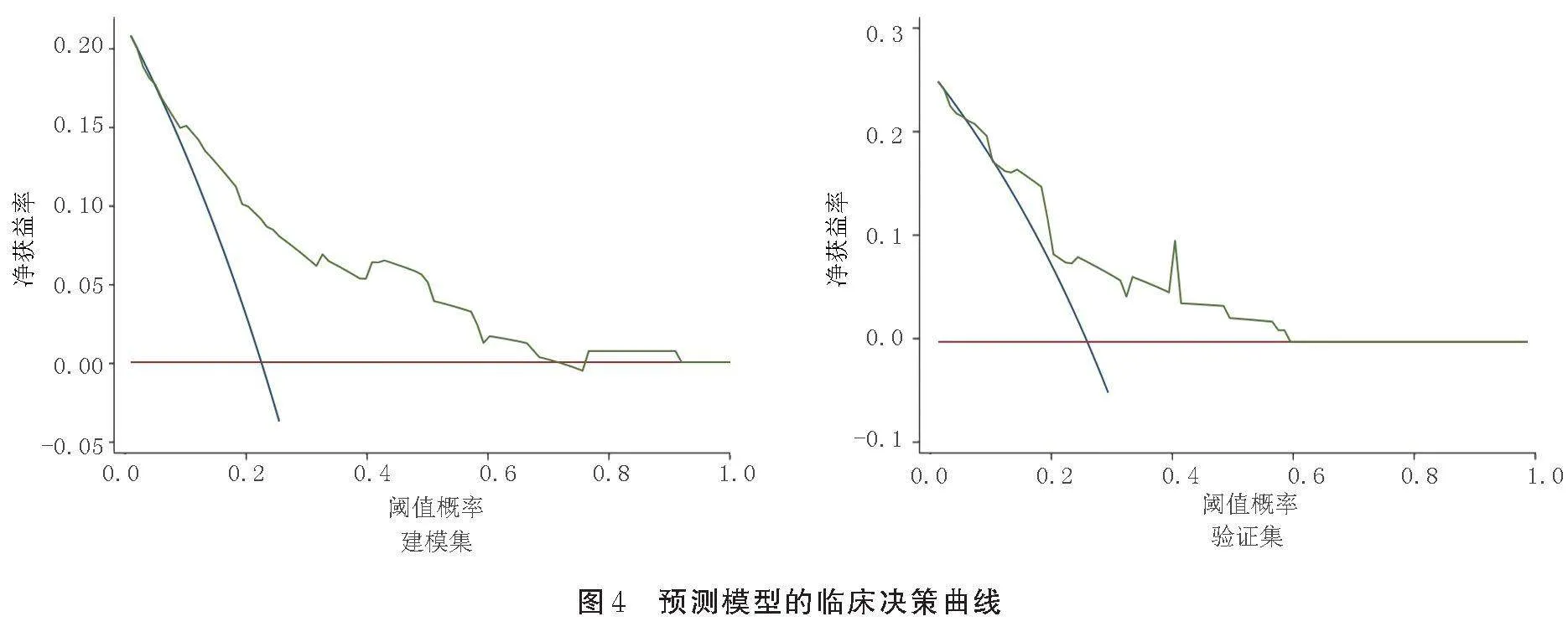
在建模集和验证集中,ROC曲线下面积分别为0.791[95%CI(0.725,0.858)]和0.755[95%CI(0.637,0.872)](见图3),说明预测模型具有较好的区分度。Hosmer⁃Lemeshow检验结果显示,建模集和验证集中模型的χ2分别为4.07和20.51,均Pgt;0.05,说明预测模型具有较好的校准度。建模集中模型显示最大净获益值阈值概率区间为7%~70%;验证集中模型的高风险净获益值阈值概率区间为6%~61%。当病人POPF的阈值概率处于高风险净获益值阈值概率区间内时,应用列线图模型的净获益水平明显高于“不干预”和“全干预”方案,提示模型具有较好的临床适用性。见图4。
3" 讨论
本研究回顾性分析276例病人,POPF发生率为22.1%,与既往研究结果[5]一致。胰瘘是胰体尾切除术后最常见的并发症,严重影响病人的预后,因此,早期筛选高危病人对指导临床决策具有重要意义。本研究根据既往文献[6⁃8]和专家经验共纳入28项观察指标,通过单因素和多因素Logistic回归分析,得出男性、术前血红蛋白≥133.5 g/L、开腹手术、术中放疗、手术时间≥237.5 min、DFA1≥2 424.0 U/L是POPF的影响因素。基于以上6项风险因素构建了胰体尾切除术后病人胰漏的风险预测列线图,区分度、准确度和临床实用性验证的结果均表明其具有较好的预测效果。
本研究结果显示,男性发生POPF的风险是女性的2.027倍,与以往关于胰十二指肠切除术的研究结果一致,如Kawai等[9]对日本11个大型研究中心的1 239例胰十二指肠切除术的病人进行研究,发现男性发生POPF的风险是女性的1.7倍;Hu等[10]对国内539例病人进行分析也发现男性POPF发生风险是女性的1.784倍。此外,Song等[11]发现男性行腹腔镜胰体尾切除术后发生严重并发症的风险是女性的2.142倍。这可能与男性内脏脂肪组织较多有关[12]。分析原因可能为:一方面,胰腺周围脂肪组织较多,影响手术视野,增加手术难度,延长手术时间,从而增加了POPF的发生风险;另一方面,内脏脂肪组织生成的内脏脂肪素可以诱导肿瘤坏死因子⁃α、白介素⁃6等多种细胞因子过表达[13],加重炎症反应,从而影响手术切口愈合,增加POPF的发生风险。
Han等[14]针对胰十二指肠切除术病人的研究发现术前血红蛋白水平较高病人发生POPF的风险是其他人的1.348倍。同样,本研究也发现术前血红蛋白≥133.5 g/L的病人发生POPF的风险是其他人的2.069倍,这可能与血红蛋白对胰腺癌具有诊断价值有关[15]。与良性/交界性肿瘤相比,胰腺癌手术的切除范围更大、难度更高,往往术中还会涉及放疗,大剂量放射线照射又会导致手术切口周围组织水肿,延缓愈合,故增加了病人POPF的发生风险。然而,Xu等[16]的研究发现贫血病人行开腹胰十二指肠切除术后发生POPF的比例明显高于正常组(31.0%与5.9%,P=0.005)。因此,术前血红蛋白水平与POPF的关系仍需大样本、高质量的研究进一步探索。
本研究结果显示,机器人手术和腔镜手术发生POPF的风险低于开腹手术,与Konishi等[17⁃18]的研究结果一致。分析原因为:一方面,因为机器人和腹腔镜技术的影像系统能更清晰地观察到腹腔内脏器官的解剖结构,同时机器人灵巧的操作优势也更便于术中精细地剥离和缝合,从而降低了POPF的发生风险;另一方面,与行机器人手术的病人能更早进食、更早排气有关[19],早期进食和排气可以尽早激活胰腺的外分泌反应,降低胰导管内压力,从而降低POPF的发生风险。
手术时间往往与手术难度和手术医生的临床经验密切相关。本研究结果显示手术时间≥237.5 min是胰体尾切除术后病人发生POPF的危险因素,其发生风险是其他人的2.872倍。同样,Shen等[20]也发现手术时间gt;280 min发生POPF的风险增加2.13倍。Jin等[21]对行胰十二指肠切除术的病人进行研究也发现较长的手术时间(gt;320 min)会使病人发生POPF的风险增加5.061倍。较长的手术时间意味着麻醉和低体温的时间也要相应延长,进而导致病人的正常生理功能更易受到损害,影响伤口愈合。此外,较长时间的手术也可能加重病人术后的炎症应激反应,进而增加POPF的发生风险。
近年来,很多学者提出术后第1天DFA1浓度对POPF具有预测价值。Maggino等[22]对338例行胰体尾切除的病人进行研究发现术后第1天DFA1浓度预测POPF的AUC是0.737,最佳界值是2 000 U/L。Daniel等[23]对以上结论进行验证发现术后第1天DFA1浓度gt;2 000 U/L的病人发生POPF的风险明显高于其他病人(32.50%与11.25%,Plt;0.001),灵敏度和特异度分别为67.98%和63.81%。本研究的最佳界值是2 424.0 U/L,与既往研究结果相似,便于早期筛选出POPF高风险人群,对日后的病情观察和临床用药具有提示作用,可降低POPF发生率。
4" 小结
综上所述,男性、术前血红蛋白≥133.5 g/L、开腹手术、术中放疗、手术时间≥237.5 min、DFA1≥2 424.0 U/L是胰体尾切除术后发生POPF的影响因素,基于上述变量构建的列线图可为临床决策提供参考。但本研究是单中心、回顾性研究,存在样本量小等不足,日后还需开展多中心、前瞻性的高质量研究对本结果进行验证。
参考文献:
[1]" ROUSSEL E,CLÉMENT G,LENNE X,et al.Is centralization needed for patients undergoing distal pancreatectomy:a nationwide study of 3 314 patients[J].Pancreas,2019,48(9):1188-1194.
[2]" LEQUEU J B,COTTENET J,FACY O,et al.Failure to rescue in patients with distal pancreatectomy:a nationwide analysis of 10,632 patients[J].HPB,2021,23(9):1410-1417.
[3]" WEINBERG L,RATNASEKARA V,TRAN A T,et al.The association of postoperative complications and hospital costs following distal pancreatectomy[J].Frontiers in Surgery,2022,9:890518.
[4]" MAEDA K,KURIYAMA N,YUGE T,et al.Risk factor analysis of postoperative pancreatic fistula after distal pancreatectomy,with a focus on pancreas-visceral fat CT value ratio and serrated pancreatic contour[J].BMC Surgery,2022,22(1):240.
[5]" BASSI C,MARCHEGIANI G,DERVENIS C,et al.The 2016 update of the International Study Group(ISGPS) definition and grading of postoperative pancreatic fistula:11 years after[J].Surgery,2017,161(3):584-591.
[6]" WANG G Q,YADAV D K,JIANG W,et al.Risk factors for clinically relevant postoperative pancreatic fistula(CR-POPF) after distal pancreatectomy:a single center retrospective study[J].Canadian Journal of Gastroenterology amp; Hepatology,2021,2021:8874504.
[7]" 孔祥虎,韩玮,李秋影.胰体尾切除术后胰瘘影响因素的多因素分析[J].中国普外基础与临床杂志,2020,27(6):708-713.
KONG X H,HAN W,LI Q Y.Multivariate analysis of influencing factor of pancreatic fistula after distal pancreatectomy[J].Chinese Journal of Bases and Clinics in General Surgery,2020,27(6):708-713.
[8]" 王健,魏伏,段东峰,等.胰体尾切除术后胰瘘发生率及其影响因素分析[J].中国普通外科杂志,2021,30(9):1040-1046.
WANG J,WEI F,DUAN D F,et al.Incidence rate of postoperative pancreatic fistula after distal pancreatectomy and the risk factors[J].Chinese Journal of General Surgery,2021,30(9):1040-1046.
[9]" KAWAI M,KONDO S,YAMAUE H,et al.Predictive risk factors for clinically relevant pancreatic fistula analyzed in 1,239 patients with pancreaticoduodenectomy:multicenter data collection as a project study of pancreatic surgery by the Japanese Society of Hepato-Biliary-Pancreatic Surgery[J].Journal of Hepato-Biliary-Pancreatic Sciences,2011,18(4):601-608.
[10]" HU B Y,WAN T,ZHANG W Z,et al.Risk factors for postoperative pancreatic fistula:analysis of 539 successive cases of pancreaticoduodenectomy[J].World Journal of Gastroenterology,2016,22(34):7797-7805.
[11]" SONG K B,HONG S R,KIM H J,et al.Predictive factors associated with complications after laparoscopic distal pancreatectomy[J].Journal of Clinical Medicine,2020,9(9):2766.
[12]" 赵凯平,翟建,冉利梅,等.中国健康定量CT大数据项目2018—2019年入组人群基线特征[J].中华健康管理学杂志,2022,16(9):596-603.
ZHAO K P,ZHAI J,RAN L M,et al.Baseline characteristics of the Chinese Health Quantitative CT Big Data Program in 2018-2019[J].Chinese Journal of Health Management,2022,16(9):596-603.
[13]" COLOMBO G,CLEMENTE N,ZITO A,et al.Neutralization of extracellular NAMPT(nicotin a mide phosphoribosyl transferase) ameliorates experimental murine colitis[J].Journal of Molecular Medicine,2020,98(4):595-612.
[14]" HAN I W,KIM H,HEO J,et al.Excess intraoperative fluid volume administration is associated with pancreatic fistula after pancreaticoduodenectomy:a retrospective multicenter study[J].Medicine,2017,96(22):e6893.
[15]" 张力,王勇.糖类抗原19-9联合血红蛋白及嗜酸性粒细胞分数对胰腺癌的诊断价值分析[J].癌症进展,2019,17(20):2426-2428;2474.
ZHANG L,WANG Y.Clinical diagnostic value of carbohydrate antigen 19-9 combined with hemoglobin and eosinophilic granulocytes for pancreatic cancer[J].Oncology Progress,2019,17(20):2426-2428;2474.
[16]" XU J Y,TIAN X D,YANG Y M,et al.Preoperative anemia is a predictor of worse postoperative outcomes following open pancreatoduodenectomy:a propensity score-based analysis[J].Frontiers in Medicine,2022,9:818805.
[17]" KONISHI T,TAKAMOTO T,FUJIOGI M,et al.Laparoscopic versus open distal pancreatectomy with or without splenectomy:a propensity score analysis in Japan[J].International Journal of Surgery,2022,104:106765.
[18]" CHEN H D,SHEN Z Y,YING X Y,et al.Robotic distal pancreatectomy reduces pancreatic fistula in patients without visceral obesity as compared to open distal pancreatectomy:a propensity score matching retrospective cohort study[J].International Journal of Surgery,2021,90:105960.
[19]" 刘文生,吉顺荣,卓奇峰,等.机器人与腹腔镜微创手术治疗分化良好的胰腺神经内分泌瘤的临床研究[J].中国癌症杂志,2022,32(9):786-793.
LIU W S,JI S R,ZHUO Q F,et al.Clinical study of robot and laparoscopic minimally invasive surgery for well-differentiated pancreatic neuroendocrine tumors[J].China Oncology,2022,32(9):786-793.
[20]" SHEN J,ZHANG Y S,HU J,et al.Albumin difference as a new predictor of pancreatic fistula following distal pancreatectomy:a retrospective study of 211 consecutive patients[J].Langenbeck's Archives of Surgery,2020,405(1):55-62.
[21]" JIN J K,XIONG G B,LI J L,et al.Predictive factors of postoperative pancreatic fistula after laparoscopic pancreatoduodenectomy[J].Annals of Translational Medicine,2021,9(1):41.
[22]" MAGGINO L,MALLEO G,BASSI C,et al.Identification of an optimal cut-off for drain fluid amylase on postoperative day 1 for predicting clinically relevant fistula after distal pancreatectomy:a multi-institutional analysis and external validation[J].Annals of Surgery,2019,269(2):337-343.
[23]" DANIEL F,TAMIM H,HOSNI M,et al.Validation of day 1 drain fluid amylase level for prediction of clinically relevant fistula after distal pancreatectomy using the NSQIP database[J].Surgery,2019,165(2):315-322.

