陆均松和青梅叶际真菌群落多样性特征及其影响因子
摘 要:【目的】陆均松和青梅是海南岛热带雨林中珍稀濒危树种。研究陆均松和青梅叶际真菌群落多样性和结构组成及其环境驱动因子,为未来利用微生物群落提供的有益功能来提高珍稀濒危植物生长适应性提供理论依据。【方法】通过对陆均松和青梅叶际真菌样品进行高通量测序,分析叶际真菌群落α、β多样性和群落组成,并阐明其主要环境驱动因子。【结果】1)本研究共分析检测到10 489个OTU,其中包括真菌10门40纲。陆均松和青梅的叶表共有OTU为523(4.99%),叶内共有OTU仅为9(0.09%)。2)优势菌纲包括:座囊菌纲(Dothideomycetes)、散囊菌纲(Eurotionmycetes)、银耳纲(Tremellomycetes)。其中青梅叶内的座囊菌纲相对丰度显著大于其他物种和隔室(P<0.01)。3)叶表真菌α多样性均高于叶内,但在不同物种上叶际真菌多样性差异不显著,物种变化解释了叶际真菌群落组成差异的13.57%(P<0.001);4)叶际真菌α多样性与叶片pH值、温度呈显著正相关(pH:R2=0.16,P<0.001;Tem:R2=0.16,P<0.001),同时与降水量呈显著负相关(Rain:R2=0.35,P<0.001)。CCA分析结果显示,Mg、降水量对叶表真菌群落组成的解释度分别为:71.29%、69.33%;pH值、Mg对叶内真菌群落组成的解释度分别为:62.48%、61.51%。5)置换多元方差分析(PERMANOVA)结果说明全氮(TN:R2=0.13,P=0.001)、全磷(TP:R2=0.12,P=0.001)、Mg(Mg:R2=0.14,P=0.001)、降水量(Rain:R2=0.13,P=0.002)是陆均松和青梅叶际真菌组成差异的主要驱动因子。【结论】物种变化显著影响了叶际真菌群落,全氮(TN)、全磷(TP)、Mg是驱动陆均松和青梅叶际真菌群落组成差异的主要影响因子。
关键词:青梅;陆均松;叶际真菌;多样性;影响因子
中图分类号:S791.47 文献标志码:A 文章编号:1673-923X(2024)07-0110-09
基金项目:海南省重点研发项目(ZDYF2024SHFZ096);国家自然科学基金项目(32271603);海南儋州热带农业生态系统国家野外科学观测研究站开放课题(RRI-KLOF202405);天然橡胶产业技术体系橡胶园生态岗位科学家经费项目(CARS-33-ZP3)。
Diversity characteristics of phyllosphere fungal communities and their influencing factors in Dacrydium pectinatum and Vatica mangachapoi
JI Kepeng1,2, LAN Guoyu2,3, WEI Yaqing2,3, XU Xinnuo1
(1. College of Tropical Agriculture and Forestry, Hainan University, Danzhou 571737, Hainan, China; 2. Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou 571101, Hainan, China; 3. Hainan Danzhou Tropical Agro-ecosystem National Observation and Research Station, Danzhou 571737, Hainan, China)
Abstract:【Objective】Dacrydium pectinatum and Vatica mangachapoi are rare and endangered species in the tropical rainforests of Hainan Island. Investigating the diversity and structural composition of phyllosphere fungal communities and their environmental drivers in D. pectinatum and V. mangachapoi, which can provide a theoretical basis for the future utilization of the beneficial functions provided by microbial communities to improve the growth adaptability of rare and endangered plants.【Method】The high-throughput sequencing method was used to analyze phyllosphere fungal samples from D. pectinatum and V. mangachapoi, which explored the α and β diversity and community composition of the phyllosphere fungal communities and to elucidate their main environmental drivers.【Result】1) A total of 10 489 OTUs were analyzed and detected in this study, including 10 phyla and 40 orders of fungi. The leaf surface shared OTU was 523 (4.99%) and the leaf inner shared OTU was only 9 (0.09%) in D. pectinatum and V. mangachapoi. 2) The dominant class included: Dothideomycetes, Eurotionmycetes, and Tremellomycetes. Among them, the relative abundance of Dothideomycetes on the leaf inner of V. mangachapoi was significantly greater than that of other species and compartments (P<0.01). 3) All leaf surface fungalα-diversity was higher than leaf inner, but the difference between phyllosphere fungal diversity was not significant across species, with species variation explaining 13.57% of the variation in the composition of the phyllosphere fungal community (P<0.001). 4) Phyllosphere fungal α-diversity showed a significant positive correlation with leaf pH and Temperature (pH: R2=0.156, P<0.001; Tem: R2=0.164, P<0.001), and also significantly negatively correlated with rainfall (Rain: R2=0.345, P<0.001). The results of CCA analysis showed that Mg and rainfall explained 71.29% and 69.33% of the fungal community composition on the leaf surface, and pH and Mg explained 62.48% and 61.51% of the fungal community composition within the leaf inner, respectively. The PERMANOVA analysis indicated that total nitrogen(TN: R2=0.13, P=0.001), total phosphorus (TP: R2=0.12, P=0.001), Mg (R2=0.14, P=0.001), and Rainfall (Rain: R2=0.13, P=0.002) were the main drivers of the differences in the composition of the phyllosphere fungi of D. pectinatum and V. mangachapoi.【Conclusion】Species variation significantly affected the interleaf fungal community, with TN, TP and Mg being the main influences driving the differences in the composition of the phyllosphere fungal community between D. pectinatum and V. mangachapoi.
Keywords: Vatica mangachapoi; Dacrydium pectinatum; phyllosphere fungal; diversity; influencing factors
微生物多样性是生物多样性研究的重要课题之一[1]。在大自然中微生物可以寄生在植物内部、表面和其他部位,这些微生物统称为植物微生物[2]。植物的叶际就是一个复杂的生态系统,其中叶际包括叶附生和叶内生微生物群落[3]。叶际上栖息着大量的微生物类群[4-5],真菌是不可忽视的一部分。这些微生物和植物共同构成了一个“共生有机体”,他们之间一直存在着相互作用[6-7]。近年来国内对热带雨林中的土壤和根际微生物开展了很多,包括多样性特征、网络结构、地理格局等等[8-11]。然而,对于叶际微生物组的研究却滞后于土壤和根际微生物组[12-13]。因此,通过探究不同植物叶际微生物群落的多样性特征和结构,对研究复杂独特的叶际微生物生态系统具有重要意义,也为了解植物与微生物互作奠定了基础。
叶际微生物是植物与环境长期选择和协同进化的结果[14]。目前,已有许多研究表明叶际微生物受到非生物因素和生物因素的影响。比如:宿主种类、邻域效应、宿主选择、地理位置等[15-19]。植物的叶片(叶附生和内生)代表了不同的栖息环境,栖息在上面的微生物面临的胁迫和可利用的养分也不同。在一项探究叶附生和内生细菌群落组装机制的研究中,发现叶附生和内生细菌群落之间存在明显的组成差异,并且附生细菌多样性远高于内生细菌[20]。在红树植物叶际真菌群落中也发现附生真菌和内生真菌的群落组成差异显著[16]。植物种类是影响叶际微生物群落组成的主要因素之一[21-22],植物宿主作为微生物的载体,其自身的特性是导致叶际微生物群落差异的重要原因。刘利玲等[23]在对青杨叶际微生物的研究中,发现真菌群落结构和叶片含水量呈显著相关。Li等[24]发现了叶片的钙含量有力地解释了不同宿主性状对细菌和真菌群落组成和多样性的影响。植物叶际常年暴露在空气中,栖息在此处的微生物会面临着干燥、高温以及营养匮乏的恶劣条件[25],这就导致了环境条件中的温度、湿度等因素在很大程度上影响了叶际微生物群落。然而环境因子在不同空间尺度上存在差异,Wei等[15]在研究不同气候区橡胶叶际微生物时,发现年平均气温是叶际真菌群落的主要驱动因子。
青梅Vatica mangachapoi属于龙脑香科青梅属的植物,其是热带雨林的指示种。然而由于大规模砍伐,其天然种群被严重破坏[26],因此青梅已经被列为国家II级重点保护植物。同时,陆均松Dacrydium pectinatum是罗汉松科Podocarpaceae陆均松属Dacrydium的珍稀濒危树种,也是该属植物分布于中国的唯一代表种类,其作为海南山地雨林的建群种和优势种,仅分布在中国海南岛的霸王岭、尖峰岭、吊罗山、五指山等700~1 300 m的山地雨林中[27]。目前关于陆均松和青梅的研究主要集中于群落结构及多样性特征调查、空间分布特征等[28-29],然而有关青梅与陆均松微生物组学方面的研究尚无相关报道。由于宿主-微生物组相互作用对宿主生存的重要性,此研究通过分析青梅和陆均松叶际真菌的群落特征及驱动因子,为利用植物微生物群落提供的有益功能来增强植物生长和适应性提供理论依据,这对研究珍稀濒危植物应对全球气候变化面临的挑战具有重要意义[30]。
1 材料与方法
1.1 研究区域与样本采集
本研究以青梅和陆均松为研究对象,取样地点选取了中国海南岛尖峰岭、五指山、吊罗山、万宁、霸王岭。其中在霸王岭、吊罗山、尖峰岭、万宁这4个地方各选取3个青梅林样方,同样在吊罗山、尖峰岭、五指山这3个地方也各选取3个陆均松林样方,每个研究区域3个样地之间距离1~2 km左右。记录了每个样地的经纬度和海拔。年平均气温、年平均降水量数据从国家气象信息中心(data. cma.cn)获取,用于以下方法的进一步分析。
在每个样地采集3个重复的成熟、成对的叶片样品(附生和内生)。重复取样相距约100 m,取样位置为距树干中心2 m和距地面12 m处。从(即北、南、东、西)的4个主方向选取植物组织样品,然后混合形成单一的复合样品。为了获得叶表微生物样品,先将叶放入pbs溶液中,然后进行摇床和超声波处理,最后进行pbs溶液过滤,所获得的滤膜需要保存-80 ℃以备将来测序分析。并将采集完叶表微生物的叶片样品,用于高通量分析检测叶内微生物。最终还将叶样品的一部分用于理化性质的分析。
1.2 DNA提取和PCR 扩增
使用FastDNA? Spin Kit for Soil试剂盒(MP Biomedicals,美国),按照制造商协议提取样品中的微生物群落基因组。采用PCR引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)对真菌进行聚合酶链式反应扩增[31],所需条件如下:95 ℃预变性3 min;95 ℃条件下变性30 s,55 ℃条件下退火30 s;72 ℃条件中延伸45 s;经过35个循环,最后72 ℃延伸10 min。所纯化后的扩增子在上海美吉生物科技有限公司的Illumina Mi Seq平台上进行等摩尔和配对测序。
1.3 数据统计分析
利用mothur计算进行Sobs、PD多样性指数计算,并进行指数间的差异检验。基于Bray-Curtis算法,用主坐标分析(PCoA)对叶际真菌群落在OTU水平上可视化,还进行了置换多元方差分析(PERMANOVA),以确定环境变量对陆均松和青皮叶际真菌落差异的解释度及显著性。采用多元直接梯度分析(CCA)进行环境因子和OTU水平上真菌群落之间的关系分析,线性回归分析真菌多样性和环境变量的相关关系。相关性热图通过相关性数值(Spearman相关系数)可视化展示样本中不同真菌种类与环境变量之间的关系。
2 结果与分析
2.1 陆均松和青梅叶际真菌群落组成
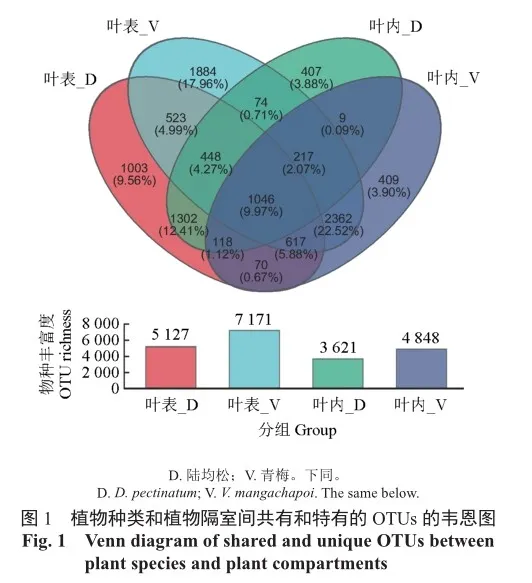
通过高通量测序,在42个叶际真菌样品中共检测到10 489个OTU,其中包括真菌10门40纲。在陆均松和青梅叶表、叶内中分别有5 127、3 621、7 171、4 848个真菌OTU,青梅叶际真菌OTU均高于陆均松(图1)。Venn图显示青梅和陆均松的叶表共有OTU为523(4.99%),叶内共有OTU仅为9(0.09%)。同时陆均松的叶内和叶表共有的OTU为1 302(12.41%),青梅的叶内和叶表共有的OTU为2 362(22.52%)(图1)。这一发现表明叶际真菌群落的组装受到植物隔室和物种的影响,特别是物种的影响更大。
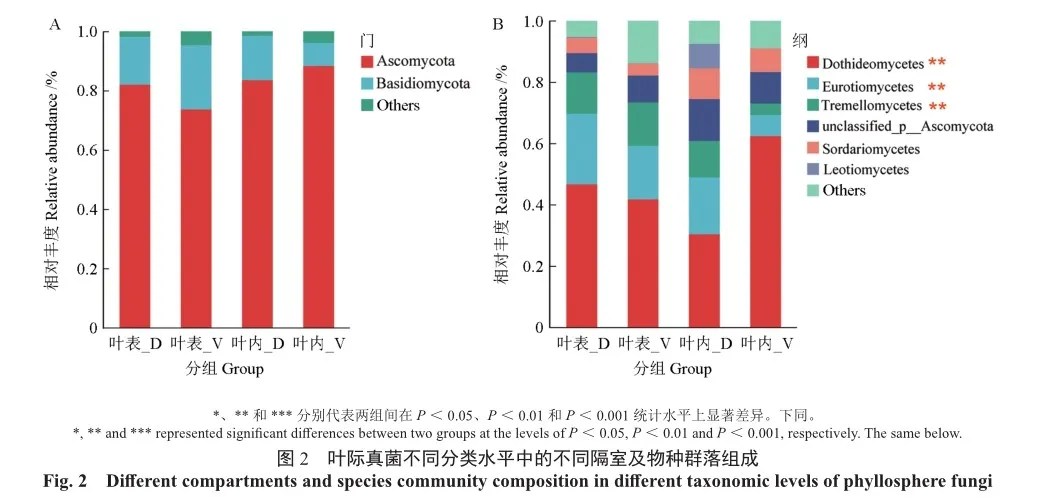
在门水平上,陆均松和青梅叶际优势菌门依次为:子囊菌门(Ascomycota)、担子菌门(Basidiomycota),但他们之间差异不显著(图2A)。在纲水平上,优势菌纲包括:座囊菌纲(Dothideomycetes)、散囊菌纲(Eurotionmycetes)、银耳纲(Tremellomycetes),其中青梅叶内的座囊菌纲相对丰度显著高于其他物种和隔室(P<0.01),而散囊菌纲却显著低于其他物种和隔室(P<0.01,图2B)。
基于Bray-Curtis距离矩阵的主坐标分析(PCoA)结果显示:陆均松叶际样品分布于面板的左侧,而青梅分布于面板右侧,陆均松和青梅叶际真菌是完全分开聚类。多元置换方差分析(PERMANOVA)显示物种变化解释了叶际真菌群落组成差异的13.57%(P<0.001),而隔室变化仅解释了3.90%(P<0.05,图3)。这表明树种身份主要影响了叶际真菌群落组成的差异。
2.2 陆均松和青梅叶际真菌群落多样性
通过分析Sobs指数和PD指数,结果显示了陆均松和青梅叶际真菌的Sobs指数和PD指数差异不显著,但在同一物种上叶表和叶内真菌差异显著(P<0.05)。不论是Sob指数还是PD指数,叶表的α多样性均高于叶内(图4)。这说明相比于物种变化,植物隔室对叶际真菌α多样性影响更大。
2.3 陆均松和青梅叶际真菌群落与环境因子的相关分析
通过线性回归分析发现,叶际真菌的α多样性指数与叶片的pH值、温度呈显著正相关(R2=0.16,P<0.001;R2=0.16,P<0.001),同时与降水量(Rainfall)呈显著负相关(R2=0.35,P<0.001)。故pH值、温度、降水量是影响陆均松和青梅叶际真菌α多样性的主要因子(图5)。
通过多元直接梯度分析(CCA),结果表明Mg、降雨、全氮(TN)、全磷(TP)对叶表真菌群落β多样性的差异具有显著影响,解释度分别为:71.29%、69.33%、56.95%、52.36%。同时pH值、Mg、有机质(SOM)、全氮(TN)、全磷(TP)对叶内真菌群落β多样性的差异具有显著影响,解释度分别为:62.48%、61.51%、53.22%、49.83%、40.51%(表1)。此外,通过多元置换方差分析(PERMANOVA),结果显示陆均松和青梅在叶表真菌群落上的差异主要受全氮、全磷、Mg、降水量(TN:R2=0.13, P=0.001、TP:R2=0.12, P=0.001、Mg:R2=0.14, P=0.001、Rain:R2=0.13,P=0.002)的影响;叶内真菌群落差异主要受到全氮、全磷、Mg(TN:R2=0.11,P=0.001、TP:R2=0.10,P=0.001、Mg:R2=0.11,P=0.001)的影响(表2)。同时,陆均松和青皮叶片的全氮、全磷、Mg含量差异显著(表3)。相关性热图结果表明,在门水平上,叶际真菌优势门子囊菌门(Ascomycota)与全磷(TP)、全氮(TN)、Mg呈负相关,担子菌门(Basidiomycota)与降水量呈负相关(图6),这与CCA分析结果相一致。




3 讨 论
通过高通量测序分析方法,本研究发现了陆均松和青梅叶际真菌的优势菌门均为子囊菌门和担子菌门,优势菌纲为座囊菌纲、散囊菌纲。这与前人在不同植物叶际微生物研究中结果一致[15,32-33]。
已有研究表明植物隔室和宿主种类会影响微生物多样性和组成[34-36]。本研究结果显示不论是陆均松还是青梅,叶表真菌的多样性均高于内生菌,并且差异显著(P<0.05),但是陆均松和青梅叶际多样性之间差异不显著,这说明植物隔室对陆均松和青梅的叶际真菌α多样性影响更大。在叶抗性性状与叶内生真菌定殖和群落组成之间关系的研究中,也得出真菌多样性在不同寄主植物间无显著差异的结果,这与本研究结果一致[37]。然而在红树植物研究中,虽然叶表真菌多样性在不同树种间差异不显著,但是在叶内真菌群落中却差异显著[16]。造成这一结果的原因很可能是不同宿主植物间所处的外部环境不同,并且对内生菌的过滤作用存在差异[16,38]。此外叶表和叶内代表着两个截然不同的生境,内生真菌比附生真菌更多地被宿主植物过滤[39],这可能导致了叶表和叶内真菌多样性的差异。本研究中叶际真菌多样性与降水量呈显著负相关,而温度则反之,是青梅和陆均松的真菌多样性的主要气候驱动因子。气候是影响自然界中微生物群落的主要因素之一[40-41],例如:干旱加剧增加了石栎叶际细菌和真丰富度和多样性[42];增温使得生长季中后期的橡树叶际真菌物种丰富度下降[43]。这与本研究结果不一致,原因是一方面是实验对象和条件设置的不同,另一方面则可能是微生物对温度和水分变化的响应存在阈值效应[44]。这将会是接下来研究的方向之一。本研究采用了采样地点的年平均温度和年平均降水量,这导致了关于相关性的研究结果具有一定的局限性。之后应使用样地气象仪现场测量的数据作为补充。
本研究还发现物种变化解释了叶际真菌群落差异的13.57%(P=0.001),而植物隔室变化仅解释了3.90%(P<0.05)。这说明物种变化对叶际真菌群落的影响更大。叶际微生群落不仅受到叶片理化性质的影响,还受到所处环境条件的影响[19]。由CCA分析可知,Mg、降水量是解释叶表真菌群落组成最主要的环境变量,pH值、Mg是解释叶内真菌群落组成最主要的环境变量。叶际真菌依赖于大气或叶片中水分和营养物质,因此这些因素都会影响到群落组成[38]。不同植物由于分类水平和生长环境的不同,导致了他们叶片理化性质之间的异质性,从而影响了微生物的定殖[45]。本研究还发现了陆均松和青皮叶片的全氮、全磷、Mg含量差异显著(表3)。置换多元方差分析(PERMANOVA)结果显示全磷(TP)、全氮(TN)、Mg在一定程度上解释了陆均松和青皮叶际样品上的差异。前人在对不同树种叶际真菌群落研究中,发现叶片氮含量是解释真菌群差异的重要因子之一[18,24]。此外在研究叶性状对樟科、壳斗科植物叶内真菌群落的影响研究中,发现叶片氮含量是主要因素[46],这与本研究结果一致。本研究中环境因子与真菌群落中的优势菌门的相关性表明(图6),不同宿主植物叶片上环境条件的差异可能作为一个生态过滤器,对某些类群进行选择,影响叶片上的群落构成[47]。
4 结 论
不管是陆均松还是青梅,叶表和叶内之间的真菌群落α多样性均差异显著,植物隔室主要影响了陆均松和青梅的叶际真菌群落α多样性。同时叶片pH值、降水量、温度对青梅和陆均松叶际真菌α多样性具有重要的调节作用。相比于植物隔室,植物宿主间的变化对陆均松和青梅叶际真菌群落组成影响更大。陆均松和青梅叶表真菌群落上的差异主要受叶片的全氮、全磷、Mg含量和降水量的影响,而叶片的全氮、全磷、Mg含量是叶内真菌群落差异主要的原因。
参考文献:
[1] 徐冰,张大勇.微生物多样性及其分布的研究进展:模式与过程[J].生命科学,2014,26(2):144-152. XU B, ZHANG D Y. Progress on the biodiversity of microorganisms: patterns and processes[J]. Chinese Bulletin of Life Sciences,2014,26(2):144-152.
[2] BONATELLI M L, LACERDA-JúNIOR G V, JUNIOR F B, et al. Beneficial plant-associated microorganisms from semiarid regions and seasonally dry environments: a review[J]. Frontiers in Microbiology,2021,11:553223.
[3] SOHRABI R, PAASCH B C, LIBER J A, et al. Phyllosphere microbiome[J]. Annual Review of Plant Biology,2023,74: 539-568.
[4] LINDOW S E, BRANDL M T. Microbiology of the phyllosphere[J]. Applied and Environmental Microbiology,2003, 69(4):1875-1883.
[5] BRITT K. The phyllosphere[J]. Current Biology,2020,30(19): 1143-1146.
[6] VANDENKOORNHUYSE P, QUAISER A, DUHAMEL M, et al. The importance of the microbiome of the plant holobiont[J]. New Phytologist,2015,206(4):1196-1206.
[7] HASSANI M A, DURáN P, HACQUARD S. Microbial interactions within the plant holobiont[J]. Microbiome,2018,6(1):58.
[8] 魏亚情,吴志祥,杨川,等.海南岛橡胶林土壤细菌群落多样性的季节变化及其影响因子[J].中南林业科技大学报, 2022,42(7):28-34. WEI Y Q, WU Z X, YANG C, et al. Seasonal changes and influencing factors of soil bacterial diversity in rubber plantations on Hainan island[J]. Journal of Central South University of Forestry Technology,2022,42(7):28-34.
[9] 许彦明,刘彩霞,吴慧,等.油茶林生草栽培对土壤理化性质、微生物多样性及酶活性的影响[J].经济林研究,2023,41(1): 45-51. XU Y M, LIU C X, WU H, et al. Effect of sod culture on soil physical and chemical characteristics, microbial diversity and enzyme activities of Camellia oleifera forest[J]. Non-wood Forest Research,2023,41(1):45-51.
[10] LAN G Y, YANG C, WU Z X, et al. Network complexity of rubber plantations is lower than tropical forests for soil bacteria but not for fungi[J]. Soil,2022,8(1):149-161.
[11] WEI Y Q, QUAN F, LAN G Y, et al. Space rather than seasonal changes explained more of the spatiotemporal variation of tropical soil microbial communities[J]. Microbiology Spectrum,2022, 10(6):e0184622.
[12] 杨宽,王慧玲,叶坤浩,等.叶际微生物及与植物互作的研究进展[J].云南农业大学学报(自然科学),2021,36(1):155-164. YANG K, WANG H L, YE K H, et al. Advances in research on phyllosphere microorganisms and their interaction with plants[J]. Journal of Yunnan Agricultural University (Natural Science), 2021,36(1):155-164.
[13] 潘建刚,呼庆,齐鸿雁,等.叶际微生物研究进展[J].生态学报, 2011,31(2):583-592. PAN J G, HU Q, QI H Y, et al. Advance in the research of phyllospheric microorganism[J]. Acta Ecologica Sinica,2011,31(2): 583-592.
[14] TRIVEDI P, LEACH J E, TRINGE S G, et al. Plant-microbiome interactions: from community assembly to plant health[J]. Nature Reviews Microbiology,2020,18(11):607-621.
[15] WEI Y Q, LAN G Y, WU Z X, et al. Phyllosphere fungal communities of rubber trees exhibited biogeographical patterns, but not bacteria[J]. Environmental Microbiology,2022,24(8), 3769-3782.
[16] YAO H, SUN X, HE C, et al. Phyllosphere epiphytic and endophytic fungal community and network structures differ in a tropical mangrove ecosystem[J]. Microbiome,2019,7(1):57.
[17] CREGGER M A, VEACH A M, YANG Z K, et al. The Populus holobiont: dissecting the effects of plant niches and genotype on the microbiome[J]. Microbiome,2018,6(1):31.
[18] KEMBEL S W, MUELLER R C. Plant traits and taxonomy drive host associations in tropical phyllosphere fungal communities[J]. Botany,2014,92(4):303-311.
[19] LAJOIE G, KEMBEL S W. Host neighborhood shapes bacterial community assembly and specialization on tree species across a latitudinal gradient[J]. Ecological Monographs,2021,91(2): e01443.
[20] YANG X, WANG P D, XIAO B W, et al. Different assembly mechanisms of leaf epiphytic and endophytic bacterial communities underlie their higher diversity in more diverse forests[J]. Journal of Ecology,2023,111(5):970-981.
[21] DING T, PALMER M W, MELCHER U. Community terminal restriction fragment length polymorphisms reveal insights into the diversity and dynamics of leaf endophytic bacteria[J]. BMC Microbiology,2013,13(1):1-11.
[22] LAFOREST-LAPOINTE I, MESSIER C, KEMBEL S W. Host species identity, site and time drive temperate tree phyllosphere bacterial community structure[J]. Microbiome,2016,4(1):27.
[23] 刘利玲,李会琳,蒙振思,等.青杨雌雄株叶际微生物群落多样性和结构的差异[J].微生物学报,2020,60(3):556-569. LIU L L, LI H L, MENG Z S, et al. Differences in phyllosphere microbial communities between female and male Populus cathayana[J]. Acta Microbiologica Sinica,2020,60(3):556-569.
[24] LI M J, HONG L, YE W H, et al. Phyllosphere bacterial and fungal communities vary with host species identity, plant traits and seasonality in a subtropical forest[J]. Environmental Microbiome,2022,17(1):29.
[25] VORHOLT J A. Microbial life in the phyllosphere[J]. Nature Reviews Microbiology,2012,10(12):828-840.
[26] 陈伟,蒋菊生,兰国玉.海南青梅林生态系统的分布规律、存在问题与管理对策[J].热带农业科学,2006,26(6):67-70. CHEN W, JIANG J S, LAN G Y. Distributions, problems and their management counter measures of Vatica mangachapoi forest ecosystem in Hainan[J]. Chinese journal of tropical agriculture, 2006,26(6):67-70.
[27] 王伯荪,张炜银.海南岛热带森林植被的类群及其特征[J].广西植物,2002,22(2):107-115. WANG B S, ZHANG W Y. The groups and features of tropical forest vegetation of Hainan Island[J]. Guihaia,2002,22(2):107-115.
[28] 郝清玉,刘淑菊,钟琼芯,等.海南岛不同海拔高度青梅林群落结构与多样性[J].林业资源管理,2012(4):48-54. HAO Q Y, LIU S J, ZHONG Q X, et al. Community structure and diversity of Vatica mangachapoi forest at different altitudes in Hainan Island[J]. Forest Resources Management,2012(4):48-54.
[29] 刘浩栋,陈巧,徐志扬,等.海南岛霸王岭陆均松天然群落物种多样性及地形因子的解释[J].生态学杂志,2020,39(2): 394-403. LIU H D, CHEN Q, XU Z Y, et al. Effects of topographical factors on species diversity across Dacrydium pectinatum natural community in Hainan Island[J]. Chinese Journal of Ecology, 2020,39(2):394-403.
[30] MUELLER E A, WISNOSKI N I, PERALTA A L, et al. Microbial rescue effects: how microbiomes can save hosts from extinction[J]. Functional Ecology,2020,34(10):2055-2064.
[31] ADAMS R I, MILETTO M, TAYLOR J W, et al. Dispersal in microbes: fungi in indoor air are dominated by outdoor air and show dispersal limitation at short distances[J]. The ISME Journal, 2013,7(7):1262-1273.
[32] 袁彩莲,张朝志,邓巍,等.基于高通量测序的三种园林植物叶际真菌多样性及群落结构解析[J].四川林业科技,2023,44(1): 24-31. YUAN C L, ZHANG C Z, DENG W, et al. Phyllosphere fungal diversity and community structure of three garden plants based on high-throughput sequencing[J]. Journal of Sichuan Forestry Science and Technology,2023,44(1):24-31.
[33] 周慧娜,张涛,徐自恒,等.山桐子叶际微生物群落多样性、结构及功能预测分析[J].经济林研究,2022,40(4):163-172. ZHOU H N, ZHANG T, XU Z H, et al. Diversity, structure and function prediction of phyllospheric microorganism community in Idesia polycarpa[J]. Non-wood Forest Research,2022,40(4): 163-172.
[34] HERRMANN M, GEESINK P, RICHTER R, et al. Canopy position has a stronger effect than tree species identity on phyllosphere bacterial diversity in a floodplain hardwood forest[J]. Microbial Ecology,2021,81(1):157-168.
[35] LAN G Y, WEI Y Q, LI Y W, et al. Diversity and assembly of root-associated microbiomes of rubber trees[J]. Frontiers in Plant Science,2023,14:1136418.
[36] YANG H, YANG Z, J, WANG Q C, et al. Compartment and plant identity shape tree mycobiome in a subtropical forest[J]. Microbiology Spectrum,2022,10(4):e01347.
[37] GONZáLEZ‐TEUBER M, VILO C, GUEVARA‐ARAYA M J, et al. Leaf resistance traits influence endophytic fungi colonization and community composition in a south American temperate rainforest[J]. Journal of Ecology,2020,108(3):1019-1029.
[38] GOMES T, PEREIRA J A, BENHADI J, et al. Endophytic and epiphytic phyllosphere fungal communities are shaped by different environmental factors in a Mediterranean ecosystem[J]. Microbial Ecology,2018,76(3):668-679.
[39] SANTAMARíA J, BAYMAN P. Fungal epiphytes and endophytes of coffee leaves (Coffea arabica)[J]. Microbial Ecology, 2005,50(1):1-8.
[40] VACHER C, HAMPE A, PORTé A J, et al. The phyllosphere: microbial jungle at the plant-climate interface[J]. Annual Review of Ecology, Evolution and Systematics,2016,7:24.
[41] ZHU Y G, PENUELAS J. Changes in the environmental microbiome in the anthropocene[J]. Global Change Biology,2020, 26(6):3175-3177.
[42] PE?UELAS J, RICO L, OGAYA R, et al. Summer season and long-term drought increase the richness of bacteria and fungi in the foliar phyllosphere of Quercus ilex in a mixed Mediterranean forest: phyllosphere richness under drought[J]. Plant Biology,2012,14(4):565-575.
[43] FATICOV M, ABDELFATTAH A, ROSLIN T, et al. Climate warming dominates over plant genotype in shaping the seasonal trajectory of foliar fungal communities on oak[J]. The New Phytologist,2021,231(5):1770-1783.
[44] FENG Y Z, ZHANG J W, BERDUGO M, et al. Temperature thresholds drive the global distribution of soil fungal decomposers[J]. Global Change Biology,2022,28(8):2779-2789.
[45] VINCENT J B, WEIBLEN G D, MAY G. Host associations and beta diversity of fungal endophyte communities in new guinea rainforest trees[J]. Molecular Ecology,2016,25(3):825-841.
[46] 罗竹慧,吴春玲,王艳丽,等.宿主身份与叶性状对海南热带山地雨林樟科和壳斗科植物叶内生真菌群落的影响[J].热带生物学报,2024,15(1):1-8. LUO Z H, WU C L, WANG Y L, et al. Effects of host identity and leaf traits on foliar endophytic fungal communities in Lauraceae and Fagaceae plants of tropical montane rainforest of Hainan island[J]. Journal of Tropical Biology,2024,15(1):1-8.
[47] MEYER K M, LEVEAU J H. Microbiology of the phyllosphere: a playground for testing ecological concepts[J]. Oecologia, 2012,168:621-629.
[本文编校:吴 毅]

