三角梅品种‘绿叶樱花’4,5-多巴双加氧酶开放阅读框克隆与分析
摘 要:【目的】多巴双加氧酶(4,5-DOPA dioxygenase extradiol)是甜菜色素生物合成途径的关键酶之一,能催化多巴分解形成甜菜醛氨酸,也是最可能与三角梅最终的花色形成相关的酶蛋白。克隆三角梅多巴双加氧酶基因的开放阅读框(ORF),对其编码的氨基酸序列进行生物信息学分析,探讨三角梅花色变化机理和甜菜色素代谢途径。【方法】以三角梅品种‘绿叶樱花’的苞片为材料,提取其RNA,并进行逆转录,之后快速转化完成基因的克隆和基因PCR扩增,最后对其编码的氨基酸序列进行保守区预测、信号肽分析、磷酸化位点预测、跨膜信号预测、同源性比对、构建系统进化树以及二、三级结构预测,研究其氨基酸序列的结构和功能。【结果】‘绿叶樱花’的多巴双加氧酶基因ORF序列长801 bp,编码266个氨基酸。ORF序列所编码的氨基酸序列具有cd07363保守结构域,其编码蛋白是一种稳定的酸性亲水蛋白,分子量为29 734.76 kD,等电点为6.26,二级结构包含了11个α螺旋、7个β转角、20个β折叠结构,具有4个磷酸化位点,没有跨膜结构,可能只在细胞质内发挥作用。该序列还与66个序列高度同源,与同科的‘金心双色’、胶果木和梭房叶子花有着相同的进化分支,符合自然进化规律。【结论】‘绿叶樱花’多巴双加氧酶开放阅读框ORF的氨基酸序列属于第三类雌二醇双加氧基因家族,具有该基因家族具有的保守氨基酸序列,表明多巴双加氧酶基因在生成甜菜色素植物中具有独特的保守性,且属于稳定、酸性的亲水蛋白,没有跨膜结构,可能只在细胞质内发挥作用。三角梅中控制花色变化的主要是甜菜色素,研究三角梅甜菜色素合成途径中的关键酶,解析其甜菜色素的合成代谢机制,可为三角梅花色形成机制提供理论参考,有望在今后的工作中,利用转基因手段丰富三角梅花色。
关键词:三角梅;多巴双加氧酶;开放阅读框;氨基酸序列;克隆
中图分类号:S718.46 文献标志码:A 文章编号:1673-923X(2024)07-0153-12
基金项目:云南省重大科技计划专项(202302AE090018)。
Cloning and analysis of open reading frame (ORF) of 4,5-DOPA dioxygenase in Bougainvillea peruviana
LI Jianyun1, YAO Guoqiong2, WANG Fei1, ZHU Wen1, LI Zihan1, SUN Zhenghai1, XIN Peiyao1
(1. Southwest Landscape Architecture Engineering Technology Research Center of National Forestry and Grassland Administration, Southwest Forestry University, Kunming 650224, Yunnan, China; 2. State-owned Weidu Forest Farm of Guangxi, Laibin 546100, Guangxi, China)
Abstract:【Objective】DOPA dioxygenase extradiol is one of the key enzymes in the beet pigment biosynthesis pathway, which can catalyze the decomposition of dopa to form beet aldehydanine. And it is also the most likely enzyme protein related to the final flower color formation of Bougainvillea peruviana. The open reading frame (ORF) of B. peruviana dioxygenase gene was cloned, and the amino acid sequence encoded by it was analyzed by bioinformatics to explore the mechanism of flower color change and the metabolic pathway of beet pigment.【Method】Taking the bracts of B. peruviana as materials, RNA was extracted, reverse transcription was carried out,and then gene cloning and gene PCR amplification were completed by rapid transformation. Finally, conserved region prediction, signal peptide analysis, phosphorylation site prediction, transmembrane signal prediction, homology comparison, phylogenetic tree construction and secondary and tertiary structure prediction were performed for the encoded amino acid sequence, the structure and function of amino acid sequence were studied.【Result】The 4,5-DOPA dioxygenase gene ORF sequence of B. peruviana was 801 bp in length, encoding 266 amino acids. The amino acid sequence encoded by the ORF sequence had a conserved domain of cd07363. The encoded protein was a stable acidic hydrophilic protein with a molecular weight of 29734.76 kD and an isoelectric point of 6.26. The secondary structure contained 11 α-helixes, 7 β-turns, and 20 β-sheets. It had 4 phosphorylation sites and no transmembrane structure. The sequence was also highly homologous to 66 sequences, with B. peruviana had the same evolutionary branch as B. peruviana Thimma, B. stipitata Griseb and Pisonia umbellifera, which was consistent with the law of natural evolution.【Conclusion】The amino acid sequence of the dopa dioxygenase open reading frame ORF of B. peruviana belongs to the third type of estradiol dioxygenase gene family, which has the conserved amino acid sequence of the gene family, indicating that the dopa dioxygenase gene has a unique conservatism in the production of beet pigment plants, and belongs to a stable, acidic hydrophilic protein. There is no transmembrane structure, and it may only play a role in the cytoplasm. Beet pigment is the main factor controlling the change of flower color in B. peruviana. Studying the key enzymes in the synthesis pathway of beet pigment in B. peruviana and analyzing the synthesis and metabolism mechanism of beet pigment can provide theoretical reference for the formation mechanism of flower color in B. peruviana. It is expected to enrich the flower color of B. peruviana by transgenic means in the future work.
Keywords: Bougainvillea peruviana; 4,5-DOPA dioxygenase; open reading frame; amino acid sequence; cloning
三角梅Bougainvillea peruviana为紫茉莉科Nyctaginaceae叶子花属Bougainvillea植物,多藤本或灌木,少乔木[1]。原产于巴西,主要分布于中国、巴西、阿根廷、日本等国家[2],目前已成为中国华南地区生产栽培和景观应用规模最大的园艺植物之一[3]。三角梅不仅观赏性强,还可入药[4]、开发天然食用色素[5]、用于生物防治及环境保护等[6]。已有研究表明,影响花色的因素有很多,如花瓣细胞内的理化环境[7]、花青素[8]、甜菜色素[9]和类胡萝卜素[10]等,而对三角梅花色起主要作用的是甜菜色素[11-12]。甜菜色素合成代谢的研究始于20世纪90年代,其合成途径主要包括酶促反应和自发反应,且反应起始于酪氨酸[13]。在甜菜色素的合成途径中,多巴双加氧酶(4,5-DOPA dioxygenase extradiol)是甜菜色素生物合成途径中的关键酶之一,它催化多巴4号、5号位碳键断裂生成4,5-开环多巴,4,5-开环多巴自发转化为甜菜色素的发色集团-甜菜醛氨酸[9]。而高等植物太阳花中的多巴双加氧酶基因最早被克隆,且属4,5-多巴雌二醇双加氧酶类[14-15]。随着基因克隆技术的发展,Harris等[16]将来自真菌毒蝇伞的多巴双加氧酶基因转化至拟南芥,再施加多巴培育,得到了变黄或变橘红色的拟南芥幼苗,并且也还检测到了甜菜黄素的产生。Nakatsuka等[17]将来自紫茉莉的多巴双加氧酶基因表达于烟草和拟南芥,成功重建甜菜素的生物合成途径。阮园[18]使用TAIL-PCR法首次成功地从盐地碱蓬基因组中克隆了4,5-多巴双加氧酶II基因SsDODA的启动子片段,并证明了盐地碱蓬SsDODA启动子片段能够驱动报告基因GUS在烟草叶片中表达。这些研究为4,5-多巴双加氧酶在植物色彩变化中起着一定的作用提供了理论依据。
对于观赏植物来说,花色是评价其观赏价值和进行品种分类的重要指标[19]。三角梅品种繁多,且花色丰富,在城市园林景观配置中占有十分重要的地位[20]。目前,对三角梅花色方面的研究相对较多,如Florian等[21]应用液相色谱—质谱等方法对三角梅花色进行研究,获得了三角梅中甜菜色素的分子结构;Zhang等[22]利用转录组分析揭示了三角梅花苞片颜色形成的规律,鉴定了三角梅甜菜色素生物合成相关基因,并确定了花瓣、雄蕊和心皮的基因共表达网络;徐夙侠等[23]对三角梅甜菜色素代谢酶多巴双加氧酶基因进行分离和表达,发现该基因的表达与花的颜色鲜艳程度直接相关。这些研究多集中于三角梅部分色素合成关键酶基因的分离表达和转录组分析,对花色性状相关的分子机制研究仍缺乏必要的理论支撑。如前所述,对三角梅花色起主要作用是甜菜色素,而多巴双加氧酶是该途径中的关键酶之一。开放阅读框是基因序列的一部分,是预测基因编码区域的重要标志,它提供了一种可能的蛋白质翻译模板,在基因组分析和基因克隆的研究中,识别开放阅读框是寻找新基因和理解其功能的关键步骤之一[24]。目前,有关三角梅多巴双加氧酶开放阅读框(ORF)克隆与分析方面的研究还未见相关报道,对三角梅品种‘绿叶樱花’Bougainvillea peruviana多巴双加氧酶开放阅读框进行克隆,分析其编码的氨基酸序列,进而探究三角梅多巴双加氧酶基因在甜菜色素合成过程中的功能和作用,可为三角梅花色形成机制提供理论参考。
1 材料与方法
1.1 试验材料
来源于云南省弥勒市吉成园林科技股份有限公司三角梅基地,取三角梅品种‘绿叶樱花’的苞片为多巴双加氧酶(ORF)克隆的材料(图1),材料放于液氮速冻后存于-80 ℃冰箱中备用。

1.2 方 法
1.2.1 RNA提取、检测与逆转录cDNA合成
以美吉RNA试剂盒提取三角梅品种‘绿叶樱花’苞片的RNA,以1%琼脂糖凝胶检测RNA完整性,核酸蛋白测定仪ND2000检测RNA浓度及质量。以天根逆转录试剂盒完成逆转录,RNA均稀释至50 ng/μL。反应体系:5×FastKing-RT Super Mix 4 μL,50 ng/μL RNA 2 μL,RNase-Free ddH2O补足到20 μL,于冰上进行加样。反应程序:42 ℃15 min(去除基因组及反转录反应),95 ℃3 min(酶灭活)。
1.2.2 多巴双加氧酶ORF的PCR扩增与克隆
使用TBtools[25]软件搜索多巴双加氧酶(TRINITY-DN4651-c0-g1)ORF区域,再通过Primer5[26]软件在序列两侧设计引物,参数设置为预期扩增产物100~500 bp,引物长度18~24 bp,退火温度50~60 ℃,从5对引物中挑选出2对,得到的预期产物为852 bp(表1)。对ORF的PCR扩增及产物检测,模板为上述逆转录产物。PCR 反应体系25 μL:1-5TM 2X High-Fidelity Master Mix 12.5 μL,上/下引物各1 μL,模板1 μL,ddH2O 9.5 μL;反应程序为:98 ℃预变性2 min;扩增35个循环,每个循环为98 ℃变性10 s,59 ℃退火15 s,72 ℃延伸(30、60、90 s);72 ℃延伸5 min后,25℃保温。扩增产物用1%琼脂糖凝胶电泳检测,于凝胶成像仪上拍照记录。使用擎科PCR产物凝胶回收试剂盒回收目的片段。回收并纯化后使用pClone007 Versatile Simple Vector Kit连接目的片段,连接反应体系为:5×pClone007 VS mix 2 μL,PCR物8 μL,ddH2O补至10 μL。室温(22~30℃)反应1~5 min。最后使用TreliefTM 5α Chemically Competent Cell进行快速转化,挑选阳性克隆进行验证、测序。
1.2.3 多巴双加氧酶ORF序列分析
目的片段经回收、连接、转化及测序以后,使用ContigExpress软件拼接序列,再通过Expasy在线翻译工具(https://web.expasy.org/translate/)将核苷酸序列翻译成蛋白序列,最后通过NCBIBLAST在线分析工具对开放阅读框序列进行分析,分析NCBI数据库中的高度同源序列。

1.2.4 多巴双加氧酶ORF编码氨基酸序列分析
使用ProtParam[27]在线分析工具(https://web. expasy.org/protparam/)对‘绿叶樱花’多巴双加氧酶ORF编码的氨基酸序列(TRINITY-DN4651-c0-g1)进行分析,解析‘绿叶樱花’多巴双加氧酶ORF编码氨基酸组成。
1.2.5 多巴双加氧酶ORF编码蛋白保守区预测和分析
通过NCBI-Conserved Domain Seae在线分析工具分析‘绿叶樱花’巴双加氧酶ORF编码氨基酸的保守结构域,分析其属于的基因家族,并比对NCBI数据库中与‘绿叶樱花’多巴双加氧酶编码氨基酸序列相似性较高的物种序列。
1.2.6 多巴双加氧酶ORF编码蛋白信号肽及磷酸化位点预测
使用SignalP 4.1 Server[28]在线分析工具预测‘绿叶樱花’ORF编码蛋白信号肽,可视化‘绿叶樱花’多巴双加氧酶ORF区蛋白信号。使用在线氨基酸分析工具NetPhos 2.0对‘绿叶樱花’DOPA蛋白进行磷酸化位点预测,可视化‘绿叶樱花’多巴双加氧酶ORF区磷酸化位点。
1.2.7 多巴双加氧酶ORF编码蛋白跨膜信号预测
通过在线氨基酸序列分析工具TMpred Server[29]对‘绿叶樱花’多巴双加氧酶ORF蛋白进行跨膜信号预测,根据‘绿叶樱花’多巴双加氧酶ORF蛋白进行跨膜信号值,解析其跨膜结构。
1.2.8 多巴双加氧酶ORF编码氨基酸同源性比对
与系统进化树构建
以‘绿叶樱花’的多巴双加氧酶编码氨基酸为参考序列,使用DNAMAN软件比对6种植物的多巴双加氧酶编码氨基酸。从NCBI(https:// www.ncbi.nlm.nih.gov/)中搜索不同物种的多巴双加氧酶基因序列,基于Neighbor-Joining法,使用MEGA-X[30]软件构建与同源性较高的物种的多巴双加氧酶基因进化树,分析的结果用FigTree(version 1.4.4)进行可视化和美化调整。
1.2.9 多巴双加氧酶ORF编码蛋白二级、三级结构预测
采用DNAstar-Protean[31]软件预测‘绿叶樱花’多巴双加氧酶ORF编码蛋白的二级结构进行预测,再通过SWISS-MODEL在线分析工具对‘绿叶樱花’多巴双加氧酶ORF编码蛋白进行三级结构预测,可视化‘绿叶樱花’多巴双加氧酶ORF编码蛋白二级和三级结构。
2 结果与分析
2.1 多巴双加氧酶基因ORF的PCR扩增分析
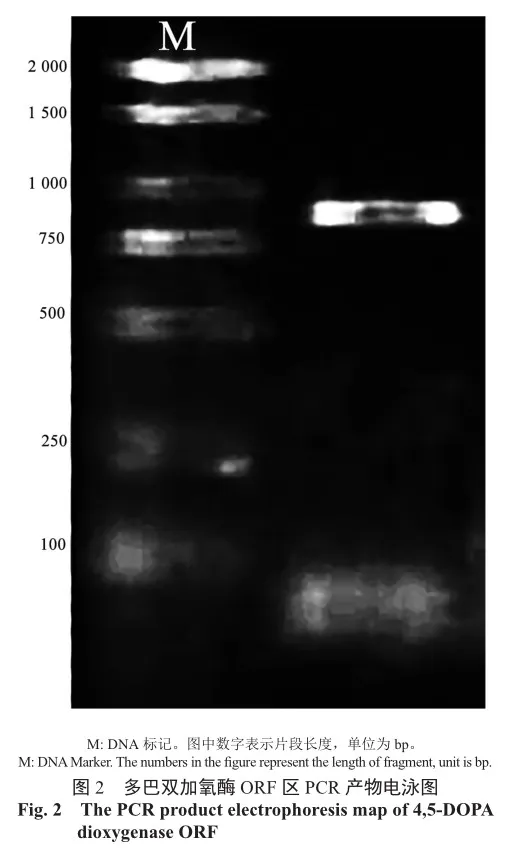
提取‘绿叶樱花’苞片的cDNA,并扩增多巴双加氧酶的开放阅读框。结果发现,72 ℃延伸60 s时得到位于750~1 000 bp之间的特异性条带,与预期产物大小852 bp相近,且条带清晰、明亮(图2),可用于后续试验。
2.2 多巴双加氧酶ORF序列分析
目的片段经回收、连接、转化及测序之后,得到两段序列,上游引物扩增产物大小为852 bp,下游引物扩增产物大小为827 bp。‘绿叶樱花’多巴双加氧酶开放阅读框全长序列大小为852 bp,该序列的开放阅读框位于28~829 bp之间,总长801 bp,起始密码子为ATG,终止密码子为TAA。该序列共编码266个氨基酸。序列如下(黄色区域为引物序列,紫色区域为起始密码子和终止密码子,奇数行代表的多巴双加氧酶开放阅读框全长,序列大小为852 bp,61表示该行从第61个碱基开始,偶数行代表的是该序列所编码的氨基酸,共266个,12表示该行从第12个氨基酸开始)。
‘绿叶樱花’多巴双加氧酶ORF区(TRINITY-DN4651-c0-g1)与NCBI数据库中66个序列具有高度同源性,且同源性均大于70%。其中,与同属植物‘金心双色’和梭房叶子花的同源性最高,分别为95.18%和94.81%;与同科异属植物避霜花Pisonia aculeata胶果木、Acleisanthes obtusa、Acleisanthes lanceolata和紫茉莉Mirabilis jalapa的同源性分别为86.34%、87.83%、82.6%、82.45%和82.44%;与其他科植物如七索藤Ercilla volubilis、冰叶日中花Mesembryanthemum crystallinum、凤卵Pleiospilos compactus subsp. canus、土人参Talinum spp.和蒜香草Petiveria alliacea的同源性分别为80.39%、81.08%、80.82%、80.23%和80.74%(图3)。

2.3 多巴双加氧酶ORF编码氨基酸序列分析
‘绿叶樱花’多巴双加氧酶ORF编码的氨基酸序列分析结果表明,多巴双加氧酶ORF序列分子量为29 734.76 kD,等电点为6.26,表明其偏弱酸性。GRAVY值为-0.31,是亲水性蛋白。不稳定系数为33.61,表明其可稳定存在,推测其分子式为C1348H2035N359O384S10。
‘绿叶樱花’多巴双加氧酶ORF编码的蛋白由20种氨基酸组成,其中非极性氨基酸数量占总氨基酸数量的44.36%,极性不带电氨基酸占 30.45%,带正电荷氨基酸占15.04%,带负电氨基酸占10.15%(图4)。
2.4 多巴双加氧酶ORF编码蛋白保守区预测和分析
通过NCBI-Conserved Domain Seae在线分析工具搜索‘绿叶樱花’多巴双加氧酶ORF编码氨基酸的保守结构域。由图5可知,‘绿叶樱花’多巴双加氧酶ORF序列具有一个cd07363保守结构域,属雌二醇双加氧酶-3B类基因家族。该序列与‘金心双色’、胶果木、避霜花、紫茉莉和冰叶日中花多巴双加氧酶编码氨基酸序列的相似性分别为95.18%、87.83%、86.34%、82.44%和81.08%。

2.5 多巴双加氧酶ORF编码蛋白信号肽和磷酸化位点预测
通过SignalP 4.1 Server在线分析工具预测‘绿叶樱花’ORF编码蛋白信号肽,结果如图6。由图可知该蛋白不具有信号肽,不属于分泌蛋白。通过在线氨基酸分析工具NetPhos 2.0对‘绿叶樱花’DOPA蛋白进行磷酸化位点预测,发现大于等于0.5的位点有4个,因此可以预测该蛋白的肽链中含有4个磷酸化位点,分别为Serine、Threonine、Tyrosine和Threshold(图7)。

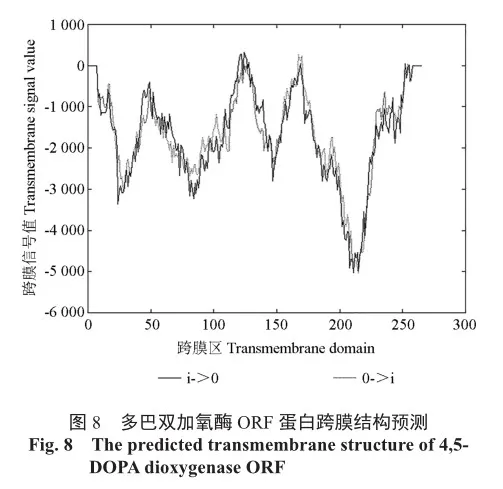
2.6 多巴双加氧酶ORF编码蛋白跨膜信号预测
生物膜含的蛋白质叫膜蛋白,细胞中普遍存在,是生物膜功能的主要承担者。对‘绿叶樱花’多巴双加氧酶ORF蛋白进行跨膜信号预测发现,其跨膜信号没有达到500,因此其没有跨膜结构,说明该蛋白可能仅在细胞质中发挥作用,不存在运输,也不是生物膜的膜蛋白(图8)。
2.7 多巴双加氧酶ORF编码氨基酸同源性比对与系统进化树构建
使用DNAMAN软件比对6种植物的多巴双加氧酶编码氨基酸,墨蓝色表示氨基酸序列完全相同,紫红色表示氨基酸序列相似性较高,浅蓝色表示氨基酸序列相似性较低,无色表示氨基酸序列相似度极低。不同植物多巴双加氧酶基因的编码氨基酸同源性比对结果如图9所示。由图9可知,克隆所得的‘绿叶樱花’多巴双加氧酶ORF与其他植物多巴双加氧酶编码的氨基酸序列差异较大,保守性不高。
从NCBI中搜索不同物种的多巴双加氧酶基因序列,绘制不同物种的多巴双加氧酶基因进化树,结果如图10所示。由图10可知,‘绿叶樱花’多巴双加氧酶ORF与同科植物‘金心双色’(>LC542878.1)、胶果木(>KR376166.1)、梭房叶子花(>KR376165.1)的多巴双加氧酶基因处于同一进化分支,其中又与同属的‘金心双色’进化最相近。在不同物种间的比较中,毒蝇伞Amanita muscaria多巴双加氧酶在进化树上形成一个独立的分支,表明其与植物多巴双加氧酶不具有同源性,是独立进化的。
2.8 多巴双加氧酶ORF编码蛋白二级、三级结构预测
在蛋白质的局部片段上,常常会观察到主链上的周期性规则构象,比如α螺旋和β转角等,这种周期性的规则主链构象被称为二级结构,对‘绿叶樱花’多巴双加氧酶ORF编码蛋白的二级结构预测发现,该蛋白含11个α螺旋、7个β转角、20个β折叠二级结构,其组成氨基酸多具有亲水性,从抗原指数来看,其位于抗原性较好的区段(图11)。

蛋白质的三级结构是指由多个二级结构单元拼装而成的具有紧密形态的三维空间结构,对‘绿叶樱花’多巴双加氧酶ORF编码蛋白进行三级结构预测,结果如图12所示。由图12可知,组成该蛋白三级构的二级结构主要为β折叠、α螺旋及β转角,这与上述二级结构预测结果一致。

3 结论与讨论
3.1 讨 论
Nobuhiro等[9]通过大肠杆菌表达该基因重组蛋白,探测了紫茉莉中多巴双加氧酶基因的表达,发现在花期的5个阶段,盛花期的表达最强,即花苞的颜色越鲜艳该基因的表达越高,证明不同时期的实验材料会导致其结果不同。试验基于三角梅品种‘绿叶樱花’苞片的转录组注释信息,克隆了其多巴双加氧酶ORF(TRINITY-DN4651-c0-g1)全长序列,该序列共852 bp,ORF全长801 bp,编码266个氨基酸,徐夙侠等[32]对同科紫茉莉的4,5-多巴双加氧酶基因进行克隆,得到ORF序列长度801 bp,编码267个氨基酸,这与本试验结果基本一致。本研究对ORF区进行生物信息学分析:预测该ORF编码的多肽链分子量为29 734.76 kD,等电点为6.26,是一种稳定、酸性的亲水蛋白;对三角梅的3个品种:斯普伦顿斯Bougainvillea spectabilis、斑叶重红Bougainvillea buttiana和‘金心双色’的多巴双加氧酶基因进行分析认为该基因编码氨基酸翻译蛋白分子量分别为33 758、33 076和33 233 kD,等电点分别是5.62、5.54和5.94,与本研究结果数据上存在较大差异,但仍属于稳定、酸性的亲水蛋白的范畴。这可能是由于采样时期不同所导致的[24],未来研究中应严格把控实验材料时期的一致性,确保实验结果的可靠与准确,也应该利用材料不同时期积极挖掘其内部因素,以更准确地了解三角梅花色的形成机理。
将‘绿叶樱花’ORF核苷酸序列进行NCBIBLAST比对,发现其与66个序列高度同源,且同源性均在70%以上,其中与同属植物‘金心双色’和梭房叶子花的同源性最高,分别为95.18%和94.81%;并且其多巴双加氧酶ORF序列具有一个cd07363保守结构域,由此结果可知‘绿叶樱花’的多巴双加氧酶基因属于第三类雌二醇双加氧基因家族(class Ⅲ extradiol dioxygenase family),具有该基因家族具有的保守氨基酸序列。李霆格等[33]在对同为被子植物门的三色堇中4,5-多巴二醇双加氧酶基因研究中发现,三色堇的DODA基因也属于雌二醇双加氧酶-3B类基因家族,与本试验结果相一致。将其氨基酸序列与其他植物多巴双加氧酶氨基酸序列进行系统发育分析,发现其与同科的‘金心双色’、胶果木和梭房叶子花有着相同的进化分支,而曹燕亭等[34]以桃、粉、红和橙色的重瓣三角梅苞片为材料,克隆的多巴双加氧酶基因与叶子花Bougainvillea spectabilis和紫茉莉Mirabilis jalapa的多巴双加氧酶基因亲缘关系较近,研究结果存在较大差异,这可能与试验材料不同有关[33]。导致亲缘识别的研究结果存在差异的主要原因主要与实验材料的选择、亲缘关系的界定标准、环境条件及测定的指标不统一有关[35]。将来的研究应重点从生理生化、分子和代谢水平上等多方面深入研究,以便更准确地鉴别植物之间的亲缘关系。
对‘绿叶樱花’多巴双加氧酶ORF编码蛋白进行二级结构和三级结构预测,二、三级结构预测结果一致,包含了11个α螺旋、7个β转角、20个β折叠结构;对其进行跨膜和信号肽预测,没有发现跨膜结构,具有4个磷酸化位点,表明其可能只在细胞质内发挥作用,柏忠良等[36]以小花深红的叶子花作为实验材料,预测该氨基酸序列二级结构是由8个α螺旋、8个β转角、20个β折叠和一些松散结构组成,对其DOD蛋白进行磷酸化位点预测可得出该蛋白的肽链中含有12个磷酸化位点,α螺旋和磷酸位点数量存在较大差异,这也可能是所使用的材料不同所导致的。多巴双加氧酶能够在大肠杆菌中产生甜菜色素的基本结构甜菜醛氨酸,这是甜菜色素中的发色和活性结构单元[37]。通过对双加氧酶进行酶促反应动力学研究发现双加氧酶是一种非血红素类含铁蛋白,但是目前还未能直接从植物体中提取出多巴双加氧酶蛋白[38]。因此,应该进一步挖掘甜菜色素生物合成途径中其他的基因和酶类,如与糖基化和酰基化反应有关的基因和酶类,来进一步解释甜菜色素结构多样性的形成机制。
目前虽已获得许多不同花色的三角梅,但仍然缺乏新异花色,利用基因工程技术创造三角梅新花色是育种的有效手段之一[39]。本研究仅克隆了多巴双加氧酶基因并进行了序列分析,且样本数量较少,存在一定的局限性,因此想要更为准确地了解三角梅花色的成色与调控机制,在未来的研究中,需要更多的样本测序和基因分析来进一步探索这些问题。
3.2 结 论
三角梅品种‘绿叶樱花’多巴双加氧酶开放阅读框ORF(TRINITY-DN4651-c0-g1)克隆与分析结果表明,多巴双加氧酶基因在生成甜菜色素植物中具有独特的保守性,且属于稳定、酸性的亲水蛋白,没有跨膜结构,可能只在细胞质内发挥作用。三角梅中控制花色变化的主要是甜菜色素而非黄酮类的花青素,结合花青素与甜菜色素代谢途径在自然界中不能共存的现象,研究三角梅甜菜色素合成途径中的关键酶,解析其甜菜色素的合成代谢机制,是使用转基因方法改变三角梅花色重要理论基础,本研究结果可为从分子生物学研究三角梅的花色变化机理提供理论依据。
参考文献:
[1] 杜学林,刘悦明,伍青,等.三角梅属研究进展[J].湖北农业科学,2022,61(1):12-17. DU X L, LIU Y M, WU Q, et al. Research progress of Bougainvillea[J]. Hubei Agricultural Sciences,2022,61(1):12-17.
[2] 陈邦海.林业实用技术培训读本园林花木养护技术[M].武汉:湖北科学技术出版社,2016:122-128. CHEN B H. Forest practical technology training reader garden flower and wood conservation technology[M]. Wuhan: Hubei Science and Technology Press,2016:122-128.
[3] 翁向英,叶如光,刘明金,等.中国簕杜鹃产业现状分析与展望[J].中国花卉园艺,2022,22(2):6-29. WENG X Y, YE R G, LIU M G, et al. Current situation analysis and prospects of the cuckoo industry in China Bougainvillea spectabilis[J]. China Flowers Horticulture,2022,22(2):6-29.
[4] G H O G A R A , J I R A U N G K O O R S K U L K , JIRAUNGKOORSKUL W. Paper flower, Bougainvillea spectabilis:update properties of traditional medicinal plant[J]. Journal of Natural Remedies,2016,16(3):82.
[5] CELLI G B, BROOKS M S. Impact of extraction and processing conditions on betalains and comparison of properties with anthocyanins: a current review[J]. Food Research International, 2017,100(3):501-509.
[6] SANGTHONG S, SUKSABYE P, THIRAVETYAN P. Air- borne xylene degradation by Bougainvillea buttiana and the role of epiphytic bacteria in the degradation[J]. Ecotoxicology and Environmental Safety,2016,126:273-280.
[7] 高赛,刘佳,唐玉情,等.长春花不同花色品种呈色的关键理化性质分析[J].经济林研究,2022,40(1):214-227. GAO S, LIU J, TANG Y Q, et al. Analysis on the key physical and chemical properties of the coloration of varietals of Catharanthus roseus[J]. Non-wood Forest Research,2022,40(1): 214-227.
[8] 朱满兰,王亮生,张会金,等.耐寒睡莲花瓣中花青素苷组成及其与花色的关系[J].植物学报,2012,47(5):437-453. ZHU M L, WANG L S, ZHANG H J, et al. Anthocyanin composition in cold-tolerant Nymphaea alba petals and its relationship with flower color[J]. Chinese Bulletion of Botany,2012,47(5):437-453.
[9] NOBUHIRO S,YUTAKA A,YUKIHIRO G, et al. Detection of DOPA 4,5-Dioxygenase (DOD) activity using recombinant protein prepared from Escherichia coli cells harboring cDNA encoding DOD from Mirabilis jalapa[J]. Plant Cell Physiology, 2009,50(5):1012-1016.
[10] MAOKA T. Carotenoids as natural functional pigments[J]. Journal of Natural Medicines,2020,74(1):1-16.
[11] LEE, D W, COLLINS, T M. Phylogenetic and ontogenetic influences on the distribution of anthocynins and betacyanins in leaves of tropical plants[J]. International Journal of Plant Sciences,2001,162(5):1141-1153.
[12] THIRUCHELVI R, MONISHA R J, GAYATHIRI A. Extraction optimization and characterization of pigment from floral bracts of Bougainville spectabilis[J]. Research Journal of Pharmacy and Technology,2020,13(3):1074.
[13] 黄青云,李鑫,徐夙侠.三角梅色素合成与应用前景[J].中国花卉园艺,2023(2):33. HUANG Q Y, LI X, XU S X. Synthesis and application prospect of Bougainvillea glabra[J]. Chinese Flowers Horticulture, 2023(2):33.
[14] CHRISTINET L, BURDET F X, ZAIKO М, et al. Characterization and functional identification of a novel plant 4,5-extradiol dioxygenase involved in betalain pigment biosynthesis in Portulaca grandiflora[J]. Plant Physiology, 2004,134(1):265-274.
[15] HINZ U G, FIVAZ J, GIROD P A, et al. The gene coding for the DOPA dioxygenase involved in betalain biosynthesis in Amanita muscaria and its regulation[J]. Molecular General Genetics,1997,256(1):1-6.
[16] HARRIS N N, JAVELLANA J, DAVIES K M, et al. Betalain production is possible in anthocyanin-producing plant species given the presence of DOPA-dioxygenase and L-DOPA[J]. BMC Plant Biology,2012,12:34.
[17] NAKATSUKA T, YAMADA E, TAKAHASHI H, et al. Genetic engineering of yellow betalain pigments beyond the species barrier[J]. Scientific Reports,2013,3(6):1970.
[18] 阮圆.盐地碱蓬4,5-多巴双加氧酶基因的克隆和功能分析[D].济南:山东师范大学,2008. RUAN Y. Cloning and functional analysis of the gene encoding 4,5-DOPA dioxygenase in Suaeda salsa[D]. Jinan: Shandong Normal University,2008.
[19] 陈建,陈晨甜,吕长平.观赏植物花色形成影响因子研究进展[J].现代园艺,2009(6):4-6,10. CHEN J, CHEN C T, LYU C P. Research progress on influencing factors of flower color formation of ornamental plants[J]. Modern Horticulture,2009(6):4-6,10.
[20] 张盛旺,黄彦晶.三角梅观赏特性及其园林应用[J].安徽农学通报,2013,19(24):97-98,112. ZHANG S W, HUANG Y J. Ornamental characteristics and garden application of Bougainvillea glabra[J]. Anhui Agricultural Science Bulletin,2013,19(24):97-98,112.
[21] FLORIAN K, STINTZING F C, CARLE R. Characterisation of betalain patterns of differently coloured inflorescences from Gomphrena globosa and Bougainvillea sp. by HPLC-DAD-ESIMSn[J]. Analytical and Bioanalytical Chemistry,2007,387(2): 637-648.
[22] ZHANG W P, ZHOU Q, LIN J S, et al. Transcriptome analyses shed light on floral organ morphogenesis and bract color formation in Bougainvillea[J]. BMC Plant Biology,2022,22(1):97.
[23] 徐夙侠,林春松,黄青云,等.三角梅甜菜色素代谢酶4,5-DOPA-dioxygenase基因的分离和表达[J].热带作物学报, 2013,34(11):2214-2221. XU S X, LIN C S, HUANG Q Y, et al. Isolation and expression of genes of beet pigment metabolizing enzyme 4,5-DOPAdioxygenase in Bougainvillea[J]. Chinese Journal of Tropical Crops,2013,34(11):2214-2221.
[24] MIR K, NEUHAUS K, SCHERER S, et al. Predicting statistical properties of open reading frames in bacterial genomes[J]. PLoS ONE,2012,7(9):e45103.
[25] CHEN C J, CHEN H, ZHANG Y, et al. TBtools: an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant,2020,13(8):1194-1202.
[26] 张新宇,高燕宁.PCR引物设计及软件使用技巧[J].生物信息学,2004,2(4):15-18,46. ZHANG X Y, GAO Y N. PCR primer design and software application techniques[J]. China Journal of Bioinformatics, 2004,2(4):15-18,46.
[27] GARG V K, AVASHTHI H, TIWARI A, et al. MFPPI-Multi FASTA ProtParam interface[J]. Bioinformation,2016,12(2): 74-77.
[28] BENDTSEN J D, NIELSEN H, HEIJNE G V, et al. Improved prediction of signal peptides: signalP 3.0[J]. Journal of Molecular Biology,2004,340(4):783-795.
[29] HASAN M A, AHMAD S. MlysPTMpred: multiple lysine PTM site prediction using combination of SVM with resolving data imbalance issue[J]. Natural Science,2018,10(9):370-384.
[30] KUMAR S, TAMURA K, NEI M. MEGA: molecular evolutionary genetics analysis software for microcomputers[J]. Computer Applications in the Biosciences,1994,10(2):189-191.
[31] HOFFMANN R, LASZLO P. Protean[J]. Angewandte Chemie International Edition,2001,40(6):1033-1036.
[32] 徐夙侠,林春松,黄青云,等.紫茉莉4,5-多巴双加氧酶基因的克隆和表达[J].亚热带植物科学,2011,40(2):1-3. XU S X, LIN C S, HUANG Q Y, et al. Cloning and expression of 4,5-dopa dioxygenase gene in Mirabilis jalapa[J]. Subtropical Plant Science,2011,40(2):1-3.
[33] 李霆格,杨文汉,曾媛,等.三色堇4,5-多巴雌二醇双加氧酶基因的克隆及生物信息学分析[J].分子植物育种,2017,15(2): 433-440. LI T G, YANG W H, ZENG Y, et al. Cloning and bioinformatics analysis of the gene of 4,5-DOPA estradiol dioxygenase in Viola wittrockiana[J]. Molecular Plant Breeding,2017,15(2):433-440.
[34] 曹燕亭,刘姗,孙蓉,等.三角梅4,5-多巴双加氧酶基因的克隆与表达分析[J].分子植物育种,2018,16(1):54-60. CAO Y T, LIU S, SUN R, et al. Cloning and expression analysis of 4,5-DOPA dioxygenase gene from Bougainvillea glabra[J]. Molecular Plant Breeding,2018,16(1):54-60.
[35] 林威鹏,彭莉,肖桃艳,等.植物亲缘识别的研究进展[J].植物生态学报,2015,39(11):1110-1121. LIN W P, PENG L, XIAO T Y, et al. Recent advance of kin recognition in plant[J]. Chinese Journal of Plant Ecology, 2015,39(11):1110-1121.
[36] 柏忠良,佘文琴,潘东明,等.叶子花花色DOD基因全长cDNA克隆与序列分析[J].福建林学院学报,2014,34(2): 152-157. BAI Z L, SHE W Q, PAN D M, et al. Cloning and sequence analysis of full-length cDNA of DOD gene in Bougainvillea glabra[J]. Journal of Fujian College of Forestry,2014,34(2): 152-157.
[37] FERNANDO G H, FRANCISCO G C. Characterization of recombinant Beta vulgaris 4,5-DOPA-extradiol-dioxygenase active in the biosynthesis of betalains[J]. Planta,2012,236(1): 91-100.
[38] LIPSCOMB J D. Mechanism of extradiol aromatic ringcleaving dioxygenases[J]. Current Opinion in Structural Biology, 2008,18(6):644-649.
[39] 刘姗,孙蓉,王胜男,等.三角梅花色素分析及其蓝色花色转基因受体的筛选研究[Z].攀枝花:攀枝花学院,2021:12-30. LIU S, SUN R, WANG S N, et al. Anthocyanidin analysis of Bougainvillea glabra and screening of its blue color transgene receptor[Z]. Panzhihua: Panzhihua College,2021:12-30.
[本文编校:吴 毅]

