‘德油6号’油茶带芽茎段快繁体系的建立
摘 要:【目的】探究基本培养基、激素类型及配比对油茶带芽茎段芽诱导、芽增殖及无菌苗生根的影响,建立油茶高效快繁体系,为今后‘德油系列’油茶商品化育苗提供技术支撑。【方法】以油茶优良单株‘德油6号’的带芽茎段为试材,研究基本培养基、生长素、激素配比对芽诱导初代培养,IBA、IAA、KT等激素配比对芽增殖培养,速蘸IBA、水杨酸等处理方法对瓶内外生根培养的影响,确定适宜的消毒方法以及增殖和生根培养基。【结果】IAA与IBA诱导外植体腋芽萌发显著高于NAA,且IAA在促进芽伸长方面明显优于IBA;WPM与1/2MS基本培养基对于芽诱导均有较好的生长效果,WPM培养基对芽生长速度方面有促进作用;油茶带芽茎段芽诱导正交试验设计采用6-BA、IAA、GA3 3种激素,因素主次:IAA>6-BA>GA3,组合A1 B1 C1:WPM+1.0 mg/L 6-BA+1.0 mg/L IAA+2.0 mg/L GA3,诱导率为93.8%;采用WPM+2.0 mg/L 6-BA+0.25 mg/L IBA+ 1.0 mg/L KT,增殖系数为3.14,且生长强壮,叶片翠绿;对单芽处理其基部速沾5.0 mg/mL IBA(10 s)+1.0 mg/L水杨酸(20 s),生根效果明显,接入1/2MS(4 g/L琼脂)空白培养基生根率高达90.9%,而接入扦插基质为蛭石+珍珠岩=1∶1时,生根率达到了87.5%。【结论】建立了油茶带芽茎段的组培快繁体系,尤其是采用速蘸高浓度生长素的方法,通过瓶内外生根的方式达到了较高的生根率。
关键词:油茶;组织培养;带芽茎段;诱导;丛生苗;生根
中图分类号:S794.4 文献标志码:A 文章编号:1673-923X(2024)07-0130-10
基金项目:湖南省创新型省份建设专项(2021NK1007);长沙市“揭榜挂帅”重大科技专项(Kq2102007-02)。
Tissue culture through the stem segment with buds of‘Deyou No. 6’ Camellia oleifera
LI Ziyu1, HOU Silu1, ZHOU Bicheng2, WU Juntao1, HU Yingjie1, YUAN Deyi1, FAN Xiaoming1
(1.a.The Key Laboratory of Non-wood Forest Products of National Forestry and Grassland Administration; b. Hunan Key Laboratory of Colleges and Universities of Oil Tea Breeding, Central South University of Forestry Technology, Changsha 410004, Hunan, China; 2. Forest Tree and Seedling Administrative General Station of Hubei Provincial Forestry Bureau, Wuhan 430079, Hubei, China)
Abstract:【Objective】To explore the effects of basic medium, hormone type and ratio on the bud and stem segment of Camellia oleifera belt, establish an efficient and rapid propagation system for C. oleifera in order to provide technical support for the commercial cultivation of C. oleifera in the future.【Method】The stem segment with bud of a superior C. oleifera plant ‘Deyou No. 6’ was used as the test material to study the effects of basic medium, growth hormone and hormone ratio on primary bud induction culture, IBA, IAA, KT and other hormone ratio on proliferation culture, and quick dip IBA, salicylic acid treatment methods on rooting culture inside and outside the bottle. Determine appropriate disinfection methods and breeding and rooting media.【Result】The axillary bud germination induced by IAA and IBA was significantly higher than NAA, and IAA was significantly better than IBA in promoting bud elongation. Both WPM and 1/2MS basic medium had good growth effect on bud induction, but WPM medium promoted the growth rate of bud. The orthogonal experiment of bud induction in stem segment of oil tea belt was designed with three hormones, 6-BA, IAA and GA3, and the main factors were IAA>6-BA>GA3, A1B1C1: WPM+1.0 mg/L 6-BA+1.0 mg/L IAA+2.0 mg/L GA3, and the induction rate was 93.8%. With WPM+2.0 mg/L 6-BA+0.25 mg/L IBA+1.0 mg/L KT, the proliferation coefficient was 3.14, and the leaves were strong and green. For single bud treatment, the rooting effect was obvious when the base of the bud was rapidly soaked with 5.0 mg/mL IBA(10 s)+1.0 mg/L salicylic acid (20 s). The rooting rate reached 90.9% when the blank medium of 1/2MS (4g/L Agar) was added, and the rooting rate reached 87.5% when the medium of vermiculite+perlite was 1∶1.【Conclusion】The tissue culture and rapid propagation system of buds and stems of C. oleifera was established, especially the method of rapid dipping with high concentration of auxin was used to achieve a higher rooting rate by rooting inside and outside the bottle.
Keywords: Camellia oleifera; tissue culture; stem segment with bud; induction; clustered seedlings; rooting
油茶Camellia oleifera作为我国特有的木本油料树种[1],具有巨大的发展优势和潜力,并且油茶林兼生态效益、经济效益和社会效益于一身,也可作为我国粮油保障的后盾和支持。通过油茶组织培养可以对一些优良种质资源离体保存和快速繁育,不仅能周年供苗,而且成本低廉。然而油茶组织培养面临繁殖系数低、生根困难和移栽成活率低等问题,致使组培技术难以应用于实际生产。选用带芽茎段作为外植体,利用组织培养的方式进行快繁诱导丛生芽,培养周期短,可短时间大量繁殖,既能保持其优良基因性状,也能产生整齐一致的苗木。部分物种已经建立起较为完善高效的快繁体系[2-4],而对于油茶前人也有一定的研究,如黄莉雅[5]发现7月是采集的带芽茎段最佳时期,通过筛选植物激素配比得到MS+2.0 mg/L 6-BA+0.2 mg/L NAA 诱导愈伤组织和芽的效果最优。由于油茶的遗传背景和倍性较为复杂,品种也较多,使得不同品种之间的培养条件差异较大,且大部分油茶可以顺利进行芽诱导和增殖,却难以攻克生根和移栽的环节,因此直接影响了油茶的工厂化生产步伐以及组培技术的推广应用。
‘德油6号’为“德油系列”油茶优良单株之一,该系列均为攸县油茶良种‘攸杂2号’与普通油茶良种‘华硕’种间杂交后代,由中南林业科技大学经济林培育与保护教育部重点实验室袁德义教授团队通过10余年远缘杂交技术选育出的新种质。该种质具有果大皮薄、含油量高,品质优,抗病性强等优点。本研究以‘德油6号’油茶带芽茎段为材料,对油茶组培快繁体系中芽诱导、增殖和高效生根培养进行研究,从而建立起完善的油茶组培快繁体系,为油茶的大量生产和种苗繁育提供参考。
1 材料与方法
1.1 材 料
2022年4—5月,于湖南长沙中南林业科技大学油茶试验基地,剪取油茶优良单株‘德油6号’强壮且健康的半木质化带芽茎段。本研究初代和增殖培养基均附加30 g/L蔗糖、7.5 g/L琼脂,调制其pH值为5.8。
1.2 方 法
1.2.1 芽诱导生长素的筛选
以1/2MS为基本培养基,固定添加2.0 mg/L 6-BA,同时分别添加激素IAA、IBA、NAA(均为1.0 mg/L)以诱导油茶腋芽分化。1.2.2 芽诱导基本培养基的筛选
将油茶带芽茎段接种在MS、1/2MS和WPM 3种不同的基本培养基上,添加相同水平的植物激素2.0 mg/L 6-BA和1.0 mg/L IAA。
1.2.3 芽诱导植物激素及配比的筛选
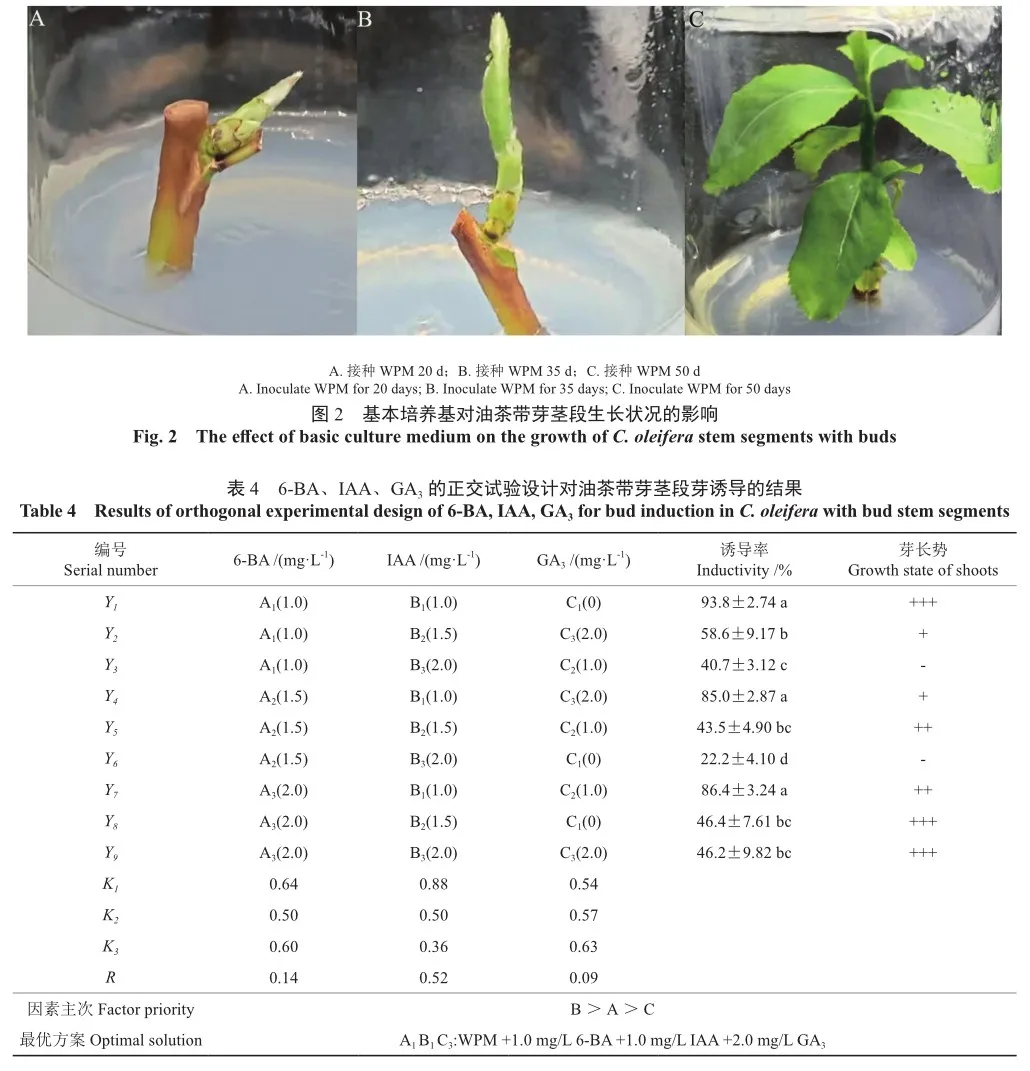
以WPM为基本培养基,并采用以下3种植物激素IAA(1,1.5,2.0 mg/L)、6-BA(1.0,1.5,2.0 mg/L)和GA3(0,1.0,2.0 mg/L)进行了L9(34)正交试验设计,共9个处理。
1.2.4 丛生芽诱导单因素试验
以WPM为基本培养基,将初代培养中获得的无菌芽接种于增殖培养基中。按筛选顺序分为A、B、C、D 4组,A组筛选增殖最适生长素种类,B组筛选增殖最适生长素浓度,C组筛选最适6-BA浓度,D组筛选最适增殖培养基。培养40 d后观察芽的生长状况,以增殖芽数、芽长势作为评价指标。
1.2.5 生根培养
1)瓶内生根
将增殖培养中所获得的生长健壮,长势基本一致的无菌苗(高2~4 cm)作为材料,去除靠近基部的叶片,下部留有1 cm之后进行速沾处理。按筛选顺序分为A、B、C、D 4组,A组筛选IBA最适速沾时间,B组筛选IBA+水杨酸最适速蘸搭配时间,C组筛选最适基本培养基,D组在前3组(A组、B组、C组)所得最佳处理方法的基础上,进行降低蔗糖浓度、添加维生素B3和添加蛭石3组实验(表1)。40 d后统计存活率与生根率,观察小苗生长状态,以及根系数量、长度、状态和发生部位等,以筛选最优生根处理方法与生根培养基。
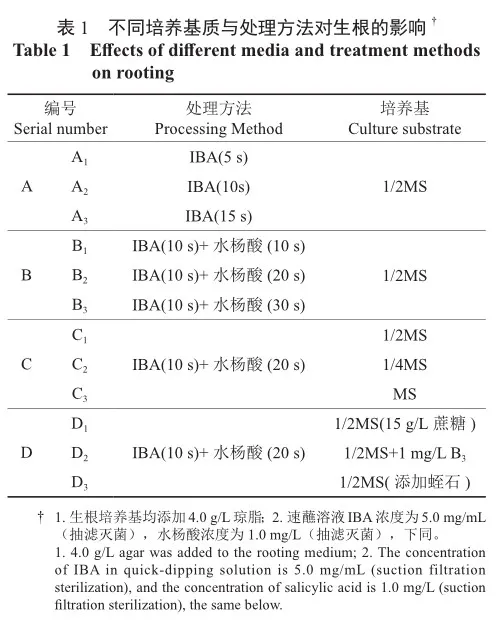
2)瓶外生根
选取生长状况一致的单芽,采用瓶内生根最适处理方法处理后,按照A. 蛭石∶椰土∶泥炭= 1∶1∶2、B. 蛭石∶椰土=1∶1和C. 蛭石∶珍珠岩= 1∶1扦插入基质中。
1.2.6 数据分析
采用Excel 2022和SPSS 25.0软件对试验数据进行处理和分析。
2 结果与分析
2.1 生长素对油茶芽诱导的影响
当细胞分裂素6-BA浓度一定时(2.0 mg/L),分别添加相同浓度(1.0 mg/L)的IAA、IBA、NAA中腋芽诱导率和生长表现存在明显差异(表2)。6-BA与IAA组合的培养基,其诱导率最高,萌发速度最快,芽体健壮,叶片大而翠绿,且有一定的增殖效果;6-BA与IBA组合的培养基诱导率略低,虽也有一定的增殖效果,但生长速率明显慢于IAA组合;6-BA+NAA处理组,芽萌动明显晚于其他两组,且多数芽呈现隐而不发,基部生长出大量愈伤组织,最终整个带芽茎段褐化死亡(图1)。

结合芽萌动的时间和芽的长势综合分析,IAA在3种激素处理中对芽的诱导效果最好,IBA次之,NAA最差。由此得出结论,在WPM作为芽诱导基本培养基的同时,最适合芽诱导的生长素为IAA。

2.2 基本培养基对油茶芽诱导的影响
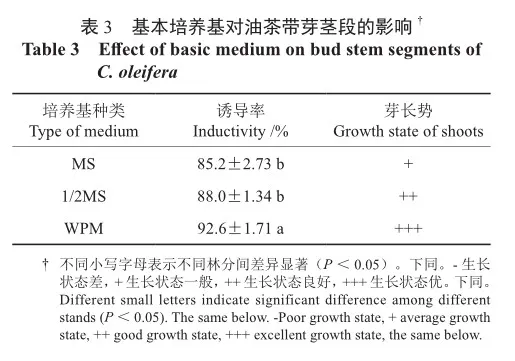
接种在MS和1/2MS培养基上的带芽茎段均在16 d后开始萌动,1/2MS培养基的腋芽翠绿色,长势良好;MS培养基中带芽茎段不仅诱导率低,芽浅绿色并且长势一般(表3)。而WPM中接种的带芽茎段则在12 d左右腋芽开始萌动,约35 d时抽出1~2 cm芽体,随后叶片展开,50 d后新芽生长至4~5 cm(图2)。因此,WPM培养基为油茶带芽茎段诱导的理想基本培养基,不仅诱导率高,且芽体长势好,嫩茎粗,茎节长,叶片翠绿健康,植株生长健壮。
2.3 植物激素配比对油茶芽诱导的影响
已有研究表明,GA3促进油茶芽诱导,因此本研究在确定以WPM作为基本培养基,添加6-BA和IAA基础上,进一步开展加入GA3的正交试验。结果表明,随着GA3浓度的增加,芽诱导率随之增加(表4),即GA3对油茶芽诱导有积极的影响。通过极差分析可知,3个因素指标值为B>A>C,即IAA>6-BA>GA3;生长素IAA是油茶带芽茎段芽诱导的主要影响因素(R=0.52)。因此,油茶带芽茎段芽诱导最适培养基配方为:WPM+ 1.0 mg/L 6-BA+1.0 mg/L IAA+2.0 mg/L GA3。
2.4 植物生长调节剂对油茶芽增殖的影响
IAA与IBA生长素对芽苗均有一定的增殖效果,IAA主要促进了芽苗纵向生长,茎节增长,而IBA浓度达到0.5 mg/L时,虽然增殖效果明显,但长时间继代后激素累积导致芽苗叶片发黄,顶芽预热渐渐褐化死亡,之后将IBA浓度降低至 0.25 mg/L时,芽苗长势健康,并且有十分明显的增殖效果;虽然高浓度的细胞分裂素可以有效促进芽苗增殖,但是当6-BA浓度达到4.0 mg/L时,新生芽弱小且容易死亡,叶面卷曲畸形,当6-BA浓度降低为2.0 mg/L时,增殖效果好,且芽苗生长健康;添加0.2~1.0 mg/L TDZ时芽苗均死亡(表5)。
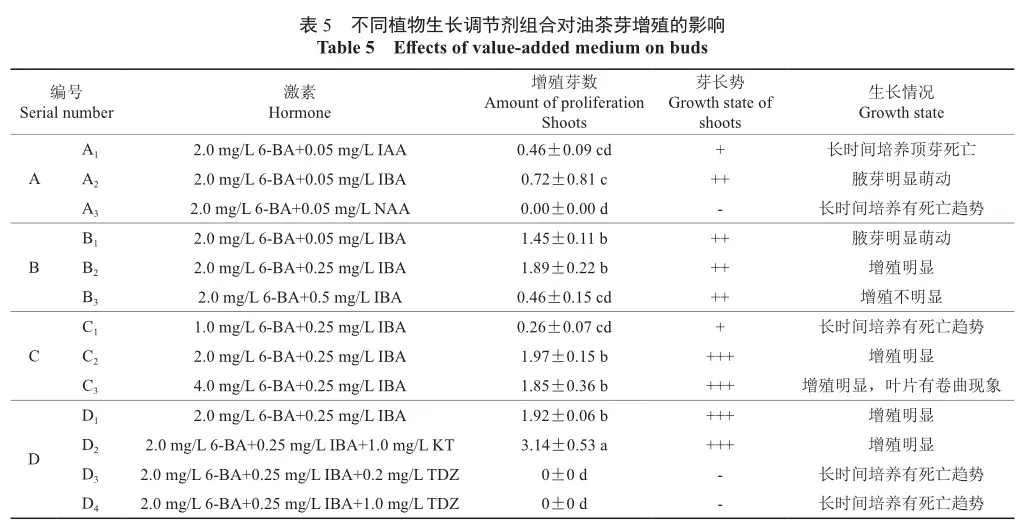
A组筛选出最适增殖的生长素为IBA;B组筛选出最适增殖的IBA浓度为0.25 mg/L;C组筛选出最适增殖的6-BA浓度为2.0 mg/L;最终筛选出最适增殖培养基为WPM+2.0 mg/L 6-BA+0.25 mg/ L IBA+1.0 mg/L KT,增殖系数为3.14,且生长强壮翠绿(图3)。

2.5 生根培养
2.5.1 瓶内生根
A组:通过速沾IBA外源激素可诱导生根,诱导率随着处理时间的增加而升高。当处理时间为10 s时,无菌苗生根率高,根数量多且强壮,可见侧根产生,且后期生长状态好。而处理时间降低为5 s时,生根率低,根数量少,根细弱;处理时间提高至15 s时,虽然无菌苗生根率最高,根数量最多且长,但无菌苗叶片边缘枯萎,部分叶片变黄掉落的现象,后期生长状态差。
B组:通过IBA(10 s)+水杨酸(20 s)处理下,平均根长最长,平均根数较多,根毛丰富,有侧根长出,且单苗生长状况健康。
C组:选择1/2MS作为基本培养基时,生根率最高,为90.9%。选择1/4MS作为基本培养基时,生根率相较于1/2MS有所降低但仍然高于MS,过低浓度的无机盐含量会导致根数细弱,根数少;选择MS作为基本培养基时,生根率只为27.2%,可能是因为MS培养基氮含量较高造成的。
D组:选择1/2MS培养基内蔗糖含量为15 g/L时,无菌苗生长状态差,生根率明显降低;添加1 mg/L B3时,虽然B3有促进生根的作用,但添加后生根率反而降低;选择蛭石+1/2MS时,基部生长出明显的愈伤组织,平均根长较短,根系质量较好,但整体生根率较低(表6)。
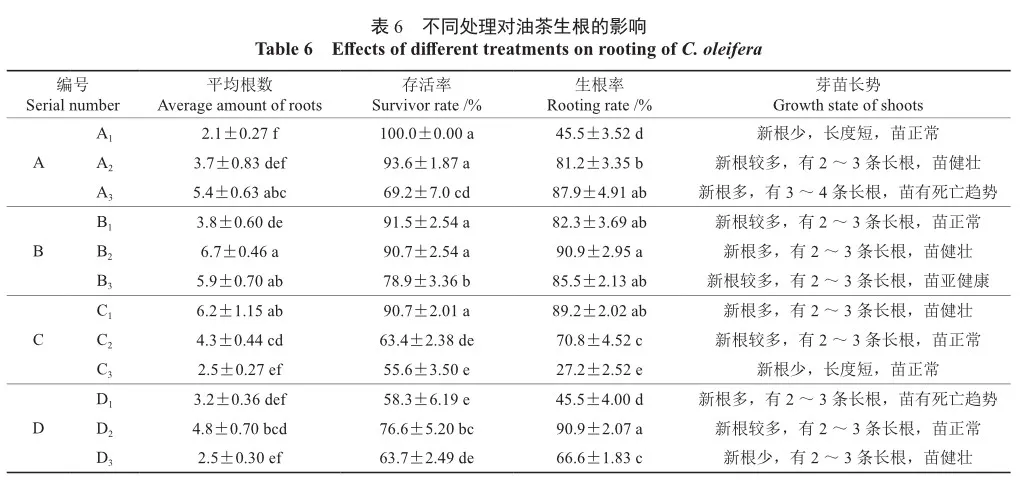
瓶内生根的无菌苗约在培养20 d时大部分产生1~3 mm的根;40 d时根系生长明显,长度约2~3 cm;经过一次继代后,根系长度达到4~ 6 cm,且可见侧根产生,部分根系变粗(图4),最终选择基部速沾5.0 mg/mL IBA(10 s)+1.0 mg/L水杨酸(20 s)诱导生根。

2.5.2 瓶外生根
将健壮的无菌苗经IBA(10 s)+水杨酸(20 s)处理,扦插入基质后及时喷洒定根水,10 d时基部出现明显的愈伤组织;20 d 时可见部分根部长出为1~3 mm,愈伤组织变大;40 d时根系明显,根系变长,根毛明显;60 d时可明显看见有侧根长出(图5B)。
扦插至2号基质的苗短时间内存活率较高达到76.1%,但生根率最低(23.2%),1个月后基质内仍然潮湿,拔出苗可见基部变黑,出现烂根现象;1号基质需补浇1~2次,生根率达到57.9%;3号基质虽需要经常查看湿度,频繁补浇3~5次,然存活率最高,为85.0%,且生根率最高(87.5%),烂根现象少,大部分苗生长健康。因此,最佳的生根基质为3号基质,生根率为 87.5%(表7),这说明瓶外生根基质对无菌苗生根率和成活率有较大的影响。

3 讨 论
3.1 植物生长调节剂对油茶芽诱导与增殖的影响
植物生长调节剂对组培苗的生长和增殖有重要作用。本研究发现,在芽诱导阶段中只使用6-BA+IAA时,腋芽萌发率已达到92.6%,通过后续正交实验证明IAA对芽诱导的影响最大,张骐飞等[6]海大4号的芽诱导中也有类似的发现[7]。当然,前人对油茶芽诱导研究中也有与此不同的结果[8-11],如柯丹萍[8]发现油茶品种‘长林166’腋芽萌发诱导中NAA影响最为显著,刘海英[9]发现NAA对油茶腋芽启动率有极显著影响等,这可能是品种之间的差异性导致的。6-BA和GA3也对芽诱导有积极的影响,但影响小于IAA。GA3本身对植物芽叶的生长和茎的伸长就有着重要的促进作用,植物可通过赤霉素合成和赤霉素细胞信号转导途径调控植物的生长发育过程[12],且结果显示赤霉素对芽诱导的影响随着0~2.0 mg/L的增加效果越明显,这说明本研究中选取的赤霉素浓度之间梯度过小,之后提高赤霉素浓度(>2.0 mg/L)可能对油茶芽诱导有更显著的影响。
不同植物生长调节剂对增殖培养的影响各不相同[13-14],且较高浓度的细胞分裂素对大部分组培苗增殖有较好的效果,常以高浓度细胞分裂素和低浓度生长素协同使用效果较为理想,如王瑞等[15]使用5.0 mg/L 6-BA+0.01 mg/L NAA+1.0 mg/L生物素为最佳组合,增殖系数高达3.90。但生长调节剂的种类过多或水平过高,也会刺激外植体的多酚氧化酶活性,加速外植体褐变甚至坏死[16]。本研究发现在添加了相同浓度IBA(0.25 mg/L)时,随着6-BA浓度增加时,增殖系数呈先增加后下降的趋势,以2.0 mg/L 6-BA配方增殖系数最高,过高的6-BA(4.0 mg/L)影响芽苗伸长,较嫩的无菌芽在增殖过程中容易发生褐化、叶面卷曲畸形和叶片脱落,最终死亡[6]。相较于只使用6-BA,6-BA和KT配合使用时,试管苗获得了最大增殖效率。在细胞分裂素与生长素协同使用方面,IBA和IAA均有促进增殖的效果,但在长时间培养中发现,添加IBA时芽苗生长健壮,效果更佳,而添加IAA时茎尖褐化死亡的现象极易发生,有部分学者发现在培养基内添加CA、PVP、甘露醇和AgNO3等能有效防止褐化[17-18],可在之后实验中进一步探究。
3.2 油茶瓶内外生根对比及移栽
本研究通过速沾高浓度生长素的方法[19-21]进行瓶内外生根,发现瓶内生根中未添加蛭石时生根率为90.9%,但根系常浮于培养基表面不向下扎根,而添加蛭石时,根系全部向下扎根,但生根率降低至66.6%。此结果与吴丽君等[22]发现使用沙蛭石基质在前期进行无糖培养最优和赵洁等[23]发现使用珍珠岩作为基质不如普通琼脂中生根的结果相似,这可能与油茶根系需要较好的通气性有关。进行瓶外生根时发现培养基质为V蛭石∶V珍珠岩= 1∶1时,生根率达到87.5%,而在V蛭石∶V椰土∶ V泥炭=1∶1∶2的培养基质时生根率最低(23.2%),这可能与泥炭的保水性好,通气性差,导致基质内含水率过高使芽苗基部腐烂不易生根,从而不利于植株的生长[24]有关,该结果表明不同的培养基质对于油茶生根有影响显著。
在移栽过程中,瓶内生根的苗长期处于高湿度,温度波动小的无菌环境[25],虽然生根率较高,但瓶内生根的苗较难适应外界变化,移栽死亡率高,移栽难度大。而瓶外生根的苗移栽成活率高于瓶内生根,因为瓶外生根所产生的根恢复能力和吸收功能更强,且在生根过程中逐步经过了自然环境的锻炼,适应了自然环境,弱苗在此过程中便已被淘汰[26]。总体来说,虽然瓶外生根率(87.5%)相较于瓶内生根率(90.9%)低,但结合移栽情况发现瓶外生根的苗存活率远高于瓶内生根,且通过直接瓶外生根的方式可以将炼苗与生根同时进行,大幅度降低生产成本,本研究认为油茶瓶外生根法最优。
3.3 展 望
近年来,由于油茶细胞工程育种与基因工程育种的兴起[26],对组织培养技术有了更高的需求。目前中国的油茶组织培养具有大量的研究成果,但仍然存在生根困难,移栽存活率低等问题。相关研究表明[27],不同油茶物种组织培养的适宜基本培养基、生长调节剂、培养环境均有所不同,因此需要建立不同种类油茶组织培养的体系。针对其他未进行组培探索的油茶品种,可以在此基础上进一步调整植物激素浓度和其他添加物类型,进而更有效地提高油茶组培快繁的效率,缩短快繁体系的建立时间。
4 结 论
最优芽诱导培养基为WPM+1.0 mg/L 6-BA+ 1.0 mg/L IAA+2.0 mg/L GA3,主要影响因子为IAA,诱导率为93.8%。
最适芽增殖培养基为WPM+2.0 mg/L 6-BA+ 0.25 mg/L IBA+1.0 mg/L KT,增殖系数为3.14,且生长强壮,叶片翠绿。
最适生根方法为瓶外生根,单苗速沾5.0 mg/mL IBA(10 s)+1.0 mg/L 水杨酸(20 s)后,插入蛭石+珍珠岩=1∶1基质中,40 d生根率达87.5%,苗木长势较好,且将炼苗与生根同时进行,有效缩短了油茶快繁体系建立的时间。
参考文献:
[1] 庄瑞林.中国油茶[M].2版.北京:中国林业出版社,2008. ZHUANG R L. Camellia oleifera[M]. 2nd ed. Beijing: China Forestry Publishing House,2008.
[2] 卢锟,仲嘉玥,张慧,等.黑老虎带芽茎段的组织培养及快速增殖[J].经济林研究,2022,40(3):162-168. LU K, ZHONG J Y, ZHANG H, et al. Tissue culture and rapid propagation of bud and stem segments of Kadsura coccinea[J]. Non-wood Forest Research,2022,40(3):162-168.
[3] 种增斌,王灵宇,李永迪,等.拧筋槭无性快繁技术研究[J].植物生理学报,2023,59(12):2355-2361.CHONG Z B, WANG L Y, LI Y D, et al. Establishment of asexual rapid propagation technology of Acer triflorum[J]. Plant Physiology Journal,2023,59(12):2355-2361.
[4] AI Y, CHEN Y Z, ZHU S X, et al. The impacts of plant growth regulators on the rapid propagation of Gardenia jasminoides. in tissue culture[J]. Forests,2024,15(3):446.
[5] 黄莉雅.油茶组织培养初步研究[D].长沙:中南林业科技大学,2010. HUANG L Y. Study on tissue culture of Camellia oleifera[D]. Changsha: Central South University of Forestry Technology, 2010.
[6] 张骐飞,陈健妙,侯辛辛,等.海大油茶4号快繁及组培芽做接穗的芽苗砧嫁接体系优化[J].中国油料作物学报,2022,44(6): 1275-1285. ZHANG Q F, CHEN J M, HOU X X, et al. In vitro rapid propagation of Camellia vietnamensis Haida youcha 4 and nurse seed grafting using its tissue culture bud as scion[J]. Chinese Journal of Oil Crop Sciences,2022,44(6):1275-1285.
[7] LAVEE S, PARNES A, AVIDAN N. Involvement of ethylene in growth induction of stationary tobacco pith tissue in vitro[J]. Plant Cell, Tissue and Organ Culture,2010,103(1):123-129.
[8] 柯丹萍.油茶品种‘长林166’的离体培养研究[D].武汉:华中农业大学,2015. KE D P. Study on in vitro culture of Camellia oleifera ‘Changlin 166’[D]. Wuhan: Huazhong Agricultural University,2015.
[9] 刘海英.油茶组培再生体系建立及愈伤组织诱导[D].武汉:华中农业大学,2011. LIU H Y. Plant regeneration and callus induction Camella oleifera[D]. Wuhan: Huazhong Agricultural University,2011.
[10] 范晓明.油茶组织培养技术研究[D].长沙:中南林业科技大学,2011. FAN X M. Study on technology about the tissue culture of Camellia oleifera[D]. Changsha: Central South University of Forestry Technology,2011.
[11] 袁德义,范晓明,谭晓风,等.油茶带芽茎段及叶片离体培养再生体系的建立[J].南京林业大学学报(自然科学版),2013,37(5): 35-39. YUAN D Y, FAN X M, TAN X F, et al. Culture in vitro and rapid propagation techniques of buds and leafs in Camellia oleifera[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2013,37(5):35-39.
[12] 袁连玉,韩雨欣,代洪苇,等.茶树CsGID1s基因家族的克隆及功能分析[J].西南大学学报(自然科学版),2023,45(7): 75-86. YUAN L Y, HAN Y X, DAI H W, et al. Cloning and functional analysis of CsGID1s gene family in tea plant[J]. Journal of Southwest University (Natural Science Edition),2023,45(7): 75-86.
[13] 王婧雅,王晓芹,姜可以,等.珍稀观赏竹白纹椎谷笹的组培快繁与叶色变异[J].植物生理学报,2024,60(1):167-176. WANG J Y, WANG X Q, JIANG K Y, et al. Tissue culture and leaf color variation of rare ornamental bamboo Sasaella glabra f. albostriata[J]. Plant Physiology Journal,2024,60(1):167-176.
[14] 顾怡婷,潘月,龙超霞,等.陀螺果离体快繁技术体系的构建[J].植物生理学报,2024,60(1):177-184. GU Y T, PAN Y, LONG C X, et al. Construction of in vitro rapid propagation technology system of Melliodendron xylocarpum[J]. Plant Physiology Journal,2024,60(1):177-184.
[15] 王瑞,陈永忠,王湘南,等.油茶组培苗高效增殖体系的建立[J].中南林业科技大学学报,2015,35(10):40-43. WANG R, CHEN Y Z, WANG X N, et al. Establishment of high efficient propagation system of tissue culture seedling of Camellia oleifera[J]. Journal of Central South University of Forestry Technology,2015,35(10):40-43.
[16] 高洁,张萍,薛璟祺,等.酚类物质及其对木本植物组织培养褐变影响的研究进展[J].园艺学报,2019,46(9):1645-1654. GAO J, ZHANG P, XUE J Q, et al. Advances in phenolic substances and their effects on browning in woody plant tissue culture[J]. Acta Horticulturae Sinica,2019,46(9):1645-1654.
[17] 饶慧云,邵祖超,柳海宁,等.抗褐化剂对葡萄愈伤组织继代培养过程中酚类物质、相关酶及其基因表达的影响[J].植物生理学报,2015,51(8):1322-1330. RAO H Y, SHAO Z C, LIU H N, et al. Effect of browning inhibitors on callus subculture of phenolic compounds, enzyme and gene expression of grape[J]. Plant Physiology Journal, 2015,51(8):1322-1330.
[18] 吕宗友,苏衍菁,赵国琦,等.不同防褐化措施对苏丹草愈伤诱导以及抗褐化的效果研究[J].草业学报,2011,20(3): 174-181. LYU Z Y, SU Y J, ZHAO G Q, et al. Effect of anti-browning agents on the induction of sudangrass callus[J]. Acta Prataculturae Sinica,2011,20(3):174-181.
[19] SIERRA S, OLMOS C C, PALLOTTI C, et al. First ex situ in vitro propagation protocol of Coronilla viminalis, an endangered fodder species adapted to drought and salinity[J]. Horticulturae, 2024,10(3):201.
[20] 郑亦卿,曾思琦,唐令,等.莓叶委陵菜叶插繁殖技术研究[J].草业科学,2024,41(2):252-261. ZHENG Y Q, ZENG S Q, TANG L, et al. A study on leaf cutting propagation technology for Potentilla fragarioidis[J]. Pratacultural Science,2024,41(2):252-261.
[21] 施琼,胡峰,黄烈健.马大杂种相思瓶内和瓶外生根技术研究[J].植物研究,2015,35(6):891-897. SHI Q, HU F, HUANG L J. In vitro and ex vitro rooting technology comparison of Acacia mangium × A. auriculiformis hybrids[J]. Bulletin of Botanical Research,2015,35(6):891-897.
[22] 吴丽君,游云飞,陈达,等.‘黄樽’薄叶金花茶组培苗生根与移栽技术研究[J].南京林业大学学报(自然科学版),2021, 45(3):117-122. WU L J, YOU Y F, CHEN D, et al. Optimization of the rooting and transplantation techniques of tissue-cultured shoots of Camellia chrysanthoides ‘Huangzun’[J]. Journal of Nanjing Forestry University (Natural Sciences Edition),2021,45(3): 117-122.
[23] 赵洁,侯雨琪,郑伟,等.凤尾茶的离体快繁技术研究[J].北方园艺,2023(23):60-67. ZHAO J, HOU Y Q, ZHENG W, et al. Study on in vitro rapid propagation of Elsholtzia bodinieri[J]. Northern Horticulture, 2023(23):60-67.
[24] 黄玉梅,刘丽,赵苗菲,等.黑木相思组培苗瓶外生根技术研究[J].森林与环境学报,2019,39(1):21-26. HUANG Y M, LIU L, ZHAO M F, et al. Test on ex vitro rooting technology of tissue culture seedlings of Acacia melanoxylon[J]. Journal of Forest and Environment,2019,39(1):21-26.
[25] 胡国宇,王丹,张猛,等.IBA对费约果扦插生根及相关生理特性的影响[J].中南林业科技大学学报,2021,41(10):45-56. HU G Y, WANG D, ZHANG M, et al. Effects of IBA on rooting and physiological characteristics of Feijoa sellowiana cuttings[J]. Journal of Central South University of Forestry Technology,2021,41(10):45-56.
[26] 李建安,韩志强.经济林遗传改良与品种创制研究进展[J].经济林研究,2023,41(1):1-13. LI J A, HAN Z Q. Advances in genetic improvement of important traits and variety innovation of non-wood forest[J]. Non-wood Forest Research,2023,41(1):1-13.
[27] 吴幼媚,王以红,蔡玲,等.油茶单芽组培生根研究[J].西部林业科学,2012,41(4):25-28. WU Y M, WANG Y H, CAI L, et al. Study on rooting of single buds of Camellia oleifera[J]. Journal of West China Forestry Science, 2012,41(4):25-28.
[本文编校:吴 毅]

