叉角厉蝽3龄若虫肠道可培养细菌多样性及促生潜力分析







摘要:【目的】了解叉角厉蝽若虫肠道可培养细菌的组成,分析可培养细菌的促生长特性,为叉角厉蝽肠道细菌与宿主、植物间的关系研究及有益菌株的开发利用提供科学依据和研究材料。【方法】采用传统的细菌分离培养法分离、纯化叉角厉蝽若虫肠道细菌,通过细菌形态特征、染色反应、生理生化试验和16S rDNA序列分析对分离到的肠道细菌进行分类鉴定,测定其固氮、溶磷、产吲哚乙酸和产铁载体能力,定性分析分离菌株的促生潜力。【结果】从叉角厉蝽若虫肠道中分离到11株细菌,其中革兰氏阳性菌8株、革兰氏阴性菌3株;细胞形态3株为短杆状、1株为球状、7株为杆状。经鉴定11株肠道细菌分属于2门2纲3目4科4属,优势门、纲、目、科、属分别为厚壁菌门(Firmicutes,85.67%)、芽孢杆菌纲(Bacilli,85.67%)、乳杆菌目(Lactobacillales,75.80%)、肠球菌科(Enterococcaceae,75.80%)、肠球菌属(Entero-coccus,75.80%);在种分类水平由粪肠球菌(E.faecalis,75.80%)、枯草芽孢杆菌(Bacillus subtilis,9.17%)、摩氏摩根氏菌(Morganella morganii,6.51%)、嗜线虫沙雷氏菌(Serratia nematodiphila,4.49%)、黏质沙雷氏菌(S.marcescens,3.30%)、苏云金芽孢杆菌(B.thuringiensis,0.28%)、贝莱斯芽孢杆菌(B.velezensis,0.27%)和高地芽孢杆菌(B.altitu-dinis,0.18%)8种组成。11株分离菌株的植物促生特性分析结果表明,2株沙雷氏菌促生潜力最大,具有固氮、溶磷、产吲哚乙酸和产铁载体4种促生活性,其次为摩根氏菌,具有溶磷、产吲哚乙酸和产铁载体3种促生活性。【结论】叉角厉蝽若虫肠道可培养细菌种类较丰富,分离获得的11株细菌均具有不同程度的促生长特性。
关键词:叉角厉蝽;可培养细菌;分离鉴定;细菌多样性;植物促生特性
中图分类号:S476.2;Q965文献标志码:A文章编号:2095-1191(2024)10-3033-13
Diversity and plant growth promoting potential of gut culturablebacteria in third-instar nymphs of Eocantheconafurcellata(Wolff)
ZHU Guo-yuan1,2,WU Guo-xing1,ZHANG Man1,SHI Chun-lan1,Ci-na-you-ruo1,CHEN Xiao1,NING Jing-yi1,WANG Si-jie1,GAO Xi1*
(1Plant Protection College,Yunnan Agricultural University,Kunming,Yunnan 650201,China;2Yunnan Institute ofTropical Crops,Jinghong,Yunnan 666100,China)
Abstract:【Objective】To study the composition of culturable bacteria in the gut of nymphs of the Eocanthecona fur-cellata(Wolff),and analyze the growth promoting characteristics of the strains,so as to provide scientific basis and re-search materials for the study of the relationship among the gut bacteria of E.furcellata,hosts and plants,as well as the development and utilization of probiotic.【Method】The traditional bacterial isolation and culture method was used to iso-late and purify the gut bacteria of nymphs of E.furcellata.The isolated gut bacteria were classified and identified by bacte-rial morphology,staining reaction,physiological and biochemical tests and 16S rDNA sequence analysis,and qualitative analysis of the growth promoting potential of the strains was conducted by determining their nitrogen fixation,phospho-rus solubilization,indoleacetic acid production and siderophoreproduction ability.【Result】A total of 11 strains of bacte-ria were isolated from the gut of nymphs of E.furcellata,the 11 strains of gut bacteria included 8 Gram-positive bacteria and 3 Gram-negative bacteria strains.The cell morphology of 3 strains was short rod-shaped,1 stain was globular,and 7strains were rod-shaped.and the 11 strains of gut bacteria bebonged to 2 phyla,2 classes,3 orders,4 families and 4 genera.The dominant phylum,class,order,family and genus were Firmicutes(85.67%),Bacilli(85.67%),Lactobacillales(75.80%),Enterococcaceae(75.80%),Enterococcus(75.80%)respectively.At the species level,E.faecalis(75.80%),Bacillus subtilis(9.17%),Morganella morganii(6.51%),Serratia nematodiphila(4.49%),S.marcescens(3.30%),B.thuringiensis(0.28%),B.velezensis(0.27%)and B.altitudinis(0.18%)were identified as abundant bacterial species.Plant promoting characterization of the 11 isolated strains showed that 2 strains of Serratia had the highest promotion potential with 4 plant growth promoting properties:nitrogen fixation,phosphorus solubilization,indoleacetic acid pro-duction and siderophoreproduction,followed by 1 strain of Morganella with 3 plant growth promoting properties:phos-phorus solubilization,indoleacetic acid production and siderophore production.【Conclusion】The culturable bacterialspecies in the gut of nymphs of E.furcellata are relatively abundant,and 11 bacterial strains isolated from the gut have different degrees of growth promoting properties.
Key words:Eocantheconafurcellata(Wolff);culturable bacteria;isolation and identification;bacterial diversity;plant growth promoting characteristics
Foundation items:Yunnan Agricultural Basic Research Joint Special Project(202101BD070001-050,202301BD 070001-137);Yunnan Young and Middle-aged Academic and Technical Leaders Reserve Talents Project(202205AC 160077);Yunnan Tobacco Company Science and Technology Plan Project(2023530000241012)
0引言
【研究意义】叉角厉蝽[Eocantheconafurcellata(Wolff)]隶属于半翅目(Hemiptera)蝽科(Pentatomi-dae)。该虫具有捕食能力强、地理分布广、繁殖力强、适应性好等特点,是一种极具生防应用潜力的捕食性天敌昆虫(张曼等,2022)。昆虫肠道微生物被认为是昆虫的第2套遗传密码(Zilber-Rosenberg and Rosenberg,2008;Possemiers et al.,2011;易春燕等,2024),肠道细菌参与宿主许多重要的生命活动,如营养代谢、生长发育、免疫防御等(周帆等,2020;李文红等,2023),在与宿主长期协同进化过程中也受宿主昆虫食物、发育阶段及性别等多种因素影响,表现出多样的种群结构和生物学功能。细菌具有生长速度快、易培养、抗逆性强等特性,除了是重要的生防资源外,还能产生铁载体、吲哚乙酸(IAA)等,合成有利于植物生长发育的物质,间接或直接提高植物的质量与产量(周荣翔等,2022)。叉角厉蝽和捕食性盲蝽等生活史中有部分时期或部分龄态需刺吸植物,且室内饲养观察发现叉角厉蝽刺吸吊兰属(Chlorophytum)植物后有助于植物分蘖。然而,对于叉角厉蝽肠道可培养细菌的组成与植物生长之间的关系知之甚少。因此,弄清叉角厉蝽若虫肠道可培养细菌的组成结构,分析肠道细菌的潜在促生长特性,对叉角厉蝽若虫生长发育、生活习性、昆虫内共生菌—昆虫—植物互作关系的研究以及菌种资源的开发利用具有重要意义。【前人研究进展】昆虫肠道可培养细菌的研究已涉及少数天敌昆虫(赵秀芝等,2011;刘宁等,2012)、经济昆虫(黄伶等,2014)、腐生性昆虫(Kim et al.,2014)、重要农业经济害虫(郑亚强等,2017)、与人体健康密切相关的卫生害虫(黄振东等,2019)及观赏鸣虫(黄慧敏,2023)等多个种类。对于半翅目蝽类微生物的研究多集中于蝽次目的植食性蝽及与异翅亚目(Heteropteran)昆虫谱系相关的昆虫(Shan etal.,2021;Li etal.,2022)。罗立华等(2016)采用纯培养法,结合形态学及16SrRNA序列分析鉴定了九香虫(Aspongopuschinesis)成虫体内的可培养细菌,共分离到52株细菌,分属于芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomo-nas)、寡养单胞菌属(Stenotrophomonas)和伯克霍尔德氏菌属(Burkholderia)4个属;王琪等(2024)采用相同的方法从斑须蝽肠道中共分离出35株菌,归为2门5属10种,其中芽孢杆菌属4种,肠球菌属(Enterococcus)3种,乳球菌属(Lactococcus)、沙雷氏菌属(Serratia)和泛菌属(Pantoea)各1种。Scopel和Cônsoli(2018)研究鉴定了新热带褐蝽(Euschistus heros)雌雄成虫卵巢、受精囊、精囊及后中肠区(V4)的可培养共生体,变形菌门(Proteobacteria)以γ-变形菌纲(Gammaproteobacteria)肠杆菌科(Enterobac-teriaceae)为代表,厚壁菌门(Firmicutes)以芽孢杆菌纲(Bacilli)肠球菌科(Enterococcaceae)和葡萄球菌科(Staphylococcaceae)为代表,且所鉴定的一些种型仅与单一结构相关,而所有与精囊相关的可培养细菌也与其他组织相关。方博文(2024)对点蜂缘蝽(Riptortuspedestris)卵、不同龄期若虫及雌雄成虫不同部位(触角、头、肠道和其他组织)的共生细菌进行了分离鉴定,共鉴定出221种细菌,隶属于4门29科66属,在门分类水平,优势菌门包括变形菌门和放线菌门(Actinobacteria)。关于捕食性蝽肠道微生物的研究报道较少,仅见斑腹刺益蝽(Podisusmaculiven-tris)、益蝽(Picromeruslewisi)和猎蝽科(Reduviidae)个别种类(Ahsaei et al.,2020;Li etal.,2022;李金梦等,2024)。Kuang等(2022)利用Illumina HiSeq高通量测序技术分析了不同食物饲养的叉角厉蝽雌成虫中肠细菌组成和多样性。李金梦等(2024)从益蝽肠道共分离得到21株细菌,经测序鉴定出6种细菌,优势细菌为粪肠球菌(Enterococcus faecalis)。朱国渊等(2024)利用单分子实时测序法研究了叉角厉蝽不同发育阶段肠道细菌群落组成和多样性,并对其潜在功能进行了预测。此外,前人研究证实,从线虫、鲈鱼和部分天敌昆虫中分离的细菌菌株也具有不同程度的促植物生长特性,如从紫茎泽兰(Eupa-toriumadenophorum)的天敌昆虫泽兰实蝇(Proceci-docharesutilis)幼虫体内分离到的不动杆菌属(Aci-netobacter)和红球菌属(Rhodococcus)细菌具有氮素转化的功能,可能在紫茎泽兰虫瘿的生长上起到主要作用(兰明先等,2018)。捕食性蝽短小长颈盲蝽(Macrolophus pygmaeus)、烟盲蝽(Nesidiocoris tenuis)可为植物获取和传播植物促生菌(如Paraburkhol-deria phytofirmans和Enterobacter sp.)(Galambos et al.,2021)。从象耳豆根结线虫(Meloidogyne entero-lobii)2龄幼虫中分离出的巴氏葡萄球菌(Staphy-lococcuspateuri)、甲基营养型芽孢杆菌(Bacillus methylotrophicus)和芽孢杆菌属(Bacillus sp.)细菌具有植物促生特性(陈梦等,2024)。【本研究切入点】前人已利用多种不同微生物分离培养方法,结合16S rDNA测序分析从昆虫肠道中分离鉴定了大量的微生物,为肠道微生物菌群功能验证、因果机制解析和功能菌株的开发应用研究提供了基础(杜梦璇等,2021;刘莎和陈从英,2023),但关于叉角厉蝽若虫肠道可培养细菌群落组成多样性及其促生长特性尚无文献报道。【拟解决的关键问题】采用传统的细菌分离培养法对叉角厉蝽若虫肠道细菌进行分离培养,并通过细菌形态特征、染色反应、生理生化试验和16S rDNA序列分析对分离到的肠道细菌进行分类鉴定,测定其固氮、溶磷、产IAA和产铁载体能力,定性分析分离菌株的促生潜力,以期为叉角厉蝽肠道菌与宿主、植物间的关系研究及有益菌株的开发利用提供科学依据和研究材料。
1材料与方法
1.1试验材料
供试虫源:叉角厉蝽于2018年采集自云南省玉溪市元江县滨江大道小燕村(23°34′43″N,102°02′15″E),带回室内于养虫室饲养至今。饲养条件:温度(26±1)℃、光周期L∶D=14 h∶10 h、相对湿度(65±10)%,以吊兰属植物和黄粉虫(Tenebrio moli-tor)蛹作为食料。
主要试剂和仪器:细菌基因组DNA提取试剂盒(金牌Mix Ver.2,北京擎科生物科技股份有限公司),PBS缓冲液(pH 7.2~7.5),胰蛋白胨(安琪酵母股份有限公司),酵母浸粉(北京生物科技有限公司),蔗糖、葡萄糖、淀粉、乳糖和麦芽糖(天津市大茂化学试剂厂)。体视显微镜(Motic,宁波舜宇仪器有限公司),超净工作台(SW-CJ-2FD,苏净集团安泰公司),立式蒸汽灭菌锅(DGL-50B,江苏登冠医疗器械有限公司),分析天平(BSA2202S-CW,赛多利斯科学仪器有限公司),迷你混合仪(MIX-25P,杭州米欧仪器有限公司),摇床(ZQTY-70S,上海知楚仪器有限公司),超低温冰箱(Thermo 906,赛多利斯科学仪器有限公司),电热恒温培养箱(DHP-420AB,天津市赛得利斯实验分析仪器制造厂)。
培养基:NA培养基、LB固体培养基、Ashby(阿须贝氏)培养基、NBRIP培养基(解磷培养基)和CAS检测培养基。
1.2叉角厉蝽若虫肠道可培养细菌分离与鉴定
1.2.1叉角厉蝽若虫肠道解剖挑选生长发育整齐一致的叉角厉蝽3龄若虫,单头放入直径为9 cm的无菌培养皿中,饥饿处理24h。将试虫放在-20℃冰箱中冷冻3~5 min,待其麻痹不动后取出剪去胸足,在超净工作台中用75%酒精进行虫体表面消毒2次,每次20 s,再用无菌水清洗3次,每次1 min,放入盛有PBS缓冲液的培养皿中,置于体视显微镜下解剖,取出完整肠道。将肠道用无菌水清洗后放入1.5 mL离心管中,用灭菌研磨棒充分研磨,加无菌水定容至1.0 mL,用迷你混合仪振荡混匀,备用(常吕恕等,2023;何雨薇等,2023;朱国渊等,2024)。设3个重复,每重复15头叉角厉蝽3龄若虫,共45头。1.2.2叉角厉蝽若虫肠道可培养细菌分离及形态鉴定将1.2.1中1.5 mL离心管内混匀备用的原液按10-4、10-5、10-6和10-7梯度稀释制备菌悬液。4个梯度各取100μL菌悬液均匀涂布于NA培养基上,每个梯度设3个重复。于28℃、无光照的恒温箱中培养2~3 d。观察菌落生长情况,根据菌落颜色、大小、形态和质地等形态特征初步区分、记录和统计各细菌数量,挑取不同形态特征的典型菌落划线接种到LB固体培养基上,直至长出单菌落,反复纯化3次(兰明先等,2018),4℃冰箱保存备用。
挑取纯化的细菌菌株单菌落,在LB固体培养基上划线接种,置于28℃恒温箱中培养2~3 d后,以《伯杰细菌鉴定手册》(布坎南和吉本斯,1984)和《微生物学》(沈萍和陈向东,2016)为参照,观察、描述并记录单菌落大小、颜色、形状、隆起、质地、边缘等特征。对肠道细菌进行革兰氏染色,在油镜下观察细菌的细胞形态和菌体颜色,菌体蓝色为革兰氏阳性菌,红色为革兰氏阴性菌。
1.2.3细菌菌株生理生化特性测定参照《微生物学实验》(沈萍等和陈向东,2018),对从叉角厉蝽若虫肠道中分离、去重复、整合得到的细菌进行大分子物质水解、糖发酵、IMViC及硫化氢、酯酶检测等生理生化特性试验,并记录结果。
1.2.4细菌菌株的分子鉴定及系统发育分析使用细菌基因组DNA提取试剂盒提取分离到的细菌DNA作为PCR扩增模板,利用细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-TACGGCTACCTTGTTACGACTT-3')扩增16SrDNA。PCR反应体系50μL:1×TSE102 Taq PCR Mix 45μL,上、下游引物各2μL,DNA模板1μL。反应程序:98℃预变性2 min;98℃10 s,56℃10 s,72℃10 s,进行35个循环;72℃延伸5 min。将1.0%琼脂糖凝胶电泳检测合格后的PCR产物送至北京擎科生物科技有限公司昆明分公司进行测序。
将16SrDNA序列提交至NCBI(https://www.ncbi.nlm.nih.gov/)数据库,进行BLSAT比对并下载相似性最高的序列。通过MEGA 7.0,采用邻接法(Neighbor-joining,NJ)构建系统发育进化树,确定肠道可培养细菌的分类学地位。
1.3细菌菌株促生特性分析
对分离到的细菌菌株进行促生特性分析,分别测定菌株固氮能力、产IAA能力、溶解难溶性磷酸盐能力及产铁载体能力。菌株固氮能力筛选采用Ashby培养基,在Ashby培养基上连续继代培养3次,第3次仍有活性的菌株即具有固氮能力(高沙尔·卡依尔哈力等,2021)。产IAA能力测定参考周益帆等(2024)的Salkowski比色液显色法,室温避光条件下静置30min后,若颜色变红则表示有IAA产生。溶磷试验采用NBRIP培养基测试,根据能否产生溶磷圈以及溶磷圈直径(D)与菌落直径(d)的比值大小初步判断菌株的溶磷能力(高沙尔·卡依尔哈力等,2021)。产铁载体能力采用CAS平板检测法,通过观察菌株周围是否有橙黄色晕圈来判断是否能合成铁载体(赵翔等,2006)。
1.4统计分析
根据培养基上各菌株的培养情况,计算各菌株的相对丰度,相对丰度(%)=某种菌的菌落数/总菌落数×100。用Excel 2016和Illustrator 2021绘图。
2结果与分析
2.1叉角厉蝽若虫肠道可培养细菌的形态特征和培养性状
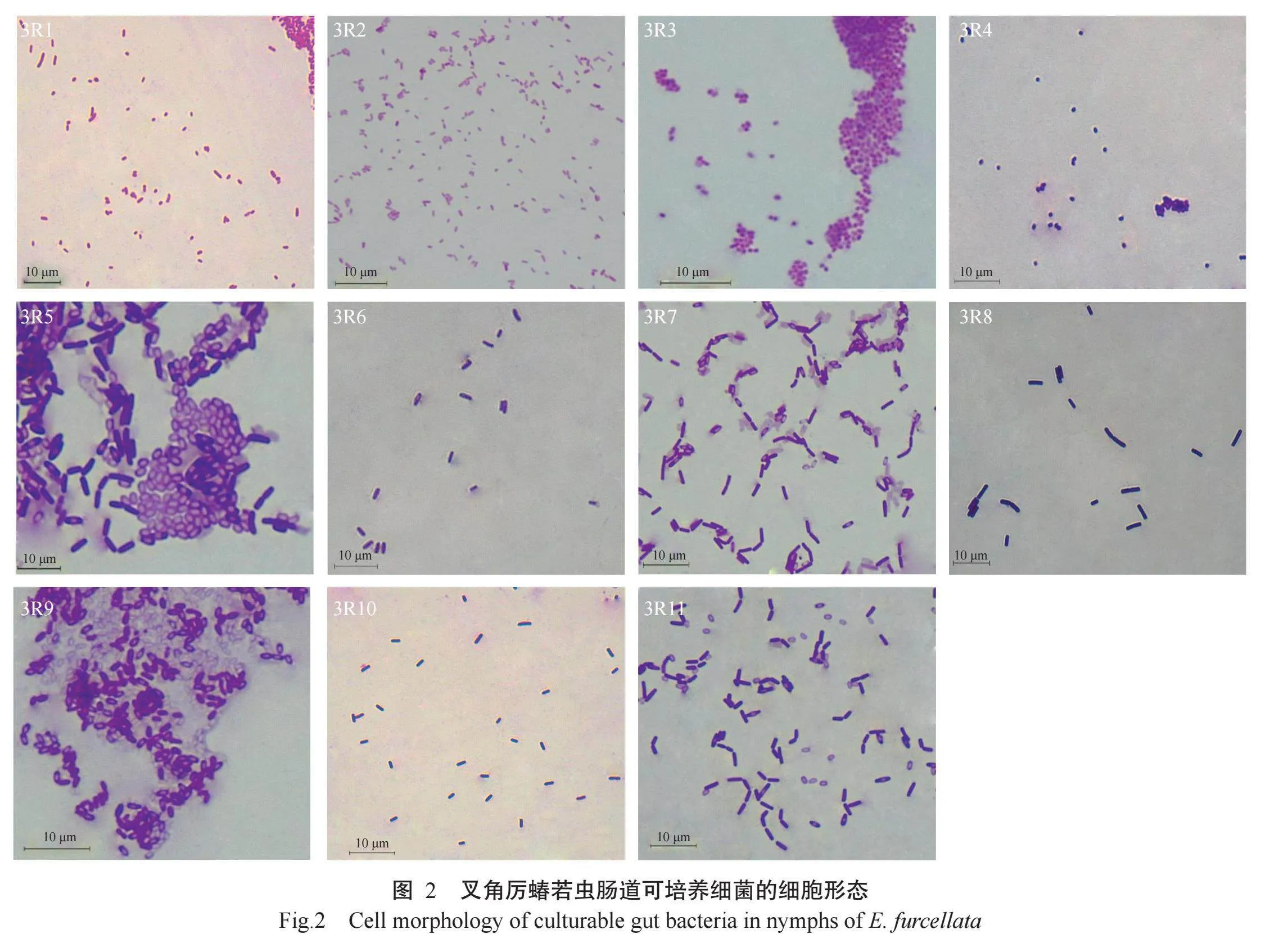
从叉角厉蝽若虫肠道中分离、纯化得到11株菌落形态各异的细菌,编号为3R1~3R11,细菌菌落形态和培养性状见表1和图1。革兰氏染色结果发现,菌株3R1~3R3为革兰氏阴性菌,3R4~3R11为革兰氏阳性菌。菌株3R1~3R3细胞形态为短杆状,3R4细胞形态为球状,其余7株(3R5~3R11)细胞形态为杆状(表1和图2)。
2.2叉角厉蝽若虫肠道可培养细菌的生理生化特性
由表2可知,11株叉角厉蝽若虫肠道可培养细菌中,8株菌(3R2、3R3、3R5~3R8、3R10和3R11)可分泌淀粉水解酶水解淀粉;5株菌(3R1~3R3、3R6和3R9)能产生脂肪酶水解油脂;10株菌(3R1~3R5、3R7~3R11)可产生明胶酶使明胶液化;葡萄糖发酵试验结果,3株菌(3R1~3R3)既产酸又产气,5株菌(3R4、3R8~3R11)只产酸不产气,3株菌(3R5~3R7)既不产酸也不产气;乳糖发酵试验结果,5株菌(3R2、3R3、3R8、3R9和3R11)既产酸又产气,2株菌(3R1和3R4)只产酸不产气,4株(3R5~3R7、3R10)既不产酸也不产气;酯酶试验结果,7株菌(3R1、3R3、3R5、3R6、3R8、3R10和3R11)为阳性;甲基红试验结果,7株菌(3R1~3R4、3R8~3R10)为阳性;伏—普试验结果,5株菌(3R1、3R3、3R8、3R9和3R11)为阳性;柠檬酸盐试验结果,除3R2、3R4和3R8外,其余8株菌均可利用柠檬酸盐;石蕊牛奶试验结果,除3R2为阴性外,其余10株菌均为阳性;硫化氢试验结果,11株菌均可产生硫化氢;尿素试验结果,11株菌均为阴性(无颜色变化);吲哚试验结果,11株菌均为阴性。
2.3叉角厉蝽若虫肠道可培养细菌分子鉴定及系统发育分析结果
利用MEGA 7.0对叉角厉蝽若虫肠道可培养细菌进行16S rDNA序列比对分析,结果(表3)显示,11株肠道细菌分属于2门4科4属。其中,变形菌门有2科2属,即耶尔森菌科(Yersiniaceae)的沙雷氏菌属和摩根氏菌科(Morganellaceae)的摩根氏菌属(Morganella);厚壁菌门有2科2属,分别是肠球菌科的肠球菌属和芽孢杆菌科(Bacillaceae)的芽孢杆菌属。
采用邻接法构建系统发育进化树,结果(图3)显示,同一属的物种以较高的置信度聚类在一起。叉角厉蝽若虫肠道可培养细菌共分为2大支,第1大支由厚壁菌门的芽孢杆菌属和肠球菌属2属的细菌组成;第2大支由变形菌门的沙雷氏菌属和摩根氏菌属的细菌组成。在第1大支中,菌株3R4与粪肠球菌(E.faecalis)单独聚为一小支(支持率99%);菌株3R8与苏云金芽孢杆菌(B.thuringiensis)聚在一起(支持率99%);3R9与高地芽孢杆菌(B.altitudinis)和气芽孢杆菌(B.aerius)聚在一起(支持率99%);菌株3R5、3R6、3R11与芽孢杆菌属的枯草芽孢杆菌(B.subtilis)聚为一支,菌株3R7、3R10与贝莱斯芽孢杆菌(B.velezensis)聚在一支,两者互为姐妹群关系。在第2大支中,菌株3R1与沙雷氏菌属的黏质沙雷氏菌(S.marcescens)聚在一支,3R3与嗜线虫沙雷氏菌(S.nematodiphila)聚在一支,两者互为姐妹群关系,亲缘关系较近;3R2与摩氏摩根氏菌(M.morga-nii)聚在一支(支持率96%)。
2.4叉角厉蝽若虫肠道可培养细菌组成分析
从叉角厉蝽若虫肠道共分离鉴定出可培养细菌2门2纲3目4科4属8种。在门分类水平上,分别为厚壁菌门和变形菌门,厚壁菌门为优势菌门,相对丰度85.67%;在纲分类水平上,由芽孢杆菌纲(85.67%)和γ-变形菌纲(14.33%)组成;在目分类水平上,分别是乳杆菌目(Lactobacillales,75.80%)、肠杆菌目(Enterobacterales,14.30%)和显核菌目(Caryophanales,9.90%),其中乳杆菌目为优势菌目;在科分类水平上,为肠球菌科(75.80%)、芽孢杆菌科(9.90%)、耶尔森菌科(7.79%)和摩根氏菌科(6.51%),优势菌科为肠球菌科;在属分类水平上,依次为肠球菌属(75.80%)、芽孢杆菌属(9.90%)、沙雷氏菌属(7.79%)和摩根氏菌属(6.51%),肠球菌属为优势菌属;在种分类水平上,分别为粪肠球菌(75.80%)、枯草芽孢杆菌(9.17%)、摩氏摩根氏菌(6.51%)、嗜线虫沙雷氏菌(4.49%)、黏质沙雷氏菌(3.30%)、苏云金芽孢杆菌(0.28%)、贝莱斯芽孢杆菌(0.27%)和高地芽孢杆菌(0.18%),其中粪肠球菌为优势菌种(图4)。
2.5叉角厉蝽若虫肠道可培养细菌的促生特性
由表4可知,11株可培养细菌中9株菌具有固氮能力,占总株数的81.82%,其中63.64%为芽孢杆菌属,18.18%为沙雷氏菌属,以3R6和3R8的固氮能力最明显;5株菌具有解无机磷能力,但5株菌间溶磷能力(D/d)存在显著差异(Plt;0.05),D/d为1.16~2.85;11株菌均具有合成铁载体能力,其中3R1、3R4、3R6和3R7最明显;3株菌具有产IAA能力,其中3R2最明显。
综合分析发现,3R1和3R3均属于沙雷氏菌属,具有固氮、溶磷、产IAA和产铁载体4种促生特性;3R2为摩根氏菌属,具有溶磷、产IAA和产铁载体3种促生特性;3R4属于肠球菌属,具有溶解磷酸钙和产铁载体能力;3R5、3R6和3R11,3R7和3R10,3R8和3R9均属于芽孢杆菌属,具有不同程度的固氮和产铁载体能力。
3讨论
本研究从叉角厉蝽若虫肠道中共分离得到11株可培养细菌,隶属于2门2纲3目4科4属8种,以厚壁菌门为优势菌门,肠球菌科为优势菌科,肠球菌属为优势菌属。该结果与益蝽及其他天敌昆虫肠道细菌优势菌门(属)的研究结果相似。优势类群可能是昆虫长期协同进化的结果,如高通量测序分析发现,无论食物类型如何,叉角厉蝽雌成虫中肠细菌均以变形菌门和厚壁菌门为主,在科分类水平上,肠杆菌科和肠球菌科是2个优势科(Kuang et al.,2022)。此外,厚壁菌门一些细菌可能促进了猎物的死亡(Nishiwaki et al.,2007);肠球菌属可产生乙酸盐,通过降低肠液的pH保护宿主,从而对捕食性蝽的捕食效率和生存适应性产生影响(李金梦等,2024);若虫期的肠道细菌主要参与宿主的生长代谢(方博文,2024)。日本弓背蚁(Camponotusjaponi-cus)消化道中分离的22株不同菌株隶属于厚壁菌门、放线菌门和变形菌门3大类群(朱卓琳等,2015)。菜蛾盘绒茧蜂(Cotesia vestalis)中肠微生物以变形菌门、厚壁菌门和子囊菌门(Ascomycota)为主,寄生取食人工饲料的小菜蛾(Plutellaxylostella)的菜蛾盘绒茧蜂中肠微生物以肠球菌属为主,其次为轮枝孢属(Verticillium)(胡娜娜,2022)。猎蝽科肠道细菌的典型菌属为肠球菌属,尤其在大红犀猎蝽(Sycanusfalleni)中肠球菌几乎占主导地位(Li et al.,2022)。从马蜂(Vespa mandarinia)肠道分离获得的61株菌中,粪肠球菌有43株,占比高达70.5%(何雨薇等,2023)。益蝽肠道6种可培养细菌分别隶属于变形菌门和厚壁菌门,优势细菌为粪肠球菌(李金梦等,2024)。
本研究结果的细菌优势菌门(属)与植食性蝽有较大差异,可能与昆虫肠道结构、发育阶段、食性、分离所用的组织部位等有关(李静,2003;Engel and Moran,2013;Scopel and Cônsoli,2018;Luo et al.,2021;Li etal.,2022),不同类型昆虫的肠道微生物类群具有多样性和差异性(Douglas,2009)。如九香虫成虫体内优势菌属为芽孢杆菌属(罗立华等,2016);植食性中黑盲蝽(Adelphocorissuturalis)体内以欧文氏菌属(Erwinia)、葡萄球菌属(Staphylococcus)和不动杆菌属为主(Xue et al.,2021);荔枝蝽(Tessara-tomapapillosa)肠道细菌中变形菌门为优势菌门,泛菌属是优势菌属(Liu et al.,2022);多食性点蜂缘蝽的触角、头、肠道和其他组织中主要的菌属为不动杆菌属、芽孢杆菌属、短杆菌属(Brevibacterium)、肠杆菌属、克雷伯氏菌属(Klebsiella)、哺乳动物球菌属(Mammaliicoccus)、假单胞菌属和葡萄球菌属等(方博文,2024)。
本研究叉角厉蝽若虫肠道可培养细菌菌株促生长特性测定结果显示,11株菌均具有合成铁载体能力、9株菌具固氮能力、5株菌具有溶磷能力、3株菌具有产IAA能力。11株细菌中具促生特性的芽孢杆菌属细菌最多(7株),但大多只具有固氮和产铁载体能力,仅1株菌(3R11)具有固氮、溶磷和产铁载体能力,7株芽孢杆菌均无产IAA能力,与前人对从植物中分离的芽孢杆菌促生特性的研究结果存在一定差异,从植物中分离得到的高IAA活性菌株大多为芽孢杆菌属(万水霞等,2020),原因可能与菌株在不同宿主中的功能不同有关,分离自土壤、根际和植物叶片中的芽孢杆菌高产IAA主要是促进植物生长、提高作物产量。从野生大豆根瘤内分离得到的高地芽孢杆菌具有解有机磷、无机磷和促生等能力,也可提升大豆叶片的光合参数(张文韬等,2022);从烟株分离得到的内生细菌枯草芽孢杆菌LYRY39-1和LYSX141可产IAA,对烟草种子根长和总长有显著的促生效果(李颖颖等,2023);从大豆根际土壤中分离得到的贝莱斯芽孢杆菌菌株TC-52具有固氮、产铁载体和IAA能力(李坤等,2024)。本研究发现2株沙雷氏菌属菌株(3R1和3R3)具有4种促生特性,与前人报道的其他昆虫和植物中沙雷氏菌属的促生特性结果较为一致(曹艳茹,2012;Morales-Jiménezetal.,2013;柯春亮等,2017)。此外,本研究发现摩根氏菌属菌株3R2具有溶磷、产IAA和合成铁载体3种促生特性,肠球菌属3R4具有溶解磷酸钙和合成铁载体能力,这在其他研究中少有报道。促生菌可通过固氮、溶磷、分泌植物激素(如IAA)等促进植物生长发育,还可增强植物的抗逆性(万水霞等,2020)。叉角厉蝽虽然是捕食性天敌昆虫,但在其生长发育过程中需刺吸植物汁液以补充水分和营养,同时需要植物提供产卵场所,这些促生细菌可能通过增强植物的抗逆性和促进植株生长从而提高叉角厉蝽对植物的利用能力和适应性,具体协同机制有待进一步探究。已有研究显示,捕食性蝽短小长颈盲蝽、烟盲蝽可为植物获取和传播植物促生菌(如Paraburkholderiaphytofirmans和Entero-bacter sp.)(Galambos et al.,2021),叉角厉蝽若虫体内分离到具有促生特性的菌株,其传播途径如何仍需进一步研究。本研究对肠道可培养细菌的促生特性只进行了初步分析,需进一步进行定量测定,同时设置盆栽试验进行验证。
昆虫体内不同种类的细菌具有不同的生理功能,其分工协作,共同促进宿主的生长发育。如摩根氏菌在钩臀蚁蛉(Myrmeleon bore)捕食猎物时可能对猎物的死亡具有促进作用(Nishiwaki et al.,2007);在降解纤维素、脂质、蛋白质和碳水化合物方面表现出催化活性(Kim etal.,2014);能够刺激促胸腺激素较早分泌来促进果蝇的生长发育(胡坤坤,2018)。沙雷氏菌属能为宿主提供维生素、氨基酸,帮助其降解纤维素、单萜或双萜等物质(Boone et al.,2013;胡霞等,2018),同时具有产蛋白酶活性(黄振东等,2019)。粪肠球菌具有抑菌、耐酸、耐胆盐及温度耐受性(胡红伟等,2017;何雨薇等,2023),可耐受阿散酸等抗生素,可改善动物胃肠功能,能利用多种糖醇作为碳源产生酸类物质,有利于小菜蛾幼虫中肠乳酸浓度的升高,具有降低血淋巴中海藻糖浓度的作用,对幼虫生长发育具有促进作用(邬向东等,2013;胡娜娜,2022)。枯草芽孢杆菌具有抑制肠道病原菌,协调肠道菌群平衡的作用;能分泌具有较强活性的淀粉酶、脂肪酶和蛋白酶,促进动物对饲粮中营养物质的消化吸收(朱瑾和朱红军,2019)。苏云金芽孢杆菌具有产蛋白酶、淀粉酶、脂肪酶和纤维素酶4种消化酶的能力(何雨薇等,2023)。高地芽孢杆菌可显著提高美洲鳗鲡(Anguilla rostrata)血清溶菌酶的活性,增强其免疫力(魏成业等,2024)。本研究分离得到的细菌是否同样具有这些生理功能有待进一步探究。
本研究从叉角厉蝽若虫肠道分离的可培养细菌种类相对于测序结果,一些有差异的细菌并没有从样品中分离得到,可能与培养基种类、培养条件有关,后期可根据差异菌株特性选择一些鉴别培养基,以获取更多的可培养细菌。
4结论
采用传统分离培养法从叉角厉蝽若虫肠道中分离获得11株细菌,归类为2门2纲3目4科4属8种,其中芽孢杆菌属4种、沙雷氏菌属2种、粪肠球菌属1种、摩根氏菌属1种,可培养细菌种类较丰富;11株细菌均具有不同程度的促生长特性。
参考文献(References):
布坎南R E,吉本斯N E.1984.伯杰细菌鉴定手册[M].第8版.中国科学院微生物研究所译.北京:科学出版社.[Buchanan R E,Gibbons N E.1984.Berger handbook for bacterial identification[M].The 8th Edition.TranslatedbyInstitute of Microbiology,Chinese Academy of Sciences.Beijing:Science Press.]
曹艳茹.2012.高产铁载体菌株的分离鉴定及其对重金属迫下长根菇菌丝体氧化应激的影响[D].成都:四川大学.[Cao Y R.2012.Isolation and identification of highsiderophore-producing bacterias and their effect on antioxi-dant system of Oudemansiellaradicata under heavy metal[D].Chengdu:Sichuan University.]
常吕恕,罗忠荣,杨光源,杨韵,孙淦琳,杨航,杨进波,张庭发,易小光,陈斌.2023.番茄潜叶蛾雌雄成虫肠道可培养细菌多样性研究[J].南方农业学报,54(10):2927-2939.[Chang L S,Luo Z R,Yang G Y,Yang Y,Sun G L,Yang H,Yang J B,Zhang T F,Yi X G,Chen B.2023.Intestine culturable bacteria diversity of male and female adults of Tuta absoluta(Meyrick)[J].Journal of Southern Agriculture,54(10):2927-2939.]doi:10.3969/j.issn.2095-1191.2023.10.011.
陈梦,尚嘉伟,龙海波,汪军,郭立佳,周游,梁昌聪,杨扬,黄俊生,杨腊英.2024.象耳豆根结线虫二龄幼虫生防细菌的筛选及其促生特性评价[J/OL].热带作物学报.(2024-05-06)[2024-08-04].http://kns.cnki.net/kcms/detail/46.1019.S.20240430.1804.002.html.[Chen M,Shang J W,Long H B,Wang J,Guo L J,Zhou Y,Liang C C,Yang Y,Huang J S,Yang L Y.2024.Screening of biocontrol bacte-ria against second-stage juveniles of Meloidogyne enterolo-bii and evaluation of their growth-promoting characteris-tics[J/OL].Chinese Journal of Tropical Crops.(2024-05-06)[2024-08-04].http://kns.cnki.net/kcms/detail/46.1019.S.20240430.1804.002.html.]
杜梦璇,姜民志,刘畅,刘双江.2021.肠道微生物菌株资源库的构建与应用开发[J].微生物学报,61(4):875-890.[Du M X,Jiang M Z,Liu C,Liu S J.2021.Gut microbial Bio-banks:Construction and applications[J].Acta Microbio-logica Sinica,61(4):875-890.]doi:10.13343/j.cnki.wsxb.20200737.
方博文.2024.点蜂缘蝽伴生细菌的分离鉴定和功能预测分析[D].武汉:湖北大学.[Fang B W.2024.Isolation,iden-tification and function prediction analysis of associated bacteria of Riptortuspedestris[J].Wuhan:Hubei Univer-sity.]doi:10.27130/d.cnki.ghubu.2023.000407.
高沙尔·卡依尔哈力,热子亚·麦麦吐逊,祖丽皮亚·玉努斯.2021.地锦草内生细菌多样性、拮抗及促生特性测定[J].微生物学通报,48(2):392-406.[Gaoshaer·Kayierhali,Raziye·Memettursun,Zulfiya·Yunus.2021.Endophytic bacteria from Euphorbia humifusa:Diversity,antagonism and growth promoting activities[J].Microbiology China,48(2):392-406.]doi:10.13344/j.microbiol.china.191069.
何雨薇,陈芳敏,夏琬婷,刘娴,黄晨晨.2023.马蜂肠道菌的分离鉴定及产消化酶功能菌株的筛选[J].微生物学通报,50(6):2624-2634.[He Y W,Chen F M,Xia W T,Liu X,Huang C C.2023.Isolation and identification of gut bacteria from Vespa mandarinia Smith and screening of digestive enzyme-producing strains[J].Microbiology China,50(6):2624-2634.]doi:10.13344/j.microbiol.china.220874.
胡红伟,段明房,闫凌鹏,麻啸涛,陈茹茹,赵帅,李自茹.2017.产细菌素粪肠球菌的分离、鉴定及体外益生特性研究[J].饲料广角,(11):27-32.[Hu H W,Duan M F,Yan L P,Ma X T,Chen R R,Zhao S,Li Z R.2017.Isola-tion,identification and in vitro probiotic characteristics of Enterococcus faecalis producing bacteriocin[J].Feed Chi-na,(11):27-32.]doi:10.3969/j.issn.1002-8358.2017.11.014.
胡坤坤.2018.肠道摩根菌对黑腹果蝇发育历期的影响[D].武汉:湖北大学.[Hu K K.2018.Effects of intestinal Mor-ganii on the developmental timing of Drosophila melano-gaster[D].Wuhan:Hubei University.]
胡娜娜.2022.小菜蛾—菜蛾盘绒茧蜂寄生体系肠道微生物多样性研究及其差异分析[D].杭州:浙江大学.[Hu N N.2022.Analyses of gut microbiota diversity and differen-tiation in the non-parasitized and parasitized diamondback moth Plutellaxylostella(Lepidoptera:Plutellidae)and its larval parasitoid Cotesia vestalis(Hymenoptera:Braconi-dae)[D].Hangzhou:Zhejiang University.]doi:10.27461/d.cnki.gzjdx.2022.002500.
胡霞,傅慧静,李俊楠,林中平,张飞萍.2018.松墨天牛幼虫肠道纤维素降解细菌的分离与鉴定[J].福建农林大学学报(自然科学版),47(3):322-328.[Hu X,Fu H J,Li J N,Lin Z P,Zhang F P.2018.Isolation and identification of cellulolytic bacteria associated with the gut of Monocha-musalternatus larvae[J].Journal of Fujian Agriculture and Forestry University(Natural Science Edition),47(3):322-328.]doi:10.13323/j.cnki.j.fafu(nat.sci.).2018.03.009.
黄慧敏.2023.优雅蝈螽肠道可培养细菌组研究[D].保定:河北大学.[Huang H M.2023.Intestinal culturable bacte-rial group research of Gampsocleisgratiosa(Orthoptera:Tettigoniidae)[J].Baoding:Hebei University.]doi:10.27103/d.cnki.ghebu.2023.001505.
黄伶,姜义仁,文竹,王斌赫,刘微,秦利.2014.柞蚕5龄幼虫肠道好氧细菌的分离鉴定[J].蚕业科学,40(6):1024-1029.[Huang L,Jiang Y R,Wen Z,Wang B H,Liu W,Qin L.2014.Isolation and identification of intestinal aero-bic bacteria from the 5th instar larva of Antheraea pernyi[J].Acta Sericologica Sinica,40(6):1024-1029.]doi:10.13441/j.cnki.cykx.2014.06.014.
黄振东,万晴,薛志静,张瑞玲,张忠.2019.德国小蠊肠道可培养非厌氧细菌的分离、鉴定与产消化酶活性分析[J].中国媒介生物学及控制杂志,30(4):409-413.[Huang Z D,Wan Q,Xue Z J,Zhang R L,Zhang Z.2019.Isolation and identification of culturable aerobic bacteria from the intestines of Blattella germanica and the activity of diges-tive enzymes produced by these bacteria[J].Chinese Jour-nal of Vector Biology and Control,30(4):409-413.]doi:10.11853/iissn.1003.8280.2019.04.012.
柯春亮,李淑娟,段雅婕.2017.解磷菌株M-3-01发酵工艺优化[J].河南科技学院学报(自然科学版),45(3):6-15.[Ke C L,Li S J,Duan Y J.2017.Optimization offermen-tation process of phosphate-solubilizing bacteria M-3-01(Serratia nematodiphila)[J].Journal of Henan Institute of Science and Technology(Natural Science Edition),45(3):6-15.]doi:10.3969/j.issn.1008-7516.2017.03.002.
兰明先,张某,李建一,鲁武锋,李召波,夏涛,李丽芳,吴国星,高熹.2018.泽兰实蝇幼虫内生细菌的分离鉴定及除草活性研究[J].江西农业学报,30(1):59-64.[Lan M X,Zhang M,Li J Y,Lu W F,Li Z B,Xia T,Li L F,Wu G X,Gao X.2018.Isolation,identification and herbicidal acti-vity of symbiotic bacteria in Procecidochares utilis larvae[J].Acta Agriculturae Jiangxi,30(1):59-64.]doi:10.19386/j.cnki.jxnyxb.2018.01.13.
李静.2003.蝽类昆虫酯酶同工酶、消化酶及体内微生物作为分类依据的可行性研究[D].保定:河北农业大学.[Li J.2003.Study on the possibility for classification of Hemip-tera insects by using esterase isoenzymes,digestive enzy-mes and the internal microorganism[J].Baoding:Hebei Agricultural University.]
李金梦,孙智荣,田旭,汪汉成,周凤,史彩华,李文红.2024.益蝽肠道微生物群落结构及其碳源代谢功能[J/OL].昆虫学报.(2024-06-17)[2024-08-03].https://link.cnki.net/urlid/11.1832.Q.20240614.1751.004.[Li J M,Sun Z R,Tian X,Wang H C,Zhou F,Shi C H,Li W H.2024.Com-munity structure and carbon source metabolic function of the intestinal microbes in Picromeruslewisi(Hemiptera:Pentatomidea)[J/OL].Acta Entomologica Sinica.(2024-06-17)[2024-08-03].https://link.cnki.net/urlid/11.1832.Q.20240614.1751.004.]
李坤,洪秀杰,王欣悦,齐鹏宇,霍佳慧,于欣卉,商梓琳,毕少杰,王彦杰.2024.贝莱斯芽孢杆菌TC-52的分离鉴定及其对水稻幼苗生长和立枯病的影响[J].江苏农业科学,52(10):129-137.[Li K,Hong X J,Wang X Y,Qi P Y,Huo J H,Yu X H,Shang Z L,Bi S J,Wang Y J.2024.Iso-lation and identification of Bacillus velezensis TC-52 and its effect on rice seedling growth and blight[J].Jiangsu Agricultural Sciences,52(10):129-137.]doi:10.15889/j.issn.1002-1302.2024.10.017.
李文红,郭涛,向立刚,余知和,李添群.2023.3种抗生素对小菜蛾肠道微生物群落的影响[J]河南农业科学,52(7):98-108.[Li W H,Guo T,Xiang L G,Yu Z H,Li T Q.2023.Effects of three antibiotics on the gut microbial com-munity of Plutellaxylostella(Lepidoptera:Plutellidae)[J].Journal of Henan Agricultural Science,52(7):98-108.]doi:10.15933/j.cnki.1004-3268.2023.07.010.
李颖颖,康业斌,李成军,李淑君.2023.3种拮抗烟草疫霉及产IAA内生细菌的分离鉴定[J].江苏农业科学,51(18):107-114.[Li Y Y,Kang Y B,Li C J,Li S J.2023.Isolation and identification of three antagonistic Phytoph-thora nicotiana and IAA-producing endophytic bacteria[J].Jiangsu Agricultural Sciences,51(18):107-114.]doi:10.15889/j.issn.1002-1302.2023.18.016.
刘宁,刘玉升,付卫东,张国良.2012.中华通草蛉越冬成虫肠道可培养好氧细菌多样性分析[J].应用昆虫学报,49(5):1287-1292.[Liu N,Liu Y S,Fu W D,Zhang G L.2012.Diversity of intestinal aerobic bacteria in overwinte-ring adults of Chrysoperla sinica[J].Chinese Journal of Applied Entomology,49(5):1287-1292.]
刘莎,陈从英.2023.肠道微生物培养的研究进展及应用[J].微生物学报,63(3):881-899.[Liu S,Chen C Y.2023.Research progress and application of gut microorganism culture[J].Acta Microbiologica Sinica,63(3):881-899.]doi:10.13343/j.cnki.wsxb.20220514.
罗立华,卢圣鄂,梁煜桓,张小平,辜运富.2016.九香虫(椿象)体内可培养细菌的多样性分析[J].微生物学通报,43(9):1945-1952.[Luo L H,Lu S E,Liang Y H,Zhang X P,Gu Y F.2016.Diversity of the culturable bacteria iso-lated from Aspongopuschinesis Dallas(Pantatomidae)[J].Mi-crobiology China,43(9):1945-1952.]doi:10.13344/j.mi-crobiol.china.150811.
沈萍,陈向东.2016.微生物学[M].第8版.北京:高等教育出版社:15-17.[Shen P,Chen X D.2016.Microbiology[M].The 8th Edition).Beijing:Higher Education Press:15-17.]
沈萍,陈向东.2018.微生物学实验[M].第5版.北京:高等教育出版社.[Shen P,Chen X D.2018.Experiments in microbiology[M].The 5th Edition.Beijing:Higher Educa-tion Press.]
万水霞,王静,李帆,蒋光月,徐文静,刘祚军.2020.玉米根际高效溶磷菌的筛选、鉴定及促生效应研究[J].生物技术通报,36(5):98-103.[Wan S X,Wang J,Li F,Jiang G Y,Xu W J,Liu Z J.2020.Screening and identification of phosphate solubilizing bacteria from maize rhizosphere soil and its growth promoting effect[J].Biotechnology Bulletin,36(5):98-103.]doi:10.13560/j.cnki.biotech.bull.1985.2019-0678.
王琪,陈芳敏,陈广青,夏琬婷,刘宁,游博,朱海.2024.斑须蝽肠道菌的分离鉴定及产纤维素酶菌株的筛选与酶活力测定[J/OL].微生物学通报.(2024-04-16)[2024-04-20].https://doi.org/10.13344/j.microbiol.china.231057.[Wang Q,Chen F M,Chen G Q,Xia W T,Liu N,You B,Zhu H.2024.Screening and enzyme activity determination of cellulase-producing strains from the gut bacteria of Dolyco-risbaccarum L.[J/OL].Microbiology China.(2024-04-16)[2024-04-20].https://doi.org/10.13344/j.microbiol.china.231057.doi:10.13344/j.microbiol.china.231057.]
魏成业,杨红玲,夏孟婷,聂庆杰,翟少伟,孙云章.2024.3株肠道原籍菌在美洲鳗鲡养殖中的应用研究[J].水产科学,43(2):189-198.[Wei C Y,Yang H L,Xia M T,Nie Q J,Zhai S W,Sun Y Z.2024.Application of three indi-genous bacterial species in aquaculture of American eel Anguilla rostrata[J].Fisheries Science,43(2):189-198.]doi:10.16378/j.cnki.1003-1111.21236.
邬向东,刘明珠,包淋斌,瞿明仁,钟启平.2013.乳酸粪肠球菌对常用抗生素耐受性及肠道致病菌抑制作用[J].饲料研究,(8):83-84.[Wu X D,Liu M Z,Bao L B,Qu M R,Zhong Q P.2013.Tolerance of Enterococcus faecalis to common antibiotics and inhibition of intestinal pahogenic bacteria[J].Feed Research,(8):83-84.]doi:10.13557/j.cnki.issn 1002-2813.2013.08.021.
易春燕,刘旭,王燕平,刘昌华,刘虹伶,吕玉梅,文维书,雷贤富,张翠翠.2024.草地贪夜蛾与黏虫肠道微生物的多样性分析[J].江苏农业科学,52(5):140-145.[Yi C Y,Liu X,Wang Y P,Liu C H,Liu H L,LüY M,Wen W Z,Lei X F,Zhang C C.2024.Analysis of gut microbiota diver-sity of Spodoptera frugiperda and Mythimna separate[J].Jiangsu Agricultural Sciences,52(5):140-145.]doi:10.15889/j.issn.1002-1302.2024.05.021.
张曼,高平,赵航,周辰彦,梁晨,汤永玉,邢孔政,吴国星,高熹.2022.捕食性天敌叉角厉蝽生长发育、繁殖及各虫态形态特征观察[J].南方农业学报,53(4):1078-1087.[Zhang M,Gao P,Zhao H,Zhou C Y,Liang C,Tang Y Y,Xing K Z,Wu G X,Gao X.2022.Development,fecundity and morphological characteristics of the predatory Eocan-theconafurcellata(Wolff)[J].Journal of Southern Agri-culture,53(4):1078-1087.]doi:10.3969/j.issn.2095-1191.2022.04.021.
张文韬,杨皓,毛国豪,庄家尧,陈新峰.2022.一株高地芽孢杆菌的鉴定与促生能力研究[J].江苏农业科学,50(5):225-229.[Zhang W T,Yang H,Mao G H,Zhuang J Y,Chen X F.2022.Identification and growth promoting abi-lity of a strain of Bacillus altitudinis[J].Jiangsu Agricul-tural Sciences,50(5):225-229.]doi:10.15889/j.issn.1002-1302.2022.05.036.
赵翔,陈绍兴,谢志雄,沈萍.2006.高产铁载体荧光假单胞菌Pseudomonas fluorescens sp-f的筛选鉴定及其铁载体特性研究[J].微生物学报,46(5):691-695.[Zhao X,Chen S X,Xie Z X,Shen P.2006.Isolation,identification and over-siderophores production of Pseudomonas fluorescens sp-f[J].Acta Microbiologica Sinica,46(5):691-695.]doi:10.13343/j.cnki.wsxb.2006.05.002.
赵秀芝,刘玉升,张帆.2011.龟纹瓢虫四虫态肠道细菌分离及鉴定[J].中国微生态学杂志,23(6):500-504.[Zhao X Z,Liu Y S,Zhang F.2011.The isolation and identifica-tion of intestinal bacteria of four states of Propylea japonica[J].Chinese Journal of Microecology,23(6):500-504.]doi:10.13381/j.cnki.cjm.2011.06.001.
郑亚强,杜广祖,李亦菲,陈斌,李正跃,肖关丽.2017.马铃薯块茎蛾肠道细菌分离鉴定及其对植物源大分子化合物的降解作用[J].环境昆虫学报,39(3):525-532.[Zheng Y Q,Du G Z,Li Y F,Chen B,Li Z Y,Xiao G L.2017.Iso-lation and identification of bacteria from larval gut of the potato tuberworm,Phthorimaeaoperculella(Zeller)and the degradation for plant-based macromolecular com-pounds[J].Journal of Environmental Entomology,39(3):525-532.]doi:10.3969/j.issn.1674-0858.2017.03.5.
周帆,庞志倡,余小强,汪肖云.2020.昆虫肠道微生物的研究进展和应用前景[J].应用昆虫学报,57(3):600-607.[Zhou F,Pang Z C,Yu X Q,Wang X Y.2020.Insect gut microbiota research:Progress and applications[J].Chinese Journal of Applied Entomology,57(3):600-607.]doi:10.7679/j.issn.2095-1353.2020.060.
周荣翔,李霁虹,张瑶,周婷婷,王雨婷,侯晓飞,马桂珍.2022.海洋细菌N-LY-1菌株的农用功能活性研究及其种属鉴定[J].南方农业学报,53(3):830-839.[Zhou R X,Li J H,Zhang Y,Zhou T T,Wang Y T,Hou X F,Ma G Z.2022.Study on agricultural function and activity of marine bacterium N-LY-1 and its species identification[J].Journal of Southern Agriculture,53(3):830-839.]doi:10.3969/j.issn.2095-1191.2022.03.025.
周益帆,王金斌,何川,岳童,白寅霜,李庆伟,唐雪明,杨焱,蒋玮,黄艳娜.2024.一株产吲哚乙酸的Bacillus velezen-sis JB0319的筛选、鉴定及其促生作用[J].土壤通报,55(1):173-183.[Zhou Y F,Wang J B,He C,Yue T,Bai Y S,Li Q W,Tang X M,Yang Y,Jiang W,Huang Y N.2024.Screening,identification and growth promotion of a strain of Bacillus velezensis JB0319 producing indoleace-tic acid[J].Chinese Journal of Soil Science,55(1):173-183.]doi:10.19336/j.cnki.trtb.2023013001.
朱国渊,刘炳顺,张曼,施春兰,汤永玉,兰明先,吴国星,次那有若,高熹.2024.叉角厉蝽不同发育阶段肠道细菌群落组成、多样性及功能预测[J].南方农业学报,55(1):13-23.[Zhu G Y,Liu B S,Zhang M,Shi C L,Tang Y Y,Lan M X,Wu G X,Ci-na-you-ruo,Gao X.2024.Composition,diversity and function prediction of the gut bacterial com-munity in different developmental stages of Eocantheconafurcellata(Wolff)[J].Journal of Southern Agriculture,55(1):13-23.]doi:10.3969/j.issn.2095-1191.2024.01.002.
朱瑾,朱红军.2019.枯草芽孢杆菌的作用机制及其在动物生产中的应用[J].粮食与饲料工业,(8):47-51.[Zhu J,Zhu H J.2019.Mechanism of Bacillus subtilis and its application in animal production[J].Cerealamp;Feed Indus-try,(8):47-51.]doi:10.7633/j.issn.1003-6202.2019.08.012.
朱卓琳,南小宁,王云果,贺虹.2015.日本弓背蚁消化道厌氧细菌的分离培养[J].应用昆虫学报,52(4):1032-1039.[Zhu Z L,Nan X N,Wang Y G,He H.2015.The isolation of anaerobic bacteria from the gut of Camponotusjaponi-cus[J].Chinese Journal of Applied Entomology,52(4):1032-1039.]doi:10.7679/j.issn.2095-1353.2015.124.
Ahsaei S M,Hosseininaveh V,Talaei-Hassanloui R,Zamani M.2020.Contribution of bacterial gut symbionts to diges-tion and development in Podisusmaculiventris(Hemip-tera:Pentatomidae)[J].The Proceedings of the National Academy of Sciences,India Section B:Biological Scien-ces,90:959-967.doi:10.1007/s40011-020-01165-3.
Boone C K,Keefover-Ring K,Mapes A C,Adams A S,Bohl-mann J,Raffa K F.2013.Bacteria associated with a tree-killing insect reduce concentrations of plant defense com-pounds[J].Journal of Chemical Ecology,39(7):1003-1006.doi:10.1007/s 10886-013-0313-0.
Douglas A E.2009.The microbial dimension in insect nutri-tional ecology[J].Functional Ecology,23:38-47.doi:10.1111/j.1365-2435.2008.01442.x.
Engel P,Moran N A.2013.The gut microbiota of insects-diversity in structure and function[J].FEMS Microbio-logy Reviews,37(5):699-735.doi:10.1111/1574-6976.12025.
Galambos N,Compant S,Wäckers F,Sessitsch A,Anfora G,Mazzoni V,Pertot I,Perazzolli M.2021.Beneficial insects deliver plant growth-promoting bacterial endophytes between tomato plants[J].Microorganisms,9(6):1294.doi:10.3390/microorganisms9061294.
Kim E,Park J,Lee S,Kim Y.2014.Identification and physio-logical characters of intestinal bacteria of the black soldier fly,Hermetiaillucens[J].Korean Journal of Applied Ento-mology,53:15-26.doi:10.5656/KSAE.2013.09.0.049.
Kuang Z L,Wen J,Zhu Y J,He X F,Chen K W.2022.Dietary association with midgut microbiota components of Eocan-theconafurcellata(Wolff)[J].Diversity,14(12):1130.doi:10.3390/d 14121130.
Li G N,Sun J J,Meng Y J,Yang C F,Chen Z,Wu Y F,Tian L,Song F,Cai W Z,Zhang X,Li H.2022.The impact of environmental habitats and diets on the gut microbiota diversity of true bugs(Hemiptera:Heteroptera)[J].Bio-logy,11(7):1039.doi:10.3390/biology 11071039.
Liu Z H,Yang Z W,Zhang J,Luo J Y,Men Y,Wang Y H,XieQ.2022.Stage correlation of symbiotic bacterial commu-nity and function in the development of litchi bugs(Hemiptera:Tessaratomidae)[J].Antonie van Leeuwen-hoek,115(1):125-139.doi:10.1007/s 10482-021-01685-6.Luo J,Chen Y X,Guo L B,Wang A B,Lu M,Xu L T.2021.
Variation of gut microbiota caused by an imbalance diet is detrimental to bugs’survival[J].Science of the Total En-vironment,771:144880.doi:10.1016/j.scitotenv.2020.144 880.
Morales-Jiménez J,Vera-Ponce de León A,García-Domínguez A,Martínez-Romero E,Zúñiga G,Hernández-Rodríguez C.2013.Nitrogen-fixing and uricolytic bacteria associated with the gut of Dendroctonusrhizophagus and Dendrocto-nus valens(Curculionidae:Scolytinae)[J].Microbial Eco-logy,66(1):200-210.doi:10.1007/s00248-013-0206-3.
Nishiwaki H,Ito K,Shimomura M,Nakashima K.2007.Insec-ticidal bacteria isolated from predatory larvae of the ant-lion species Myrmeleon bore(Neuroptera:Myrmeleonti-dae)[J].Journal of Invertebrate Pathology,96(1):80-88.doi:10.1016/j.jip.2007.02.007.
Possemiers S,Bolca S,Verstraete W,Heyerick A.2011.The intestinal microbiome:A separate organ inside the body with the metabolic potential to influence the bioactivity of botanicals[J].Fitoterapia,82(1):53-66.doi:10.1016/j.fitote.2010.07.012.
Scopel W,Cônsoli F L.2018.Culturable symbionts associated with the reproductive and digestive tissues of the Neo-tropical brown stinkbug Euschistus heros[J].Antonie van Leeuwenhoek,111(12):2413-2424.doi:10.1007/s 10482-018-1130-9.
Shan H W,Wu W,Sun Z T,Chen J P,Li H J.2021.The gut microbiota of the insect infraorder Pentatomomorpha(Hemiptera:Heteroptera)for the light of ecology and evo-lution[J].Microorganisms,9(2):464.doi:10.3390/micro-organisms9020464.
Xue H,Zhu X Z,Wang L,Zhang K X,Li D Y,Ji J C,Niu L,Wu C C,Gao X K,Luo J Y,Cui J J.2021.Gut bacterial diversity in different life cycle stages of Adelphocorissuturalis(Hemiptera:Miridae)[J].Frontiers in Microbio-logy,12:670383.doi:10.3389/fmicb.2021.670383.
Zilber-Rosenberg I,Rosenberg E.2008.Role of microorgani-sms in the evolution of animals and plants:The hologe-nome theory of evolution[J].FEMS Microbiology Re-views,32(5):723-735.doi:10.1111/j.1574-6976.2008.00 123.x.
(责任编辑麻小燕)

