慢性不可预知温和应激诱导的抑郁小鼠中央杏仁核和边缘前皮质神经网络的可塑性变化
关键词:抑郁;可塑性;杏仁核;内侧前额叶皮层
随着生活节奏的加快和社会竞争的激烈,人们越来越容易经历慢性应激状态。慢性应激对个体的心理健康和认知功能产生的负面影响,特别是其在诱发抑郁症和影响空间学习记忆能力方面的作用,已成为当代神经科学和心理学研究的重点[1, 2]。慢性应激通过激活身体的应激反应系统,引发一系列生理和生化变化,影响大脑内的神经递质平衡和神经细胞功能,从而进一步干扰了大脑的神经网络,尤其是在处理情绪和认知任务的关键脑区,如海马、内侧前额叶皮层(mPFC)和杏仁核等[3-5]。目前认为这些变化是抑郁症发病机制的核心,对其的研究不仅加深了对抑郁症神经生物学基础的理解,也为开发针对性的治疗策略提供了新的线索[6]。
空间学习记忆是一种复杂的认知功能,依赖于海马和与之密切相关的mPFC及杏仁核等脑区[7, 8]。对啮齿类动物的研究表明,慢性应激引起的抑郁症和空间记忆障碍与大脑内特定脑区的神经网络可塑性变化密切相关[9, 10]。慢性应激能够减少背侧海马及腹侧海马神经元的突触连接,影响空间信息的编码、存储和检索过程[11]。同时,mPFC及杏仁核等脑区也显示出神经结构和功能的显著改变,包括神经元萎缩及神经递质系统功能失调等,不仅影响了情绪调节,还干扰了认知功能,尤其是与空间记忆相关的海马功能,表明海马、mPFC及杏仁核之间存在着复杂的神经纤维网络和信号传导[12, 13]。最近发现,中央杏仁核(CeA)与mPFC 的边缘前皮质(PrL)之间的纤维联系和神经通路可能与抑郁小鼠空间学习和记忆能力的改变有关[14, 15]。尽管目前对海马等脑区间神经回路的调控机制有了初步的理解,但在不同亚区,特别是CeA和PrL两个区域内部的神经网络协同作用,以及不同类型神经元编码能力的可塑性变化尚不明确[16]。从这一角度出发,本研究利用慢性不可预知温和应激(CUMS)建立抑郁症小鼠模型,通过行为学对小鼠的抑郁水平和空间学习记忆能力进行评估,利用膜片钳技术记录CeA和PrL脑区中不同亚群神经元动作电位的发放模式,希望能够深入理解慢性应激引起的抑郁状态下小鼠CeA和PrL神经网络可塑性的变化规律,及其在调控空间认知功能中的作用机制。这不仅有助于揭示慢性应激与抑郁症发病机制之间的联系,也为抑郁症的预防和治疗提供新的研究视角和理论基础。
1 材料和方法
1.1 实验动物
雄性6 周龄C57Thy1-YFP/GAD67-GFP 小鼠30只,SPF级,其GABA能神经元由绿色荧光蛋白(GFP)遗传标记[17],体质量为21.9±0.7 g,由南京大学动物实验中心提供。遵循实验动物饲养标准,温度保持在22~24 ℃,相对湿度维持在40%~60%,提供12 h 光照/12 h黑暗周期,环境噪声lt;45 dB。该研究方案经蚌埠医科大学动物伦理委员会审批(伦理批号:伦动科批字[2024]第477号)。
1.2 主要试剂和仪器
标准电极液和人工脑脊液中Na-Gluconate、EGTA、Tris-GTP、Mg2+-ATP、dextrose、K-Gluconate、HEPES、KOH、NaOH、NaCl、KCl、MgSO4、NaH2PO4、CaCl2和葡萄糖酸钾(Sigma),SA104T 糖水偏好系统(江苏赛昂斯生物科技有限公司),Morris水迷宫和旷场实验系统(Noldus),强迫游泳实验分析系统(北京科月华诚科技有限公司),红外微分干涉相差显微镜(Nikon),显微操纵仪和微电极管拉制仪(Sutter),Axoclamp900A膜片钳微电极放大器(Axon),震荡切片机(Vibratome),VS-303D 图像采集和摄像监控系统(Burleigh)。
1.3 方法
1.3.1 实验分组和模型制备 利用随机数字表法将C57Thy1-YFP/GAD67-GFP 小鼠随机分为对照组和CUMS组,每组15只,对照组不做处理,对CUMS组施加一系列轻微、不可预测的应激刺激以建立模型,模拟抑郁症的发病机制和症状。首先让小鼠适应实验环境1周,随后每天随机对小鼠施加2 种不同类型的温和应激,包括圆筒束缚1 h、夹尾2 min、潮湿垫料12 h、社会隔离12 h、夜间持续光照12 h、恐惧声音干扰30 min、鼠笼晃动5 min、禁水12 h、热源烘烤30 min,共持续8周。
1.3.2 糖水偏好实验 准备两个饮水瓶,一个装普通纯水,一个装糖水(浓度为1%的蔗糖溶液),以及用于记录饮水量的精密秤。为消除社会因素的影响,对小鼠进行单笼饲养5 d,并在实验前给予小鼠糖水24 h进行适应性喂养。实验开始后,首先记录两瓶饮水的初始质量,然后将两个饮水瓶同时放入小鼠笼内,让小鼠自由选择饮用12 h。为避免位置偏好影响结果,实验期间需定时交换两瓶水的位置。实验结束后,记录两瓶饮水的最终质量,并计算小鼠的糖水偏好指数(SPI)。SPI=糖水消耗量/(糖水消耗量+纯水消耗量)×100%。实验期间定期检查饮水瓶以确保清洁和液体充足。
1.3.3 旷场实验 旷场为暗色调方形平面区域(60 cm×60 cm),边缘有墙壁。使用高清视频追踪系统从上方记录小鼠在旷场中的活动。保持室内安静,光照及温度等恒定。实验开始前,将小鼠置于实验室内3 h以适应环境。实验开始后,将小鼠轻轻放置在旷场测试区域,记录和分析小鼠5 min的自由活动行为,包括总运动距离、穿越格子数、进入中心区域次数、中心区域停留时间、中心区域路程百分比、中心区域活动时间百分比,以及立起次数,立起即小鼠前肢离开地面站立起来四处观望的行为。每次实验前后清洁旷场,以避免不同小鼠之间的气味干扰。
1.3.4 强迫游泳实验 准备一个高度为30 cm、直径为20 cm的圆柱形玻璃容器,其中水位高度为20 cm,使小鼠在水中不能触及底部且无法爬出,水温维持在23~25 ℃。实验室内保持安静且光照适宜。正式实验前1 d将小鼠置于实验室进行预适应。实验中将小鼠轻轻放入装有温水的玻璃容器中,测试时间为6 min,前2 min作为适应期,后4 min用于正式记录和评估。观察并记录小鼠在水中的行为和时间,包括挣扎时间、游泳时间、静止时间和爬行时间。挣扎是指小鼠在水中积极游动以尝试逃脱的行为,这种行为通常包括快速且有力的四肢运动;游泳表现为小鼠在不尝试逃脱(非挣扎)的情况下在水中的移动;静止是指小鼠在水中几乎不做任何运动,仅进行必要的动作以保持头部在水面以上呼吸;爬行表现为小鼠尝试攀爬容器边缘,试图逃离水面的行为。实验结束后,立即将小鼠从水中取出,轻轻擦干,并放回暖箱中休息。
1.3.5 Morris水迷宫实验 水迷宫为一个直径为120 cm的圆形水池,底部为黑色背景。水池的目标象限安放一个被水面覆盖的隐藏平台(直径6 cm),小鼠可以站立,避免被淹没。迷宫周围遮光帘上有不同的可视标记参照物,包括圆形等4种图形。整个实验包括定位实验和空间探索实验,实施过程中无噪声和强光干扰,实验者手法轻柔,保证小鼠背朝向水池中央入水,随即离开水池。正式实验前,小鼠先接受适应性训练,让其在迷宫中自行探索。适应性训练后,进入定位实验。采用随机法将小鼠放置在水池的不同象限,让其自行游泳,记录每只小鼠寻找并成功登上平台的时间(定位潜伏期)和路径长度。如果在60 s内寻找平台的任务失败,则引导小鼠登上平台,其定位潜伏期记录为60 s。定位实验共持续6 d,每天进行4次训练,训练间隔为2 h,每天训练设为1个trial,同时记录小鼠平均游泳速度。定位实验结束后24 h进行空间探索实验,移除隐藏平台,将小鼠从平台对侧的对角象限释放入水,记录120 s 内其第1次进入目标平台所在象限的时间(目标区首次入口时间),目标象限内路程占总路程百分比,以及120 s内不同象限的停留时间。
1.3.6 膜片钳全细胞记录 对小鼠行戊巴比妥钠(40 mg/kg)麻醉后立即进行开颅手术,取出脑组织,迅速将其置于含有dextrose 10 mmol/L、CaCl2 0.5 mmol/L、NaH2PO4 1.3 mmol/L、MgSO4 4 mmol/L、KCl 3 mmol/L、NaCl 124 mmol/L、HEPES 5 mmol/L、NaHCO3 26 mmol/L的人工脑脊液中,维持在冰水混合状态并保持充分氧合,pH 值调整至7.4。随后将脑组织切割成厚度为400 μm的脑片,并转移到人工脑脊液中持续充分氧合1 h,环境温度控制在24±2 ℃。在红外微分干涉相差显微镜下对CeA和PrL区的谷氨酸能和GABA能神经元进行观察。可以通过多种方式对两类神经元进行区分,如GABA能神经元的GFP在蓝光的激发下呈现出绿色荧光[18]。此外,神经元的形态特征也是鉴别的重要依据[19]。谷氨酸能神经元的胞体一般呈锥形,主树突从顶端发出并向皮质延伸,沿途逐渐分出更细的树突,长短不同的微细树突从基底部发出,短树突往往不超越皮质,而长树突可延伸至髓质。GABA能神经元的胞体通常呈卵圆形,突起从胞体分散至四周。另外,在电生理特征方面,谷氨酸能神经元在动作电位发放过程中时相精确性逐渐降低,动作电位间距(ISI)逐渐延长[20]。在全细胞模式下通过pClamp软件记录和分析两类神经元的电生理参数,例如Vts-Vr代表阈电位(Vts)和静息电位(Vr)的差值,即神经元产生动作电位所需克服的电位差异,称为能障;绝对不应期(ARP)是指神经元一个动作电位发放结束后到下一个动作电位开始发放之间的最小时间段,期间神经元处于不可再兴奋的状态;ISI是指两个连续完整动作电位之间的时间间隔。在统计分析中,将Vr绝对值低于75 mV的神经元排除统计范围[21]。
1.4 统计学分析
采用SPSS23.0统计软件进行统计分析,计量资料用均数±标准差形式表示,Morris水迷宫定位实验中的潜伏期数据采用重复测量的方差分析,空间探索等其他行为学和电生理实验数据采用单因素方差分析,方差齐性检验,组间比较采用LSD法,配对样本t检验,以Plt;0.05为差异有统计学意义。
2 结果
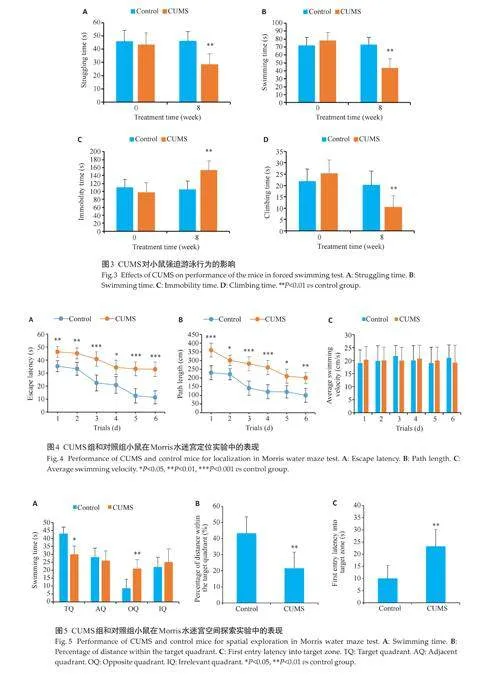
2.1 CUMS对小鼠糖水偏好的影响
在施加CUMS前,两组小鼠SPI差异无统计学意义(Pgt;0.05),经过8周的CUMS后,与对照组相比,CUMS组小鼠的SPI降低(Plt;0.01,图1)。
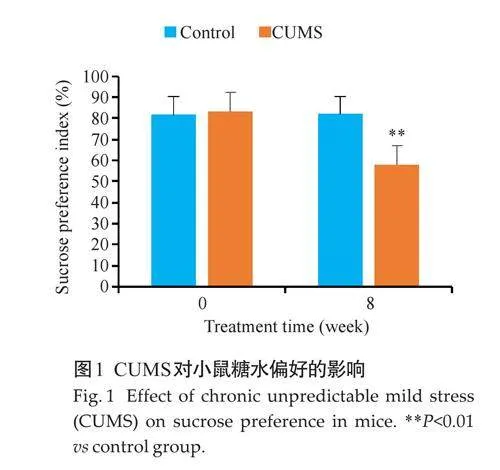
2.2 CUMS对小鼠旷场活动行为的影响
施加CUMS 前,两组小鼠在总运动距离、穿越格子数、进入中心区域次数、中心区域停留时间、中心区域路程百分比、中心区域活动时间百分比,以及立起次数方面的差异无统计学意义(Pgt;0.05),通过8周的CUMS后,与对照组相比,CUMS 组小鼠的各项指标均下降(Plt;0.01,图2)。
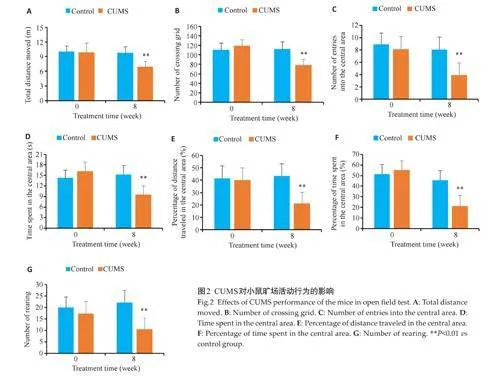
2.3 CUMS对小鼠强迫游泳行为的影响
施加CUMS前,两组小鼠在挣扎时间、游泳时间、静止时间和爬行时间方面的差异无统计学意义(Pgt;0.05),施加8周的CUMS后,与对照组相比,CUMS组小鼠的挣扎时间、游泳时间和爬行时间均降低(Plt;0.01),而静止时间则增高(Plt;0.01,图3)。
2.4 CUMS对小鼠空间记忆的影响
在定位实验阶段,随着训练次数及天数的增加,两组小鼠的定位潜伏期和路径长度均逐渐缩短(F=5.361,P=0.021),而CUMS 组小鼠寻找平台的时间和路径长度均高于对照组(Plt;0.05)。6 d 的训练中,两组小鼠的平均游泳速度差异无统计学意义(Pgt;0.05,图4),排除了小鼠之间可能存在的运动能力差异对实验结果的影响。在空间探索实验阶段,与另外3个象限相比,两组小鼠在目标象限的游泳时间增长(F=4.681,P=0.037)。与对照组相比,CUMS组小鼠的目标象限内路程占总路程百分比和游泳时间均降低(Plt;0.05),而目标区首次入口时间和对角象限内游泳时间均增长(Plt;0.01,图5)。
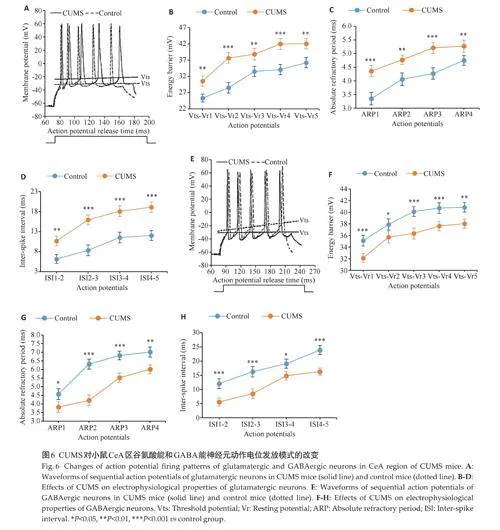
2.5 CUMS对小鼠对CeA和PrL区神经元电生理指标的影响
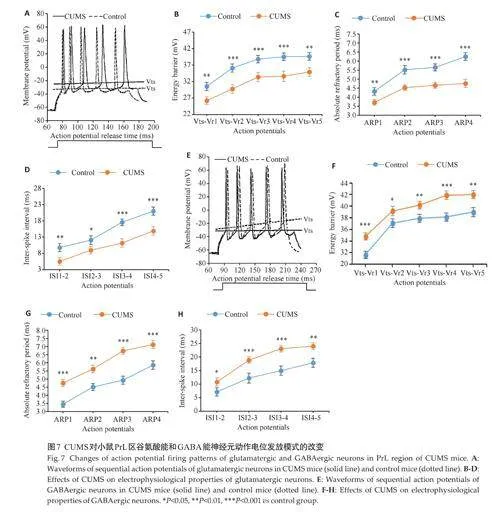
对小鼠CeA区不同亚群神经元动作电位参数的检测显示,与对照组相比,CUMS 组谷氨酸能神经元的Vts-Vr、ARP和ISI数值均增高(Plt;0.01),GABA能神经元的Vts-Vr、ARP和ISI数值均降低(Plt;0.05,图6)。而在PrL区,与对照组相比,CUMS组谷氨酸能神经元的Vts-Vr、ARP和ISI数值均降低(Plt;0.05),GABA能神经元的Vts-Vr、ARP和ISI数值均增高(Plt;0.05,图7)。
3 讨论
抑郁症以持续的低落心情、兴趣减少、焦虑等为主要特征,包括情绪、认知和行为方面的改变。其核心症状之一表现为空间学习和记忆障碍,如对新的空间环境信息或导航路径的记忆获取障碍,在已知环境中导航的定向障碍及空间关系处理障碍等[22]。这可能与大脑神经网络在结构和功能上的调整和重塑有关,其中涉及到了某些关键脑区如海马、杏仁核和mPFC[23, 24]。海马在处理环境信息和空间定位中的作用使其在空间学习障碍中扮演重要角色,而杏仁核、mPFC与海马之间的神经连接在抑郁症的神经环路中至关重要,这些连接的改变可能影响个体对空间环境的认知和记忆[25]。啮齿类动物的研究表明,腹侧海马通过其神经元的轴突直接投射到mPFC的边缘下皮质,同时边缘下皮质也向腹侧海马发送回馈信号,从而形成双向通路,这种反馈机制可能对空间记忆的形成和精细化调节至关重要[26]。另外一些研究中,通过光遗传学手段抑制杏仁核外侧区到背侧海马的投射神经元可以提高抑郁小鼠的空间记忆能力,而抑制基底杏仁核区的投射神经元降低了对空间记忆的学习和巩固,激活边缘下皮质向杏仁核外侧区发送抑制性信号的投射神经元则有助于促进空间记忆的编码[27, 28]。虽然目前对相关脑区在抑郁症中的作用已有了一定的认识,但其内在神经机制仍不完全清楚,尤其是与空间学习记忆相关的不同脑区及其亚区之间神经网络的可塑性变化。已有证据表明,CeA与PrL之间的纤维投射在复杂的空间认知任务中发挥关键作用[29],因此,抑郁引起的空间学习记忆障碍可能与两个亚区中不同类型神经元编码模式的改变所引起的亚区间神经通路的重塑有关。
慢性应激与抑郁症之间的关系尤为密切,长期的应激状态可以干扰神经递质的正常功能和神经网络的相对平衡,这种神经化学变化可能会诱发或加剧抑郁症状[30]。因此,慢性应激是抑郁症的一个重要触发因素。CUMS是一种广泛用于抑郁症动物模型的应激方式,主要通过在一段时间内给予多种不可预测的轻微应激,诱发产生类似抑郁症的行为和生理改变[31]。本研究利用CUMS建立抑郁小鼠模型,通过行为学等实验评估动物模型的稳定性。糖水偏好实验显示CUMS降低了小鼠的SPI,表明其对糖水的摄取减少,即对甜味的兴趣降低,对奖励乐趣的感受减弱,这是抑郁症的核心症状之一。旷场实验中,CUMS组小鼠在总运动距离、穿越格子数、进入中心区域次数、中心区域停留时间、中心区域路程百分比、中心区域活动时间百分比,以及立起次数方面的指标均下降,共同表明了CUMS组小鼠呈现出一系列与抑郁症相关的行为特征,包括活动范围减少,对环境的探索和对新奇刺激的兴趣降低,对环境的不安或恐惧感增加等。强迫游泳实验显示CUMS降低了小鼠的挣扎时间、游泳时间和爬行时间,提高了静止时间,反映出小鼠对于逃脱或解决困境的努力减弱。综合来看,CUMS 小鼠模型模拟了人类抑郁症的多个核心特征,如情绪低落、食欲降低、兴趣减退和焦虑等。
为了深入了解抑郁对小鼠空间记忆的影响,我们进行了Morris水迷宫实验,该实验被广泛用于评估动物的空间学习和记忆能力[32]。定位训练期间,两组小鼠的平均游泳速度差异无统计学意义,排除了游泳能力因素对空间学习能力评估的影响。随着训练天数的增加,两组小鼠的定位潜伏期均逐渐缩短,表明小鼠逐渐熟悉了迷宫环境并获得利用空间信息进行导航的能力,从而减少了寻找目标平台所需的时间。然而,CUMS组小鼠寻找平台的时间和路径长度均高于对照组,意味着CUMS导致的抑郁状态对小鼠的认知功能产生了负面影响,造成在空间学习和记忆上的困难,使其更难以适应新的环境和任务。空间探索训练阶段,与对照组相比,CUMS组小鼠的目标象限内路程占总路程百分比和游泳时间均降低,而目标区首次入口时间和对角象限内游泳时间均增长,说明抑郁小鼠对目标象限内的任务目标感知能力下降,对于任务目标的空间定位和记忆能力受到了损害。为了更好地揭示Morris水迷宫实验结果背后的神经生物学机制,需要进一步通过电生理检测以探究相关脑区的可塑性变化。对不同亚群神经元动作电位参数的检测显示,与对照组相比,CUMS组小鼠CeA区谷氨酸能神经元和PrL区GABA能神经元的Vts-Vr、ARP和ISI数值均增高,意味着这些神经元在产生动作电位时需要克服更大的电位差,动作电位结束后需要更长的恢复时间才能再次兴奋,相邻动作电位之间的时间间隔变得更长,表明CUMS导致了神经元对外界刺激的敏感性和兴奋性降低,在产生连续动作电位时的发放能力和调节能力受到影响,单位时间内动作电位的发放频率和数量减少。另一方面,CUMS组小鼠CeA区GABA能神经元和PrL区谷氨酸能神经元的Vts-Vr、ARP 和ISI数值均降低,意味着这些神经元在产生动作电位时从静息状态达到阈值所需的电位差减少,恢复到可再次发放动作电位的状态所需时间减少,相邻动作电位之间的时间间隔缩短,说明CUMS导致了神经元对外界刺激的敏感性和兴奋性升高,动作电位的发放能力和调节能力得到增强,单位时间内动作电位的发放频率和数量增加。上述实验结果表明,CUMS影响了小鼠CeA和PrL区谷氨酸能和GABA能神经元的电活动特性,其兴奋性和传导性发生了显著的调整和重塑,这些神经生理变化可能与小鼠空间学习记忆任务中的障碍相关。
研究显示,应激对动物的认知功能,特别是对空间记忆的影响,依赖于应激的种类、强度、持续时间及恢复时间等因素,具有复杂性[33, 34]。轻度至中度的短暂应激可以促进空间记忆的形成,这种效应被认为是适应性的[35, 36]。然而,过强或过长的应激暴露往往导致认知功能受损,如PTSD模型中的反复足底电击刺激和抑郁模型中的CUMS等[37]。急性应激可能通过调节mPFC、海马和杏仁核等的神经活动暂时提高记忆能力,而慢性应激则可能导致相关脑区神经细胞的损伤,从而损害记忆能力[38-40]。本研究中所使用的CUMS的核心特征包括不可预测性、多样性和持续性,模拟了日常生活中可能遇到的多种压力因素。糖水偏好等一系列行为学实验也进一步验证了CUMS这种长期的累积效应更贴近人类慢性抑郁的发病过程和主要特征,并且对小鼠的空间记忆产生了影响,表现为环境识别、路径规划、导航定位和信息整合存储能力受到了损害。已有证据表明,神经细胞膜上电压门控性钠通道(VGSCS)的可塑性改变,特别是其基因表达和功能的调节,与空间学习和记忆能力密切相关。该调节过程可以通过多种机制进行,包括磷酸化状态的改变等[41]。一些研究显示,在进行空间学习任务后,特定脑区中的VGSCS表达水平会有显著变化,这些变化影响通道的开启和关闭动力学,进而影响神经信号的传递效率和精确性[42, 43]。基于本研究中对小鼠CeA和PrL区谷氨酸能和GABA能神经元电活动特征的分析,我们提出了这样的设想,抑郁状态下,神经细胞膜上VGSCs的表达和功能出现可塑性变化,影响了神经传导的模式和神经网络之间的同步,这对于记忆整合尤为重要。同时,VGSCs 活性的改变影响了神经递质的释放,尤其是在CeA和PrL区,这直接引起记忆形成和提取过程中的突触可塑性,其中可能牵涉到突触后膜的重塑,如受体的重新配置或突触密度的调整等。这些结构和功能的重组改变了神经元的Vts-Vr、ARP和ISI等编码特性指标和神经网络的整体活动,进而在进行空间导航或类似的认知任务时,损害了信息的处理和记忆的形成。因此,着重于探索抑郁状态下CeA和PrL区神经细胞膜上VGSCs可塑性变化的分子机制,包括参与调节其表达和功能的信号通路和调节因子,将是我们下一步研究工作的聚焦方向。
综上所述,CUMS模拟了抑郁症的核心特征,对小鼠空间记忆产生负面影响,导致了CeA区谷氨酸能神经元和PrL 区GABA 能神经元功能受到抑制,CeA 区GABA能神经元和PrL区谷氨酸能神经元功能得到上调,意味着CeA区兴奋性降低,而PrL区兴奋性升高,进一步影响了神经网络的整体活动和记忆的形成过程。这些发现为理解抑郁症的神经生物学机制提供了一定的线索,也为未来开发针对抑郁症的治疗策略提供了新的思路。

