非增强T1-mapping、DKI、BOLD-MRI在评估IgA肾病患者肾功能中的应用价值研究*

[摘" "要]" "目的:探讨非增强T1-mapping磁共振,扩散峰度成像(diffusion kurtosis imaging, DKI)及血氧饱和水平依赖成像(blood oxygenation level-dependent MRI, BOLD-MRI)在IgA肾病(immunoglobulin A nephropathy, IgAN)患者的肾功能评估中的应用价值,并对各项MRI参数的评估效用进行比较。方法:纳入经肾活检确诊的57例IgAN患者以及19名健康志愿者,根据肾功能不全严重程度[肾小球滤过率(estimated glomerular filtration rate, eGFR)水平]将IgAN患者分为轻度损害组[≥60 mL/(min·1.73 m2)]、中度损害组[30~lt;60 mL/(min·1.73 m2)、重度损害组[<30 mL/(min·1.73 m2)],比较对照组与IgAN组各亚组间的肾脏MRI参数,分析T1-mapping(T1值)、DKI(Fak、MK、MD值)、BOLD-MRI(R2*值)与肾功能评估指标如eGFR、血清肌酐(serum creatinine, Scr)及胱抑素C(cystatin C, CysC)等的相关性,探索3种肾脏MRI在评估IgAN患者肾功能中的应用价值。结果:对照组与IgAN组T1值差异有统计学意义[(1 592.15±89.91) ms vs (1 776.30±172.08) ms, Plt;0.001];IgAN各肾功能不全亚组间T1值两两比较,差异均有统计学意义[轻度损害组(1 684.86±103.57) ms、中度损害组(1 888.99±182.01) ms、重度损害组(1 969.14±133.74) ms, 均Plt;0.001]。对照组与IgAN组Fak值差异有统计学意义[0.15(0.08~0.20) vs 0.19(0.11~0.32), Plt;0.05],轻度损害组与重度损害组间差异有统计学意义[0.17(0.11~0.25) vs 0.35(0.28~0.40), Plt;0.01];各组R2*值差异均无统计学意义。IgAN组T1值与eGFR、血红蛋白(hemoglobin, Hb)、红细胞压积(hematocrit, HCT)呈负相关(r=-0.620、-0.679、-0.629, 均P<0.001),与Scr、CysC呈正相关(r=0.559、0.604, 均P<0.001);Fak值与eGFR呈负相关(r=-4.004, P<0.05),与Scr、CysC呈正相关(r=0.366、0.378, P<0.05, P<0.01);MD值与Hb、HCT呈正相关(r=0.472、0.498, P<0.001);R2*值与各项临床指标皆无相关性;T1值预测IgAN肾功能轻、中、重度的AUC分别为0.791(95%CI: 0.660~0.922, Plt;0.01)、0.972(95%CI: 0.914~1.000, Plt;0.01)、0.988(95%CI: 0.958~1.000, Plt;0.01);Fak值预测IgAN重度肾功能损害的AUC为0.883(95%CI: 0.678~1.000, Plt;0.01)。结论:非增强T1-mapping、DKI对IgAN患者的肾功能状态具有预测价值,且非增强T1-mapping的预测价值优于DKI。
[关键词]" "IgA肾病;T1-mapping;扩散峰度成像;血氧饱和水平依赖成像;磁共振
[中图分类号]" "R692" " " " " " " "[文献标志码]" "A" " " " " " " "[文章编号]" "1674-7887(2024)03-0206-07
Application value of native T1-mapping, DKI and BOLD-MRI in evaluating renal function in patients with IgA nephropathy*
SONG Jiaqi1, 2**, WANG Yao1, TANG Xinbin1, TAN Zhuojing1, CHEN Minyue1, YUAN Jianlei1, SUN Chen1, ZHOU Fei1, LU Huijian1, YUAN Li1, SHI Zhaoyu1***" " " " (1Department of Nephrology, the Affiliated Hospital of Nantong University, Jiangsu 226001; 2Department of Endocrinology, Yiwu Central Hospital)
[Abstract]" "Objective: To investigate the application value of native T1-mapping, diffusion kurtosis imaging(DKI), and blood oxygenation level-dependent MRI(BOLD-MRI) in the evaluation of renal function in patients with IgA nephropathy(IgAN), and to compare the effectiveness of each MRI parameter. Methods: Fifty-seven IgAN patients diagnosed by biopsy and 19 healthy volunteers were included in this study. According to the severity of renal insufficiency, IgAN patients were divided into mild, moderate and severe impairment of renal function groups. MRI parameters were compared between healthy control group and IgAN group, as well as between each IgAN subgroup. To analyze the correlation between T1-mapping(T1), DKI(Fak, MK, MD), BOLD(R2*) and renal function evaluation indicators, such as estimated glomerular filtration rate(eGFR) , serum creatinine(Scr) and cystatin C(CysC), explore and verify the application value of multiple renal MRI in evaluating renal function in IgAN patients. To compare the diagnostic performance of three types of magnetic resonance. Results: The difference of T1 value between control group and IgAN group was statistically significant[(1 592.15±89.91) ms vs (1 776.30±172.08) ms, Plt;0.001]. There were significant differences in T1 values among different IgAN subgroup[mild(1 684.86±103.57) ms, moderate(1 888.99±182.01) ms, severe(1 969.14±133.74) ms, all Plt;0.001]. There was significant difference in Fak value between control group and IgAN group[0.15(0.08-0.20) vs 0.19(0.11-0.32), Plt;0.05]. There was significant difference in Fak value between mild and severe renal impairment groups[0.17(0.11-0.25) vs 0.35(0.28-0.40), Plt;0.01]. There was no significant difference in R2* value among the groups. In IgAN group, T1 value was negatively correlated with eGFR(r=-0.620, P<0.001), hemoglobin(Hb)(r=-0.679, P<0.001), hematocrit(HCT)(r=-0.629, P<0.001), Scr(r=0.559, P<0.001), CysC(r=0.604, P<0.001). Fak was negatively correlated with eGFR(r=-4.004, P<0.05), and positively correlated with Scr(r=0.366, P<0.05) and CysC(r=0.378, P<0.01). MD was positively correlated with Hb(r=0.472, P<0.001) and HCT(r=0.498, P<0.001). There was no correlation between R2* value and clinical indicators. The AUC of T1 value for predicting mild, moderate and severe impairment of renal function in IgAN are 0.791(95%CI: 0.660-0.922, Plt;0.01), 0.972(95%CI: 0.914-1.000, Plt;0.01) and 0.988(95%CI: 0.958-1.000, Plt;0.01). The AUC of Fak value for predicting severe impairment of renal function in IgAN are 0.883(95%CI: 0.678-1.000, Plt;0.01). Conclusion: Native T1-mapping and DKI are able to assese renal function in IgAN patients, and the predictive value of native T1-mapping is better than that of DKI.
[Key words]" "immunoglobulin A nephropathy; T1-mapping; diffusion kurtosis imaging; blood oxygenation level-dependent magnetic resonance imaging; magnetic resonance imaging
IgA肾病(immunoglobulin A nephropathy, IgAN)是原发性肾小球疾病中最常见的类型,国内经肾活检确诊的病例中45.3%~54.3%为IgAN[1],20%~40%的患者发病20年后进展为终末期肾脏病[2],目前肾活检结果仍是评估IgAN病情进展的金标准[3],但肾活检取材局限,不能全面反映肾组织改变,且为有创操作,难以重复观察和随访病情,临床亟需用非侵入性检查来替代肾活检。近年,多种MRI技术已成功应用于评估组织器官功能,MRI不仅提供实体器官复杂的解剖学信息,还可在水分子运动、细胞功能上揭示病变的特性,有望用于肾脏疾病的无创检查。非增强T1-mapping是一种新型定量MRI技术,通过直接测量组织的T1值反映组织病变程度[4];扩散峰度成像(diffusion kurtosis imaging, DKI)是一种反映体内水分子非高斯分布扩散运动状态的功能MRI技术,能更准确地反映组织内水分子扩散的真实情况,从而提供实体器官内更复杂的生理信息;血氧饱和水平依赖成像(blood oxygenation level-dependent MRI, BOLD-MRI)用于检测组织氧合情况,可以评估组织内氧生物利用度[5]。本研究拟观察以上3种MRI与IgAN患者肾功能指标间的相关性,并对多个MRI序列的评估性能进行比较。
1" "资料与方法
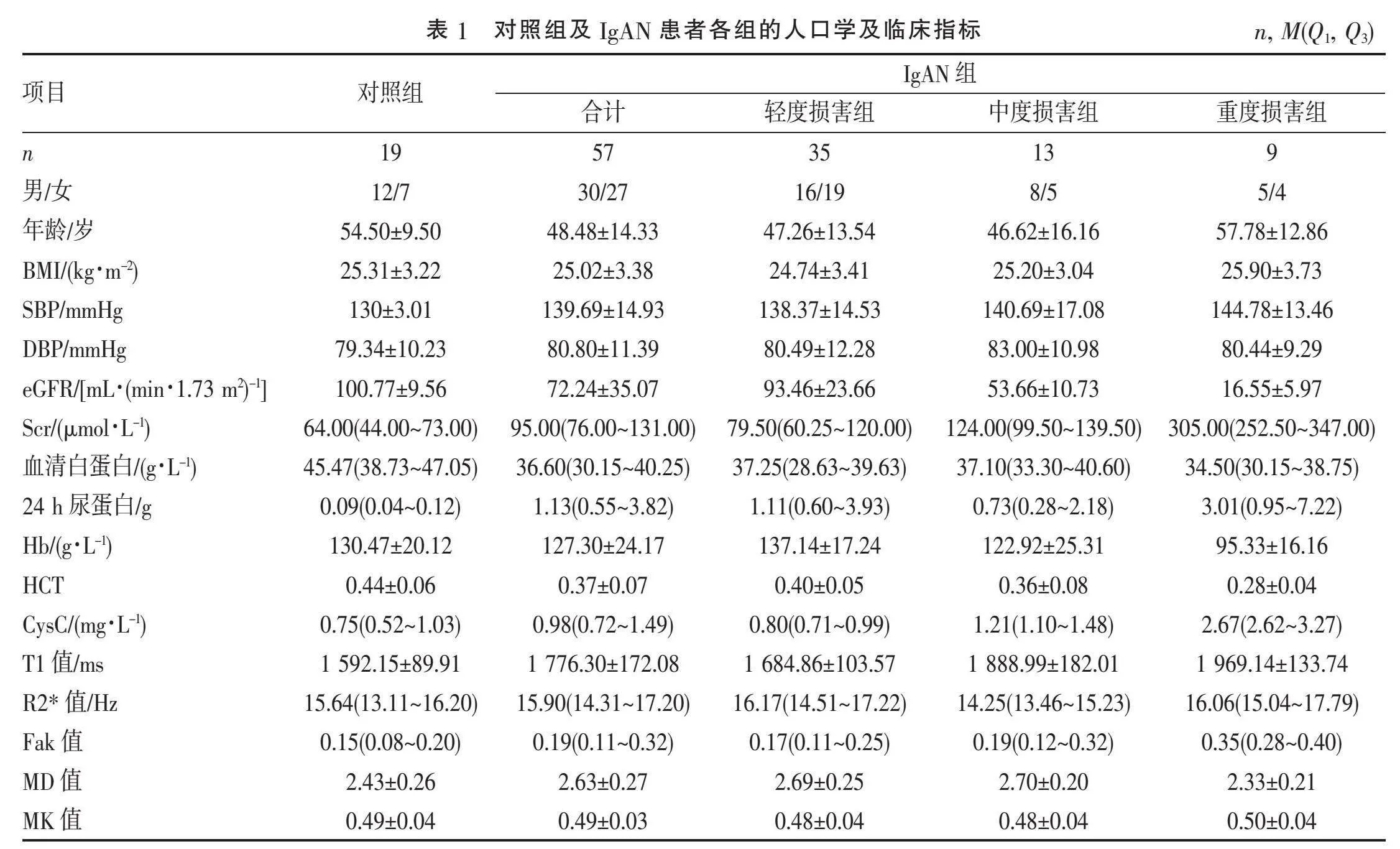
1.1" "研究对象" "选取2020年10月—2022年1月在南通大学附属医院肾脏内科治疗的IgAN患者57例作为IgAN组,纳入标准:(1)肾活检确诊为IgAN的慢性肾脏病(chronic kidney diseases, CKD)1~5期患者;(2)肾活检前1周内接受肾脏多模态MRI检查。排除标准:(1)拒绝或有MRI检查禁忌证无法配合检查者,如无法屏气完成检查、体内有金属物植入、幽闭恐惧症患者等;(2)合并肾脏肿瘤、孤立肾、巨大囊肿等疾病者;(3)图像质量差者。同期招19名健康志愿者作为对照组。所有研究对象均签署知情同意书。
1.2" "临床资料收集" "收集研究对象的年龄、性别、血压、BMI、肾小球滤过率(estimated glomerular filtrationrate, eGFR)、血红蛋白(hemoglobin, Hb)、红细胞压积(hematocrit, HCT)、24 h尿蛋白、血清白蛋白、血清肌酐(serum creatinine, Scr)、血清胱抑素C(cystatin C, CysC)。eGFR通过基于Scr的CKD-EPI公式[6]计算,将IgAN患者分为轻度损害组[eGFR≥60 mL/(min·1.73 m2)]、中度损害组[eGFR 30~lt;60 mL/(min·1.73m2)]、重度损害组[eGFR<30 mL/(min·1.73 m2)]。
1.3" "MRI检查" "非增强T1-mapping、DKI、BOLD-MRI。检查均采用美国GE公司的3.0TMR仪(GEDiscovery MR750w),采用16通道腹部表面相控阵列线圈,最大梯度场强40 mT/m,最大转换率200 mT/(m·s)。受检者检查前禁食、禁水6 h以上,并对其进行呼吸训练;因检查过程采用呼吸门控技术控制以避免由于呼吸运动造成的伪影,受试者均需在MRI检查前进行屏气练习;头部先进入仪器,全程取仰卧位,线圈置于患者中腹部,保持自然呼吸进行MRI常规平扫及各3种序列扫描,随后在ADW4.6工作站处理生成图像。
1.3.1" "MRI扫描序列及参数" "(1)非增强T1-mapping采用于单点恢复饱和的稳态采集快速成像序列,即SMART1序列扫描,扫描参数:重复时间5 200 ms,矩阵192 mm×128 mm,视野320 mm×320 mm,激励次数1,加速因子2,层数8,层厚5 mm,层间距1 mm,翻转角45°,回波时间75 ms,总扫描时间约2 min。(2)DKI采用双自旋回波序列进行扫描,重复时间3 158 ms,矩阵128 mm×128 mm,激励次数2,层厚5 mm,翻转角90°,回波时间92.2 ms,总扫描时间约12 min。(3)BOLD-MRI序列采用多梯度重聚回波序列,重复时间175 ms,矩阵192 mm×128 mm,视野320 mm×320 mm,激励次数1,层厚5 mm,层间距1 mm,翻转角15°,回波时间1.3、4.6、6.2、7.8、9.5、11.1、12.7 ms,总扫描时间45 s。
1.3.2" "图像分析" "图像均由1名工作10年以上的资深影像科医师采用盲法在GE ADW4.6工作站分析处理。(1)在自动生成的肾脏T1-mapping冠状图像上进行测量,避开肾脏髓质、肾窦及血管结构、伪影,分别于两侧肾脏皮质区的上、中、下极各选择1个区域,手动绘制共6个感兴趣区(regions of interest, ROI),单个ROI的面积为15~20 mm2,得到6个T1值,取平均值为最终T1值。(2)在DKI图像上,避开肾脏髓质、肾窦及血管结构、伪影,分别于双侧肾脏皮质区上、中、下极手动绘制共6个ROI,单个ROI面积为15~20 mm2,获取Fak、MD、MK值的均值。(3)BOLD-MRI系统自动生成R2*伪彩图,避开肾脏髓质、肾窦及血管结构、伪影,在肾脏皮质区用圆形工具在双侧肾脏上、中、下极圈画6个ROI,并计算R2*值,取6个ROI R2*值的平均值为最终肾皮质R2*值。
1.4" "统计学方法" "采用SPSS 25.0统计软件(IBM SPSS Statistics)进行统计分析。正态分布计量资料以■±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD法;非正态分布计量资料以M(Q1, Q3)表示,两组及多组间比较采用秩和检验,分类变量以率(%)表示。磁共振序列参数与肾功能的相关关系采用Pearson相关系数或Spearman相关系数。使用ROC曲线评价肾脏皮质T1值和Fak值预测IgAN患者不同程度肾功能损害的诊断价值。所有检验均为双侧检验,Plt;0.05为差异有统计学意义。
2" "结" " " 果
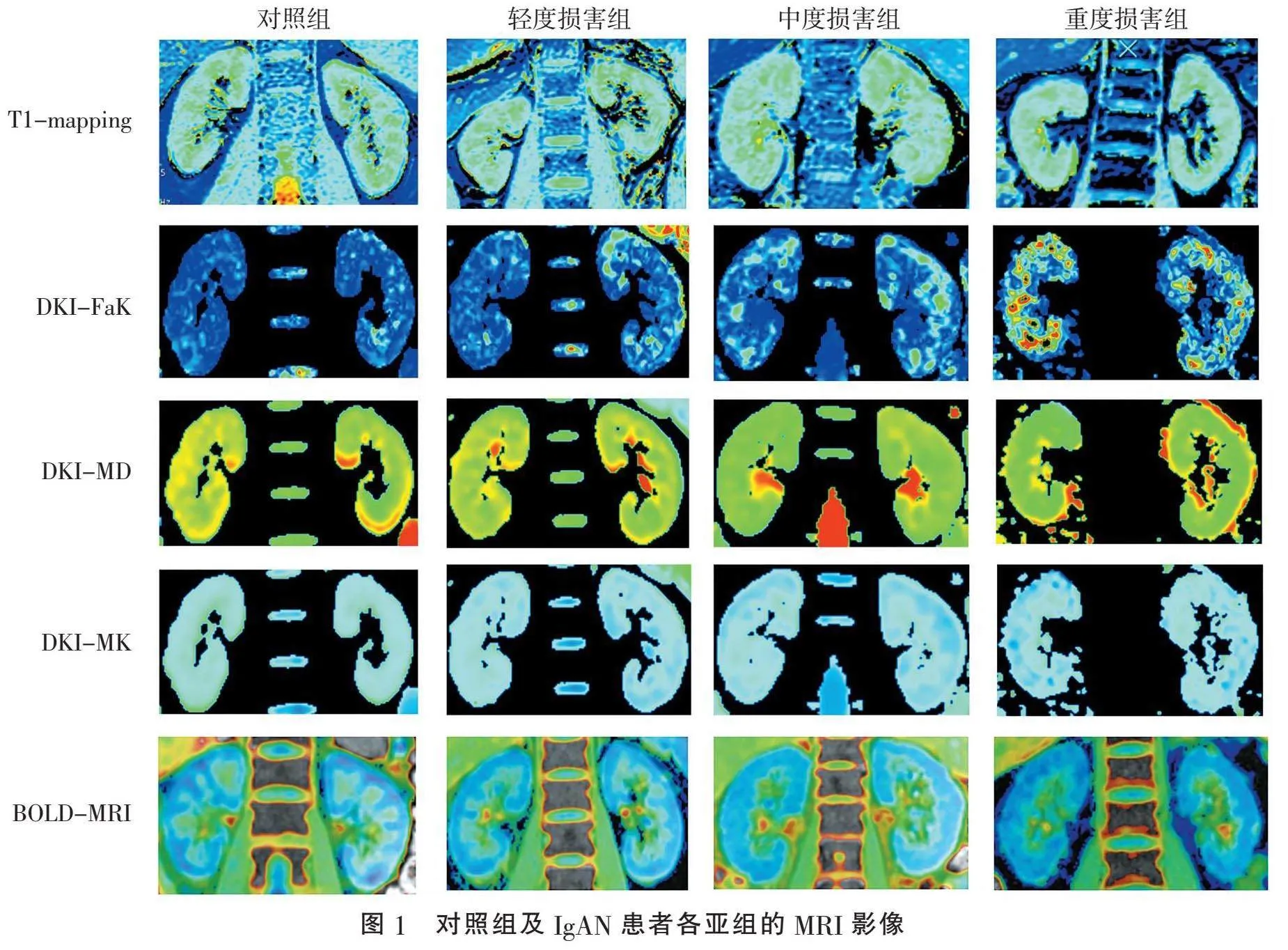
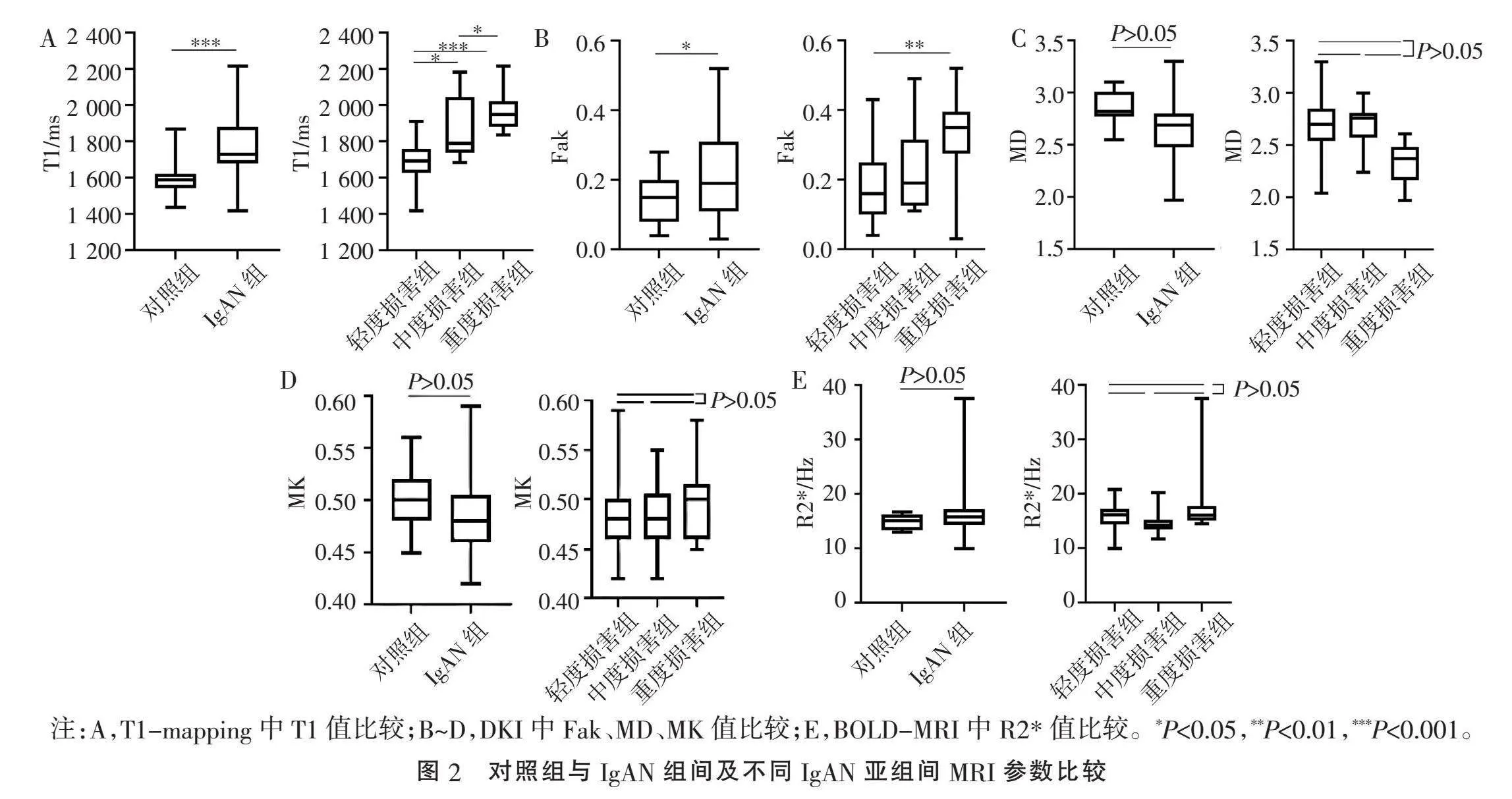
2.1" "对照组与IgAN组患者一般资料及各项MRI参数比较" "对照组、肾功能轻、中、重度损害组的T1值组间差异有统计学意义(Plt;0.001),随着IgAN患者肾功能损伤程度的加重,其T1值逐渐升高,见表1。对照组及IgAN患者各亚组的MRI影像见图1。
对照组与IgAN组T1值的差异有统计学意义(Plt;0.05);IgAN患者各亚组间T1值两两比较差异均有统计学意义(均Plt;0.05),见图2A。对照组与IgAN组Fak值差异有统计学意义(Plt;0.05),IgAN各组间Fak值两两比较,Fak值在肾功能轻度损害组与重度损害组的差异有统计学意义(Plt;0.05),见图2B。肾脏皮质MD值、MK值和R2*值在对照组及IgAN各组间差异均无统计学意义(均Pgt;0.05),见图2C~E。
2.2" "MRI参数与肾功能指标的相关性" "肾脏皮质T1值与eGFR呈负相关(r=-0.620, P<0.001),与Scr、CysC呈正相关(r=0.559、0.604, Plt;0.001),见图3A;肾脏皮质Fak值与eGFR呈负相关(r=-4.004, Plt;0.01),与Scr、CysC呈正相关(r=0.366、0.378, Plt;0.01),见图3B;肾脏皮质MD值与CysC呈负相关(r=-0.330, Plt;0.05),与eGFR、Scr无显著相关性,见图3C;肾脏皮质MK值、R2*值与eGFR、Scr、CysC皆无显著相关性,见图3D~E。
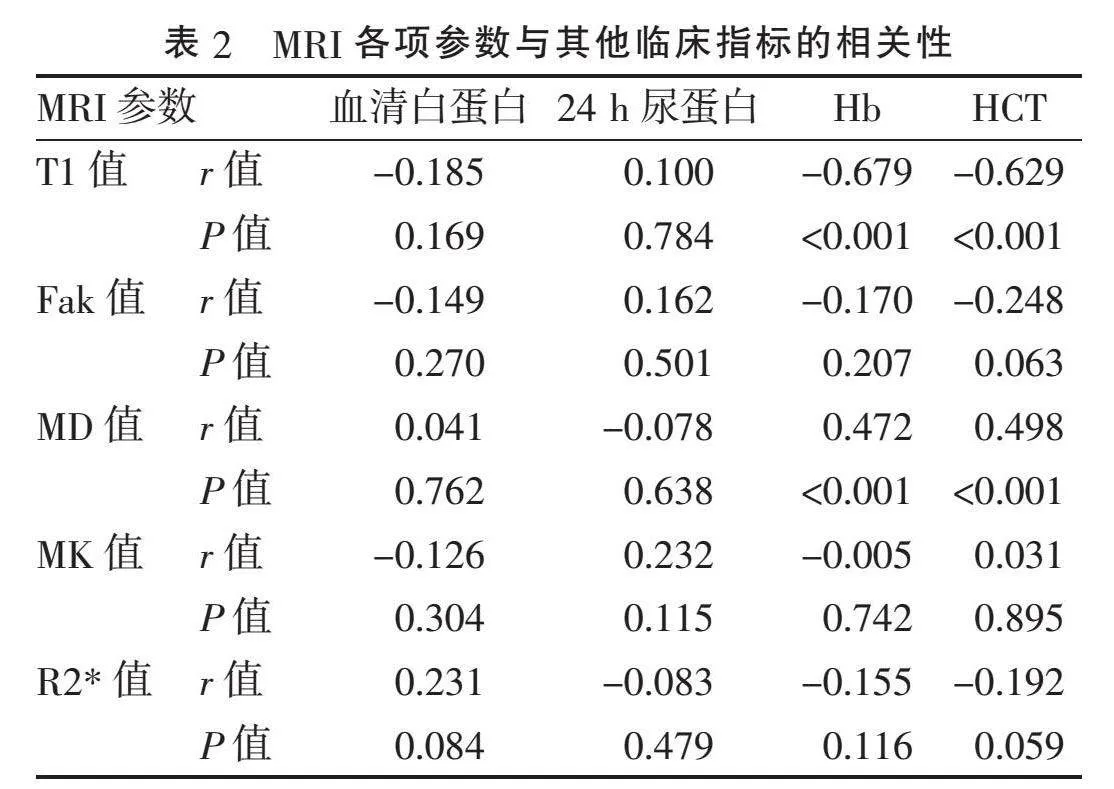
2.3" "MRI参数与其他临床指标的相关性" "T1值与Hb、HCT呈负相关(r=-0.679、-0.629, Plt;0.001),与血清白蛋白及24 h尿蛋白无相关性;Fak值与Hb、HCT、血清白蛋白、24 h尿蛋白无显著相关性;MD值与Hb、HCT(r=0.472、0.498, Plt;0.001)呈正相关,与血清白蛋白及24 h尿蛋白无显著相关性;MK值、R2*值与各项临床指标皆无显著相关性,见表2。
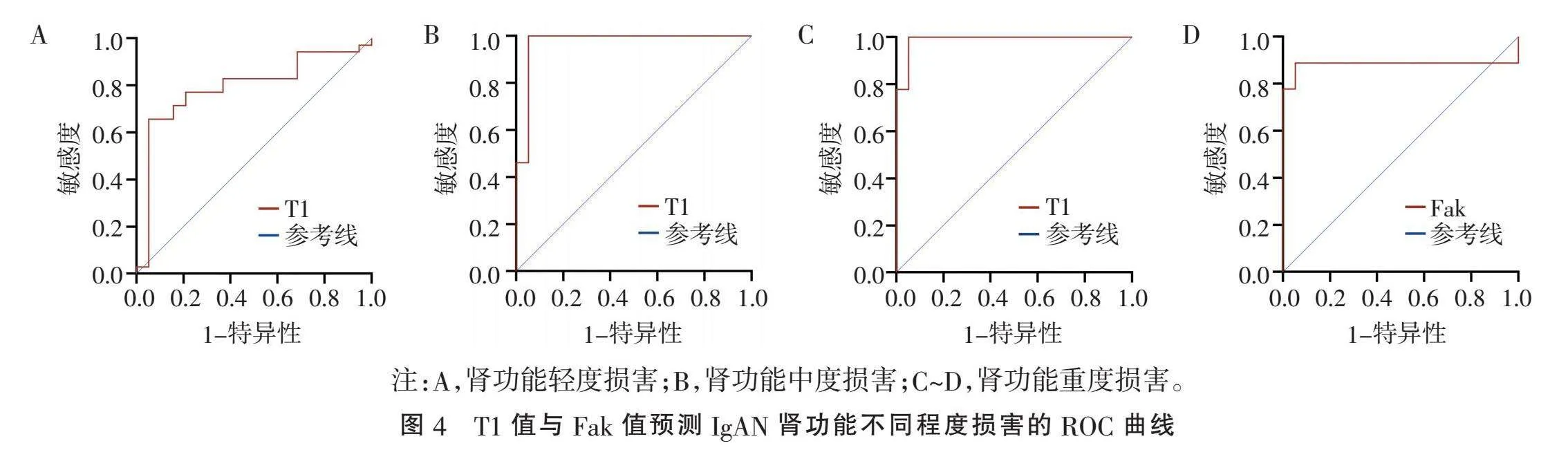
2.4" "肾脏皮质T1值及Fak值预测IgAN不同程度肾功能损害" "T1值预测IgAN肾功能轻、中及重度损害的AUC分别为0.791(95%CI: 0.660~0.922, Plt;0.01)、0.972(95%CI: 0.914~1.000, Plt;0.01)、0.988(95%CI: 0.958~1.000, Plt;0.01),敏感度分别为0.657、1.000、1.000,特异度依次为0.947、0.947、0.947,最大约登指数对应的临界值分别为1 667.62、1 673.39、1 749.08 ms(图4A~C)。Fak值预测IgAN肾功能重度损害的AUC为0.883(95%CI: 0.678~1.000, Plt;0.01),敏感度为0.889,特异度为0.947,最大约登指数对应的临界值为0.23(图4D),对肾功能轻度及中度损害的诊断性能无统计学意义(Pgt;0.05)。
3" "讨" " " 论
T1-mapping在评估心脏及肝脏纤维化方面的价值已得到证实[7],T1值可综合反映组织细胞和细胞外基质,能直接量化组织的病理变化,然而非增强T1-mapping在肾脏研究较少[8]。DKI反映组织内水分子扩散情况,除常规的扩散指标外,还可以获得峰度指标。同时,DKI可以量化非高斯水扩散,其描述组织微观结构的能力更为突出,广泛应用于中枢神经系统,在肝脏和前列腺等实体器官中的应用也越来越多[9],已有研究[10]证实DKI能反映肾脏功能,另外,Y.LIU等[11]发现DKI对于评估IgAN患者的肾脏纤维化有一定价值。BOLD-MRI是目前唯一能无创性检测肾脏内氧含量的影像学方法,已用于评价大多数肾脏病模型动物以及糖尿病肾病等患者的肾功能[12-13]。虽然以上MRI技术已被证实可以评估肾组织病变程度,而关于3种MRI技术在IgAN中的对比研究鲜见。
研究[14]发现,与健康人群相比,IgAN患者的肾脏皮质T1值显著增加,并与肾脏疾病标志物相关。本课题组既往研究[8]发现T1-mapping在评估肾功能方面表现良好,是一种有效的无创检测慢性肾小球肾炎患者肾纤维化的方法。本研究发现,与对照组相比,IgAN组肾脏皮质T1值上升;且随着IgAN患者eGFR的下降,Scr及CysC上升,T1值随之升高;此外,T1值在肾功能轻、中、重度损害的IgAN患者间差异均有统计学意义,且经过ROC曲线评价,T1值对IgAN患者肾功能轻、中、重度损害均具有较为优秀的诊断性能。提示非增强T1-mapping可用于临床评估IgAN患者肾功能情况,并可监测病情进展程度。
Y.LIU等[10]研究表明,DKI获得的峰度和表观扩散系数与IgAN患者的肾功能高度相关。本研究中肾脏皮质Fak值在对照组与IgAN患者间差异有统计学意义,证实Fak值也能评价IgA患者的肾功能;但IgAN组中仅肾功能轻度与重度损害组间差异有统计学意义,其余各组间差异无统计学意义。同时ROC曲线分析提示Fak值仅在肾功能重度损害时才有较好的评估能力。
关于BOLD-MRI在评估IgAN中的作用尚未达成共识。S.T.LANG等[15]研究表明BOLD-MRI对IgAN不敏感,可能在肾灌注减少、肾血流量改变时肾皮质和髓质组织氧分压也能保持几乎不变[16];相反,苏妍等[17]研究表明IgAN组肾脏皮质R2*值与GFR呈负相关,BOLD-MRI可作为评估肾组织氧合状态的无创性方法。本研究无论是对照组与IgAN组间,还是IgAN各亚组间R2*值差异均无统计学意义,均未发现BOLD-MRI对IgAN患者的肾功能有评估价值。各研究结果的差异有多种原因,如不同的研究方案及样本量、感兴趣区域的选择、HCT等因素。
虽然基于Scr的eGFR是评估肾功能的准确指标,但在患者资料缺乏、高龄及肥胖患者中eGFR的使用及准确性受到影响。本研究中,T1值及DKI中Fak值与多项肾功能指标如eGFR、Scr及CysC均显著相关,MD值与CysC也具有相关性,证实T1-mapping和DKI能反映肾功能情况。肾功能下降时,肾促红细胞生成素生成减少,同时血浆中一些毒性物质干扰红细胞生成并缩短其寿命而导致贫血[18],因此贫血在一定程度上也能反映肾功能情况。本研究发现,T1值及DKI中MD值与Hb、HCT显著相关,提示T1值和MD值与临床间接反映肾功能变化的指标也具有一定的相关性。
综上所述,非增强T1-mapping及DKI对IgAN患者的肾功能具有一定的评估价值,且非增强T1-mapping的预测价值优于DKI,两种MRI技术有望作为无创便捷、可重复的手段,帮助诊断及监测IgAN患者的病情进展。本研究存在以下局限:为单中心、横断面研究,样本量较小,各分期患者数量不足,分布不均,需要扩大样本量进一步证实结果;未纳入肾活检病理结果,缺乏对MRI与肾脏纤维化评分等病理指标的相关性研究,需在今后的研究中进一步补充。
[参考文献]
[1]" "FAN P, SONG J M, CHEN Q, et al. The influence of environmental factors on clinical pathological changes of patients with immunoglobulin A nephropathy from different areas of China[J]. Ren Fail, 2018, 40(1):597-602.
[2]" "O′SHAUGHNESSY M M, HOGAN S L, THOMPSON B D, et al. Glomerular disease frequencies by race, sex and region: results from the International Kidney Biopsy Survey[J]. Nep-hrol Dial Transplant, 2018, 33(4):661-669.
[3]" "ROMAGNANI P, REMUZZI G, GLASSOCK R, et al. Chronic kidney disease[J]. Nat Rev Dis Primers, 2017, 3:17088. [4]" "TAYLOR A J, SALERNO M, DHARMAKUMAR R, et al. T1 mapping: basic techniques and clinical applications[J]. JACC Cardiovasc Imaging, 2016, 9(1):67-81.
[5]" "MAEHARA M. Development of voxel-based optimization diffusion kurtosis imaging(DKI) and comparison with conventional DKI[J]. Radiol Phys Technol, 2019, 12(3):290-298.
[6]" "KASISKE B L, WHEELER D C. Kidney disease: improving global outcomes—an update[J]. Nephrol Dial Transplant, 2014, 29(4):763-769.
[7]" "HOFFMAN D H, AYOOLA A, NICKEL D, et al. T1 mapping, T2 mapping and MR elastography of the liver for detection and staging of liver fibrosis[J]. Abdom Radiol, 2020, 45(3):692-700.
[8]" "WU J H, SHI Z Y, ZHANG Y, et al. Native T1 mapping in assessing kidney fibrosis for patients with chronic glomerulonephritis[J]. Front Med, 2021, 8:772326.
[9]" "ROSENKRANTZ A B, PADHANI A R, CHENEVERT T L, et al. Body diffusion kurtosis imaging: basic principles, applications, and considerations for clinical practice[J]. J Magn Reson Imaging, 2015, 42(5):1190-1202.
[10]" "LIU Y, ZHANG G M Y, PENG X Y, et al. Diffusion kurtosis imaging as an imaging biomarker for predicting prognosis in chronic kidney disease patients[J]. Nephrol Dial Transplant, 2022, 37(8):1451-1460.
[11]" "LIU Y, ZHANG G M Y, PENG X, et al. Diffusional kurtosis imaging in assessing renal function and pathology of IgA nephropathy: a preliminary clinical study[J]. Clin Radiol, 2018, 73(9):818-826.
[12]" "KIM S G. Biophysics of BOLD fMRI investigated with animal models[J]. J Magn Reson, 2018, 292:82-89.
[13]" "FENG Y Z, YE Y J, CHENG Z Y, et al. Non-invasive assessment of early stage diabetic nephropathy by DTI and BOLD MRI[J]. Br J Radiol, 2020, 93(1105):20190562.
[14]" "GRAHAM-BROWN M P, SINGH A, WORMLEIGHTON J, et al. Association between native T1 mapping of the kidney and renal fibrosis in patients with IgA nephropathy[J]. BMC Nephrol, 2019, 20(1):256.
[15]" "LANG S T, GUO J, BRUNS A, et al. Multiparametric quantitative MRI for the detection of IgA nephropathy using tomoelastography, DWI, and BOLD imaging[J]. Invest Radiol, 2019, 54(10):669-674.
[16]" "O′CONNOR P M, EVANS R G. Structural antioxidant defense mechanisms in the mammalian and nonmammalian kidney: different solutions to the same problem?[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 299(3):R723-R727.
[17]" "苏妍, 杨丽萍, 黄翀, 等. IgA肾病磁共振血氧水平依赖成像测量值与其滤过功能及病理的相关性研究[J]. 中国现代医学杂志, 2016, 26(1):62-68.
[18]" "中华医学会肾脏病学分会肾性贫血诊断和治疗共识专家组. 肾性贫血诊断与治疗中国专家共识(2018修订版)[J]. 中华肾脏病杂志, 2018, 34(11):860-866.
[收稿日期] 2022-10-27

