健脾养血祛风方缓解特应性皮炎的机制研究






【摘 要】 目的:探讨健脾养血祛风方调节肠道脆弱拟杆菌以影响免疫细胞因子改善脾虚型特应性皮炎作用机制的可能性。方法:84只雌性BABL/c小鼠建立皮炎模型,将其随机分为空白组14只和菌群失调腹泻模型(脾虚型)70只。腹泻模型采用林可霉素灌胃诱导小鼠肠道菌群失调。腹泻模型造模后随机分成模型组、阳性对照组、中药低剂量治疗组、中药中剂量治疗组和中药高剂量治疗组,每组14只。阳性对照组予酪酸梭菌二联活菌散灌胃,中药各剂量组予健脾养血祛风方灌胃,空白组和模型组予等体积生理盐水灌胃,各组均连续给药 10 d。观察背部皮肤肿胀度和组织形态学变化,检测血清免疫球蛋白E(Immunoglobulin E,IgE)、白介素17A(Interleukin17A,IL-17A)、转化生长因子-β1(Transforming Growth Factor-β,TGF-β1)表达水平,分泌型免疫球蛋白A(Secretory IgA,SIgA),脆弱拟杆菌定量及肠黏膜完整性相关基因定量。结果:与模型组比较,西药治疗组、中药高剂量治疗组血清IgE、 IL-17A表达水平显著降低(P<0.001、P<0.05),TGF-β1表达水平显著升高(P<0.001),西药治疗组、中药治疗组结肠组织Bacteroides fragilis相对丰度显著回升(P<0.001)。结论:健脾养血祛风方对脾虚型AD小鼠具有免疫调节作用,以高剂量效果最佳,健脾养血祛风方通过调控外周血IgE、IL-17A、TGF-β1而减轻炎症反应,并改善肠道免疫功能的SIgA和脆弱拟杆菌的相对丰度值,进而修复AD小鼠的肠道屏障受损和肠道稳态失衡,从而发挥改善脾虚型特应性皮炎小鼠皮损的作用。
【关键词】 健脾养血祛风方;特应性皮炎;脆弱拟杆菌
【中图分类号】R275.9
【文献标志码】 A 【文章编号】1007-8517(2024)19-0029-07
DOI:10.3969/j.issn.1007-8517.2024.19.zgmzmjyyzz202419007
Study on the Mechanism of Jianpi Yangxue Qufeng Prescription in Relieving Atopic Dermatitis
CHEN Sixuan1 HU Guilan2 YE Jianzhou2 YANG Xuesong1 LUO Guangyun1 ZHANG Qiongyu2 CONG Lin1*
1. Yunnan University of Chinese Medicine, Kunming 650000, China;
2. The First Affiliated Hospital of Yunnan University of Chinese Medicine, Kunming 650000, China
Abstract:Objective To explore the possibility that Jianpi Yangxue Qufeng prescription regulates Bacteroides flimsy in intestinal tract to affect the mechanism of immune cytokines in improving spleen ascinia atopic dermatitis. Methods A dermatitis model was established in 84 female BABL/c mice, and the mice were randomly divided into a blank group (14 mice) and a bacteria-dysbiosis diarrhea model (70 mice). Intestinal flora disturbance was induced by lincomycin intragastric administration in diarrhea model. After modeling, the diarrhea model was randomly divided into model group, positive control group, Chinese medicine low-dose treatment group, Chinese medicine medium-dose treatment group and Chinese medicine high-dose treatment group, with 14 patients in each group. The positive control group was given oral administration of Clostridium butyric compound active bacteria powder, the Chinese medicine dosage groups were given oral administration of Jianpi Yangxue Qufeng prescription, and the blank group and model group were given equal volume normal saline. All groups were given continuous administration for 10 days. The swelling degree and histopathological changes of the back skin were observed, and serum Immunoglobulin E (IgE), Interleukin17A (IL-17A), Transforming Growth faction-β, and immunoglobulin E (IGE) were detected. TGF-β1) expression level, Secretory IgA (SIgA), Bacteroides fragilis and intestinal mucosal integrity related genes were quantified. Result Compared with model group, the expression levels of IgE and IL-17A in western medicine treatment group and Chinese medicine high-dose treatment group were significantly decreased (P<0.001, P<0.05), and the expression level of TGF-β1 was significantly increased (P<0.001). The relative abundance of Bacteroides fragilis in colon tissue increased significantly in the western medicine treatment group and the Chinese medicine treatment group (P<0.001). Conclusion Jianpi Yangxue Qufeng prescription has immunomodulatory effect on AD mice with spleen deficiency, and the best effect is at high dose. Jianpi Yangxue Qufeng prescription can reduce inflammation by regulating IgE, IL-17A, TGF-β1 in peripheral blood, and improve the relative abundance of SIgA and Bacteroides fragility in intestinal immune function. Furthermore, the damage of intestinal barrier and homeostasis of AD mice were repaired, and the intestinal immune balance was restored, thereby improving the skin lesions of mice with spleen deficiency atopic dermatitis.
Key words:Jianpi Yangxue Qufeng prescription;Atopic Dermatitis;Bacteroidetes Fragilis
特应性皮炎(atopic dermatitis, AD)是一种与遗传和免疫异常有关的慢性、复发性、炎症性皮肤病,也被称为特应性湿疹、异位性湿疹和遗传过敏性湿疹。研究[2]显示,全球范围内AD患病人数高达2.3亿,中国AD患病率略低于欧美国家,其中儿童为12.94%[1],成年人为3.7%~8.7%,呈逐年上升趋势。AD发病年龄早、持续时间久、瘙痒症状剧烈,易引起睡眠障碍并严重影响患者生活质量[1-2]。现有研究[3]表明,AD患者免疫细胞失衡与饮食结构有密切关联性。流行病学调查、临床观察及粪便菌群分析等研究[4]均提示,肠道微生态早期的失衡及免疫屏障功能受损可直接影响变态反应性疾病的发病过程。本研究探讨健脾养血祛风方调节免疫细胞因子,从而改善AD的作用机制的可能性,采用化学药物激发和抗生素灌胃的方法建立肠道菌群紊乱的AD小鼠模型,研究口服健脾养血祛风方通过调节脆弱拟杆菌来干预AD发病发展进程的机制,为健脾养血祛风方可通过肠道免疫功能治疗AD提供理论基础。
1 材料
1.1 实验动物 Babl/c小鼠84只,雌性,6周龄,由云南民族大学动物实验中心提供,自由进食饮水,12 h昼夜节律。本研究经云南中医药大学实验动物伦理委员会批准,实验过程严格遵循3R原则。
1.2 实验药品制备 健脾养血祛风方(黄芪30 g,炒白术15 g,当归15 g,防风20 g,刺蒺藜30 g,蜈蚣1条),上述中药饮片均由云南省中医医院中药房提供,传统方法煎煮浓缩制备成煎剂进行灌胃。林可霉素注射液:宜昌人福药业,2 mL∶0.6 g,批号(01X05961)。酪酸梭菌二联活菌散:科兴制药,500 mg/袋,批号(21X07452)。
1.3 主要试剂与仪器 造模药物DNFB溶液:MACKLIN,2,4-二硝基氟(1-fluoro-2,4-dinitrobenzene);分子式:C6H3FN204;CAS号:70-34-8;MDL号:MFCD00007096;移液器: Eppendorf型移液器;恒温加热摇床:QB-9006 型摇床;摇床 TS-2000A, Kulin-bell;低温高速离心机: Eppendrof 5424R型离心机;超微量分光光度计: ND-one-W型分光光度计;多功能酶标仪: MOLECULAR DEVICES Spectra Max i3x型酶标仪;普通酶标仪: BioRAD型普通酶标仪;三目倒置显微镜: DMIL LED Leica Microsystems;二氧化碳细胞培养箱: Thermo Scientific 3425 型培养箱;高压灭菌锅: HIRAYAMA型灭菌锅;纯水机: BIOGEN 倍捷科技;其他:干燥箱、恒温水浴锅、冰箱等。
1.4 动物分组与模型制备 84只雌性6周龄小鼠,随机分为6组:空白组,模型组、阳性对照组、健脾养血祛风方低、中、高剂量组(n=14)。特应性皮炎小鼠造模:参照文献[13-14]报道方法进行特应性皮炎小鼠造模,实验前1 d去除小鼠背部毛发 (2 cm×3 cm),实验第1天、第3天,除对照组外,其余各组小鼠分别用100 μL、50 μL1% DNCB涂于小鼠背部脱毛区及右耳,从第7天开始改为 0.5%DNCB隔天涂抹1次; 对照组涂抹相应的基质溶液(丙酮-橄榄油=3∶[KG-*3/5]1),小鼠背部出现脱屑、红斑、水肿、结痂等情况视为造模成功。
脾虚型造模:空白组小鼠予纯净水灌胃 (0.4 mL/20 g), 2次/d;余组予林可霉素注射液0.3 mL/只,2次/d,共6 d;6 d后小鼠出现皮炎损害,同时伴有便溏、体力和食量下降等表现视为脾虚型特应性皮炎造模成功。
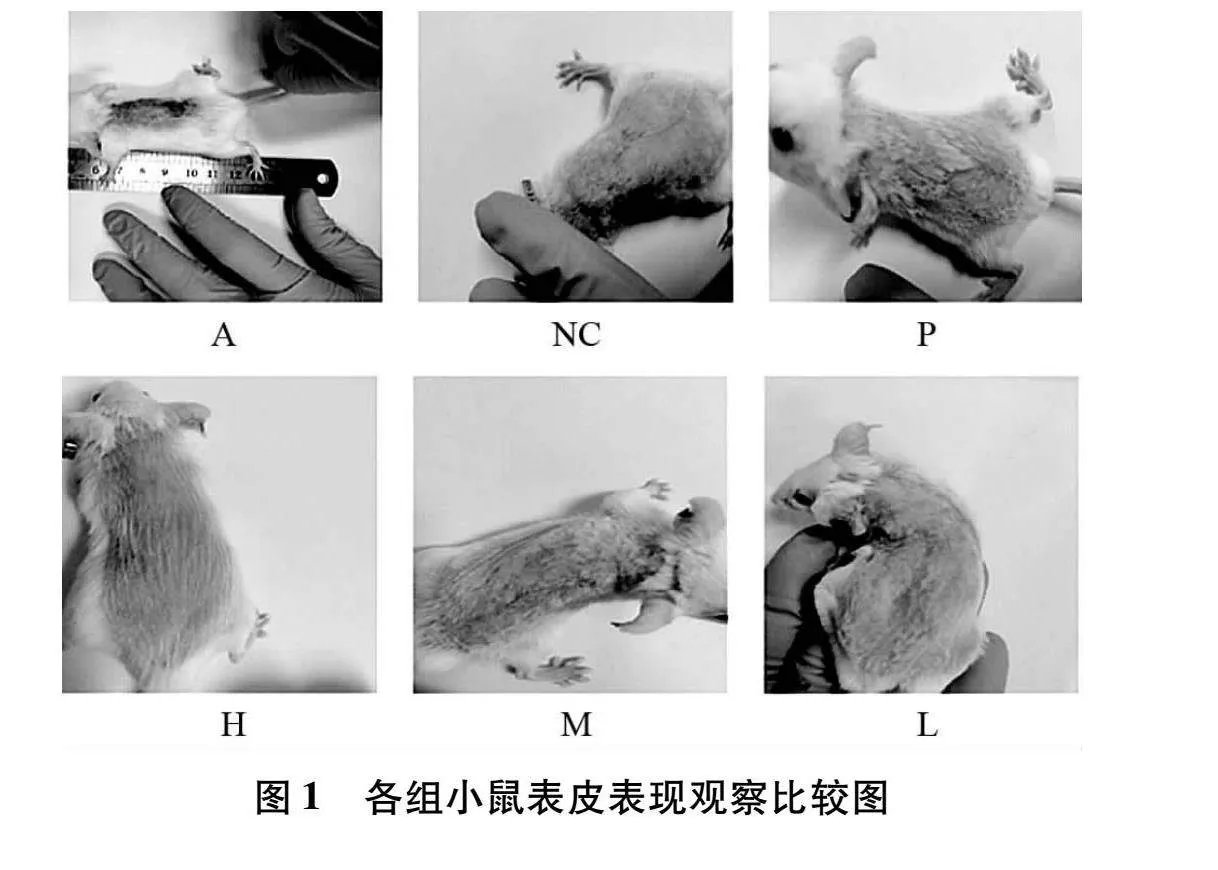
NC:空白组;A:模型组:P:阳性对照组;H:健脾养血祛风方高剂量组;M:健脾养血祛风方中剂量组;L:健脾养血祛风方低剂量组。
2 方法
2.1 给药方法 健脾养血祛风方低、中、高剂量组分别给予健脾养血祛风方8.126 g生药/kg、16.25 g生药/kg、24.376 g生药/kg,即灌胃浓缩后方剂量分别为0.06 mL、0.13 mL、0.2 mL,2次/d。对照组用酪酸梭菌二联活菌散灌胃,浓度为5 mg/L小鼠,灌胃剂量为0.2 mL,2次/d。空白组及模型组给予纯净水0.2 mL,2次/d。
2.2 动物取材与指标检测 小鼠麻醉后腹主动脉取血,4 ℃、3000 r/min离心10 min,分离得到血清,分置于1.5 mL离心管中,后冻存于-20 ℃冰箱。检测之前将所有的试剂、样本平衡至室温。
2.2.1 小鼠背部皮损表现及皮损病理学观察 肉眼观察特应性皮炎造模完成时及给药后10 d的各组小鼠背部造模皮损处的客观症状,参照《中医病证诊断疗效标准》[5]判定疗效,并按照公式计算疗效指数及治疗指数。皮肤组织病理切片观察:实验结束后,取出6组小鼠背部皮肤,放入37%福尔马林溶液中固定,然后进行脱水、透明、石蜡包埋、切片、HE 染色、封片等处理,显微镜下观察皮损情况,并拍照记录。
2.2.2 ELISA法检测血清IgE、IL-17A、TGF-β1水平 本法采用双抗体夹心酶联免疫吸附检测技术。特异性抗小鼠IgE抗体、IL-17A、TGF-β1抗体预包被在高亲和力的酶标板上。酶标板孔中加入标准品和待测样本,经过孵育,样本中存在的IgE、IL-17A、TGF-β1与固相抗体结合。洗涤去除未结合的物质后,加入生物素化的检测抗体孵育。洗涤去除未结合的生物素化的抗体,加入辣根过氧化物酶标记的链霉亲和素 (Streptavidin-HRP)。洗涤后,加入显色底物 TMB,避光显色。颜色反应的深浅与样本中IgE、IL-17A、TGF-β1的浓度成正比。加入终止液终止反应,在450 nm 波长(参考波长570~630 nm)测定吸光度值。
2.2.3 ELISA法检测粪便中SIgA水平 本试剂盒应用双抗原夹心法测定标本中小鼠分泌型免疫球蛋白A(SIgA)水平。用纯化的抗原包被微孔板,制成固相抗原,往包被的微孔中依次加入分泌型免疫球蛋白 A(SIgA),再与HRP标记的抗原结合,形成抗原-抗体-酶标抗原复合物,经过彻底洗涤后加底物TMB显色。TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的分泌型免疫球蛋白A(SIgA)呈正相关。用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中小鼠分泌型免疫球蛋白A(SIgA)浓度。
2.2.4 小鼠微生物中脆弱拟杆菌的荧光定量PCR 采用细菌基因组DNA提取试剂盒(离心柱型)提取这些菌种的总基因组,用引物27-F和1492-R对细菌总基因组进行PCR扩增。测定标准质粒浓度:依据浓度对其进行梯度稀释,按照MightyAmp for Real Time (SYBR Plus)操作说明。样本中特定微生物的定量分析:将提取的小鼠粪便样品细菌DNA分别稀释至10 ng/μL,上机进行实时定量PCR反应,反应条件和体系标准曲线。每个样品两次重复,同时设置固定浓度阳性对照(标准质粒)。
2.2.5 小鼠结肠肠组织实时定量PCR 每小鼠取一定量(50~100 mg)结肠组织,采用珠打研磨法(1.4 mm氧化锆磁珠,珠打速度2 m/s)匀浆,随后在试剂盒裂解液中裂解(TaKaRa MiniBEST Universal RNA Extraction Kit),总RNA的提取步骤按照试剂盒说明书进行。采用反转录试剂盒(PrimeScriptTM RT reagent kit with gDNA Eraser, TAKARA)将1 μg左右提取所得合格未降解的总RNA反转录成cDNA,反转录方法参照试剂盒说明书。按照试剂盒(SYBR Premix Ex TaqTM II (Tli RNaseH Plus) Kit,Takara)方法在ABI 7500荧光定量PCR仪进行功能基因表达的测定。
2.3 统计学方法 采用统计软件Graphpad Prism 5对实验数据进行处理, 数据以(x±s)表示, 多组间比较采用单因素方差分析,组间两两比较采用t检验。 P<0.05为差异有统计学意义。
3 实验结果
3.1 小鼠背部皮损表现 对照组小鼠皮肤正常;模型组小鼠出现不同程度的脱屑、红斑、水肿且有渗出物、结痂;阳性对照组皮损程度减轻;健脾养血祛风方各剂量组皮损也有所改善,高剂量组作用效果最明显。如图1所示。
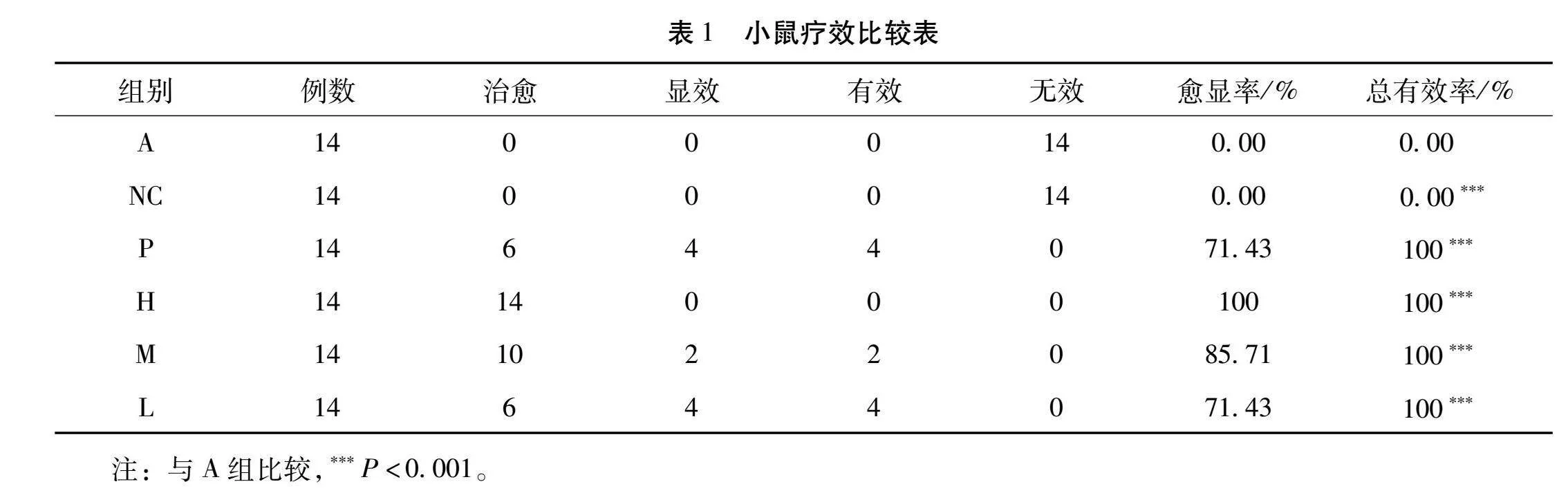
健脾养血祛风方对特应性皮炎小鼠皮炎评分的影响:参照《中医病证诊断疗效标准》[5],记录治疗前后的疗效评分,依据其下降率进行疗效评价。总有效率=(治愈例数+显效例数+有效例数)/本组小鼠总例数×100%。
小鼠背部皮损疗效观察,与A组相比,给药各组均有显著疗效,差异有统计学意义(P<0.001);且健脾养血祛风方的愈显率呈剂量依赖。见表1。
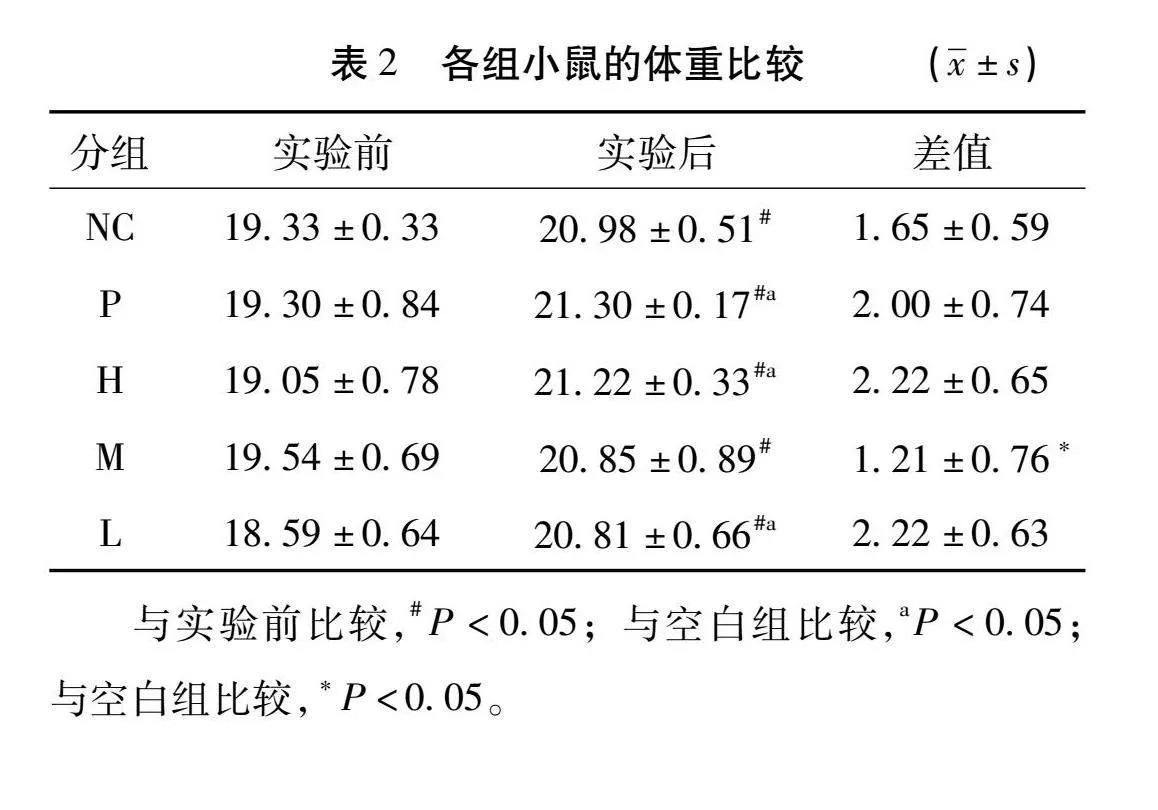
3.2 小鼠实验后的体重及体重变化比较 实验前,各组小鼠体重无统计学差异(P>0.05)。造脾虚模型后各组小鼠出现腹泻、便溏、体重下降等胃肠菌群失调的现象。给药后各组小鼠体重均较实验前增加,均具有统计学意义(P<0.05);与空白组相比较,实验各组除健脾养血祛风方中剂量组小鼠外,实验后体重均明显高于空白组,差异有统计学意义(P<0.05)。健脾养血祛风方中剂量组体重差值明显低于空白组,具有统计学意义(P<0.05)。阳性对照组和健脾养血祛风方高、低剂量组差值变化无统计学意义(P>0.05)。见表2。
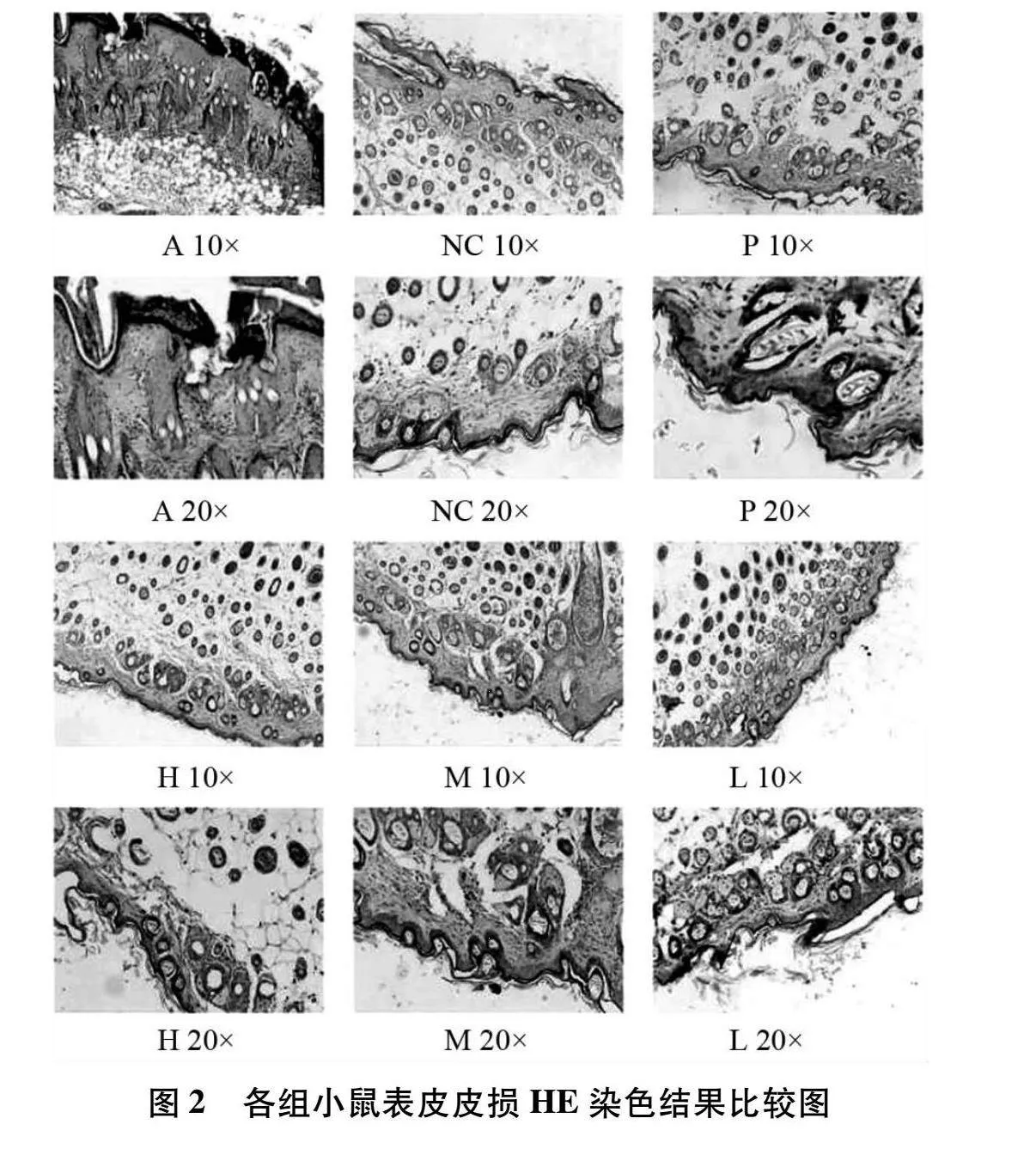
3.3 小鼠表皮皮损病理学观察结果 各组小鼠表皮皮损HE染色显示:造模前和空白组小鼠皮肤结构完整清晰,各层厚度正常,细胞形态正常,未见角化过度或角化不全,细胞未见变性及坏死。且真皮层无明显异常变化;特应性皮炎小鼠造模完成后背部受试区皮肤结构严重受损,表皮增厚,角化过度伴角化不全,棘层肥厚。细胞杂乱排序,局部可见坏死。真皮层细胞水肿,毛细血管扩张充血,并伴有大量炎症细胞浸润;实验组及阳性对照组小鼠皮肤角化程度明显降低,细胞排列较整齐,且真皮层炎性细胞浸润明显减轻;阳性对照组较其余各组小鼠皮损,细胞水肿明显,间隙较大,细胞核略大;高剂量组表皮结构较清晰完整,轻度角化过度及角化不全,细胞排列较整齐,真皮层细胞水肿,少量炎细胞浸润。
3.4 ELISA法检测血清IgE水平 治疗后,与模型组(A组)小鼠相比较,阳性对照组(P组)小鼠和健脾养血祛风高、低剂量组小鼠的血清IgE水平显著降低,差异有统计学意义(P<0.001),健脾养血祛风方中剂量组小鼠的血清IgE水平明显降低,差异有统计学意义(P<0.01);与空白组(NC组)小鼠相比较,模型组(A组)小鼠血清IgE水平显著升高,差异有统计学意义(P<0.01)。见表3。
3.5 ELISA法检测血清IL-17A水平 治疗后,与模型组(A组)小鼠相比较,健脾养血祛风方高剂量组和阳性对照组小鼠的血清IL-17A水平显著降低,差异有统计学意义(P<0.01),健脾养血祛风方中、低剂量组小鼠的血清IL-17A水平明显降低,差异有统计学意义(P<0.05);与空白组(NC组)小鼠相比较,模型组小鼠血清IL-17A水平明显升高,差异统计学意义(P<0.05)。见表4。
3.6 各组小鼠血清中TGF-β1表达水平 治疗后,与模型组(A组)小鼠相比较,健脾养血祛风方高剂量组和阳性对照组小鼠的血清TGF-β1水平显著升高,差异有统计学意义(P<0.001),健脾养血祛风方中剂量组小鼠的血清TGF-β1水平明显升高,差异有统计学意义(P<0.05);健脾养血祛风方低剂量组小鼠的血清TGF-β1水平无明显变化,差异无统计学意义(P>0.05);与空白组(NC组)小鼠相比较,模型组(A组)小鼠的血清TGF-β1水平显著降低,差异有统计学意义(P<0.01)。见表5。
3.7 ELISA法检测小鼠粪便SIgA水平 治疗后,与模型组(A组)小鼠相比较,除空白组(NC组)以外,其余各组小鼠的粪便SIgA水平显著升高,差别有统计学意义(P<0.001);与空白组(NC组)小鼠相比较,模型组(A组)小鼠的粪便SIgA水平显著降低,差异有统计学意义(P<0.001)。见表6。
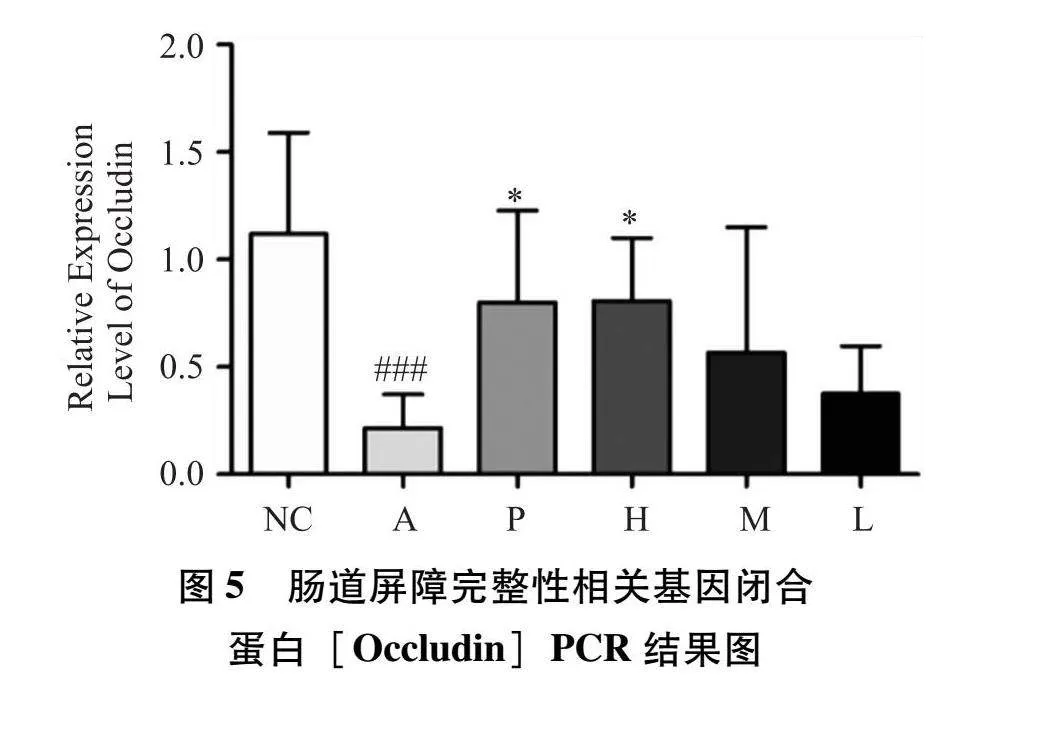
3.8 小鼠脆弱拟杆菌的荧光定量PCR结果 利用荧光定量PCR技术进一步调查了益生菌及不同剂量健脾养血祛风方对小鼠脆弱拟杆菌(Bacteroides fragilis)的影响,所得结果如图9所示。与空白组(NC组)相比,A组的Bacteroides fragilis丰度显著降低(P<0.001);与模型组(A组)相比,阳性对照组及高剂量健脾养血祛风方组小鼠的Bacteroides fragilis相对丰度显著回升,差异有统计学意义(P<0.01)。经治疗后小鼠各组的Bacteroides fragilis相对丰度较空白组仍较低。
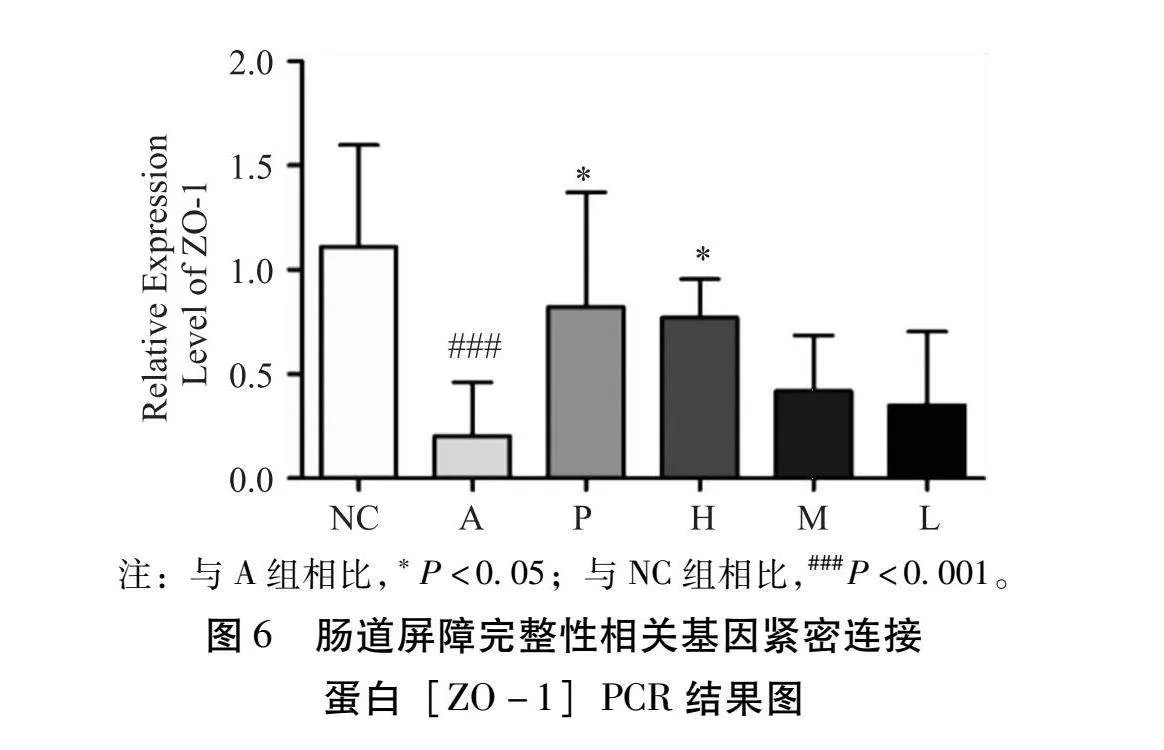
3.9 小鼠结肠肠组织中肠黏膜屏障完整性相关基因定时定量PCR的结果 本研究检测了小鼠组织中与肠道屏障完整性相关基因表达(富含黏蛋白-2[Muc2]、紧密连接蛋白[ZO-1]和闭合蛋白[Occludin])的mRNA表达。表达结果如图4~6所示。与NC组相比,A组的Muc2、Occludin和ZO-1表达量明显降低(P<0.001)。与A模型组相比,健脾养血祛风方低、中剂量组的Muc2、Occludin、ZO-1的表达量均有所升高,但是没有显著性差异。健脾养血祛风方高剂量组及阳性P组与A组对比,Muc2、Occludin和ZO-1的表达量均有所升高,并且差异具有统计学意义(P<0.05)。综上所述,健脾养血祛风方及益生菌药物组能够修复AD小鼠的肠道屏障受损和肠道稳态失衡。
4 讨论
皮肤和肠道微生物群落是两种主要的生态系统,其在AD中的作用机制已被广泛研究。皮肤和胃肠道是人体重要的免疫器官。人体肠道细菌的定植和易位异常可引起胃肠道免疫功能紊乱,进而激发胃肠道免疫炎症反应,引起特应性皮炎发生。流行病学调查、粪便菌群分析和临床研究[6]均提示,变态反应性皮肤病的发生与肠道微生态失衡及免疫屏障功能障碍密切相关。肠道菌群通过致病菌释放内毒素激发或者加剧免疫炎症反应,使Treg细胞的数量/功能受阻后削弱其对Th1、Th2和Th17等效应细胞的免疫应答调控能力。肠道菌群失衡可削弱肠道免疫屏障致其抗原增加,激发其免疫应答功能向Th2功能转变,增加发生变态反应的风险[7]。现已证明[16],Th17/Treg的轴失衡是促进Toll受体启动免疫应答,激活炎症反应,其轴的失衡被认为是AD慢性期的主要发病机制。Th17细胞可通过分泌 IL-17、IL-6等细胞因子诱导产生多种前炎症细胞因子和趋化因子,引起机体免疫反应[17]。其中IL-17为Th17细胞分泌的重要细胞因子之一,其可激活AD的炎症反应及加重组织损伤[16]。Treg细胞是机体发挥负向免疫调节的细胞之一,在维持机体免疫耐受和免疫平衡中发挥重要作用。Treg细胞主要分泌IL-4、IL-10和TGF-β等抗炎细胞因子参与机体多种免疫性疾病。实验研究发现AD小鼠Th17细胞在患病时高表达,通过健脾养血祛风方治疗后IL-17细胞因子水平明显降低,炎症反应明显减轻。而Treg细胞在患病时低表达,通过中药治疗后TGF-β细胞因子水平明显升高。充分说明IL-17与TGF-β存在明显负相关性。
研究发现AD发病的过程中存在多种免疫学异常为主要表现,以T细胞的过度活化和IgE水平升高等为显著特征。临床上观察到AD患者不仅存在皮肤免疫屏障受损,还伴有肠道异常症状的表现。胃肠道是一个巨大的免疫器官,其肠道菌群的失衡也可激发其免疫应答功能,增加发生变态反应的风险[8]。实验显示治疗后SCORAD积分,中药组与阳性对照组均能明显改善患者症状,从实验室检测分析,中药组与阳性对照组患者血清IgE水平显著下降,粪便SIgA水平显著升高,TGF-β表达上升。SIgA是肠道黏膜分泌最大的免疫球蛋白,参与免疫应答,粪便SIgA水平反应机体肠道的免疫功能。健脾养血祛风方和酪酸梭菌二联活菌散均可以通过肠道免疫通路激活免疫信号,提高机体的免疫功能,抑制过敏反应及调节肠道微生态,通过触发免疫耐受而产生抗炎细胞因子[15]。与模型组相比较,不同剂量的健脾养血祛风方组小鼠与益生菌组小鼠血清IgE水平显著下降,说明健脾养血祛风方和酪酸梭菌二联活菌散均可抑制小鼠皮肤的超敏反应,缓解皮肤瘙痒、炎性渗出等症状。AD患者粪便中脆弱拟杆菌的相对丰度较健康人低,经治疗后脆弱拟杆菌的相对丰度较治疗前明显升高。胃肠道菌群中的拟杆菌具有抗炎属性[9],Sprr2a是一种参与皮肤屏障功能的蛋白[10],可诱导CD4+T细胞与Foxp3+Treg细胞转换并形成免疫耐受[11]。拟杆菌能够调节宿主基因的转录并上调Sprr2a的表达,参与肠道黏膜细胞内Toll样受体并调节抗菌肽活性,干预固有免疫和细胞分化[12]。根据临床观察和文献检索预测健脾养血祛风方和益生菌改善特应性皮炎的皮肤屏障功能的作用机制是通过调节肠道脆弱拟杆菌改善肠道黏膜屏障介导的Toll样受体,干预初代T细胞分化,激活免疫相关细胞抗炎因子,诱导免疫Treg细胞转换,抑制过敏反应,减轻皮肤瘙痒等症状。药物通过肠道免疫通路,激活免疫信号,可以从而改善机体整体免疫功能,抑制过敏反应,减少炎性渗出,减轻皮肤瘙痒等症状,为“从肠论治”皮肤病奠定了一定的研究基础。但肠道微生物的多样性,菌群种类繁多,其作用机制非常复杂,通路较多,其途径不仅有免疫方面,还有代谢途径和神经内分泌途径,要具体明确是哪种菌属或经哪种通路影响和调节皮肤屏障和皮肤炎症,还有待进一步研究。
参考文献
[1]
NUTTEN S. Atopic dermatitis: global epidemiology and risk factors[J]. Ann Nutr Metab,2015(1):8-16.
[2]KABASHIMA K. New concept of the pathogenesis of atopic dermatitis: Interplay among the barrier,allergy,and pruritus as a trinity[J]. J Dermatol Sci,2013,70(1):3-11.
[3]KALIOM M, KIRJAVAINEN P, EEROLA E, et al. Distinct paterns of neonatal gut microflora in infants in whom atopywas and was not developing[J]. J Alergy&Clin Immunol,2001,107(1):129-134.
[4]娄俊丽,黄永坤.过敏性疾病与肠道菌群[J].临床儿科杂志,2009,27(2):196-198.
[5]国家中医药管理局.中医病证诊断疗效标准[S].南京:南京大学出版社,1994:87.
[6]GOTO Y, KURASHIMA Y, KIYONO H. The gut microbiota and inflammatory bowel disease[J]. CurrOpin Rheumatol,2015,27(4):388-396.
[7]HARTMANN M, ENK A. Mycophenolate mofetil and skin diseases[J]. Lupus,2005,14(1):S58-63.
[8]COSTA M C, STMPFLI H R, ARROYO L G, et al. Changes in the equine fecal microbiota associated with the use of systemic antimicrobial drugs[J]. BMC Vet Res,2015(11):19.
[9]MAZMANIAN S K, ROUND J L, KASPER D L. A microbial symbiosis factor prevents intestinal inflammatory disease[J]. Nature,2008,453(7195):620-625.
[10]HOOPER L V. Molecular Analysis of commensal host -microbial relationships in the intestine[J]. Science,2001,291(5505):881-884.
[11]ROUND J L, FLAVELL R A. Inducible Foxp3+ regulatory T-cell develop-ment by a commensal bacterium of the intestinal microbiota[J]. Proc Natl Acad Sci USA,2010,107(27):12204-12209.
[12]YU C G, HUANG Q. Recent progress on the role of gut microbiota in the pathogenesis of inflammatory bowel disease[J]. J Dig Dis,2013,14(10):513-517.
[13]邓晶晶,李彤,包富龙,等,瑶浴清消方对急性湿疹小鼠模型Th1/Th2调节平衡的作用[J].中国皮肤性病学杂志,2021,35(9):1044-1049.
[14]谢英华,章明敏.克癀胶囊对小鼠急性湿疹模型的作用观察[J].中国现代药物应用.2018,12(19):213-215.
[15]SMITS H H,ENGERING A,DESIREE V D K,et al.Selective probiotic bacteria induce IL-10- producing regulatory T cells in vitro by modulating dendritic cell function through dendritic cell-specific intercellular adhesion molecule 3-grabbing nonintegrin[J].Journal of Allergy and Clinical Immunology,2005,115(6): 1260-1267.
[16]KOGA C, KABASHIMA K,SHIRAISHI N,et al. Possible pathogenic role of Th17 cells for atopic dermatitis[J]. J Invest Dermatol,2008,128(11): 2625-2630.
[17]KOLLS J K. 17 cells in mucosal immunity and tissue inflammation[J].Semin Immunopathol, 2010(32): 1-2.
(收稿日期:2024-01-05 编辑:陶希睿)
中国民族民间医药·上半月2024年10期
