IL-21和CCL19修饰可提高NKP30 CAR-T细胞对肺癌的杀伤效率并促进其肿瘤浸润

摘要:目的 探讨细胞因子IL-21 和趋化因子CCL19 修饰的NKP30 CAR-T细胞是否增强对肺癌的杀伤和浸润作用。方法 在NKP30 CAR基础上融合基因IL-21和CCL19构建IL-21-CCL19 NKP30 CAR;CAR-T细胞的培养使用CD3CD28单抗及细胞因子IL-2 刺激;流式细胞术检测免疫细胞表型;迁移实验检测IL-21 对免疫细胞的迁移作用;乳酸脱氢酶(LDH)及成球实验检测CAR-T细胞的杀伤及浸润能力;酶联免疫斑点技术(ELISPOT)检测IFN-γ的分泌数量;ELISA检测IL-21及CCL19的分泌情况;体内实验中,将肿瘤细胞显微注射到斑马鱼卵黄囊,构建斑马鱼移植瘤模型,24 h后将免疫细胞注射至同样部位,体式荧光显微镜拍摄荧光。结果 NKP30配体(B7H6)在正常组织及血液细胞不表达,在肺癌细胞上高表达(90%以上)。IL-21-CCL19 NKP30CAR-T细胞与NKP30 CAR-T细胞和常规T细胞相比,具有更强的增殖能力、迁移能力及中心记忆T细胞的形成(Plt;0.001),免疫抑制分子CTLA4与PD1显著降低(Plt;0.005),对肺癌细胞具有更强的杀伤能力(Plt;0.001),伴随IFN-γ数量明显增加(Plt;0.001)。IL-21-CCL19 CAR-T 细胞杀伤肺癌细胞中产生大量细胞因子IL‑21 (3152.33±526.74 pg/mL)和趋化因子CCL19(1853±211.95 pg/mL)。体内实验中,CAR-T细胞和普通T细胞比较,具有较强的杀伤能力和增殖能力,但2种CAR-T细胞无明显差异(Pgt;0.05)。结论 IL-21-CCL19 NKP30 CAR-T细胞更容易浸润到肿瘤内部,有效杀伤肿瘤细胞,同时产生更多的记忆T细胞。
关键词:肺癌;NKP30;嵌合抗原受体基因修饰T淋巴细胞;IL-21;CCL19
近年来,免疫疗法尤其是单克隆抗体和靶向药物越来越多地应用于肺癌的临床治疗,但仍有很多局限性,如总的缓解率偏低、间质性肺炎及心肌炎等严重副作用[1]。嵌合抗原受体基因修饰T 淋巴细胞(CAR-T)疗法对于部分B 细胞淋巴瘤和白血病的疗效显著,也为实体瘤的免疫治疗开辟了新途径。CAR-T 细胞用于肺癌的治疗主要挑战包括:肺癌的靶抗原存在异质性,靶向抗原的CAR-T 细胞特异性不强,导致副作用较大,如脱靶效应与细胞因子风暴等[2];肿瘤的周围基质和免疫细胞构建的物理障碍及免疫屏障使得CAR-T 细胞难以完全浸润肿瘤组织;肿瘤内部低氧营养匮乏,使得浸润其内的CAR-T难于长时间存活及扩增[3]。为了解决部分问题,我们在NKp30 CAR-T基础上,将细胞因子IL-21 及趋化因子CCL19 融合表达于NKP30 CAR-T 细胞,形成IL-21-CCL19 NKP30 CAR-T细胞。
相对于常规CAR-T 细胞,IL-21-CCL19NKP30CAR-T细胞主要有以下优势:首先,NKp30是NK细胞的活化性受体,是NK细胞发挥杀伤活性的关键因素之一。B7-H6 作为NKp30 的主要配体,特异性的表达在肿瘤细胞表面,目前尚未在健康细胞中发现过B7-H6[4, 5]。其次,细胞因子IL-21 可以促进T细胞增殖,长期维持记忆干细胞表型[6, 7],解决CAR-T细胞在肿瘤内部长期存活问题。再次,趋化因子CCL19 能够促进效应T细胞浸润到肿瘤部位[8],有望解决CAR-T难以到达实体瘤内部问题。截至目前,已有多个CAR-T细胞的临床研究,亦有少量NKP30 CAR 的研究,如Gacerez等[9]构建人的NKP30 CAR-T细胞对B7-H6靶向肿瘤非常敏感,取得有效的抗肿瘤活性。目前尚未发现IL-21-CCL19 NKP30 CAR-T细胞用于实体瘤或肺癌的研究。因此,本研究拟探讨这种新型IL-21-CCL19 NKP30CAR-T细胞的靶向性、持久性和趋化性,为临床实体瘤应用研究提供新的方法。
1 材料和方法
1.1 细胞株
人肺癌细胞系H460 和DMS114 购自中国科学院细胞库。细胞系A549在本实验室保存。所有细胞株均在RPMI 1640 培养基中培养,并添加10%胎牛血清和1%抗生素。肺癌抗原使用肺癌细胞株经丝裂霉素(浓度为20 μg/mL)处理2 h,DPBS洗涤2遍,使得肺癌细胞失去活性,但保留抗原性。
1.2 材料
RPMI 1640( Gibco);胎牛血清(PAN SERATECH,稀释倍数1∶10);抗生素(MP-Biomedicals,稀释倍数1∶100);DPBS(Gibco);丝裂霉素c(sigma,终浓度20 μg/mL);淋巴分离液(MP);KBM581(康宁);CD3CD28单抗(T Cell TransAct™ human,美天旎,稀释倍数1∶100);慢病毒(上海汉恒生物公司);流式抗体CD3-PerCP、CD25-PE、NKP30-APC, B7H6-PE、CD45RO-PE、CD62-APC、PD1-PE、CTLA4-PE(BD)(eBioscience,稀释倍数1∶500);封闭抗体IL-21R(ATR-107)及CCR7(BD);乳酸脱氢酶(LDH)试剂盒(罗氏);膜联蛋白PKH26 染料(sigma);ELISPOT 试剂盒(达科为);IL-21 及CCL19 细胞因子ELISA试剂盒(博士德);其他细胞因子混合试剂盒(BD);荧光探针Dil(美伦)。
1.3 方法
1.3.1 CAR表达载体的构建及人T细胞的转导 抗人NKP30 single-chain variable fragment (scFv),CD8a 引导链连接人NKP30胞外功能区,CD8 a铰链区和CD28跨膜区,胞内嵌入4.1BB或CD3z 共刺激信号域。21×19 CAR 是在上述NKP30 CAR 基础上加一个启动子(PGK),启动细胞因子IL-21及CCL19,之间嵌入2A序列,允许IL-21 和CCL19 分开表达。载体自带GFP 荧光。采取10 mL健康志愿者的新鲜抗凝血,用淋巴分离液分离外周血单核细胞(PBMC)。经淋巴细胞培养基进行无血清培养,调整细胞浓度为2×106/mL,添加CD3CD28单抗及细胞因子IL-2。37 ℃培养24 h后,进行病毒转染,分组如下;空病毒组(Mock 组);NKP30CAR T 组(Conv. CAR-T 组);IL-21-CCL19 NKP30CAR T组(21×19 CAR-T组),设定MOI=10∶1,37 ℃培养4 h,去除病毒上清,隔天扩增培养,细胞浓度维持2×106/mL,并添加细胞因子IL-2。
1.3.2 流式细胞术 被检测细胞加入5 μL 流式抗体,室温孵育15 min后,PBS洗涤2次,经流式细胞仪检测。所有检测均设同型对照。肺癌NKP30 配体B7H6 的表达:使用B7H6-PE 抗体标记肺癌细胞株;CAR-T 细胞增殖分裂倍数:使用PBS 稀释染料eFluor™ 670,与免疫细胞悬浮液以1∶1 的比例混合。在暗处37 ℃孵育10 min。加入4~5 倍体积的冷全培养基终止标记,并在冰上孵育5 min,用完全培养基洗涤细胞3 次;CAR-T 细胞感染效率:以APC-NKP30 及GFP 为双指标检测CAR T 细胞比例,并分别检测CD4+T 及CD8+T 细胞的CAR-T 细胞比例;记忆细胞(TCM)的比例:使用CD45RO 和CD62 抗体进行标记;活化指标:使用CD3 及CD25 抗体进行标记;耗竭指标:使用PD1 或CTLA4 抗体进行标记。
1.3.3 细胞迁移实验 responder T 细胞预先用DyeeFluor™ 670标记,取200 μL培养于Trans-well(罗氏)上层小室。Conv. CAR-T或21×19 CAR-T与丝裂霉素c处理的HCG-27 细胞共培养3 d,400 μL 细胞接种到Transwell下层,培养3 h或5 h。用流式细胞仪检测从上层迁移到下层的细胞。在另外的实验中用Anti-CD21或Anti-CCR7 封闭IL-21 或CCL19,与上述相同,检测从上层迁移到下层的细胞。
1.3.4 乳酸脱氢酶(LDH)杀伤 效靶比1∶1,CAR-T细胞密度调至1×106/mL,终体积200 μL/孔,设3 个复孔。根据说明书设立对照组,包括加入靶细胞的自发释放组(SR靶)、加入靶细胞并在检测前40 min 加入10 mL/LTriton-100 的最大释放组(MR靶),只加入效应细胞的自发释放组(SR效应),在37 ℃孵箱中培养4 h。离心后吸出50 μL/孔上清,转移至另一ELISA板,加入50 μL/孔LDH 反应液,室温避光放置30 min 后,测定吸光度A492 nm ,计算杀伤活性=[(实验孔-SR效应-SR靶)(/MR靶-SR靶)]×100%。
1.3.5 肿瘤细胞球的杀伤 将肺癌细胞以1×103 /孔经膜联蛋白PKH26染色(红色),接种于非处理的96孔板中,4 d后,观察成球情况,每孔加入效应细胞,效应细胞与靶细胞1∶1共培养,4 h或24 h动态监测效应细胞对肿瘤细胞的杀伤情况。
1.3.6 酶联免疫斑点技术(ELISPOT) 根据说明书,使用96 孔板预先包被人IFN- γ 抗体(达科为),采用ELISPOT 法检测产生IFN- γ 的效应细胞。以NT、Conv. CAR-T 细胞及15×19 CAR-T 细胞为效应细胞,肺癌细胞为靶细胞。效应细胞与靶细胞共培养24 h(效靶比1∶1),使用AID EliSpot Reader classic (AIDGmbH)对斑点形成细胞(SFC)进行计数。
1.3.7 细胞因子释放实验 细胞因子释放实验按照5×104 /孔效应细胞与5×104 /孔HCG-27 细胞混合,每组实验设3孔重复,培养于96孔的平板上,KBM581培养基终体积200 μL,孵育3 d,400 g离心5 min。收集游离上清,按照说明书,ELISA检测IFN-γ、IL-21 及CCL19 细胞因子水平。其他细胞因子IL-2、 IL-4、IL-6、IL-10、TNFα、IFN-γ及IL-17A在流式细胞仪上使用细胞计数珠阵列(CBA)法进行检测,数据使用CBA FCAP Array(BD Biosciences)软件进行处理。
1.3.8 斑马鱼移植瘤模型 斑马鱼由福州百维斯生物科技有限公司提供,异种移植采用注射毛细血管(玻璃毛细血管)连接到微喷射器。斑马鱼受精后48 h注射HCG-27 细胞,注射前HCG-27 细胞经红色荧光探针Dil 染色,显微注射200 个细胞/条至卵黄囊。选择异种移植成功斑马鱼在35 ℃养殖。肿瘤细胞注射后24 h,分组注射效应细胞。PBS 组:只注射PBS 做为对照;空病毒组(Mock):注射空病毒转染的T 细胞;Conv.CAR-T 组:注射NKP30 CAR T 细胞;21×19CAR-T 组:注射IL-21-CCL19 NKP30 CAR T 细胞。注射部位及细胞数与肿瘤细胞相同。0hpi 及24hpi 在体式荧光显微镜下拍摄,通过ImageJ 软件计算每条鱼的荧光面积。
1.3.9 统计学分析 所有数据统计分析均使用Prism 9(GraphPad)软件进行,计量数据以均数±标准差表示,多组间差异比较采用单因素方差分析,两组之间均数比较使用双侧t 检验,组间比较使用配对t 检验,Plt;0.05被认为差异有统计学意义。
2 结果
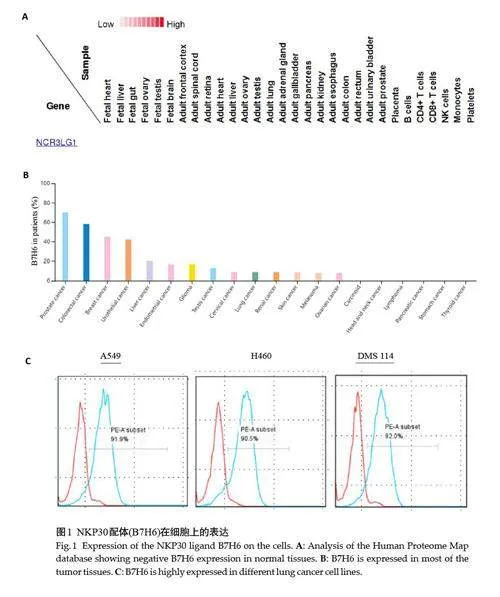
2.1 NKP30配体在肺癌细胞上的表达
根据Human Proteome Map数据库查找,NKP30的配体B7H6(NRC3LG1)在正常组织及血液细胞不表达(图1A),B7H6在多数肿瘤细胞上有表达,如前列腺癌、肠癌、乳腺癌、肝癌及肺癌等(图1B)。本文检测的3株肺癌细胞均高表达B7H6分子(图1C)。
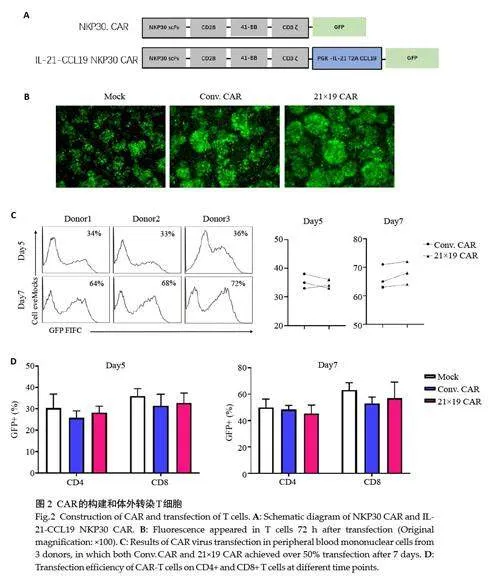
2.2 21×19 CAR的构建与T细胞体外转染
作为对照,我们构建了常规的的NKP30 CAR,包含CD28、4-1BB和CD3ζ序列(以下简称Conv. CAR),IL-21-CCL19 NKP30 CAR是在此基础上增加单独启动子PGK链接IL-21 和CCL19 序列,之间用2A分开(简称21×19 CAR)(图2A)。编码CAR的慢病毒载体转染人类外周血单个核细胞,72 h后荧光显微镜可见明显的GFP荧光(图2B),Conv. CAR或21×19 CAR转染效率第7天左右达到峰值50%以上,但2组之间没有明显差异(图2C), 进一步细分不同时间点T细胞各亚群的转染效率,第7天,CD4+和CD8+均达50%以上,差异无统计学意义(图2D)。
2.3 21×19 CAR-T细胞促进T细胞增殖与迁移
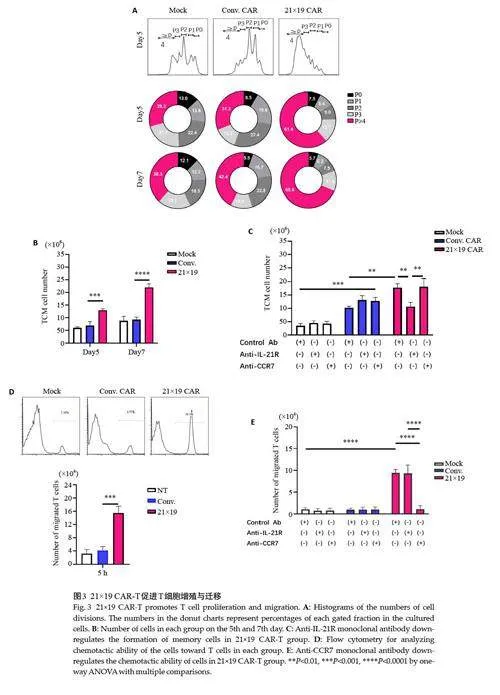
21×19 CAR-T 组增殖明显快于其他组(图3A)。21×19 CAR-T 细胞的数量高于其他组,Mock 组与Conv.CAR-T组无明显差异(图3B)。经封闭抗体(同型对照抗体、IL-21R单抗或CCR7 单抗)刺激5 d,测定记忆细胞绝对数量,IL-21R 抗体可完全削弱21×19CAR-T 组的记忆细胞,而CCR7 抗体却无此作用(图3C)。迁移试验结果表明,与其他组细胞相比,21×19CAR-T细胞对T细胞的迁移显著增强(图4D)。CCR7抗体能够阻断CCL19-CCR7 通路,这种趋化能力明显下降(图4E)。
2.4 21×19 CAR-T 细胞的免疫表型
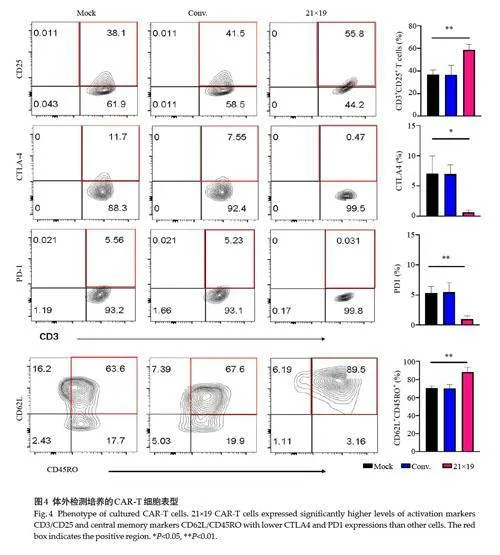
不同组细胞经肺癌抗原刺激24 h后,21×19 CART细胞的活化标志CD25 水平明显高于其他组。21×19 CAR-T 细胞的免疫抑制分子CTLA4 与PD1 显著降低。结果发现,与其他组相比,抗原刺激下21×19CAR-T 细胞中心记忆TCM(CD62L+CD45RO+)比例显著增加。
2.5 21×19 CAR-T细胞强大的体外杀伤能力
与Mock细胞相比,Conv. CAR-T及21×19 CAR-T细胞对不同肺癌细胞株不同效靶比均明显增加,但后2 组之间无明显差异(图5A)。动态荧光观察不同细胞组对肺癌细胞球的杀伤能力,结果显示Mock 组杀伤效率低,24 h 后仍有大量肿瘤细胞,还有增加趋势,T 细胞扩增不明显(图5B);conv. CAR-T 组虽然可见部分免疫细胞扩增,但难于进入细胞球内部,仍然有大量肿瘤细胞存活(图5B)。21×19 CAR-T 4 h内将大部分肿瘤细胞杀灭,伴随效应细胞的扩增。ELISPOT 结果显示(图5C),conv. CAR-T 细胞组与21×19 CAR-T 细胞组产生特异性IFN-γ细胞数量明显高于Mock 组,但前两组之间差异没有统计学意义(Pgt;0.05)。
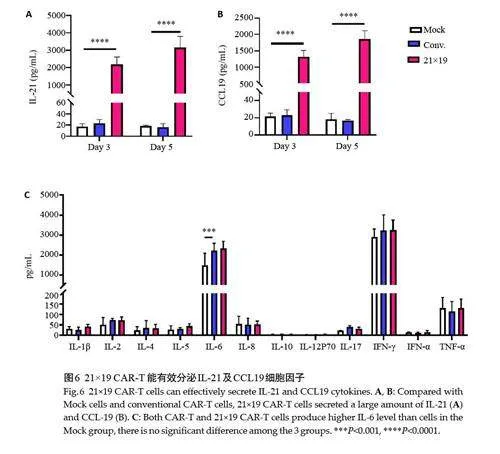
2.6 21×19 CAR-T细胞产生IL‑21 和CCL19细胞因子
21×19 CAR-T细胞能显著促进IL-21产生(图6A)与CCL19分泌(图6B),其他细胞因子IL-2、IL-4、IL-10、TNFα及IL-17A上清分泌极少,分泌较多的IFN-γ在3组之间差异没有统计学意义。与Mock 组比较,conv.CAR-T细胞与21×19 CAR-T细胞分泌较多的细胞因子IL-6,后两组差异没有统计学意义(图6C)。
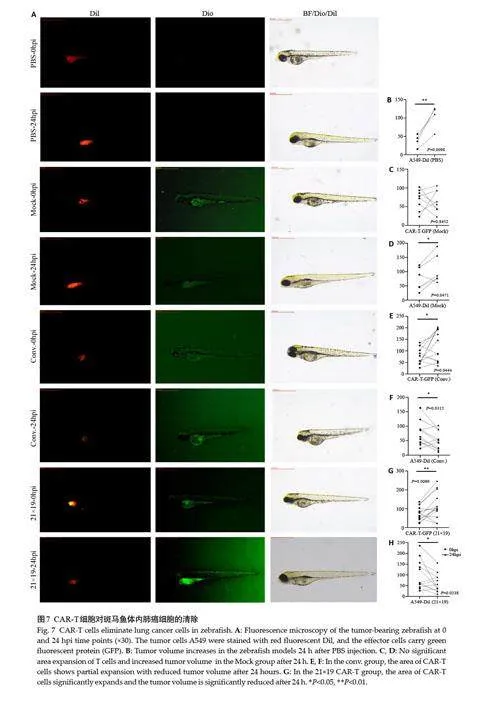
2.7 21×19 CAR-T细胞介导斑马鱼体内肺癌的杀伤
本研究将A549 细胞及效应细胞被植入每条斑马鱼的卵黄囊,体视荧光显微镜监测癌细胞和效应的存活情况(图7A)。结果显示PBS组肿瘤细胞面积无缩小,甚至有增加趋势(图7B)。Mock 组肿瘤面积无缩小(图7D),效应T细胞无扩增(图7C)。conv. CAR-T 细胞与21×19 CAR-T细胞在斑马鱼体内遇到A549 细胞后不同程度扩增(图7E、G)。conv. CAR-T 组与21×19 CAR-T组肿瘤细胞24 h后不同程度缩小(图7F、H)。
3 讨论
CAR经历了4 代的发展,第4 代 CAR是在第3 代CAR基础上,进行各种改造,包括逻辑门及添加各种细胞因子等[10, 11]。本文构建的新型IL-21-CCL19 NKP30CAR-T 细胞,副作用较小,能够分泌大量的IL-21 和CCL19因子,CAR-T细胞容易浸润到肿瘤内部,并促进中心记忆T细胞产生,抑制T细胞耗竭。
CAR-T 细胞对肿瘤细胞特异性的核心是选择合适的靶点,目前肺癌CAR-T热门靶点已有10 余种,包括间皮素、黏蛋白Tn 突变体、表皮生长因子受体等[12-14]。本文选择NKP30 作为CAR靶点,具有以下优点:①NKp30 的配体B7-H6 特异性表达肿瘤细胞上,可视为肿瘤特异性抗原,不会引起“误伤”的现象。②NKP30 CAR-T 细胞表达的CAR 不含有识别肿瘤表面抗原的抗体片段,不会引发患者免疫反应的蛋白结构,从而降低了CAR-T 细胞被患者免疫系统排斥的可能性。所以NKP30 CAR-T较传统的CAR-T细胞有明显优势。
本文在NKP30 CAR-T 细胞上融合了细胞因子IL-21及趋化因子CCL19,主要因为这2种因子对CAR-T细胞具有独特作用。IL-21主要由活化的 CD4+T细胞产生,调节免疫细胞活性,能够刺激B细胞分化成记忆细胞和T细胞增殖[15]。有报道IL-21 可以促进CAR-T细胞长期维持记忆干细胞表型,调节局部微环境并辅助CAR-T 细胞功能[16-18]。本实验IL-21 能够显著提高NKP30 CAR-T细胞增殖能力,产生更多中心记忆细胞(CD45RA+CD62L+)。纤维网状细胞分泌的CCL19能够趋化外周DC细胞、T细胞到达淋巴器官[19],Adachi等[20]在CAR结构中加入CCL19,能够招募体内DC细胞和T细胞到达肿瘤部位,引起自体免疫细胞反应,有效提高肿瘤清除能力。本研究融合了CCL19 的CAR-T细胞,能够主动招募T细胞,迁移到肿瘤部位,增强内部肿瘤细胞杀伤。
目前评估CAR-T 细胞临床前的金标准是小鼠异种移植。然而,小鼠异种移植实验是昂贵和缓慢的。因此,其他脊椎动物体内实验将有助于弥补从体外到小鼠异种移植的差距。由于斑马鱼在胚胎和早期发育阶段缺乏功能性适应性免疫系统,移植细胞不会产生排斥[21-23],斑马鱼异种移植模型已成功用于抗肿瘤作用[24-26],已有学者应用斑马鱼进行CAR-T细胞体内研究,如Pascoal 等[27]用胚胎斑马鱼成功进行CAR-19 的研究。我们基于斑马鱼异种移植的方法来研究CAR-T 细胞介导的对人类肺癌的杀伤。结果发现21×19 CAR-T 细胞对斑马鱼体内肺癌细胞的杀伤明显高于普通T 细胞,同时CAR-T 细胞增殖明显。由于效应细胞杀伤肿瘤细胞时,效应细胞直接显微注射到肿瘤内部,无法如小鼠实验,经尾静脉注射效应细胞可以观察是否浸润到肿瘤内部,本研究结果显示21×19 CAR-T 与conv. CAR-T 细胞对肿瘤杀伤无明显差异。斑马鱼移植瘤模型相比小鼠还有其他缺陷,比如无法分离斑马鱼体内肿瘤细胞,无法进一步研究;观察时间较短,无法比较生存期;操作需要借助显微注射,对实验人员技术要求较高等。
虽然本研究构建的新型CAR-T 细胞解决部分问题,但还有很多值得改进地方,如体内免疫应答过强又会产生细胞因子释放综合征(CRS)[28]。除了阻断IL-6 途径外[29],有研究者尝试通过改变CAR 基因转染方式,导入“自杀基因”以及利用纳米微粒调控CAR-T 细胞的体内寿命和动力学,用来削弱或避免CRS[30]。
综上所述,本研究在NKP30 CAR-T 中加入细胞因子IL-21 及趋化因子CCL19,构建了新型的第4 代CAR-T 细胞。初步结果显示,这种新型CAR-T 细胞增殖能力增强,在杀伤靶细胞过程中,能够产生更多中心记忆细胞。而且这种新型CAR-T细胞能够促进CAR-T 细胞浸润到肿瘤内部,提高肿瘤清除能力,解决了普通CAR-T细胞的缺陷。为进一步临床研究打下良好的理论基础。
参考文献:
[1] Liu YJ, He YY. A narrative review of chimeric antigen receptor-T
(CAR-T) cell therapy for lung cancer[J]. Ann Transl Med, 2021, 9
(9): 808.
[2] Schubert ML, Schmitt M, Wang L, et al. Side-effect management of
chimeric antigen receptor (CAR) T-cell therapy[J]. Ann Oncol,
2021, 32(1): 34-48.
[3] Cochrane RW, Fiorentino A, Allen E, et al. How to test human CAR
T cells in solid tumors, the next frontier of CAR T cell therapy[M]//
Cancer Immunotherapy. New York: Humana, 2024: 243-265.
[4] Gutierrez-Silerio GY, Bueno-Topete MR, Vega-Magaña AN, et al.
Non-fitness status of peripheral NK cells defined by decreased
NKp30 and perforin, and increased soluble B7H6, in cervical cancer
patients[J]. Immunology, 2023, 168(3): 538-53.
[5] Mohammadi A, Najafi S, Amini M, et al. The potential of B7-H6 as a
therapeutic target in cancer immunotherapy[J]. Life Sci, 2022, 304:
120709.
[6] SHAEivary, Kheder RK, Najmaldin SK, et al. Implications of IL-21
in solid tumor therapy[J]. Med Oncol, 2023, 40(7): 191.
[7] Ma MC, Xie YY, Liu JH, et al. Biological effects of IL-21 on
immune cells and its potential for cancer treatment[J]. Int
Immunopharmacol, 2024, 126: 111154.
[8] Xu DH, Liu X, Ke SY, et al. CCL19/CCR7 drives regulatory T cell
migration and indicates poor prognosis in gastric cancer[J]. BMC
Cancer, 2023, 23(1): 464.
[9] Gacerez AT, Hua CK, Ackerman ME, et al. Chimeric antigen
receptors with human scFvs preferentially induce T cell anti-tumor
activity against tumors with high B7H6 expression[J]. Cancer
Immunol Immunother, 2018, 67(5): 749-59.
[10]Silvestre RN, Eitler J, de Azevedo JTC, et al. Engineering NKCAR.
19 cells with the IL-15/IL-15Rα complex improved
proliferation and anti-tumor effect in vivo[J]. Front Immunol, 2023,
14: 1226518.
[11] Liu ZH, Zhou JY, Yang XZ, et al. Safety and antitumor activity of
GD2-Specific 4SCAR-T cells in patients with glioblastoma[J]. Mol
Cancer, 2023, 22(1): 3.
[12]Morello A, Sadelain M, Adusumilli PS. Mesothelin-targeted CARs:
driving T cells to solid tumors[J]. Cancer Discov, 2016, 6(2):
133-46.
[13]Feng KC, Guo YL, Dai HR, et al. Chimeric antigen receptormodified
T cells for the immunotherapy of patients with EGFRexpressing
advanced relapsed/refractory non-small cell lung cancer
[J]. Sci China Life Sci, 2016, 59(5): 468-79.
[14]Zeltsman M, Dozier J, McGee E, et al. CAR T-cell therapy for lung
cancer and malignant pleural mesothelioma[J]. Transl Res, 2017,
187: 1-10.
[15]Zeng R, Spolski R, Casas E, et al. The molecular basis of IL-21-
mediated proliferation[J]. Blood, 2007, 109(10): 4135-42.
[16]Ngai H, Tian GW, Courtney AN, et al. IL-21 selectively protects
CD62L+ NKT cells and enhances their effector functions for
adoptive immunotherapy[J]. J Immunol, 2018, 201(7): 2141-53.
[17] Ptáčková P, Musil J, Štach M, et al. A new approach to CAR T-cell
gene engineering and cultivation using piggyBac transposon in the
presence of IL-4, IL-7 and IL-21[J]. Cytotherapy, 2018, 20(4):
507-20.
[18]Singh H, Figliola MJ, Dawson MJ, et al. Reprogramming CD19-
specific T cells with IL-21 signaling can improve adoptive
immunotherapy of B-lineage malignancies[J]. Cancer Res, 2011, 71
(10): 3516-27.
[19]Pang NZ, Shi JX, Qin L, et al. IL-7 and CCL19-secreting CAR-T
cell therapy for tumors with positive glypican-3 or mesothelin[J]. J
Hematol Oncol, 2021, 14: 118.
[20]Adachi K, Kano Y, Nagai T, et al. IL-7 and CCL19 expression in
CAR-T cells improves immune cell infiltration and CAR-T cell
survival in the tumor[J]. Nat Biotechnol, 2018, 36(4): 346-51.
[21]Yao YX, Wang L, Wang X. Modeling of solid-tumor
microenvironment in zebrafish (Danio rerio) larvae[M]// Tumor
Microenvironment. Cham: Springer, 2020: 413-428.
[22]Reinhardt F, Coen L, Rivandi M, et al. DanioCTC: analysis of
circulating tumor cells from metastatic breast cancer patients in
zebrafish xenografts[J]. Cancers, 2023, 15(22): 5411.
[23]殷 果, 李 荣, 刘岳飞, 等. Notch信号通路抑制剂DAPT改善酒精诱
导的斑马鱼神经元分化障碍[J]. 南方医科大学学报, 2023, 43(6):
889-99.
[24]Li Y, Liu WH, Xu J, et al. Chlorahololide D, a lindenane-type
sesquiterpenoid dimer from Chloranthus holostegius suppressing
breast cancer progression[J]. Molecules, 2023, 28(20): 7070.
[25]Murali Shankar N, Ortiz-Montero P, Kurzyukova A, et al. Preclinical
assessment of CAR-NK cell-mediated killing efficacy and
pharmacokinetics in a rapid zebrafish xenograft model of metastatic
breast cancer[J]. Front Immunol, 2023, 14: 1254821.
[26]Barati M, Chahardehi AM, Hosseini Y. Finding integrative
medication for neuroblastoma and glioblastoma through zebrafish as
A model of organism[J]. Curr Top Med Chem, 2023, 23(30):
2807-20.
[27]Pascoal S, Salzer B, Scheuringer E, et al. A preclinical embryonic
zebrafish xenograft model to investigate CAR T cells in vivo[J].
Cancers, 2020, 12(3): 567.
[28]Rejeski K, Subklewe M, Locke FL. Recognizing, defining, and
managing CAR-T hematologic toxicities[J]. Hematology Am Soc
Hematol Educ Program, 2023, 2023(1): 198-208.
[29]Li XL, Gong NQ, Tian FL, et al. Suppression of cytokine release
syndrome during CAR-T-cell therapy via a subcutaneously injected
interleukin-6-adsorbing hydrogel[J]. Nat Biomed Eng, 2023, 7(9):
1129-41.
[30]Stock S, Klüver AK, Fertig L, et al. Mechanisms and strategies for
safe chimeric antigen receptor T-cell activity control[J]. Int J
Cancer, 2023, 153(10): 1706-25.
(编辑:经 媛)

