Adrb1-A187V突变短睡眠小鼠在不同饮食条件下的行为变化
摘要:目的 探究在限制性饮食和高脂饮食模式下,短睡眠Adrb1-A187V小鼠模型与其野生型小鼠行为活动的差异。方法 将短睡眠基因小鼠分为常规饮食组、气味保留禁食组、完全禁食组、高脂饮食组。常规饮食组:小鼠代谢与行为监测系统中,Adrb1+/+小鼠25只和Adrb1+/m小鼠26只。气味保留禁食组:小鼠代谢与行为监测系统中,Adrb1+/+小鼠17只,Adrb1+/m小鼠19只;EEG/EMG睡眠活动监测系统中,Adrb1+/+小鼠6只,Adrb1+/m小鼠6只。完全禁食组:小鼠代谢与行为监测系统中,Adrb1+/+小鼠6只,Adrb1+/m小鼠4~5只;EEG/EMG睡眠活动监测系统中,Adrb1 +/+小鼠6只,Adrb1+/m小鼠6只。高脂饮食组:小鼠代谢与行为监测系统中,Adrb1+/+小鼠6只,Adrb1+/m小鼠7只;EEG/EMG睡眠活动监测系统中,Adrb1+/+小鼠6只,Adrb1+/m小鼠6只。在两组小鼠颅骨上植入脑电/肌电电极,通过给予小鼠24 h气味保留禁食实验、完全禁食实验以及高脂饮食实验,检测其在不同进食模式下,小鼠如何改变行为活动以适应饮食环境的变化。结果 在气味保留禁食实验中,Adrb1+/m小鼠表现出更加稳定的运动水平的波动,活动相对较少(Plt;0.05),睡眠时间更长(Plt;0.01,Plt;0.05),有利于适应饥饿环境,具有更耐饿的特性;完全禁食实验中,Adrb1+/m小鼠的夜间进水量更多(Plt;0.05),进水的生物节律性更好,表现出在进水方面出现的“少食多餐”。同时,非快速动眼睡眠(NREM)时长增加(Plt;0.01),可以帮助小鼠抵抗饥饿。高脂饮食实验中,Adrb1+/m小鼠表现出更高的运动水平,表现为夜间站立次数和运动距离水平更高(Plt;0.0001),且快速动眼睡眠(REM)在白天增加(Plt;0.01)。结论 Adrb1-A187V突变小鼠可更快速对环境变化做出反应,在限制性饮食条件中,通过增加睡眠减少能量消耗以维持能量稳态;在高脂饮食条件中,则保持更高的运动水平,与限制性饮食条件相反。
关键词:短睡眠基因;睡眠;进食;能量稳态;Adrb1-A187V基因突变
作为自然界动物的两个本能行为,睡眠和饮食需要相互协调进而调控各项生理活动。睡眠是节约能量的重要策略;而进食和觅食行为必然发生在非睡眠时相。生理上,睡眠与饮食模式相互影响,健康的饮食习惯能够改善睡眠,而良好的睡眠又往往伴随着健康的营养状态[1]。有研究表明,饥饿促进觉醒和随后的进食,而进食产生的饱腹感可以通过神经内分泌或神经肽信号的变化促进睡眠,这些睡眠觉醒、进食和能量消耗的调节环路相互重叠[2]。食物的匮乏会抑制小鼠的睡眠,使小鼠易于从睡梦中惊醒,但高脂饮食会显著增加小鼠的NREM睡眠、REM睡眠和睡眠碎片化[3-6]。长期的高热量的饮食摄入会影响睡眠调节和睡眠结构。在高热量饮食的小鼠中,特别是在光照期,REM睡眠明显增加[3, 4]。同时,营养不平衡的饮食或时间不当的饮食模式也会对睡眠产生负面影响[1, 7]。另一方面,当睡眠结构出现变化时,饮食模式可能也会随之改变。睡眠时间减短可能会导致饮食行为不规律,比如摄入过多的能量、脂肪和糖,以及减少对有益健康的食物摄入[8-11]。睡眠的质量低下和时长不足、睡眠时间不当可能导致过度进食,代谢障碍,体质量增加和肥胖[12-14]。因此,作为影响生理健康的关键因素,睡眠和饮食具有相互调节的关系。
成年人则需要7~9 h 的睡眠才能够得到充分的休息,达到最佳机能状态[15, 16]。而自然短睡眠人群终生每日只需要4~6 h睡眠,且精力充沛,主观感觉良好,除了睡眠时间短,他们还有许多其它优异的特征:比如生活乐观、对痛觉更高的阈值以及体型匀称等,因而推测自然短睡眠人群拥有先天性的高质量睡眠[17]。在前期的研究中,我们报道了从部分自然短睡眠人群中发现ADRB1(肾上腺素受体β1)基因的罕见突变,该突变使187氨基酸残基从丙氨酸(A)变为缬氨酸(V,A187V)[17]。该突变的小鼠模型(Adrb1-A187V)表现为活动时长增加,睡眠时间减少[17],出现了类似于家族性自然短睡眠者的睡眠表型。长期以来认为中枢去甲肾上腺素能信号可以参与调节睡眠活动过程[18-21],但对于肾上腺素β1受体在中枢神经系统的功能却知之甚少。如上所述,作为日常生活中重要且必不可少的生理活动,睡眠和饮食活动息息相关、密切联系,在多个层面上相互影响。目前已有很多针对饮食调节睡眠和睡眠改变饮食的研究,但尚未有短睡眠基因动物模型响应睡眠和饮食环境改变的报道。因而本研究通过分析Adrb1-A187V短睡眠小鼠模型在限制饮食(饥饿)和高脂饮食条件下,睡眠和饮食行为活动的改变,进一步探究睡眠质量和进食行为的相互联系以及短睡眠基因对进食行为的调节作用。
1 材料和方法
1.1 实验动物及分组
C57BL/6遗传背景的Adrb1-A187V突变小鼠由广东药康生物科技有限公司订制完成。中科中山药物创新研究院动物实验中心协助饲养管理,小鼠饲养环境为SPF级。实验动物使用许可证:SYXK(粤)2023-0340;动物饲养的标准为GB14925-2010。实验过程中饲养条件为:12 h昼夜更替,给予小鼠充足的饲料和水,笼内垫料每周更换1次。室内温度控制在22±2 ℃。实验开始后,每只小鼠置于笼中单独饲养。所有实验程序均经中科中山药物创新研究院动物保护与使用委员会(IACUC)批准(伦理批准号2024-02-SGS-01)。实验设置分组如下:常规饮食组:小鼠代谢与行为监测系统中,Adrb1 +/+小鼠25 只和Adrb1 +/m小鼠26 只。气味保留禁食组:小鼠代谢与行为监测系统中,Adrb1 +/+小鼠17只和Adrb1 +/m小鼠19 只;EEG/EMG睡眠活动监测系统中,Adrb1 +/+小鼠6只和Adrb1 +/m小鼠6只。完全禁食组:小鼠代谢与行为监测系统中,Adrb1+/+小鼠6只和Adrb1+/m小鼠4~5 只;EEG/EMG睡眠活动监测系统中,Adrb1+/+小鼠6只和Adrb1+/m小鼠6只。高脂饮食组:小鼠代谢与行为监测系统中,Adrb1+/+小鼠6只和Adrb1+/m小鼠7只;EEG/EMG睡眠活动监测系统中,Adrb1+/+小鼠6 只和Adrb1+/m小鼠6只。
1.2 实验试剂
异氟烷(瑞沃德生命科技股份有限公司),红霉素眼膏(广州白云山医药集团),碘伏(利尔康医疗科技股份有限公司),3%双氧水(利尔康医疗科技股份有限公司),瑞莫迪卡洛芬注射液(因诺特医药有限公司)。异丙醇(天津市大茂化学试剂厂),无水乙醇(天津市大茂化学试剂厂),牙科水泥(上海玉研科学仪器有限公司),琼脂糖(赛国生物科技有限责任公司),UltraGelRed(南京诺唯赞生物科技有限公司),Taq DNA聚合酶(南京诺唯赞生物科技有限公司),GC-rich PCRBuffer(南京诺唯赞生物科技有限公司),PBS(赛默飞世尔科技有限公司),蛋白酶K粉末[生工生物工程(上海)股份有限公司],动物饲料(常州鼠一鼠二生物科技有限公司)。
1.3 主要仪器及设备
蛋白电泳仪(北京六一生物科技公司),凝胶成像仪(杭州柏恒科技有限公司),基因扩增仪(广州科朋科学仪器有限公司),高速台式离心机(杭州奥盛仪器有限公司),Mini离心机(杭州奥盛仪器有限公司),小动物麻醉机(深圳市瑞沃德生命科技有限公司),小鼠脑立体定位仪(深圳市瑞沃德生命科技有限公司),颅钉(铭网科技(中山)有限公司),EEG电极(江苏易格生物科技有限公司),高纯银丝(上海玉研科学仪器有限公司),3MVetbond Tissue Adhesive(上海玉研科学仪器有限公司),Super glue(汉高乐泰股份有限公司)。
1.4 实验方法
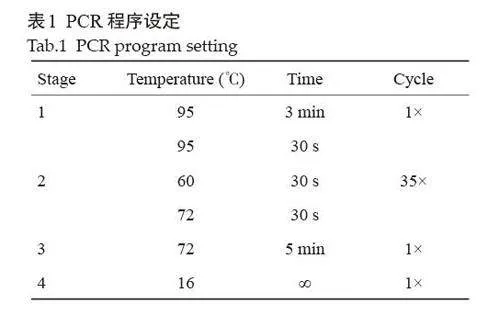
1.4.1 PCR方法鉴定小鼠基因型 剪取小鼠尾巴3~5 mm,置于1.5 mL EP管中,向EP管内加入鼠尾裂解液510 μL,放入55 ℃恒温水浴锅过夜。过夜取出振荡混匀,放入离心机4000 r/min、离心5 min。吸取400 μL的上清转移至新离心管。每管加入400 μL 的预冷异丙醇溶液,翻转均匀后,离心机12 000 r/min、4 ℃ 离心10 min。弃上清,加入500 μL 的70%乙醇溶液,翻转均匀后12 000 r/min 4 ℃ 5 min离心。弃上清,倒置晾干。分别加入400 μL的ddH2O溶解,涡旋震荡溶解。引物序列为:Adrb1 +/+ : Forward Primer (GGGCAGGAAGGACACCAACG),Reverse Primer (GATCTGGTCATGGGATTGCT),Adrb1 +/m: Forward Primer (GATCTGGTCATGGGATTGCT),Reverse Primer (GGGCAGGAAGGACACCAAGA)。每管体系为20 μL。根据小鼠的数量计算需要的总的容量体积进行配制。反应程序见表1。PCR反应结束后,每管PCR产物中加入8 μL DNA marker,随后将其加入至琼脂糖凝胶孔中,每孔加10 μL样品。电泳140 V,时间20 min。结束之后将凝胶放于凝胶成像仪进行拍照。
1.4.2 小鼠脑电/肌电安装 手术用工具刀于280 ℃灭菌5 min,灭菌后喷酒精待用;将3月龄左右小鼠放置于麻醉机的诱导麻醉箱中,通入异氟烷麻醉小鼠,待小鼠昏迷后取出固定于脑立体定位仪,戴上面罩,固定小鼠头部并根据小鼠状态适当调整异氟烷的浓度;将红霉素覆盖小鼠眼睛,防止实验过程中眼睛干涩。待呼吸平稳后,用镊子轻夹尾巴测试痛感,无疼痛反应即可进行开颅手术。小鼠头部剃毛,用碘伏擦拭头皮表面消毒,随后用手术剪剪开头皮露出头皮,暴露整个颅顶,3%双氧水擦拭腐蚀粘膜,并用PBS 清洗,暴露Bregma 点;在Bregma 延长线上找到原点,将4 颗带有银丝的螺钉按照如下坐标埋入颅骨表面:AP+1.0 mm;ML±1.25 mm;AP-3.0 mm,ML±2.5 mm;钻孔植入螺丝,大小适度,将焊接银丝的螺丝植入孔中,固定至不晃动,用牙科水泥固定位置。使用Superglue固定螺钉与颅骨表面;在封好的牙科水泥上放置EEG/EMG微电极,连接螺丝导线,焊锡加固电极连接,电路测通,将肌电电极插入小鼠颈部两侧肌肉,再次用牙科水泥固定,粘合皮肤与水泥交接处,缝合手术区域,皮下注射镇痛剂;将小鼠从脑立体定位仪上取下,给予适量水和食物单独放置饲养笼恢复并适应2周。
1.4.3 小鼠EEG睡眠数据分析 EEG/EMG植入术后恢复2 周左右,将单笼饲养的小鼠放置于温度、光亮可控的监测房间内,给予12 h∶12 h关灯的光周期饲养条件,脑电微电极连接于脑电放大器输入端,再适应2~3 d;然后进行连续记录。得到脑电的原始数据后,通过半自动化动物睡眠-觉醒记录与解析平台通过Sirenia® SleepPro软件,快速傅里叶变换方法,对小鼠睡眠及觉醒周期的功率频谱及睡眠时间Time-Course 进行分析。其中滤波带宽设定为0~30 Hz,每帧为4 s。不同期觉醒-睡眠脑电判定规则为:非快速动眼睡眠为高波幅、低频率(0.5~4 Hz)慢波及较低的肌电活动;快速动眼睡眠(REM)为规则的θ波(5.5~8.5 Hz)及低肌电活动;清醒期为不规则的快慢频率波形混合,并伴随较高肌电活动。通过Sirenia®Sleep Pro软件,对每帧数据进行功率谱的自动分析,对睡眠分期进行识别。以10 s为1个单位对EEG和EMG进行分析,人工校验后导出数据,可以对比不同饮食条件前后总的睡眠时间,不同睡眠时相,不同睡眠脑电频谱的变化等参数,从而总结出不同饮食条件对睡眠的影响。
1.4.4 小鼠行为活动监测 将已鉴定过基因型的两组小鼠,随机分布于连接小鼠行为与进食饮水监测系统(南京达尔文公司)的隔音箱中适应1 周,保持12 h 昼夜光照,实验期间给予充足的食物和水,每周更换1次垫料。以下实验均按照:适应期结束后,连续记录2 d常规饮食条件下的各项参数(进食量、饮水量、站立次数、活动量),每晚关灯时开始记录。取2 d常规饮食条件下各项参数的均值,记作常规饮食维度参数。正常饮食条件(NC):在每批小鼠接受饮食限制或者切换成其他饲料前的基线记录都会被算作在内。气味保留禁食(RF):开始气味保留禁食实验时,在当晚熄灯前5 min,使用隔板遮挡食物槽,持续24 h使小鼠可闻到食物气味,却无法看到和吃到食物。记录气味保留禁食实验期间的数据,与常规饮食维度参数进行比较。完全禁食(AF):开始完全禁食实验时,在当晚熄灯前5 min,取出食物槽内所有食物,持续24 h。在此期间,小鼠无法闻到食物气味,也无法看到和吃到食物。记录完全禁食实验期间的数据,与常规饮食维度参数进行比较。高脂饮食(HF):开始高脂饮食实验时,在当晚熄灯前5 min,将常规饲料换成高脂饲料,给予2周。行为监测系统的采样率一般为每10 min采集1次(图2H和图4H为每5 min采1次)。每个采样的10 min内进食量gt;0.3 g、0.15~0.3 g、lt;0.15 g分别定义为“大餐”、“中餐”、“小餐”。饮水量gt;0.3 g、0.15~0.3 g、lt;0.15 g分别定义为“大水”、“中水”、“小水”。实验记录中出现的异常值(包括小鼠将食物叼进笼内;传感器无法正确检测剩余食物总量;小鼠玩水导致水被浪费而并未摄入体内;设备掉线未能成功记录实验数据)被排除,没有纳入统计。
1.4.5 小鼠睡眠活动监测 将头部已安装EEG/EMG的两组小鼠随机置于隔音的睡眠检测系统中,术后恢复两周,期间保持12 h昼夜光照,水和食物正常供应,每周更换1 次垫料。正式实验开始前记录小鼠在普通喂养下的睡眠活动,记作常规饮食维度参数。气味保留禁食:气味保留禁食实验当天,在熄灯前5 min取出笼内所有食物,置于进水槽视角盲区的位置,保证小鼠可以闻到食物的味道,却无法看到或吃到食物。期间水可以正常饮用,持续24 h,记录小鼠在气味保留禁食24 h期间的睡眠活动。气味保留禁食24 h后,恢复小鼠正常饮食。完全禁食:禁食实验当天,在熄灯前5 min撤走所有笼内食物,期间水可以正常饮用,持续24 h,记录小鼠在禁食24 h 期间的睡眠活动。禁食24 h 后,恢复小鼠正常饮食。高脂饮食:高脂实验当天,在熄灯前5 min将常规饲料换成高脂饲料,给予1 d。
1.5 统计学方法
本文中所有实验数据均采用GraphPad Prism 9.0软件进行分析,两组比较时采用Unpaired t-test分析,多组比较时采用Two-way ANOVA分析,实验中的数据结果均以均数±标准差表示。Plt;0.05表示差异具有统计学意义。采用GraphPad Prism 9.0和Microsoft Excel软件完成实验图的绘制。
2 结果
2.1 常规饮食下小鼠的行为活动
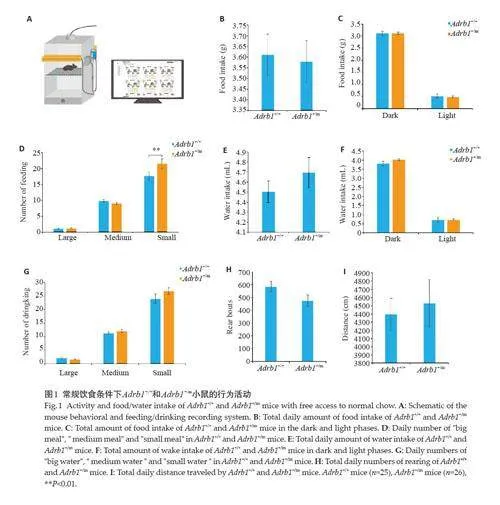
Adrb1 +/+和Adrb1 +/m小鼠在常规饮食条件下的进食行为较为相似,但Adrb1 +/m组吃“小餐”的次数更多(Plt;0.01,图1B~D)。Adrb1 +/+和Adrb1 +/m小鼠的进水行为类似,总进水量、进水的时间分布、频率等无显著差异(图1E~G)。将小鼠的运动行为分为垂直运动和水平活动,分别量化为站立次数和运动距离。正常饮食条件各项运动结果显示,Adrb1 +/+和Adrb1 +/m小鼠的运动参数类似,未见差异(图1H~I)。
2.2 气味保留禁食实验下小鼠的进食相关行为
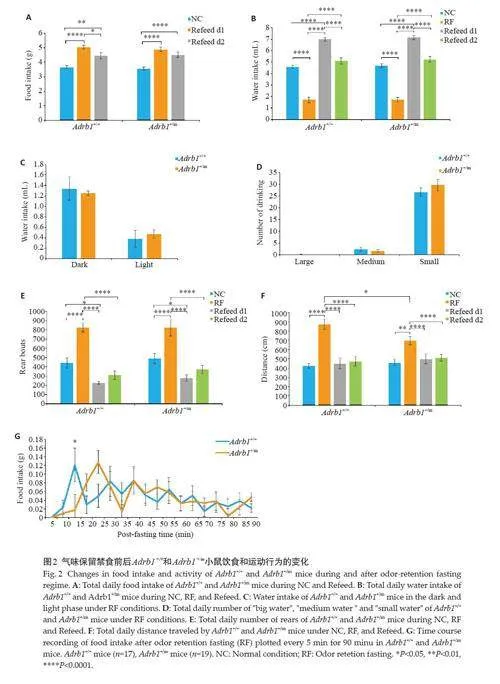
解除RF后第1天,Adrb1 +/+和Adrb1 +/m小鼠的摄食量高于正常水平(Plt;0.0001,图2B),在重摄食第2 天依旧保持较正常本底更高的水平(Plt;0.01,图2B)。在RF前后,各组小鼠进水量的变化趋势一致。RF当天,Adrb1 +/+和Adrb1 +/m小鼠的进水量下降(Plt;0.0001,图2C),野生型和突变体比较未见显著差异(图2B~E)。Adrb1 +/+和Adrb1 +/m小鼠的活动量随RF的变化类似(图2F、G),RF期间站立次数(Plt;0.0001,图2F)和运动距离(Plt;0.01,图2G)显著增加,推测对应饥饿条件下的觅食行为。但Adrb1 +/+小鼠的运动距离相对于Adrb1 +/m小鼠更高,呈现出更高水平的活动(Plt;0.05,图2G)。双因素方差分析方法结果显示:在RF结束后15 min,Adrb1 +/+小鼠出现第一个重摄食峰值,而Adrb1 +/m小鼠在25 min 才出现重摄食峰值(Plt;0.05,图2H),两种基因型存在显著差异。
2.3 气味保留禁食实验下小鼠的睡眠-觉醒行为
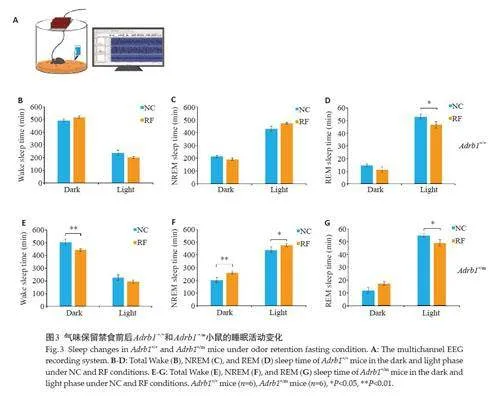
Adrb1 +/+小鼠在RF前后,清醒和NREM睡眠的时长未见显著变化(图3C、D),REM睡眠时间在白天出现下降(Plt;0.05,图3E)。Adrb1 +/m小鼠相较于正常饮食条件下夜间清醒时间显著缩短(Plt;0.01,图3F),NREM睡眠时间在白天和夜间均增加(Plt;0.05,图3G),REM睡眠在白天减少(Plt;0.05,图3H)。
2.4 完全禁食实验下小鼠的进食相关行为
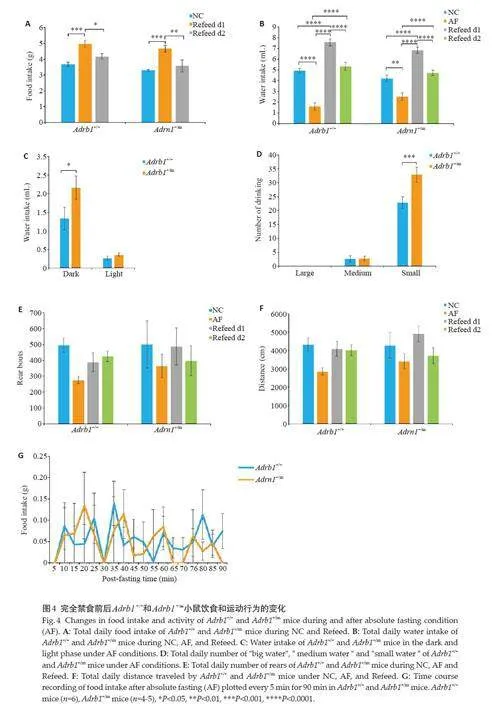
在解除AF后第1天,Adrb1 +/+和Adrb1 +/m小鼠的摄食量远高于基底水平(Plt;0.001,图4B),但在重摄食第2天便恢复到与正常饮食条件相当的水平。AF前后,各组小鼠全天进水活动变化类似,但Adrb1 +/m小鼠在夜间的进水量明显更多(Plt;0.05,图4C、D)。Adrb1 +/m小鼠更倾向于喝“小水”,其喝“小水”的次数和总量更多(Plt;0.001,图4E)。与RF不同的是,各组小鼠在AF期间的运动量均呈下降趋势(图4F、G)。双因素方差分析方法结果显示:AF结束后,2组小鼠重摄食行为相似,差异无统计学意义。
2.5 完全禁食实验下小鼠的睡眠-觉醒行为
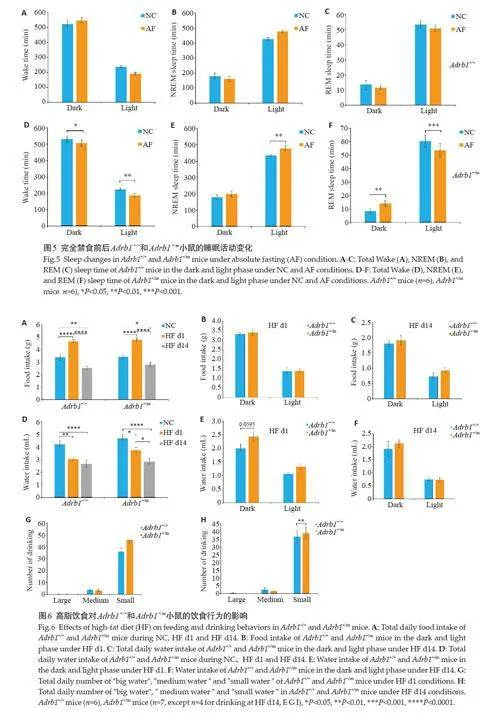
Adrb1 +/+小鼠在AF前后均未出现明显的睡眠活动改变(图5B~D)。而Adrb1 +/m小鼠在夜间和白天清醒时长降低(Plt;0.05,图5E),白天NREM睡眠增加(Plt;0.01,图5F),夜间REM睡眠增加并在白天减少(Plt;0.01,图5G)。Adrb1 +/m突变小鼠白天NREM睡眠增多是AF和RF共有的表型。
2.6 高脂饮食实验下小鼠的进食相关行为
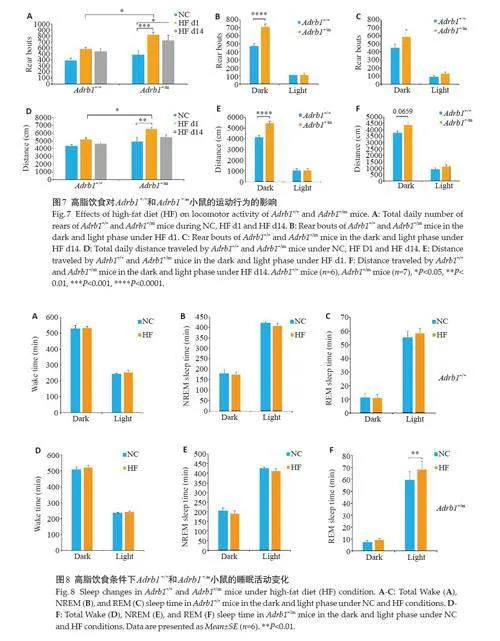
喂食高脂食物时,Adrb1 +/+和Adrb1 +/m小鼠的总进食量均呈现先增加后减少的趋势(Plt;0.001,图6B)。各基因型之间没有表现出进食的时间、分布的差异。随着高脂饮食的时间增加,Adrb1 +/+和Adrb1 +/m 小鼠进水量均持续减少(Plt;0.05,图6E)。在HF d1 中,Adrb1 +/m小鼠的夜间进水量呈现出较Adrb1 +/+小鼠更高的趋势(P=0.0595,图6F),在HF d14没有出现这种趋势(图6G)。Adrb1 +/+小鼠在HF d1里喝“小水”的次数和总量都具有更高水平(Plt;0.01,图6H、I)。
HF前后,Adrb1 +/+小鼠的站立总次数和运动总距离未见显著变化,Adrb1 +/m小鼠在HF d1和HF d14的站立总次数均增加(Plt;0.05,图7A),且在HF d1 的运动总距离增多(Plt;0.01,图7D)。在HF d1,Adrb1 +/m小鼠的站立总次数和运动总距离均高于Adrb1 +/+小鼠(Plt;0.05,图7A、D)。在HF d1,Adrb1 +/m小鼠夜间的站立次数和运动距离水平更高(Plt;0.0001,图7B、E)。在HF d14时,Adrb1 +/m小鼠夜间运动距离也呈现出更高的趋势(P=0.0659,图7C、F)。
2.7 高脂饮食实验下小鼠的睡眠-觉醒行为
HF饮食并没有显著改变Adrb1 +/+组小鼠的睡眠和清醒时长(图8A~D)。Adrb1 +/m组小鼠的清醒时长和NREM睡眠时长也没有变化(图8E、F),REM睡眠在白天增加(Plt;0.01,图8G)。
3 讨论
通过在不同层面的分析,我们发现Adrb1 +/+和Adrb1 +/m小鼠在正常饮食条件下的基本行为活动相似,但Adrb1 +/m小鼠表现出更多吃“小餐”的行为。与Adrb1 +/+相比,Adrb1 +/m小鼠在保证一天总摄食量的情况下,更倾向每餐吃少量的食物。少食多餐是一种以全天多次小餐为特征的饮食方案。多项研究表明少食多餐可以减少呕吐、腹胀等在内的胃肠道症状[22-24]。少食多餐与肥胖之间存在反比关系,高进食频率与整体健康的生活方式有关,有助于减脂和更好地维持体质量[25-28]。在能量摄入相等的情况下,进餐次数少可能与更高的血糖水平有关[29]。Adrb1 +/m小鼠的这种“少食多餐”的特性可能与其本身更好的行为代谢状态有关。
小鼠在禁食条件下的各种行为活动在多个方面发生变化。气味保留和完全撤走两种禁食过程期间,各组小鼠的进水量均显著下降。在RF 期间,Adrb1 +/+和Adrb1 +/m 小鼠的进水行为基本一致。而在AF 期间,Adrb1 +/m小鼠虽然与Adrb1 +/+小鼠的全天总进水量无差异,但是夜间进水量明显更多。夜间(以清醒为主的阶段)集中喝水的现象表明,Adrb1 +/m小鼠的生物节律性更好。在运动方面,两种禁食条件造成的运动变化差异较大。RF 引起各组小鼠运动(站立次数和运动距离)增多,提示“觅食”行为的增加,但Adrb1 +/m小鼠的运动距离(尤其是夜间运动距离)显著低于野生型。一种猜想是在能量缺乏的情况下,突变小鼠为了储存能量和维持代谢,不会进行过度活动;另一种猜想是突变小鼠对饥饿的耐受性更高,因而从事觅食行为的动机比较低。在图2H中,突变的小鼠重摄食时较慢,符合其耐饿的假设。在AF 情况下,各组出现运动减少的趋势,而Adrb1 +/m小鼠的夜间站立次数和运动距离更高,波动更小,相对于Adrb1 +/+小鼠来说运动的昼夜节律更好。在RF期间,Adrb1 +/+小鼠的睡眠/清醒时间未见显著变化,而Adrb1 +/m小鼠的清醒时间显著减少,NREM睡眠显著增加。在禁食期间,机体为保证能量供应,会采取两种策略。一种是“冒险行为”:探索周围环境去寻找潜在的食物,以提高活动量、增加消耗能量为代价[30];另一种则是“保守行为”:通过主动增加睡眠,减少清醒时间,降低机体代谢和能量损失,极端的例子为“冬眠”[31]。我们推测,在RF 期间,由于有食物气味线索,Adrb1 +/+小鼠采取第1 种策略,即增加活动水平去寻找食物;对于Adrb1 +/m小鼠,虽然活动量出现增加,但波动幅度较小,且睡眠时间也显著提升,清醒时间显著减少。AF 期间,Adrb1 +/+小鼠的活动更少,但睡眠时长无显著变化。Adrb1 +/m小鼠更偏向于第2 种策略,即显著提高睡眠时间,最大程度地减少能量损耗。且无论哪种禁食条件,Adrb1 +/m小鼠的运动水平的波动都更加稳定,而Adrb1 +/+小鼠更容易受外界事物干扰,其运动行为容易发生高低起伏的波动。此外,在RF 结束后Adrb1 +/+小鼠更快的出现重摄食的第1 个高峰,与之相比Adrb1 +/m小鼠的延迟摄食行为提示了其更耐饿的特性。
在高脂饮食期间,各组小鼠都表现出进食量的先增加后减少,进水量逐步减少的过程。在高脂初期,与Adrb1 +/+小鼠相比,Adrb1 +/m小鼠呈现夜间集中饮水的倾向,说明其具有更佳的饮水节律。总进水量没有差异的情况下,进水的频率更高。特别是在HF d1,Adrb1 +/m小鼠喝“小水”的次数和总量更多。在这里,Adrb1 +/m 小鼠再一次展现出喝水方面的“少食多餐”的特性。在HF d1,Adrb1 +/m小鼠总是保持更高的运动水平,主要表现为夜间站立次数和夜间运动距离的增加,与饥饿条件下的运动趋势相反。表明在摄入过多脂肪后,Adrb1 +/m 小鼠为保持机体内部稳态,自发地增加活动,以提高能量代谢。但在运动水平增高的条件下,短期内睡眠水平无显著差异。说明高脂饮食在增加运动量的同时,没有显著改变睡眠的水平和质量。综上,这些特性提示了ADRB1-A187V 突变携带者可能的代谢优势,该优势是否为ADRB1 基因所特有,还是短睡眠人群所共有是将来值得继续研究的主题。
参考文献:
[1] Zuraikat FM, Wood RA, Barragán R, et al. Sleep and diet: mounting
evidence of a cyclical relationship[J]. Annu Rev Nutr, 2021, 41:
309-32.
[2] Shukla C, Basheer R. Metabolic signals in sleep regulation: recent
insights[J]. Nat Sci Sleep, 2016, 8: 9-20.
[3] Panagiotou M, Meijer JH, Deboer T. Chronic high-caloric diet
modifies sleep homeostasis in mice[J]. Eur J Neurosci, 2018, 47
(11): 1339-52.
[4] Luppi M, Al-Jahmany AA, del Vecchio F, et al. Wake-sleep and
cardiovascular regulatory changes in rats made obese by a high-fat
diet[J]. Behav Brain Res, 2017, 320: 347-55.
[5] Kang J, Park M, Oh CM, et al. High-fat diet-induced dopaminergic
dysregulation induces REM sleep fragmentation and ADHD-like
behaviors[J]. Psychiatry Res, 2023, 327: 115412.
[6] dos Santos SO, Arias J, Ribeiro AA, et al. Incrimination of
Lutzomyia cruzi as a vector of American visceral leishmaniasis[J].
Med Vet Entomol, 1998, 12(3): 315-7.
[7] Theorell-Haglöw J, Lemming EW, Michaëlsson K, et al. Sleep
duration is associated with healthy diet scores and meal patterns:
results from the population-based EpiHealth study[J]. J Clin Sleep
Med, 2020, 16(1): 9-18.
[8] Chaput JP, McHill AW, Cox RC, et al. The role of insufficient sleep
and circadian misalignment in obesity[J]. Nat Rev Endocrinol,
2023, 19(2): 82-97.
[9] Cheng FW, Li YP, Winkelman JW, et al. Probable insomnia is
associated with future total energy intake and diet quality in men[J].
Am J Clin Nutr, 2016, 104(2): 462-9.
[10]Mossavar-Rahmani Y, Weng J, Wang R, et al. Actigraphic sleep
measures and diet quality in the Hispanic Community Health Study/
Study of Latinos Sueño ancillary study[J]. J Sleep Res, 2017, 26(6):
739-46.
[11] Fenton S, Burrows TL, Skinner JA, et al. The influence of sleep
health on dietary intake: a systematic review and meta-analysis of
intervention studies[J]. J Hum Nutr Diet, 2021, 34(2): 273-85.
[12]Markwald RR, Melanson EL, Smith MR, et al. Impact of insufficient
sleep on total daily energy expenditure, food intake, and weight gain
[J]. Proc Natl Acad Sci U S A, 2013, 110(14): 5695-700.
[13]Morselli L, Leproult R, Balbo M, et al. Role of sleep duration in the
regulation of glucose metabolism and appetite[J]. Best Pract Res
Clin Endocrinol Metab, 2010, 24(5): 687-702.
[14]Penev PD. Sleep deprivation and energy metabolism: to sleep,
perchance to eat[J]? Curr Opin Endocrinol Diabetes Obes, 2007, 14
(5): 374-81.
[15]Watson NF, Badr MS, Belenky G, et al. Recommended amount of
sleep for a healthy adult: a joint consensus statement of the
American academy of sleep medicine and sleep research society[J].
Sleep, 2015, 38(6): 843-4.
[16]Hirshkowitz M, Whiton K, Albert SM, et al. National Sleep
Foundation's sleep time duration recommendations: methodology
and results summary[J]. Sleep Health, 2015, 1(1): 40-3.
[17]Shi GS, Xing LJ, Wu D, et al. A rare mutation of β1-adrenergic
receptor affects sleep/wake behaviors[J]. Neuron, 2019, 103(6):
1044-55. e7.
[18]Kjaerby C, Andersen M, Hauglund N, et al. Memory-enhancing
properties of sleep depend on the oscillatory amplitude of
norepinephrine[J]. Nat Neurosci, 2022, 25(8): 1059-70.
[19]Poe GR, Foote S, Eschenko O, et al. Locus coeruleus: a new look at
the blue spot[J]. Nat Rev Neurosci, 2020, 21(11): 644-59.
[20]Berridge CW, Schmeichel BE, España RA. Noradrenergic
modulation of wakefulness/arousal[J]. Sleep Med Rev, 2012, 16(2):
187-97.
[21]Szabadi E. Functional neuroanatomy of the central noradrenergic
system[J]. J Psychopharmacol, 2013, 27(8): 659-93.
[22]Abell TL, Bernstein RK, Cutts T, et al. Treatment of gastroparesis: a
multidisciplinary clinical review[J]. Neurogastroenterol Motil,
2006, 18(4): 263-83.
[23]Parkman HP, Yates KP, Hasler WL, et al. Dietary intake and
nutritional deficiencies in patients with diabetic or idiopathic
gastroparesis[J]. Gastroenterology, 2011, 141(2): 486-98, 498. e1-7.
[24]Hassanzadeh S, Saneei P, Keshteli AH, et al. Meal frequency in
relation to prevalence of functional dyspepsia among Iranian adults
[J]. Nutrition, 2016, 32(2): 242-8.
[25]Holmbäck I, Ericson U, Gullberg B, et al. A high eating frequency is
associated with an overall healthy lifestyle in middle-aged men and
women and reduced likelihood of general and central obesity in men
[J]. Br J Nutr, 2010, 104(7): 1065-73.
[26]Titan SM, Bingham S, Welch A, et al. Frequency of eating and
concentrations of serum cholesterol in the Norfolk population of the
European prospective investigation into cancer (EPIC-Norfolk):
cross sectional study[J]. BMJ, 2001, 323(7324): 1286-8.
[27]Ma YS, Bertone ER, Stanek EJ 3rd, et al. Association between eating
patterns and obesity in a free-living US adult population[J]. Am J
Epidemiol, 2003, 158(1): 85-92.
[28]Ruidavets JB, Bongard V, Bataille V, et al. Eating frequency and
body fatness in middle-aged men[J]. Int J Obes Relat Metab Disord,
2002, 26(11): 1476-83.
[29]Carlson O, Martin B, Stote KS, et al. Impact of reduced meal
frequency without caloric restriction on glucose regulation in
healthy, normal-weight middle-aged men and women[J].
Metabolism, 2007, 56(12): 1729-34.
[30]Ngo FY, Li HH, Zhang HQ, et al. Acute fasting modulates foodseeking
behavior and neural signaling in the piriform cortex[J].
Nutrients, 2022, 14(19): 4156.
[31]Siegel JM. Sleep function: an evolutionary perspective[J]. Lancet
Neurol, 2022, 21(10): 937-46.
(编辑:余诗诗)

