原代大鼠主动脉血管干细胞的体外培养扩增及鉴定


摘要:目的 采用“切段外膜贴壁培养法”体外培养扩增出原代大鼠主动脉血管干细胞,为开展血管重构及相关疾病研究提供实用的工具细胞。方法 无菌分离2~3周龄Sprague-Dawley大鼠胸腹主动脉,切成长约2.0 mm的血管节段,均匀种瓶,经外膜贴壁固化后进行原代培养,待细胞生长融合度达80%~90%时传代。镜下观察细胞形态及其生长特性,采用流式细胞仪分析目的细胞表面标志物CD分子表达情况,成脂、成骨诱导分化实验检测其多向分化潜能。结果 接种3 d后,少量梭形、星形或多角形的细胞从血管节段周围爬出;5~6 d后形成岛屿状细胞集落,细胞增殖迅速,呈放射状向外扩大,并出现细胞克隆现象;7~8 d后细胞融合成片,呈涡旋状分布;传至第3代后,细胞匀质性较高,表现为典型的“成纤维样”排列生长。流式细胞仪分析细胞主要表达CD44、CD73、CD90,阳性率分别为80.3%、62.2%、46.8%;低表达CD34、CD45、CD11b/c,阳性率分别为1.1%、0.2%、0.2%。体外诱导分化实验表明目的细胞具有成脂、成骨分化潜能。结论“ 切段外膜贴壁培养法”可成功分离培养出具有间充质干细胞特性的大鼠主动脉血管干细胞。
关键词:血管干细胞;主动脉;切段外膜贴壁培养法;原代培养;免疫表型;分化潜能;血管重构
血管干细胞(VSCs)指驻留于血管壁,可分化为构成功能性血管中所有细胞类型的细胞[1],主要包括微血管中紧邻血管内皮细胞的周细胞,以及定居于大血管最外层的血管外膜细胞[2, 3]。成人VSCs在正常情况下一般处于静止的未分化状态,而病理条件下则被激活,可增殖分化为平滑肌细胞、内皮细胞或其他类型细胞,并向管腔侧迁移,参与内皮修复、中膜增厚、新生内膜形成等过程,同时VSCs还可通过旁分泌效应、基质蛋白调节和微血管形成等途径影响血管的结构和功能,在血管重构中发挥着关键作用[4-6]。调控VSCs 的增殖、分化、迁移,以及与血管其他细胞组份之间的交互作用则有望成为防治血管重构的新策略[7]。因此,成功分离培养出VSCs对于开展血管重构的分子机制与防治研究具有重要的应用价值。
然而,VSCs的原代培养尚未广泛开展,且既往研究忽视了VSCs所在血管区域,将血管全层组织细胞接种培养,如酶消化法[8-10]剪碎全层主动脉,加以消化、过筛后进行培养,该法实验成本较高、消化条件不易把控;而组织块法[11]则将血管剪碎成组织小块后随机接种,这无疑降低了目的细胞的纯度。为此有部分学者主张单独剥离主动脉外膜层用于培养VSCs[12-14],但大鼠、小鼠等小型实验动物的主动脉管径细小,分离外膜操作难度较大,且该过程增加了污染机率,容易损失血管组织。故本研究充分考虑VSCs所在血管区域,创新性地将团队前期培养主动脉内皮细胞所采用的“内膜外翻切段贴壁培养法”[15]改造为“切段外膜贴壁培养法”,以期建立一种简便高效、成本较低的大鼠主动脉VSCs体外分离培养方法,为开展血管重构及相关疾病研究提供充足实用的工具细胞。
1 材料和方法
1.1 实验动物
2~3 周龄Sprague-Dawley 大鼠3 只,雌雄不限,购自上海斯莱克实验动物有限责任公司,动物质量合格证号:SCXK(沪)2022-0004。所有实验操作遵循国际兽医学编辑协会《关于动物伦理与福利的作者指南共识》及中国中医科学院西苑医院动物使用伦理要求(伦理批准号:2021XLC044-1)。
1.2 主要试剂及仪器
低糖、高糖型DMEM液体培养基(Cytiva),大鼠间充质干细胞专用培养基(厦门生物角公司),胎牛血清(Gibco),胰蛋白酶、油红O染色试剂盒(北京鼎国昌盛公司),茜素红染色试剂盒(Solarbio),间充质干细胞表面标志物检测试剂盒(苏州赛业公司)。超净工作台(苏州安泰空气技术公司),低速离心机(湖南湘仪公司),二氧化碳培养箱(Thermo),倒置生物显微镜(Leica),流式细胞仪(Becton Dickinson)。
1.3 主动脉VSCs的原代培养
将3只2~3周龄的Sprague-Dawley大鼠以0.3%戊巴比妥钠腹腔注射麻醉后,颈椎脱臼处死,用75%酒精浸泡消毒5 min;逐层打开胸腹腔,充分暴露胸腹主动脉,沿脊柱将其无菌钝性分离,带回洁净室。在超净台内,用预冷PBS液冲洗清除主动脉表面的残留血迹,小心剥除血管外脂肪组织,用无菌手术刀片将其切成长约2.0 mm的血管小段,并转移至离心管中,滴加5 mL低糖型DMEM完全培养基浸泡10 min;离心弃上清液,将血管节段均匀接种于25 cm2培养瓶内,轻缓翻转培养瓶,使瓶底朝上,置于37 ℃、5% CO2培养箱中固化60 min;翻正瓶身,添加适量完全培养基,以刚好覆盖血管节段为度;将培养瓶小心平稳放入培养箱,静置48 h 后补加1 mL 完全培养基,其后每隔48 h 半量换液1 次。
1.4 主动脉VSCs的传代培养
原代培养第8天,吸弃旧培养基,添加4 mL 0.25%胰蛋白酶液37 ℃预消化1~2 min后,将消化液及血管节段组织块一同弃去,再次加入4 mL新鲜酶液继续消化,期间适度震摇瓶底。当镜下观察到大部分细胞回缩变圆、脱壁时,收集细胞悬液转入离心管中,1000 r/min离心3 min,弃上清液,将细胞沉淀与3 mL大鼠间充质干细胞专用培养基轻缓吹打混匀后,以1∶3的传代比例接种培养,记为第1 代细胞。其后待细胞生长融合度达80%~90%时,重复上述传代操作。
1.5 主动脉VSCs形态学观察
于倒置生物显微镜明场下观察原代及传代培养细胞的生长情况,包括细胞形态、是否贴壁、融合程度、分布特点、克隆形成等,并拍照记录。
1.6 主动脉VSCs表面标志物CD分子流式分析
取第4代细胞,用0.25%胰蛋白酶/0.02% EDTA混合酶液消化制备成单细胞悬液,调整细胞数为3×105/流式上样管,短时低速离心,弃上清液,每管添加100 μL缓冲液重悬细胞,并分别加入2 μL 即用型CD44、CD73、CD90、CD34、CD45、CD11b/c 一抗,充分吹打混匀后,于4 ℃避光孵育30 min;1000 r/min离心5 min,漂洗2 遍,用100 μL缓冲液重悬细胞,每管加入2 μL相应的即用型PE标记荧光二抗,充分混匀,4 ℃避光孵育30 min;短时低速离心,漂洗2遍,用400 μL缓冲液重悬细胞后,立即上流式细胞仪检测。
1.7 主动脉VSCs诱导成脂分化实验
取第4代“成纤维样”目的细胞,以及作为阴性对照的“铺路石样”主动脉内皮细胞(参照课题组前期建立的培养方法获得[15]),吸弃原培养基,PBS液漂洗2遍,添加3 mL成脂诱导液(由高糖型DMEM、胎牛血清、地塞米松、胰岛素、吲哚美辛、3-异丁甲基黄嘌呤组成)后放入培养箱中继续培养,每隔3 d半量更换成脂诱导液1次;诱导10~14 d,镜下观察到细胞质内出现大小不等的透亮脂滴时,吸弃诱导液,PBS液漂洗2遍,4%多聚甲醛室温固定15 min,PBS液漂洗2遍,行油红O染色检测细胞成脂分化潜能,并拍照记录。
1.8 主动脉VSCs诱导成骨分化实验
取第4代“成纤维样”目的细胞,以及作为阴性对照的“铺路石样”主动脉内皮细胞(参照课题组前期建立的培养方法获得[15]),吸弃原培养基,PBS液漂洗2遍,添加3 mL成骨诱导液(由高糖型DMEM、胎牛血清、地塞米松、维生素C、β-磷酸甘油组成)后放入培养箱中继续培养,每隔3 d半量更换成骨诱导液1次;诱导18~21 d,镜下观察到细胞聚集处形成致密的矿化结节时,吸弃诱导液,PBS液漂洗2遍,4%多聚甲醛室温固定15 min,PBS液漂洗2 遍,行茜素红染色检测细胞成骨分化潜能,并拍照记录。
2 结果
2.1 原代主动脉VSCs的形态学观察
原代接种3 d后,少量梭形、星形或多角形的细胞从血管节段周围爬出(图1A);5~6 d后形成岛屿状细胞集落,呈放射状向外延伸扩大(图1B、C),并出现细胞克隆现象(图1D);7~8 d后,细胞密度进一步增大,集落相互融合,呈涡旋状排列分布,单层贴壁生长(图1E、F)。
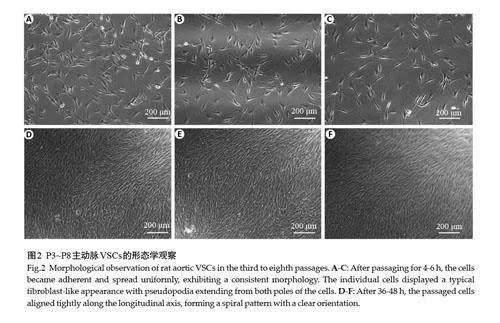
2.2 传代主动脉VSCs的形态学观察
传代接种4~6 h 后,细胞已完全贴壁铺展,均匀散在分布,形态趋于一致,单个细胞表现为典型的“成纤维样”,胞体两极伸出长短不一、粗细不等的伪足(图2A~C);36~48 h后,细胞生长旺盛,密度达80%以上,沿胞体长轴紧致排列成涡旋状,具有明显方向性,未见呈“丘陵-山谷”状交错生长的血管中膜平滑肌细胞(图2D~F)。细胞传至第8代时形态基本保持不变,未出现明显外形变宽、体积增大、形状扁平等分化衰老现象。
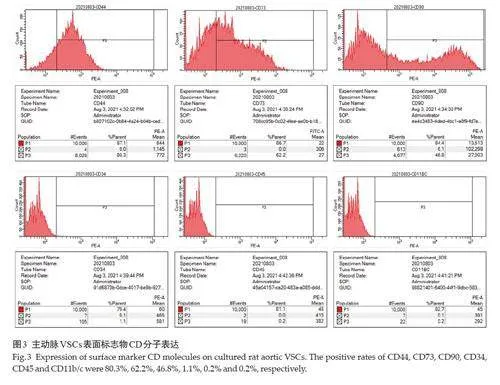
2.3 主动脉VSCs表面标志物CD分子检测
第4 代目的细胞主要表达CD44、CD73、CD90,阳性率分别为80.3%、62.2%、46.8%;低表达CD34、CD45、CD11b/c,阳性率分别为1.1%、0.2%、0.2%(图3)。
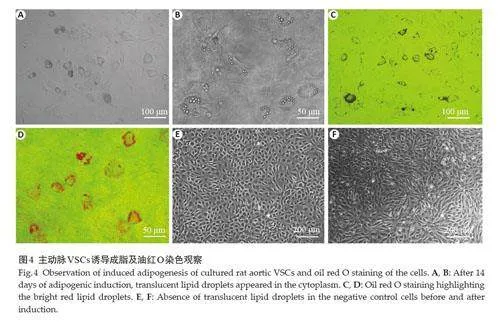
2.4 主动脉VSCs诱导成脂分化实验
第4代目的细胞经成脂诱导液培养14 d后,胞质内出现串珠样、大小不一的圆形透亮脂滴,多位于细胞边缘,并逐渐增多,有相互融合的趋势(图4A、B);经油红O染色后可见鲜红色的“戒环样”脂滴(图4C、D)。阴性对照细胞诱导前后皆未见有透亮脂滴(图4E、F)。
2.5 主动脉VSCs诱导成骨分化实验
第4代目的细胞经成骨诱导液培养21 d后,细胞聚集处层叠融合而失去细胞结构,形成不规则致密矿化结节(图5A、B);经茜素红染色后可见鲜红色结节(图5C、D)。阴性对照细胞诱导前后皆未见有矿化结节(图5E、F)。
3 讨论
血管重构,指多种因素引起的血管壁结构和功能异常改变,与血管壁细胞的增殖、迁移、凋亡,以及细胞外基质降解、血管炎症等复杂细胞分子机制密切相关,是众多心血管疾病的共同病理基础[16, 17]。自2004年徐清波教授团队[18]首次报道主动脉根部外膜中存在大量VSCs后,有众多学者发现外膜是血管壁的主要“损伤感知组织”,VSCs 能够“由外而内”地调控血管结构和功能,即在内膜发生改变之前,VSCs早已对缺氧、血管膨胀、炎症损伤等各种刺激作出反应,增殖、分化并迁移至中膜和内膜,进而导致血管重构的发生[19, 20]。
但目前对于VSCs的研究仍处于早期阶段,国内仅有少数学者发表了主动脉VSCs 原代培养的相关文献[9,10,12],而不同血管来源的VSCs存在异质性,所发挥的功能也不尽相同[21]。因此,建立大鼠主动脉VSCs的原代培养方法,对于开展动脉粥样硬化、高血压、主动脉瘤等以主动脉为主要损伤靶器官的血管重构相关疾病研究具有重要意义。主动脉由以内皮细胞为主的内膜、以平滑肌细胞为主的中膜及富含胶原纤维的外膜共同组成,其中内膜内皮下区域和血管外膜富含VSCs[2, 3],但内皮下区域的VSCs与内皮细胞、平滑肌细胞、成纤维细胞、巨噬细胞等难以明确区分[22],所以主动脉VSCs的体外培养来源应以血管外膜为主。为此,本研究首次采用“切段外膜贴壁培养法”,即将主动脉切成长约2.0 mm的血管节段,以血管外膜面与培养瓶的生长基质面相贴接种,最终成功分离培养出了大鼠主动脉VSCs。该方法简便高效,所需费用少,值得推广。
在原代大鼠主动脉VSCs的体外培养中,因增龄可负向调控组织的再生潜能,即随着机体年龄增长,干细胞对生长因子及生态位信号的响应效率、准确性逐渐下降,其增殖分化能力也随之减退[23, 24],故课题组以2~3周龄的幼体大鼠为取材对象,相对于以往文献选用的2月龄以上成年大鼠而言[10, 14],其主动脉中的VSCs含量及增殖分化能力更具优势。此外,使接种组织块牢固贴壁是“切段外膜贴壁培养法”得以成功的前提。除接种后将培养瓶垂直或倒置放入培养箱固化外[12-14],本研究还严格控制培养基用量,并绝对静置48 h,以有效防止血管节段漂浮,促使其锚定、贴壁。最后,细胞的纯化及其干性维持也是培养扩增VSCs 的关键环节。以往研究主要采用免疫磁珠吸附法、流式细胞分选术纯化干细胞[8-14],但这些方法对技术要求较高,费用昂贵,且易影响细胞得率及活性。因此,课题组转而通过优化实验方法以提高细胞纯度:确保血管节段接种时与培养瓶生长基质面相贴的是VSCs含量较高的血管外膜,接种后的第8天弃去血管节段,以减少中膜、内膜层平滑肌细胞、内皮细胞的爬出;细胞传代时采用胰蛋白酶液预消化1~2 min,将其吸弃后再添加新鲜酶液继续消化,以有效清除对化学酶敏感度高而脱壁较早的一类杂细胞,如血管内皮细胞等[15];利用VSCs增殖能力强、数量占优的特点,在传代培养过程中可充分发挥其群体优势而抑制杂细胞的增殖,经数次传代培养后,自然能达到纯化VSCs的效果;干细胞具有较强的集落形成能力,采用低密度接种法将细胞密度控制在较低水平,有助于触发其代谢调节信号,保持干细胞的增殖能力及多向分化潜能[25, 26]。因此,当细胞生长融合度达到80%~90%时,按照1∶3的比例低密度传代,并采用干细胞专用培养基进行培养扩增,这在保障VSCs增殖生长的同时,更有利于维持其干性。最终实验结果表明细胞传至第8 代时形态基本保持不变,未出现明显外形变宽、体积增大、形状扁平等分化衰老现象。
此外,因目前尚缺乏鉴定VSCs的特异性生物标志物,而以往文献报道血管外膜细胞是间充质干细胞的前体细胞,在免疫表型、分化潜能等方面与间充质干细胞具有高度相似性[8],且间充质干细胞被认为是细胞治疗中最具应用前景的成体干细胞类型之一[27, 28]。故课本研究进一步检测了目的细胞的间充质干细胞特性,结果显示VSCs呈典型的“成纤维样”涡旋状分布,增殖迅速,可形成细胞克隆团,主要表达CD44、CD73、CD90,低表达CD34、CD45、CD11b/c,能够被诱导分化为脂肪细胞、成骨细胞,表明VSCs 具有典型的间充质干细胞特性,这与以往文献报道基本一致[8-10]。
综上所述,本研究创新性地采用“切段外膜贴壁培养法”成功分离培养出了大鼠主动脉VSCs,并通过细胞形态学观察、免疫表型分析及多向分化潜能检测证明其具有间充质干细胞特性,这为体外开展主动脉血管重构及相关疾病的分子机制研究与防治奠定了重要的细胞生物学实验基础。
参考文献:
[1] Lin CS, Lue TF. Defining vascular stem cells[J]. Stem Cells Dev,
2013, 22(7): 1018-26.
[2] 李诗媛, 周 敏, 丁利军. 血管周围干细胞在组织纤维化和损伤修复
中的作用[J]. 中国细胞生物学学报, 2023, 45(8): 1248-56.
[3] Wörsdörfer P, Mekala SR, Bauer J, et al. The vascular adventitia: an
endogenous, omnipresent source of stem cells in the body[J].
Pharmacol Ther, 2017, 171: 13-29.
[4] Tang J, Wang HX, Huang XZ, et al. Arterial Sca1+ vascular stem
cells generate de novo smooth muscle for artery repair and
regeneration[J]. Cell Stem Cell, 2020, 26(1): 81-96. e4.
[5] Zhang L, Issa Bhaloo S, Chen T, et al. Role of resident stem cells in
vessel formation and arteriosclerosis[J]. Circ Res, 2018, 122(11):
1608-24.
[6] Wang D, Li LK, Dai T, et al. Adult stem cells in vascular remodeling
[J]. Theranostics, 2018, 8(3): 815-29.
[7] Jiang LJ, Sun XL, Deng JC, et al. Different roles of stem/progenitor
cells in vascular remodeling[J]. Antioxid Redox Signal, 2021, 35
(3): 192-203.
[8] Klein D, Weisshardt P, Kleff V, et al. Vascular wall-resident CD44+
multipotent stem cells give rise to pericytes and smooth muscle cells
and contribute to new vessel maturation[J]. PLoS One, 2011, 6(5):
e20540.
[9] 郭 虹, 刘杰文, 杨少光, 等. 地塞米松促进胎儿主动脉血管CD105+
间充质干细胞向脂肪细胞分化[J]. 中国病理生理杂志, 2004, 20
(10): 1786-9.
[10]刘煜昊, 房佰俊, 史明霞, 等. 自发性高血压大鼠间充质干细胞生物
学特性变化的研究[J]. 中国生物工程杂志, 2004, 24(04): 49-53.
[11]凌思英, 张柏杨, 滕 勇, 等. 人大隐静脉干细胞原代培养方法的改良
[J]. 生物工程学报, 2018, 34(6): 973-82.
[12]杨礼菊, 马 颖, 李 源, 等. 小鼠血管壁CD34+干细胞的分离、培养及
鉴定[J]. 生理学报, 2023, 75(2): 205-15.
[13]Han CT, Xie C, Dang QY, et al. Immunomagnetic isolation of the
vascular wall-resident CD34+ stem cells from mice[J]. J Vis Exp,
2023(202): e66193.
[14]Wu Y, Zhang RN, Sen-Zhao, et al. Isolation and culture of vascular
wall-resident CD34+ stem/progenitor cells[J]. Cardiology Plus,
2019, 4(4): 116-20.
[15]唐元瑜, 刘海琴, 马华根. 原代SD大鼠主动脉内皮细胞培养方法的
建立及其鉴定[J]. 吉林大学学报 (医学版), 2021, 47(04): 1038-42.
[16]Lin SG, Lin RR, Zhang HK, et al. Peripheral vascular remodeling
during ischemia[J]. Front Pharmacol, 2022, 13: 1078047.
[17]Ye C, Zheng F, Wu N, et al. Extracellular vesicles in vascular
remodeling[J]. Acta Pharmacol Sin, 2022, 43(9): 2191-201.
[18]Hu Y, Zhang Z, Torsney E, et al. Abundant progenitor cells in the
adventitia contribute to atherosclerosis of vein grafts in ApoEdeficient
mice[J]. J Clin Invest, 2004, 113(9): 1258-65.
[19]李伟慷, 崔清卓, 郑玉光, 等. 基于TLR4/NF-κB/NLRP3通路的羟基
红花黄色素A抑制血管紧张素II诱导的血管外膜成纤维细胞迁移
研究[J]. 中草药, 2023, 54 (05): 1478-86.
[20]Klein D. Vascular wall-resident multipotent stem cells of
mesenchymal nature within the process of vascular remodeling:
cellular basis, clinical relevance, and implications for stem cell
therapy[J]. Stem Cells Int, 2016, 2016: 1905846.
[21]Tyurin-Kuzmin PA, Hayashi Y, Kulebyakin K. Editorial: functional
heterogeneity of stem cells[J]. Front Cell Dev Biol, 2023, 11:
1179911.
[22]Orekhov AN, Bobryshev YV, Chistiakov DA. The complexity of cell
composition of the intima of large arteries: focus on pericyte-like
cells[J]. Cardiovasc Res, 2014, 103(4): 438-51.
[23]Narbonne P. The effect of age on stem cell function and utility for
therapy[J]. Cell Med, 2018, 10: 2155179018773756.
[24]李 媛, 钟海英, 董世访, 等. 不同年龄小鼠骨来源间充质干细胞衰老
相关特性与成骨分化能力的比较研究[J]. 陆军军医大学学报,
2024, 46 (13): 1512-22.
[25]Greuel S, Hanci G, Böhme M, et al. Effect of inoculum density on
human-induced pluripotent stem cell expansion in 3D bioreactors
[J]. Cell Prolif, 2019, 52(4): e12604.
[26]Liang L, Xu L, Dong Q, et al. Low initial cell density promotes the
differentiation and maturation of human pluripotent stem cells into
erythrocytes[J]. Stem Cells Dev, 2024, 33(11-12): 321-31.
[27]Yang GQ, Fan XH, Liu YC, et al. Immunomodulatory mechanisms
and therapeutic potential of mesenchymal stem cells[J]. Stem Cell
Rev Rep, 2023, 19(5): 1214-31.
[28]Wan XX, Hu XM, Xiong K. Multiple pretreatments can effectively
improve the functionality of mesenchymal stem cells[J]. World J
Stem Cells, 2024, 16(2): 58-63.
(编辑:余诗诗)

