天麻素通过调节CCR5/AKT信号传导缓解新生小鼠缺血缺氧后小胶质细胞介导的炎症反应
摘要:目的 研究天麻素(GAS)通过CCR5/AKT信号对新生小鼠缺血缺氧(HIBD)后小胶质细胞介导炎症反应的影响。方法选用36 只10 d 龄的C57BL/6J 小鼠,随机分为假手术组(Sham)、缺血缺氧模型组(HIBD)、缺血缺氧+天麻素治疗组(HIBD+GAS),12只/组。模型组和治疗组均行左颈总动脉分离并结扎,1 h后置于缺氧环境中40 min后放回母笼,治疗组在术前1 h、缺氧后2 h 及缺氧后12 h 腹腔注射剂量为100 mg/kg 的GAS。体外培养BV2 小胶质细胞验证天麻素对CCR5/AKT及炎症因子TNF-α、IL-1β的影响,将其分为:对照组(Control)、氧糖剥夺组(OGD)、OGD+GAS处理组(OGD+GAS)、GAS处理组(GAS);为进一步验证CCR5 拮抗剂Maraviroc(M)的作用以及其与GAS 联合干预的作用,将细胞分为:Control 组、(OGD)组、M组、OGD+M 组、OGD+M+GAS 组。Control 组用高糖培养基正常培养,含GAS 组用 GAS 0.34 μmol/L 处理1 h,含M 组用Maraviroc 10 μmol/L 处理1 h,最后将含OGD组均更换为无糖培养基并置于缺氧小室2 h 以构建OGD模型。通过Westernblotting 检测CCR5、AKT、p-AKT、TNF-α、IL-1β 的蛋白表达,免疫荧光双标染色检测新生小鼠胼胝体CCR5 以及BV2 小胶质细胞中CCR5 和p-AKT 的表达变化。结果 与Sham组相比,HIBD组中CCR5、TNF-α 表达显著增加,p-AKT 表达显著减低(Plt;0.05,0.01 或0.001),GAS治疗后逆转了上述结果(Plt;0.05 或0.01)。与Sham组相比,HIBD组中新生小鼠胼胝体区小胶质细胞标记物IBA1及CCR5的荧光强度明显升高,其共表达增加,而GAS干预后IBA1及CCR5的荧光强度显著降低,共表达减少。与Control 组相比,OGD 组CCR5、TNF-α、IL-1β 表达显著增加,p-AKT 表达显著减少(Plt;0.05,0.01 或0.001);GAS 或Maraviroc治疗后,逆转了上述结果(Plt;0.05或0.01)。OGD+M组与OGD+M+GAS组比较,差异无统计学意义。结论 GAS可能通过靶向CCR5激活AKT的磷酸化表达水平,抑制炎症因子的表达,发挥神经保护作用。
关键词:天麻素;缺血缺氧性脑损伤;氧糖剥夺;小胶质细胞;CCR5/AKT
新生儿缺血缺氧性脑损伤(HIBD)是围产期窒息引起的缺血缺氧导致的新生儿脑神经损伤性疾病[1],是导致新生儿急性死亡和长期神经功能障碍的主要原因。新生儿HIBD后常见的症状包括惊厥、昏迷等,严重的情况下还可能出现吸入性肺炎和脑水肿等并发症,极大地威胁患儿生命[2]。目前对HIBD的治疗主要是缓解症状,例如采用高压氧治疗、低温治疗[3],但治疗效果不明显。因此,深入了解HIBD的发病机制和防治措施对减少新生儿缺血缺氧性脑病的患病率和死亡率具有重要意义。
小胶质细胞是中枢神经系统主要的先天免疫细胞。研究发现,阿米巴样小胶质细胞在大、小鼠出生前1 周侵入胼胝体区并占据主导地位,随着发育至成体时变为分支状的小胶质细胞,监测组织急慢性损伤。当创伤、感染或被任何其他神经退行性变刺激后,胼胝体内的小胶质细胞由分支状,转变为阿米巴样,吞噬坏死的组织,并产生大量促炎细胞因子[4, 5]。在新生小鼠HIBD后胼胝体区小胶质细胞被激活,触发多种信号通路和促炎介质的产生,如肿瘤坏死因子α(TNF-α)和白介素1β(IL-1β)等促进大脑炎症反应[6]。因此,抑制小胶质细胞的激活,减少炎症因子的释放可能是预防HIBD的有效策略。
CCR5是细胞表面G蛋白偶联受体家族的一员,主要在T淋巴细胞、巨噬细胞和树突状细胞在内的各类免疫效应细胞上表达,通过与其配体结合发挥调控免疫细胞向炎症微环境的趋化等生理功能[7]。研究表明CCR5参与小胶质细胞的激活和趋化[8, 9],在脑卒中、帕金森等疾病中的神经炎症和免疫反应的发生、发展过程中发挥关键作用。因此,阻断CCR5作用可能成为抑制小胶质细胞介导炎症反应的一条重要途径。CCR5 的激活会影响AKT信号通路的活性,调节细胞增殖、存活或代谢等生理过程[10]。PI3K/AKT通路是细胞生长、代谢、炎症等多个信号传递过程中的关键通路,能通过调控神经细胞凋亡、炎症反应和线粒体功能等方面发挥神经保护作用[11]。AKT作为一种成熟的促生存信号分子,能够抵抗大脑中的氧化损伤和线粒体损伤[12],通过磷酸化调节细胞的增殖和分化[13, 14],改善葡萄糖代谢[15],促进细胞存活和生长。
天麻素(GAS)是从传统中药“天麻”中提取的一种天然酚性糖苷,具有抑制中枢神经系统过度兴奋、恢复大脑皮质正常兴奋水平的功效。GAS能降低炎症因子水平,抑制氧化应激,达到镇静、安眠和缓解偏头痛的作用[16, 17] 。有研究报道,天麻素通过降低趋化因子CX3CL1及其受体CX3CR1蛋白的表达从而抑制脊髓小胶质细胞的活化,进而降低炎症因子的表达[18]。另一项研究显示,天麻素可以通过PI3K/AKT/Nrf2 信号通路减轻视网膜神经节细胞缺血性损伤[19]。但CCR5/AKT在缺血缺氧性脑损伤后小胶质细胞介导的炎症反应中的作用及GAS干预的影响尚未有研究报道。
因此,本研究探讨天麻素是否通过CCR5/AKT信号抑制缺血缺氧性脑损伤后小胶质细胞介导的炎症反应,为HIBD的治疗提供新的策略和实验依据。
1 材料和方法
1.1 主要实验仪器、试剂和动物
1.1.1 主要实验仪器 恒温细胞培养箱和高速离心机(Thermo);XMTD数显调节电热恒温水浴箱(温度37 ℃~100 ℃)(余姚市东方电工仪器厂);水平摇床(型号WD-9405B)(北京市六一仪器厂);荧光显微镜(Olympus),Western blotting 电泳、转膜、成像设备(BIO-RAD)。
1.1.2 主要药品和试剂 吸入用异氟烷(山东安特牧业科技有限公司);RIPA裂解液、10% SDS(康为试剂生物科技有限公司);无水乙醇、甲醇(四川西陇化有限公司);Tris-base、Tween 20(Solarbio);天麻素(昆明制药厂);CCR5 拮抗剂Maraviroc(APExBIO);β‑actin、CCR5、IL-1β、p-AKT 抗体(Origene);TNF‑α 抗体(Millipore);山羊抗兔IgG和山羊抗鼠IgG(武汉三鹰生物技术有限公司)。
1.1.3 实验动物 C57BL/6J 小鼠由河南斯克贝斯生物科技股份有限公司提供(许可证号:SCXK(豫)2020-0005),所有实验已通过昆明医科大学伦理审批(伦理批准号:kmmu20231361)。用新生10 d的小鼠构建HIBD模型。新生小鼠均由母鼠喂养,在安静环境下饲养,自由进食,提供清洁水源,室温控制在22±2 ℃。
1.2 方法
1.2.1 实验动物分组、模型复制及给药 将10 d龄新生小鼠36只随机分为Sham组、HIBD模型组、HIBD+GAS组,12只/组。经吸入异氟烷麻醉后,对HIBD组和HIBD+GAS组小鼠进行左颈总动脉分离和结扎,Sham组仅进行隔离不结扎。术后放回母笼恢复1 h 后置于含92%N2,8% O2的缺氧箱中缺氧40 min 以构建HIBD模型。温度控制在28±2 ℃,在术前1 h、缺氧后2 h 及缺氧后12 h,对HIBD+GAS组小鼠腹腔注射剂量为100 mg/kg的GAS。
1.2.2 细胞培养、分组及模型构建 在37 ℃含5% CO2的恒温培养箱中,使用含10%胎牛血清的高糖培养基培养BV2 小胶质细胞(新加坡国立大学林荣安教授提供)。体外验证天麻素对CCR5/AKT及炎症因子TNF-α、IL-1β的影响,将BV2小胶质细胞分为:对照组(Control)、氧糖剥夺组(OGD)、OGD+GAS处理组(OGD+GAS)、GAS处理组(GAS)。对照组用高糖培养基正常培养,GAS组预先用0.34 μmol/L GAS处理1 h,然后将培养基换为无血清、无糖培养基,在37 ℃、5% CO2、95% N2的缺氧小室中培养2 h 以构建OGD模型。为进一步验证CCR5拮抗剂Maraviroc 的作用以及其与GAS联合干预的作用,将细胞分为:对照组(Control)、氧糖剥夺组(OGD)、Maraviroc 处理组(M)、氧糖剥夺+Maraviroc 处理组(OGD+M)、氧糖剥夺+Maraviroc+ 天麻素处理组(OGD+M+GAS),含M组预先用10 μmol/L Maraviroc预处理1 h后再进行上述的后续处理。
1.2.3 Western blotting实验 裂解液提取细胞或组织蛋白,BCA测其浓度,随后SDS-PAGE 凝胶电泳,转膜,5% 脱脂牛奶封闭,4 ℃条件孵育一抗(1∶1000)过夜,TBST洗一抗,室温孵育二抗(1∶5000)1 h,洗二抗,用化学发光成像系统检测条带。使用Image J软件进行条带灰度值分析。
1.2.4 细胞免疫荧光实验 将各组细胞样本进行免疫荧光双标染色,用多聚甲醛固定,10%山羊血清室温封闭1 h,加入对应的一抗(1∶200)4 ℃孵育过夜,洗一抗,使用Cy3 标记的山羊抗兔IgG(1∶200)和FITC 标记的lectin(1∶200)进行室温孵育1 h,最后用含DAPI的抗淬灭封片剂封片。在荧光显微镜下拍摄。
1.2.5 石蜡切片免疫荧光实验 将脑组织石蜡切片放入55 ℃恒温箱中烤片30 min,依次进行脱蜡和水化,随后用柠檬酸缓冲液进行高压热抗原修复,血清室温封闭后加入一抗CCR5(1∶200)和小胶质细胞标记物IBA1(1∶50),4 ℃ 孵育过夜。弃去一抗,加入Cy3标记的羊抗兔(1∶200)和FITC标记的羊抗小鼠(1∶200)进行室温孵育1 h。弃去二抗,滴加含DAPI的防淬灭封片剂封片。
1.3 统计学分析
利用GraphPad Prism 9.5.0 软件进行数据分析,组间比较采用单因素方差分析,所有数据以均数±标准差表示,当Plt;0.05时认为差异具有统计学意义。
2 结果
2.1 GAS 抑制HIBD新生小鼠胼胝体中CCR5、TNF-α的表达,促进AKT的磷酸化
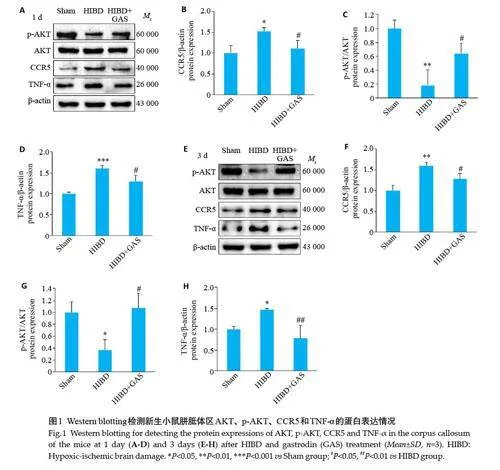
Western blotting结果显示,与Sham组相比,HIBD后1 d和3 d组缺血侧胼胝体区CCR5、TNF-α蛋白表达水平显著升高,p-AKT蛋白表达水平显著降低;而GAS干预后CCR5、TNF-α的表达显著降低,p-AKT的表达显著升高(Plt;0.05,图1)。
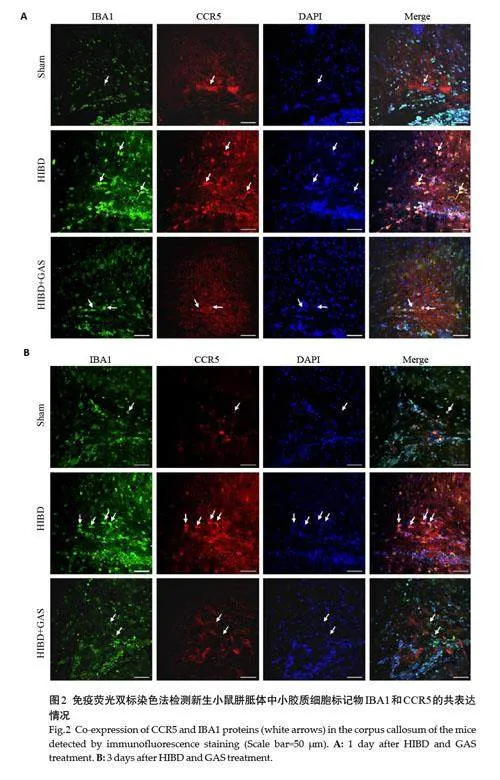
免疫荧光双标染色显示,与Sham组相比,HIBD后1 d、3 d组,新生小鼠胼胝体区小胶质细胞标记物IBA1荧光强度增加。同时,损伤后CCR5 的荧光强度也升高,并且与小胶质细胞共表达增多;而GAS 干预后IBA1及CCR5的荧光强度降低,共表达减少(图2)。
2.2 GAS抑制OGD后BV2小胶质细胞中CCR5、TNF-α和IL-1β的表达,促进AKT的磷酸化
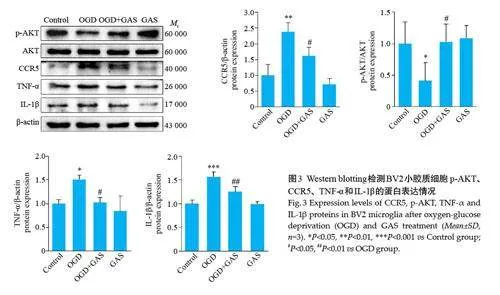
Western blotting 结果显示,与Control 组相比,OGD组中BV2小胶质细胞中CCR5、TNF-α和IL-1β蛋白表达水平显著升高,p-AKT蛋白表达水平显著降低;而GAS干预后CCR5、TNF-α和IL-1β的表达显著降低,p-AKT的表达显著升高(Plt;0.05,图3)。
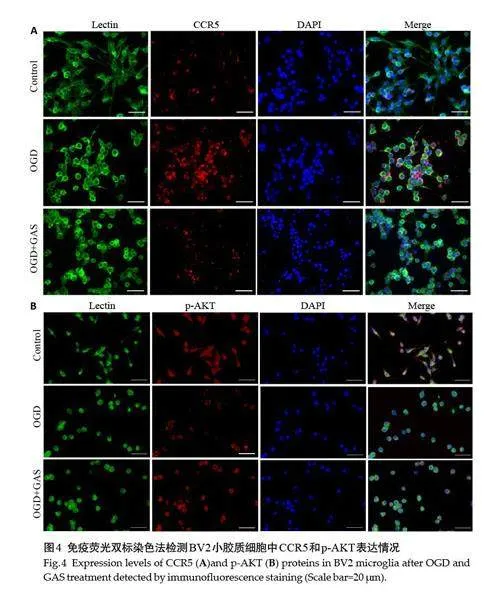
免疫荧光染色结果显示,与Control 组相比,OGD处理后BV2小胶质细胞中CCR5的荧光强度显著增强,p-AKT的荧光强度显著降低;而GAS干预后,CCR5的荧光强度显著降低,p-AKT的荧光强度显著增强(图4)。
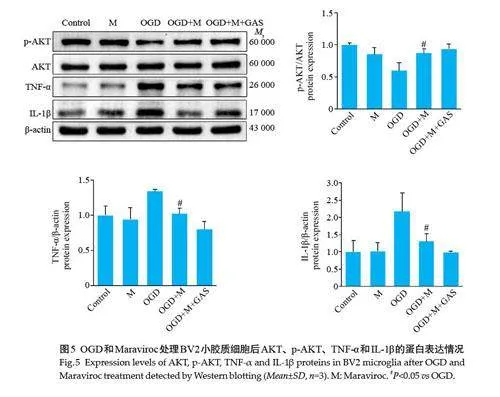
2.3 Maraviroc 抑制OGD后BV2 小胶质细胞中TNF-α和IL-1β的表达,促进AKT的磷酸化
Western blotting结果显示,与OGD组相比,OGD+M组中TNF-α和IL-1β蛋白表达水平显著降低,p-AKT蛋白表达水平显著升高(Plt;0.05,图5);OGD+M组与OGD+M+GAS组的差异没有统计学意义。
3 讨论
HIBD是由各种原因引起的脑组织缺血缺氧导致的脑部病变,最常见的是新生儿缺血缺氧性脑病,这不仅严重危害新生儿的生命,还是导致儿童病残的主要原因之一[20]。围产期缺氧性脑损伤的婴儿若未经治疗,约有18%的患儿可能在22~41月大时出现中度至重度残疾甚至死亡,而及时治疗则可以将这一比率降至5%[21]。HIBD的损伤机制较复杂,目前尚未完全明确。大量研究已表明,缺血缺氧可以激活小胶质细胞迁移到受损部位,一方面增殖、吞噬和清除细胞碎片;另一方面,激活后的小胶质细胞表达并产生大量炎性因子TNF-α、IL-1β和诱导型一氧化氮合酶等细胞毒性物质,加重神经元的损伤[22]。研究表明,在发生脑损伤的C57BL/6新生小鼠胼胝体区中小胶质细胞数量显著增加,而苍白球和内囊区域的小胶质细胞数量没有显著增加,表明新生小鼠的胼胝体区域是小胶质细胞变化较敏感的部位[23]。本研究发现,在新生小鼠HIBD后胼胝体区小胶质细胞聚集以及OGD诱导的BV2 小胶质细胞中炎性因子TNF-α和IL-1β水平均显著上调,提示缺血缺氧后活化的小胶质细胞参与了炎症反应的发生。
CCR5是一种广泛表达于小胶质细胞、星形胶质细胞、单核细胞和神经元的趋化因子受体[24]。研究表明,在感染期间,CCR5配体的增加可导致CCR5过表达和促进细胞募集到病变区域,释放炎性因子,从而放大局部炎症反应,加重损伤[25]。动物研究显示,在多柔比星诱导的认知障碍小鼠中,CCR5及其配体和促炎因子均上升,而腹腔给药CCR5拮抗剂马拉韦罗(Maraviroc)降低了促炎因子的水平,并改善了小鼠穿越Morris水迷宫的神经行为表现[26]。本研究发现,CCR5 在新生小鼠HIBD后脑内胼胝体区激活的小胶质细胞中表达明显增多,且该区域炎性因子TNF-α的表达也显著升高;体外用OGD 诱导BV2 小胶质细胞后,CCR5、IL-1β 和TNF‑α 的表达亦明显增加,而使用Maraviroc 阻断CCR5后炎性因子TNF-α、IL‑1β的表达显著降低,与先前的研究一致。说明缺血缺氧后小胶质细胞中高表达的CCR5 受体与炎症损伤密切相关,但其具体机制尚不明确。
有研究报道,在沉默小鼠原代神经元中CCR5的表达后可影响AKT的磷酸化水平[7]。此外,阻断CCR5可减少小胶质细胞的迁移,且该作用与抑制AKT通路有关[27]。同时,CCR5 拮抗剂Maraviroc 可影响人前列腺癌细胞中磷酸化AKT的表达[28]。这些研究结果提示,CCR5与AKT之间存在相互调节的关系。本研究发现,HIBD后小鼠缺血侧胼胝体及OGD 激活的小胶质细胞中CCR5 表达升高,而磷酸化的AKT表达显著降低。用Maraviroc阻断CCR5受体后发现BV2小胶质细胞中磷酸化的AKT的表达明显上调。说明CCR5/AKT信号亦参与了缺血缺氧性脑损伤的病理生理过程。
天麻素是一种源自中草药天麻的有效成分,在治疗中风和心脑血管疾病方面已有广泛应用。具有抗氧化、抗炎、抑制细胞凋亡的作用。利用小鼠双侧颈总动脉夹闭脑缺血模型,发现天麻素可通过激活NO-cGMPPKG信号通路,使神经元内NO活性显著增加,促进GTP 转化为cGMP 作用于其常见靶点PKG,促进海马神经的发生与增殖,从而使脑缺血后小鼠神经结构和功能损伤得到改善,发挥神经保护作用[29]。课题组前期研究发现,天麻素通过下调Notch 信号通路相关蛋白Notch-1、NICD、RBP-JK和Hes-1表达[30]以及增加Sirt3蛋白的表达[31],抑制小胶质细胞的激活,发挥保护作用。此外,天麻素可调节自噬的PI3K/AKT通路相关蛋白表达的磷酸化,减轻血管性痴呆大鼠的学习和记忆缺陷,改善海马组织学损伤[32]。本研究结果显示,天麻素能够抑制新生小鼠HIBD后胼胝体区小胶质细胞及OGD诱导的BV2 小胶质细胞中CCR5 的过度表达,并促进AKT信号的磷酸化,减少炎症因子的分泌,达到神经保护和抗炎的效果。在体外天麻素与CCR5受体阻断剂Maraviroc联合干预(OGD+M+GAS组)后,与单纯阻断剂组(OGD+M组)相比,p-AKT、TNF-α、IL-1β的表达无明显差异,说明GAS可能通过抑制CCR5 受体促进AKT的磷酸化,从而抑制炎症因子的表达。
综上所述,GAS可能通过靶向CCR5 促进AKT的磷酸化,抑制炎性因子的表达,发挥神经保护作用。本研究与以往研究一致,强调了缺血缺氧导致的炎症反应在HIBD发病机制中的关键作用,探讨了GAS在神经保护和抗炎方面的潜在功效,这为治疗HIBD提供了新的视角。本研究重点关注CCR5/AKT信号通路在HIBD后小胶质细胞介导的炎症反应中的作用及GAS干预的影响,为新生儿缺血缺氧性脑损伤治疗研究提供新的潜在靶点,但本研究也存在不足,未在体内深入研究CCR5在HIBD模型中的作用,这是未来研究的重要方向。我们将探索GAS 干预对CCR5 基因敲除小鼠HIBD模型的影响,进一步探索CCR5/AKT信号通路在HIBD中的具体机制,以及GAS如何通过这一通路发挥作用,这将有助于更精确地定位治疗靶点。
参考文献:
[1] Kamino D, Almazrooei A, Pang EW, et al. Abnormalities in evoked
potentials associated with abnormal glycemia and brain injury in
neonatal hypoxic-ischemic encephalopathy[J]. Clin Neurophysiol,
2021, 132(1): 307-13.
[2] 汤 易, 刘 影. 评估新生儿缺血缺氧性脑损伤MRI的临床应用与研
究进展[J]. 磁共振成像, 2013, 4(3): 228-31.
[3] Sankaran R, Radhakrishnan K, Sundaram K R. Hyperbaric oxygen
therapy in patients with hypoxic ischemic encephalopathy[J].
Neurol India, 2019, 67(3): 728-31.
[4] Parakalan R, Jiang B, Nimmi B, et al. Transcriptome analysis of
amoeboid and ramified microglia isolated from the corpus callosum
of rat brain[J]. BMC Neurosci, 2012, 13: 64.
[5] Pont-Lezica L, Beumer W, Colasse S, et al. Microglia shape corpus
callosum axon tract fasciculation: functional impact of prenatal
inflammation[J]. Eur J Neurosci, 2014, 39(10): 1551-7.
[6] Yao YY, Ling EA, Lu D. Microglia mediated neuroinflammationsignaling
regulation and therapeutic considerations with special
reference to some natural compounds[J]. Histol Histopathol, 2020,
35(11): 1229-50.
[7] Festa BP, Siddiqi FH, Jimenez-Sanchez M, et al. Microglial-toneuronal
CCR5 signaling regulates autophagy in neurodegeneration
[J]. Neuron, 2023, 111(13): 2021-37.
[8] Cowell RM, Xu H, Parent JM, et al. Microglial expression of
chemokine receptor CCR5 during rat forebrain development and
after perinatal hypoxia-ischemia[J]. J Neuroimmunol, 2006, 173(1-
2): 155-65.
[9] Bokhari SM, Yao H, Bethel-Brown C, et al. Morphine enhances Tatinduced
activation in murine microglia[J]. J Neurovirol, 2009, 15
(3): 219-28.
[10]Lin CS, Hsieh PS, Hwang LL, et al. The CCL5/CCR5 axis promotes
vascular smooth muscle cell proliferation and atherogenic
phenotype switching[J]. Cell Physiol Biochem, 2018, 47(2):
707-20.
[11] Li X, Zhang J, Zhu X, et al. Progesterone reduces inflammation and
apoptosis in neonatal rats with hypoxic ischemic brain damage
through the PI3K/Akt pathway[J]. Int J Clin Exp Med, 2015, 8(5):
8197-8203.
[12]Wei ZZ, Zhang JY, Taylor TM, et al. Neuroprotective and
regenerative roles of intranasal Wnt-3a administration after focal
ischemic stroke in mice[J]. J Cereb Blood Flow Metab, 2018, 38(3):
404-21.
[13]Wang Z, Qiu Z, Gao C, et al. 2,5-hexanedione downregulates nerve
growth factor and induces neuron apoptosis in the spinal cord of rats
via inhibition of the PI3K/Akt signaling pathway[J]. PLoS One,
2017, 12(6): e0179388.
[14]Zhang BG, Hu L, Zang MD, et al. Helicobacter pylori CagA induces
tumor suppressor gene hypermethylation by upregulating DNMT1
via AKT-NFkappaB pathway in gastric cancer development[J].
Oncotarget, 2016, 7(9): 9788-800.
[15]王 妍, 阮毓卿, 崔 璨, 等. 交泰丸通过激活PI3K/AKT信号通路改
善阿尔茨海默病模型小鼠大脑的葡萄糖代谢[J]. 南方医科大学学
报, 2024, 44(5): 894-903.
[16]艾艳萍. 天麻素对癫痫合并偏头痛病人血清炎症因子、脑源性神经
营养因子及氧化应激水平的影响[J]. 中西医结合心脑血管病杂志,
2018, 16(11): 1592-5.
[17]Guan J, Wang L, Jin J, et al. Simultaneous determination of
calycosin-7-O-beta-D-glucoside, cinnamic acid, paeoniflorin and
albiflorin in rat plasma by UHPLC-MS/MS and its application to a
pharmacokinetic study of Huangqi Guizhi Wuwu Decoction[J]. J
Pharm Biomed Anal, 2019, 170: 1-7.
[18]Qin B, Luo N, Li Y, et al. Protective effect of gastrodin on peripheral
neuropathy induced by anti-tumor treatment with vincristine in rat
models[J]. Drug Chem Toxicol, 2021, 44(1): 84-91.
[19]Li S, Yang Q, Zhou Z, et al. Gastrodin protects retinal ganglion cells
from ischemic injury by activating phosphatidylinositol 3-kinase/
protein kinase B/nuclear factor erythroid 2-related factor 2 (PI3K/
AKT/Nrf2) signaling pathway[J]. Bioengineered, 2022, 13(5):
12625-36.
[20]Levene ML, Kornberg J, Williams TH. The incidence and severity of
post-asphyxial encephalopathy in full-term infants[J]. Early Hum
Dev, 1985, 11(1): 21-6.
[21]Finer NN, Robertson CM, Richards RT, et al. Hypoxic-ischemic
encephalopathy in term neonates: perinatal factors and outcome[J].
J Pediatr, 1981, 98(1): 112-7.
[22]Yu L, Huang L, Zhao Y, et al. Atorvastatin promotes pro/antiinflammatory
phenotypic transformation of microglia via Wnt/
β‑catenin pathway in hypoxic-ischemic neonatal rats[J]. Mol
Neurobiol, 2024, 61(6): 3559-77.
[23]Renz P, Schoeberlein A, Haesler V, et al. A novel murine multi-Hit
model of perinatal acute diffuse white matter injury recapitulates
major features of human disease[J]. Biomedicines, 2022, 10(11):
2810.
[24]Yan J, Xu W, Lenahan C, et al. CCR5 activation promotes NLRP1-
dependent neuronal pyroptosis via CCR5/PKA/CREB pathway after
intracerebral hemorrhage[J]. Stroke, 2021, 52(12): 4021-32.
[25]Martin-Blondel G, Brassat D, Bauer J, et al. CCR5 blockade for
neuroinflammatory diseases-beyond control of HIV[J]. Nat Rev
Neurol, 2016, 12(2): 95-105.
[26]Wu Y, Che J, Dong J, et al. CCR5 antagonist maraviroc alleviates
doxorubicin-induced neuroinflammation and neurobehavioral
deficiency by regulating NF-κB/NLRP3 signaling in a breast cancer
mouse model[J]. Neuropharmacology, 2024, 254: 109981.
[27]Laudati E, Curro D, Navarra P, et al. Blockade of CCR5 receptor
prevents M2 microglia phenotype in a microglia-glioma paradigm
[J]. Neurochem Int, 2017, 108: 100-8.
[28]Xiong Z, Yu S, Xie Z, et al. Cancer-associated fibroblasts promote
enzalutamide resistance and PD-L1 expression in prostate cancer
through CCL5-CCR5 paracrine axis[J]. iScience, 2024, 27(5):
109674.
[29]校 欢, 马晓娇, 承欧梅, 等. NO-cGMP-PKG信号通路在天麻素促进
脑缺血后海马神经发生中的作用[J]. 中国中药杂志, 2019, 44(24):
5451-6.
[30]吴 芳, 左涵珺, 任雪琪, 等. 天麻素对氧糖剥夺诱导的小胶质细胞
Notch信号通路的影响[J]. 神经解剖学杂志, 2022, 38(1): 38-44.
[31]Guo J, Zhang XL, Bao Z R, et al. Gastrodin regulates the Notch
signaling pathway and Sirt3 in activated microglia in cerebral
hypoxic-Ischemia neonatal rats and in activated BV-2 microglia[J].
Neuromolecular Med, 2021, 23(3): 348-62.
[32]Chen YX, Yang H, Wang DS, et al. Gastrodin relieves cognitive
impairment by regulating autophagy via PI3K/AKT signaling
pathway in vascular dementia[J]. Biochem Biophys Res Commun,
2023, 671: 246-54.
(编辑:吴锦雅)

