马瑟兰葡萄果实生长发育和品质变化的转录组分析

摘要:【目的】探究酿酒葡萄品种马瑟兰果实生长发育过程中的品质变化,挖掘关键的生长发育及果实品质调控基因,为马瑟兰葡萄栽培措施的精准制定和果实品质提高提供理论依据。【方法】以贺兰山东麓马瑟兰葡萄为试验材料,采集花后20 d、花后45 d、花后75 d及花后100 d不同发育阶段的葡萄果实,测量果粒横径和纵径,测定果实可溶性固形物、总糖、可滴定酸和总酚含量,并进行转录组测序分析。【结果】随着马瑟兰葡萄果实生长发育,果实色泽加深、果粒体积增大,果实可溶性固形物和总糖含量逐渐上升,可滴定酸含量逐渐下降,总酚含量在花后20 d至花后75 d期间逐渐下降而在花后75 d至花后100 d期间略有上升。从不同发育阶段葡萄果实间共筛选到33517个DEGs,花后45 d与花后20 d比较组、花后75 d与花后45 d比较组、花后100 d与花后75 d比较组共有的DEGs为3976个。GO功能注释分析结果表明,各比较组DEGs主要注释到细胞器、细胞膜、含蛋白复合物、细胞过程和代谢过程等功能条目。KEGG信号通路富集分析结果表明,氨基酸的生物合成、糖酵解/糖异生及类黄酮生物合成等是马瑟兰葡萄果实发育过程中的重要信号通路。从富集在类黄酮生物合成信号通路的DEGs中,发现查耳酮合成酶基因(CHS)和黄烷酮-3-羟化酶基因(F3H)均在花后45 d至75 d期间上调表达,F3H在花后75 d至花后100 d期间下调表达,表明CHS与F3H基因在马瑟兰葡萄果皮着色中起重要调控作用。【结论】马瑟兰葡萄生长发育过程中伴随着果实色泽加深、果粒体积增大和生化成分的动态变化。类黄酮生物合成信号通路在葡萄转色过程中起重要作用,CHS和F3H基因影响马瑟兰葡萄果实着色及品质形成。
关键词:马瑟兰;酿酒葡萄;果实品质;转录组测序
中图分类号:S663.1文献标志码:A文章编号:2095-1191(2024)08-2310-10
Transcriptome analysis of growth,development,and quality changes in Marselan grape berries
FU Guang-qing LIU Jia-ning YANG Yu-xian WANG Bo REN Yan-hua SHANGGUAN Ling-fei FANG Jing-gui ZHANG Jun-xiang3*,WANG Xi-cheng1*
(1Jiangsu Academy of Agricultural Sciences,Nanjing,Jiangsu 210014,China;2College of Horticulture,NanjingAgricultural University,Nanjing,Jiangsu 210095,China;3College of Enology and Horticulture,Ningxia University,Yinchuan,Ningxia 75002 China)
Abstract:【Objective】The study aimed to study the quality changes during the berry growth and development of wine grape variety Marselan,and to identify key genes regulating growth,development,and berry quality,providing theoreti-cal basis for the precise formulation of cultivation practices and the improvement of berry quality.【Method】Marselan grapes from the eastern foothills of Helan Mountain were used as experimental materials.Grape berries were collelddplbVYT8wxK9Rgvxo3Fm3ABqUaULeMQa6tFwO3d3A=cted at 20,45,75 and 100 d after flowering at different developmental stages.The transverse and longitudinal diameters of the berries were measured,and the contents of soluble solids,total sugar,titratable acid and total phenolics were determined.Transcriptome sequencing analysis was also conducted.【Result】As the Marselan grape berries developed,their color deepened and berry size increased.The berry soluble solid content and total sugar content gradually rose,while the titrata-ble acid content gradually decreased.The total phenolic content decreased from 20 d to 75 d after flowering,but slightly increased between 75 d and 100 d after flowering.A total of 33517 DEGs were identified among grape berries at different developmental stages,with 3976 DEGs shared between the comparison groups of 45 d after flowering versus 20 d after flowering,75 d after flowering versus 45 dafter flowering,and 100 d after flowering versus 75 d after flowering.The re-sults of GO functional annotation analysis showed that the DEGs in each comparison group were mainly annotated to func-tional categories such as organelles,cell membranes,protein-containing complexes,cellular processes and metabolic pro-cesses.The results of KEGG signaling pathway enrichment analysis showed that amino acid biosynthesis,glycolysis/glu-coneogenesis and flavonoid biosynthesis were important signaling pathways during the development of Marselan grape berries.Among the DEGs enriched in the flavonoid biosynthesis signaling pathway,it was found that the chalcone syn-thase gene(CHS)and flavanone-3-hydroxylase gene(F3H)were up-regulated from 45 d to 75 d after flowering and down-regulated from 75 d to 100 d after flowering,suggesting that the CHS and F3H genes played important regulatory roles in the coloration of Marselan grape skin.【Conclusion】The growth and development of Marselan grapes are accom-panied by the deepening of fruit color,enlargement of berry size,and dynamic changes in biochemical components.The flavonoid biosynthesis signaling pathway plays an important role in the color transition process of grapes,and the CHS and F3H genes have influence on the coloration and quality formation of Marselan grape berries.
Key words:Marselan;wine grape;berry quality;transcriptome sequencing
Foundation items:National Key Research and Development Program of China(2019YFD1002500);Ningxia Key Research and Development Project(2023BCF01001)
0引言
【研究意义】贺兰山东麓葡萄酒产区的环境气候条件十分有利于酿酒葡萄品质的形成(宋希贤等,2019),是最适宜种植酿酒葡萄和酿造优质葡萄酒的产区之一。马瑟兰葡萄(Vitis vinifera cv.Marselan)原产于法国,是世界知名酿酒葡萄品种,有抗菌、耐旱、糖度高等特点,因独特的品质深受消费者青睐(郭志君等,2023)。目前,宁夏的马瑟兰葡萄种植面积近2800 ha,占全国马瑟兰葡萄种植总面积的65%以上;宁夏酿酒葡萄种植面积3.5万ha,约占全国酿酒葡萄种植总面积的35%(陈光宇,2023)。因此,开展贺兰山东麓马瑟兰酿酒葡萄品质特征分析,对提高该产区葡萄与葡萄酒辨识度、促进葡萄产业发展具有重要意义。【前人研究进展】葡萄的适应性较强,但在不同生态区域的发育特点存在差异,果实品质也有一定差异,这些差异是影响各产区葡萄酒风格的主要因素(Ilieva et al.,2016;许泽华等,2023)。葡萄果实在收获时的生化组成,包括在成熟过程中积累的初级和次级代谢物对葡萄酒的特性有深远影响(杜远鹏等,2022)。研究各葡萄酒产区的葡萄果实发育特点及品质形成规律,有助于制定科学高效的酿酒葡萄栽培管理措施(魏世超,2021)。葡萄果实品质中,糖、酸、香气等性状被重点关注,了解果实生长发育过程中的品质性状动态变化对指导生产栽培有重要意义(王梦婷,2022)。葡萄果实发育的特点是初始阶段果实小、坚硬且呈酸性,随后为转色期停滞阶段,最后阶段果实变大、变软、变甜并积累一系列感官化合物(Sweetman et al.,2012)。果实发育的实际过程还受大量基因调控,酿酒葡萄设拉子和霞多丽果实发育过程中黄酮醇的合成和黄酮醇合酶基因的表达影响其品质(Downeyetal.,2003);MYB转录因子家族基因如VvmybA1在调节葡萄果皮花青素生物合成及控制果色方面发挥重要作用(Azuma et al.,2008);遮荫处理可下调马瑟兰葡萄花青素合成酶基因(CHS、CHI、DFR、F3H、LDOX、F3'5'H)的表达和下调光诱导型花青苷合成调控基因(VvMYB30、VvbHLH79、VvbHLH121)的表达,从而降低花青素含量(Ma etal.,2019);VviRTIC1和VviRTIC2基因控制黑比诺家族2个葡萄品种浆果发育时间(Theine et al.,2021)。深度测序技术的发展及日渐准确的葡萄可用性基因组和转录组数据,为进行葡萄果实不同发育阶段转录组分析提供了基础。转录组测序是当今果树学领域基因表达研究及功能分析的重要技术(贾昌路等,2015),对深入了解果树发育机理及解析相关性状形成的分子机制有重要作用。孙红等(2017)研究长期低盐处理对葡萄果实品质及转录组的影响,结果发现长期低盐处理显著降低果皮花青素含量,轻微降低果肉可溶性固形物含量,显著降低葡萄糖和果糖含量;刘帅等(2021)基于转录组研究光质对转色期红地球葡萄果实着色及品质的影响,分析影响葡萄着色及品质的因素并挖掘出关键的光调控基因。【本研究切入点】转录组测序技术在葡萄果实品质形成相关研究的应用已较成熟,而有关贺兰山东麓马瑟兰葡萄果实生长发育过程中的表型和品质变化及转录组分析尚未见报道。【拟解决的关键问题】以贺兰山东麓马瑟兰葡萄为试验材料,采集不同发育阶段的果实,测定其生理生化指标并进行转录组测序分析,探究马瑟兰葡萄果实生长发育过程中的品质变化,挖掘关键的生长发育及果实品质调控基因,为马瑟兰葡萄栽培措施的精准制定和果实品质提高提供理论依据。
1材料与方法
1.1样品采集
采样地点为宁夏银川贺兰山东麓国家葡萄酒地理标志保护区西夏王葡萄种植基地(38°24′N,106°03′E),选取树龄12年左右、长势相近的马瑟兰葡萄植株,均采用“厂”字形栽培架势种植,株行距1.5 m×2.0 m,按酒庄标准管理。于2021年6—9月分别采集花后20 d(幼果期,标记为F)、花后45 d(绿果期,标记为E)、花后75 d(转色期,标记为V)和花后100 d(成熟期,标记为M)的葡萄果实,每个阶段选取9株树势中等、生长情况相对一致的葡萄植株,每3株为1个生物学重复,从每个生物学重复的试验植株上随机选取5穗葡萄,从每穗葡萄的不同部位随机选取20粒浆果,每个样品共100粒浆果。葡萄浆果采摘后立即在液氮中冷冻并迅速送至实验室,每个样品随机选取60粒浆果,其中30粒浆果用于测定生理指标,另外30粒浆果用于提取总RNA进行转录组分析。
1.2生理指标测定
使用游标卡尺测量葡萄不同发育阶段的果粒横径和纵径,利用分析天平测定单果重,采用手持糖度计(PAL- 日本ATAGO公司)测定果实可溶性固形物含量,采用0.1 mol/L氢氧化钠滴定液测定可滴定酸含量,参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的费林试剂热滴定法测定总糖含量。采用高效液相色谱法(HPLC)测定葡萄不同发育阶段的果实总酚含量(Kennedy and Jones,2001)及花后100 d成熟果实中的糖组分和酸组分,使用1260型高效液相色谱仪(美国Agilent公司)进行分析。
1.3总RNA提取和转录组测序
各发育阶段葡萄样品分别取80 mg组织置于液氮中研磨,每个样品设3个生物学重复,将样品粉末转移至1.5 mL的65℃预热CTAB-pBIOZOL试剂中,65℃水浴恒温处理15 min,4℃下12000×g离心5 min;取上清液加入400μL氯仿,4℃下12000×g离心10 min;取上清液转移至新的2.0 mL离心管,加入700μL酸酚和200μL氯仿,4℃下12000×g离心10 min;加入等体积的氯仿,4℃下12000×g离心10 min;取上清液加入等体积的异丙醇,-20℃静置2 h进行沉淀;4℃下12000×g离心20 min,弃上清;最后用1 mL 75%乙醇清洗沉淀,置于生物安全柜中风干后加入50µL DEPC水溶解。提取的总RNA使用NanoDrop Eight分光光度计(美国ThermoFisher Scientific公司)和Agilent 2100生物分析仪(美国Agilent公司)进行检测。RNA检测合格后,按照CloneMinerTM II cDNA文库构建试剂盒(美国Ther-moFisher Scientific公司)说明构建cDNA文库,文库质量检测合格后,委托深圳华大基因科技有限公司采用DNBSEQ平台进行测序。
1.4测序数据分析
对测序获得的原始序列(Raw reads)进行质量控制,获得有效序列(Clean reads),利用HISAT2将Clean reads与参考基因组序列(http://plants.ensembl.org/Vitis_vinifera/Info/Index)进行比对。通过FPKM(Fragments per kilobases per millionreads)计算基因表达水平,利用DESeq2进行差异表达分析,以|log2 Fold Change|≥1且错误发现率(FDR)<0.05为标准,筛选出不同发育阶段样品间的差异表达基因(DEGs)。根据DEGs在染色体上的位置,使用Circos绘制DEGs染色体定位图。采用GO和KEGG数据库,对DEGs进行GO功能注释分析和KEGG信号通路富集分析。
1.5统计分析
利用SPSS 26.0进行单因素方差分析(One-way ANOVA),采用Duncan’s法进行多重比较,采用Excel 2021绘图。
2结果与分析
2.1不同发育阶段葡萄果实生理生化指标变化
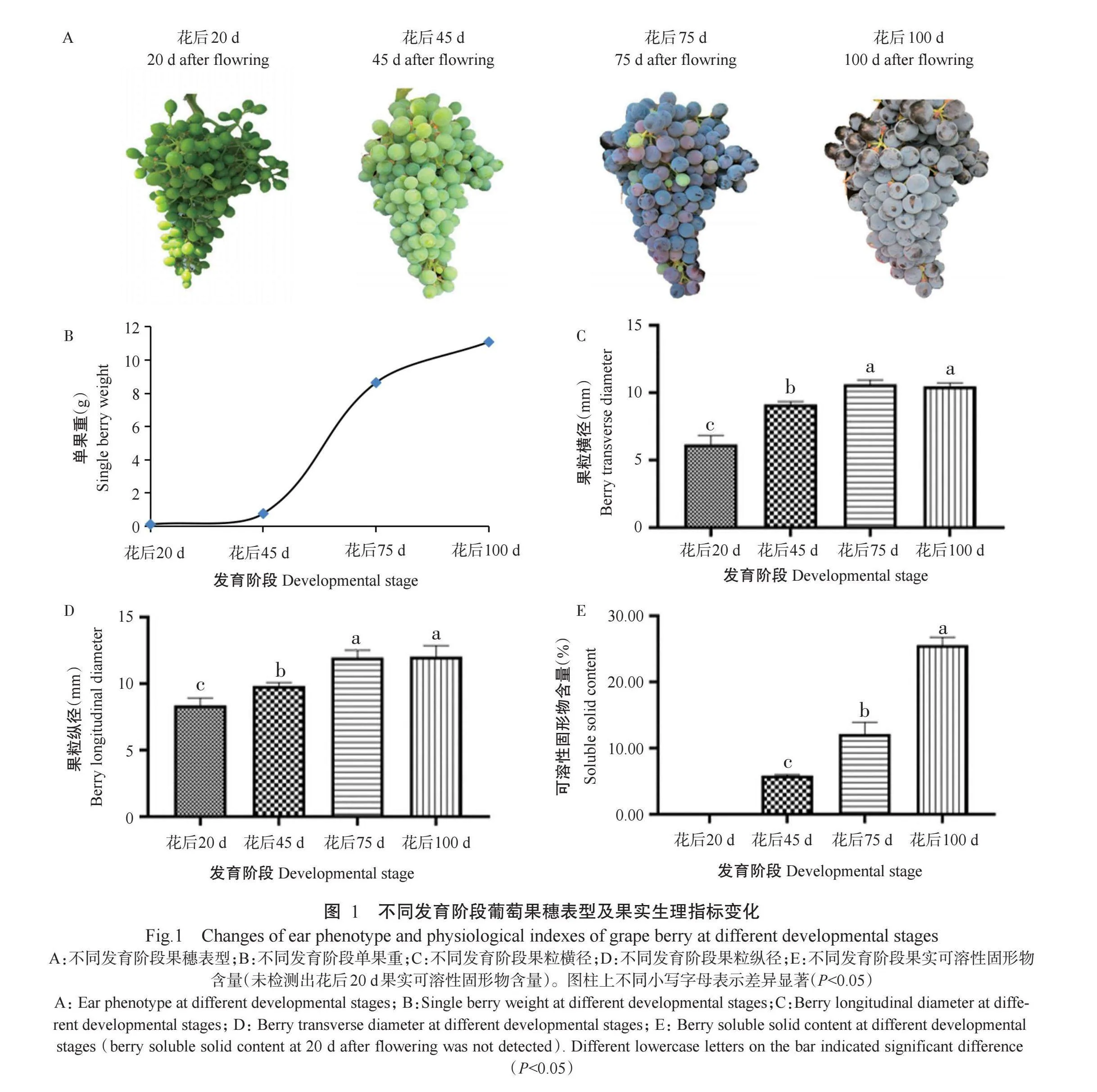
随着葡萄果实生长发育,果穗表型及果粒横径、果粒纵径、单果重等生理指标均发生明显变化。花后20 d至花后100d的各阶段果穗表型变化如图1-A所示,随着发育阶段的推移,果实色泽加深、果粒体积增大。随着葡萄果实发育,单果重在花后20 d至花后75 d迅速增加,花后75 d至花后100 d增速放缓,总体呈S形曲线(图1-B)。随着发育阶段的推移,花后45 d与花后75 d的果粒横径、果粒纵径均较前一阶段显著增加(r<0.05,下同)(图1-C和图1-D)。
葡萄果实可溶性固形物含量随着生长发育逐渐上升,花后75 d至花后100d期间增幅较大,与花后45 d相比,花后100 d的果实可溶性固形物含量显著增加4.36倍(图1-E)。
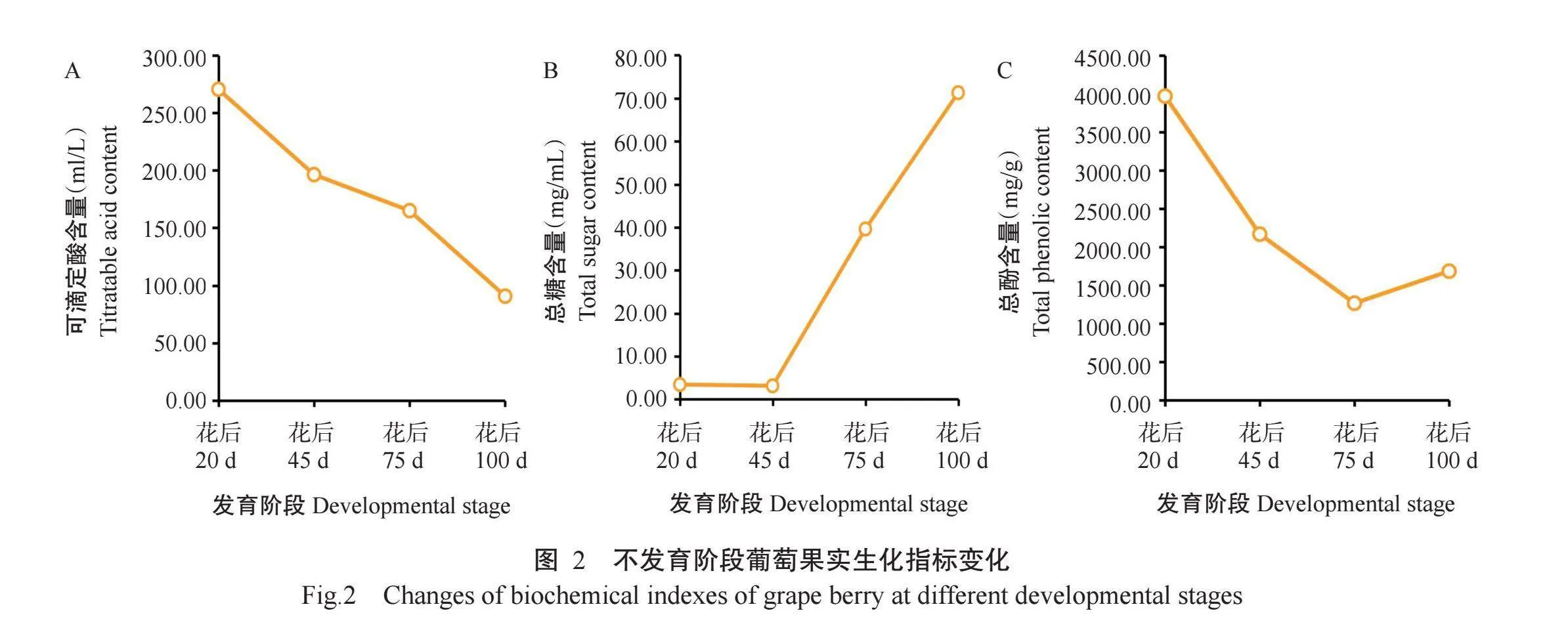
葡萄果实的可滴定酸含量随着生长发育逐渐下降(图2-A)。果实的总糖含量从花后45d开始大量积累(图2-B),与可溶性固形物含量的变化趋势一致。果实总酚含量在花后20 d至花后75d期间逐渐下降,而在花后75 d至花后100d期间略有上升(图2-C),这可能与果实发育后期,种子发育成熟有关。
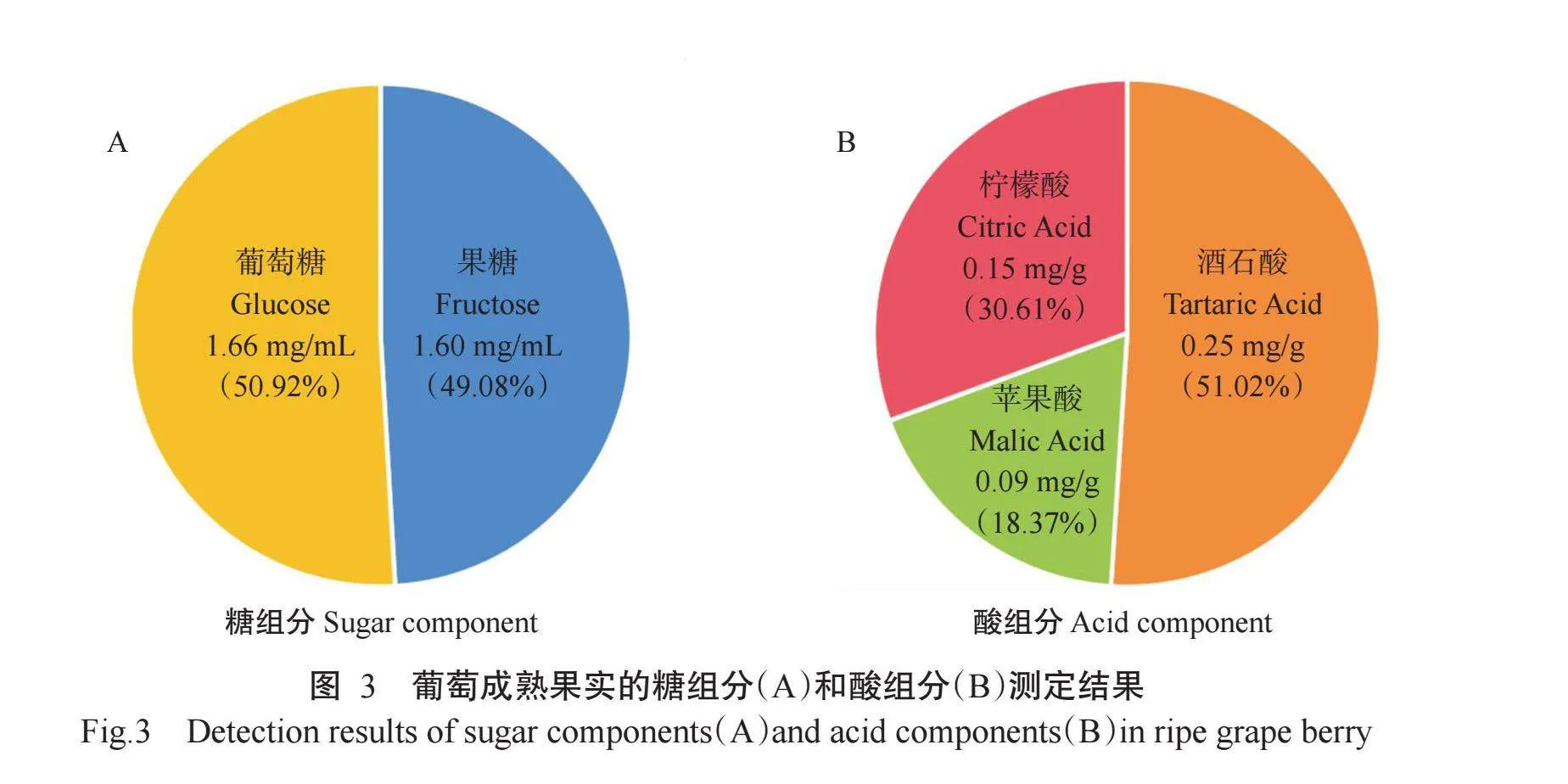
花后100 d是葡萄果实成熟阶段,此时马瑟兰葡萄果实中的果糖和葡萄糖含量分别为1.60和1.66 mg/mL,二者比例约为1∶1(图3-A)。果实中有机酸组分主要有酒石酸、苹果酸和柠檬酸;其中酒石酸含量为0.25 mg/g,比例最大;苹果酸和柠檬酸含量分别为0.09和0.15 mg/g,比例较小(图3-B)。
2.2转录组测序分析结果
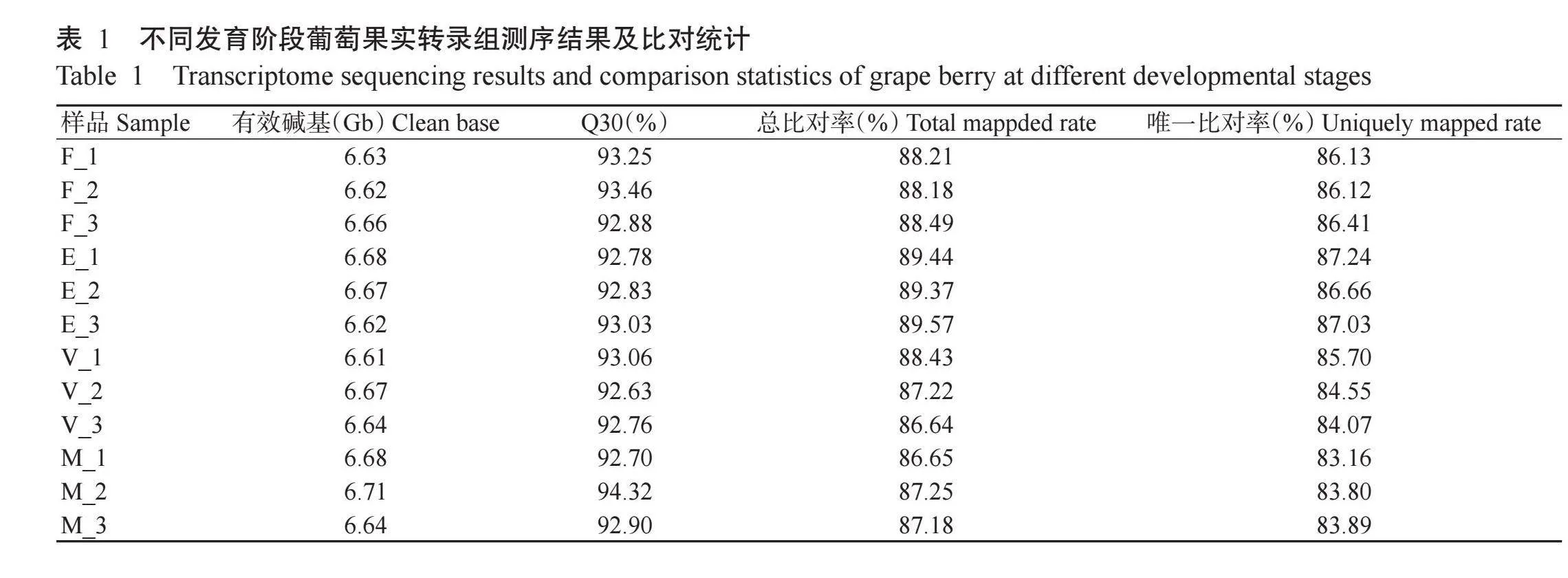
使用DNBSEQ平台对花后20 d(F)、花后45 d(E)、花后75 d(V)和花后100 d(M)的马瑟兰葡萄果实样品进行转录组测序,各样品有效碱基为6.61~6.71 Gb,Q30为92.63%~94.32%。将各样品的Cleanreads与参考基因组序列进行比对,其中86.64%~89.57%比对到参考基因组,83.16%~87.24%比对到唯一位置。综上所述,转录组测序数据质量较好,可用于后续分析。
2.3不同发育阶段葡萄果实间DEGs分析结果
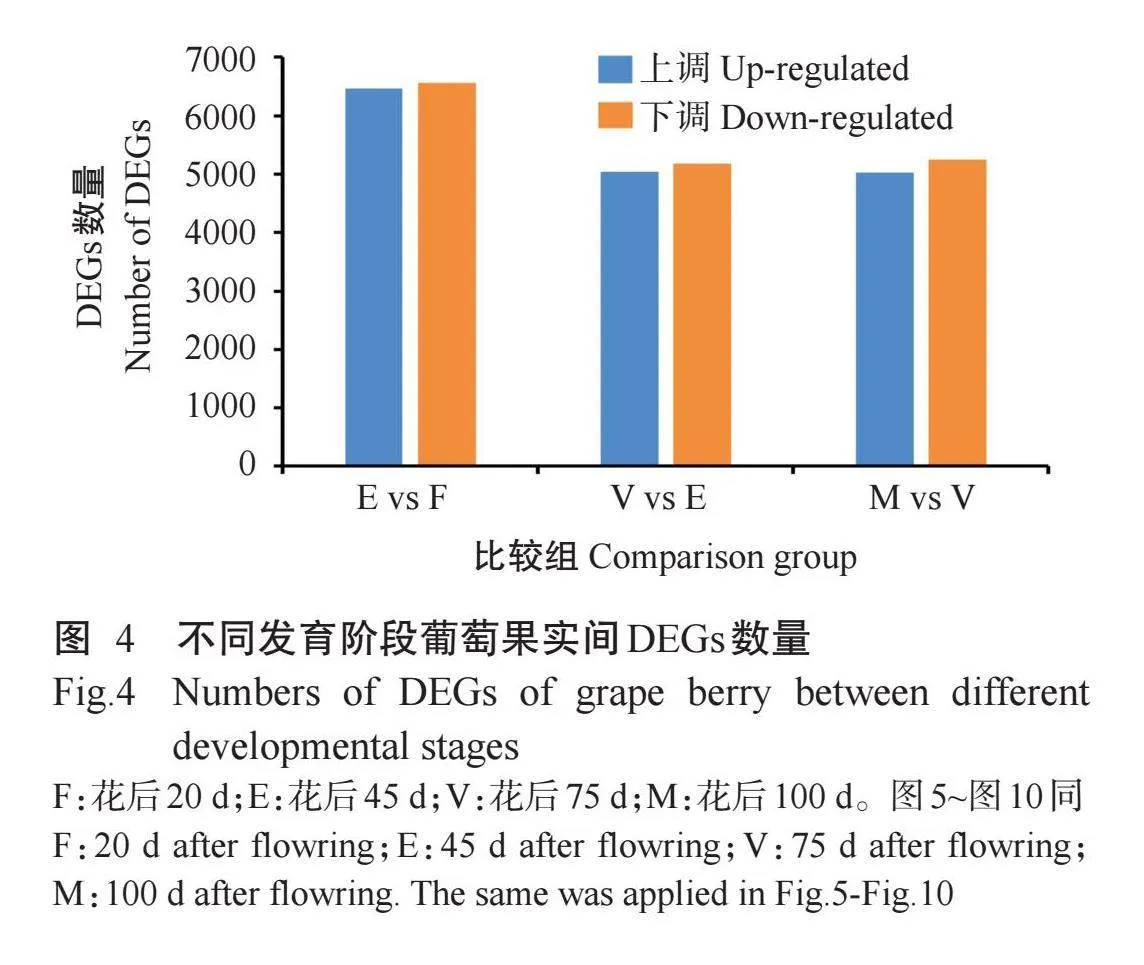
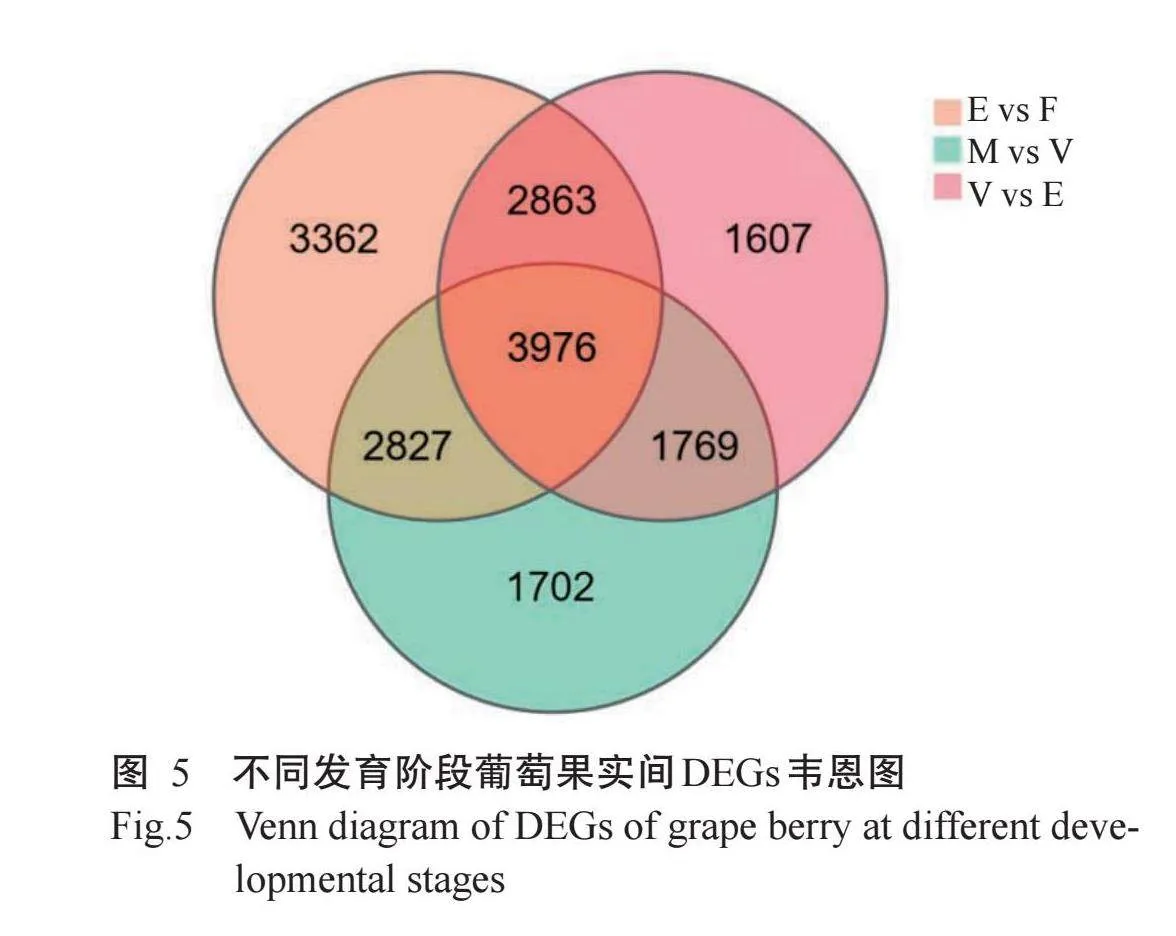
对葡萄果实不同发育阶段基因差异表达情况进行统计,结果如图4所示,共检测到33517个DEGs,其中花后45 d与花后20 d比较组(E vs F)有13028个DEGs,包括6469个上调DEGs及6559个下调DEGs;花后75 d与花后45 d比较组(V vs E)有5035个上调DEGs,5180个下调DEGs,共10215个DEGs;花后100 d与花后75 d比较组(M vs V)的DEGs数量为10274个,其中5028个上调,5246个下调。结果表明,花后45 d与花后20 d比较组的DEGs数量最多,该时期葡萄果实发育可能受大量DEGs调控,随着生长发育的逐步稳定,花后75 d与花后45 d比较组、花后100 d与花后75d比较组的DEGs数量减少。
不同发育阶段葡萄果实间DEGs韦恩图如图5所示,3个比较组的共有DEGs为3976个,花后45d与花后20d比较组的特有DEGs为3362个,花后75d与花后45 d比较组的特有DEGs为1607个,花后100 d与花后75 d比较组的特有DEGs为1702个。这些DEGs可能在葡萄果实的生长发育过程中发挥重要作用。
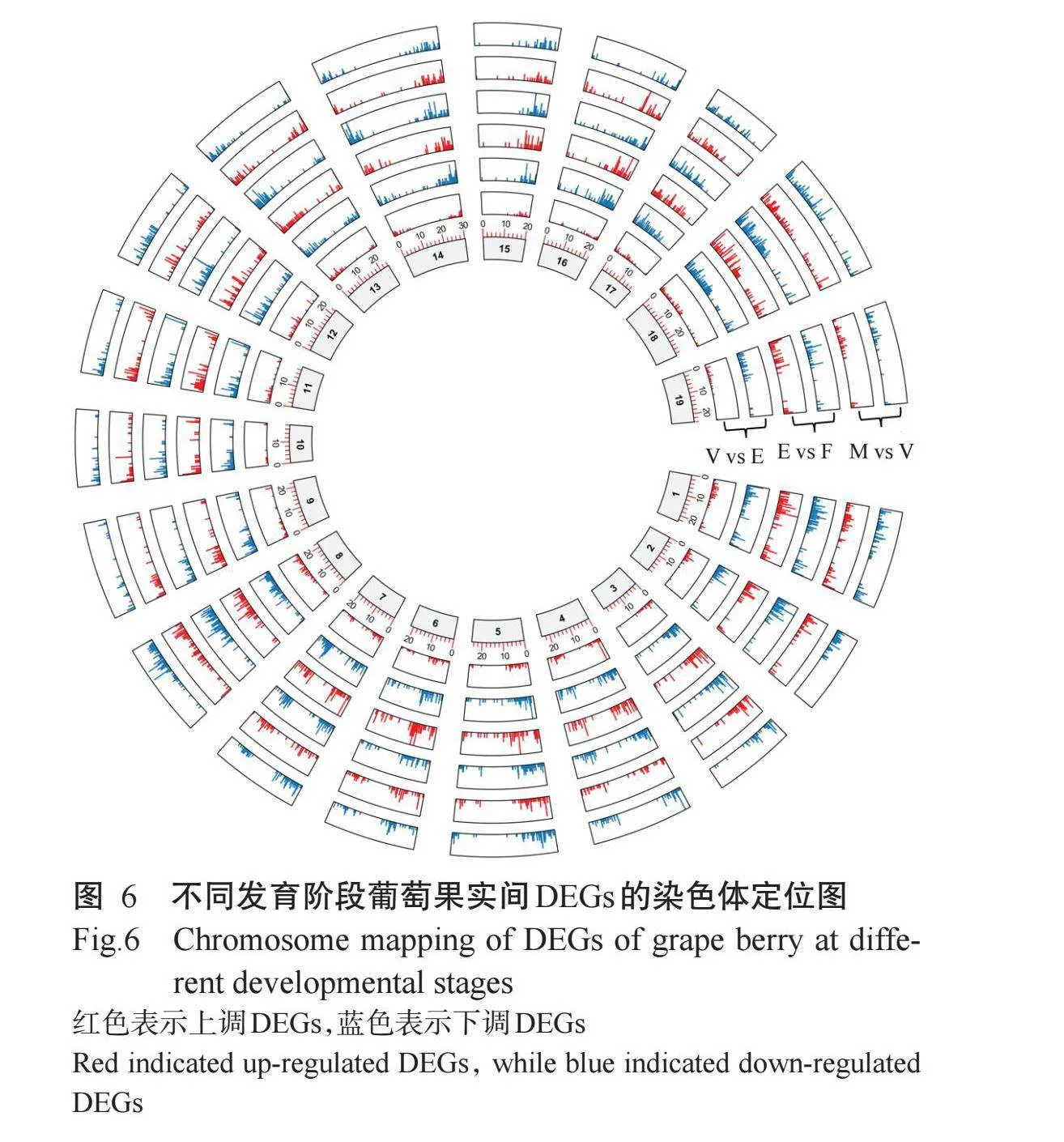
为进一步明确各染色体上DEGs的分布信息,绘制DEGs染色体定位图,图6显示了马瑟兰葡萄果实不同发育阶段DEGs的分布模式,从外到内的6个同心圆分别代表了不同发育阶段比较组的DEGs定位,花后45 d与花后20d比较组分布在各染色体上的DEGs数量较多,共12017个,花后100 d与花后75 d比较组分布在各染色体上的DEGs较少,共11705个。
DEGs在马瑟兰葡萄19条染色体上均有分布,其中分布在18号染色体上的DEGs数量最多,3个比较组分别有945、941和935个;分布在8号和14号染色体上的DEGs数量较多,3个比较组的数量范围在806~899个。分布在19号染色体上的DEGs数量较少,花后100 d与花后75 d比较组有383个,其余2个比较组分别为548和544个;分布在10号和15号染色体上的DEGs数量较少,3个比较组的数量范围在395~429个。
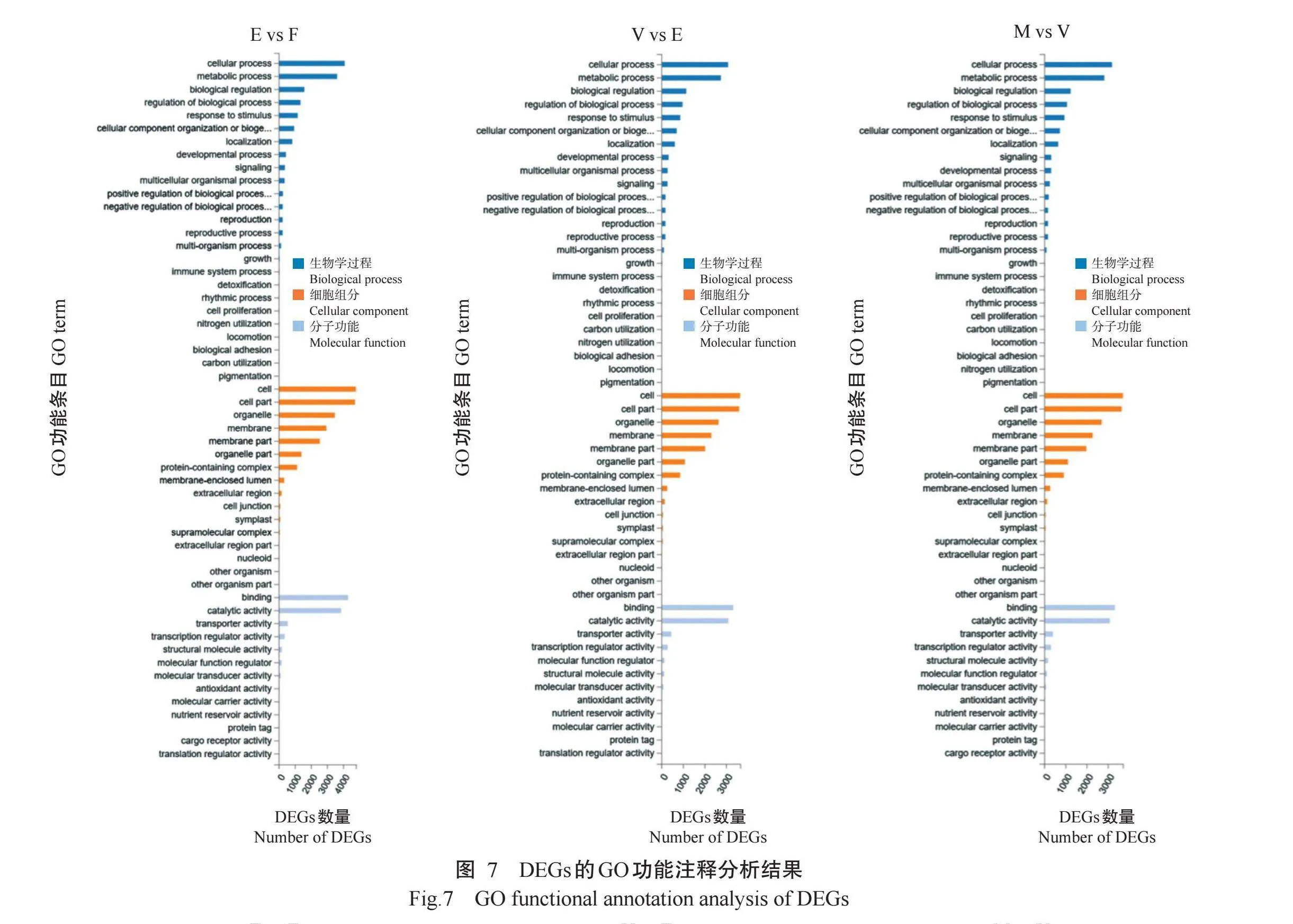
2.4 DEGs的GO功能注释和KEGG信号通路富集分析结果
对各比较组间DEGs进行GO功能注释分析,结果如图7所示,DEGs注释到生物学过程(Biological process)、细胞组分(Cellular component)和分子功能(Molecular function)3个一级条目。在细胞组分中,多数DEGs注释到细胞器(Organelle)、细胞膜(Mem-brane)、含蛋白复合物(Protein-containing complex)等功能条目,这些细胞区域与果实发育成熟相关;在生物学过程中,DEGs主要注释到细胞过程(Cellular process)和代谢过程(Metabolic process)功能条目;在分子功能中,涉及结合(Binding)和催化活性(Cata-lytic activity)功能条目,主要与果实的生长发育有关。
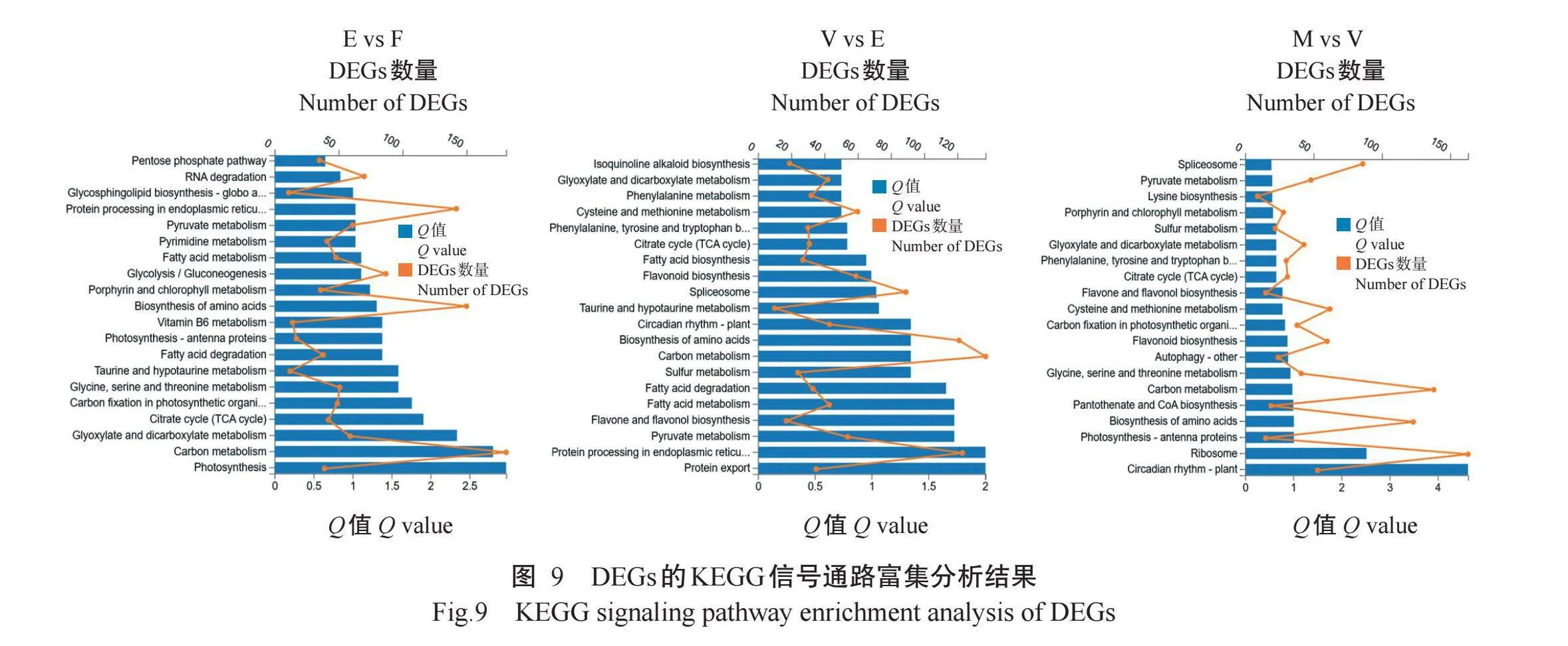
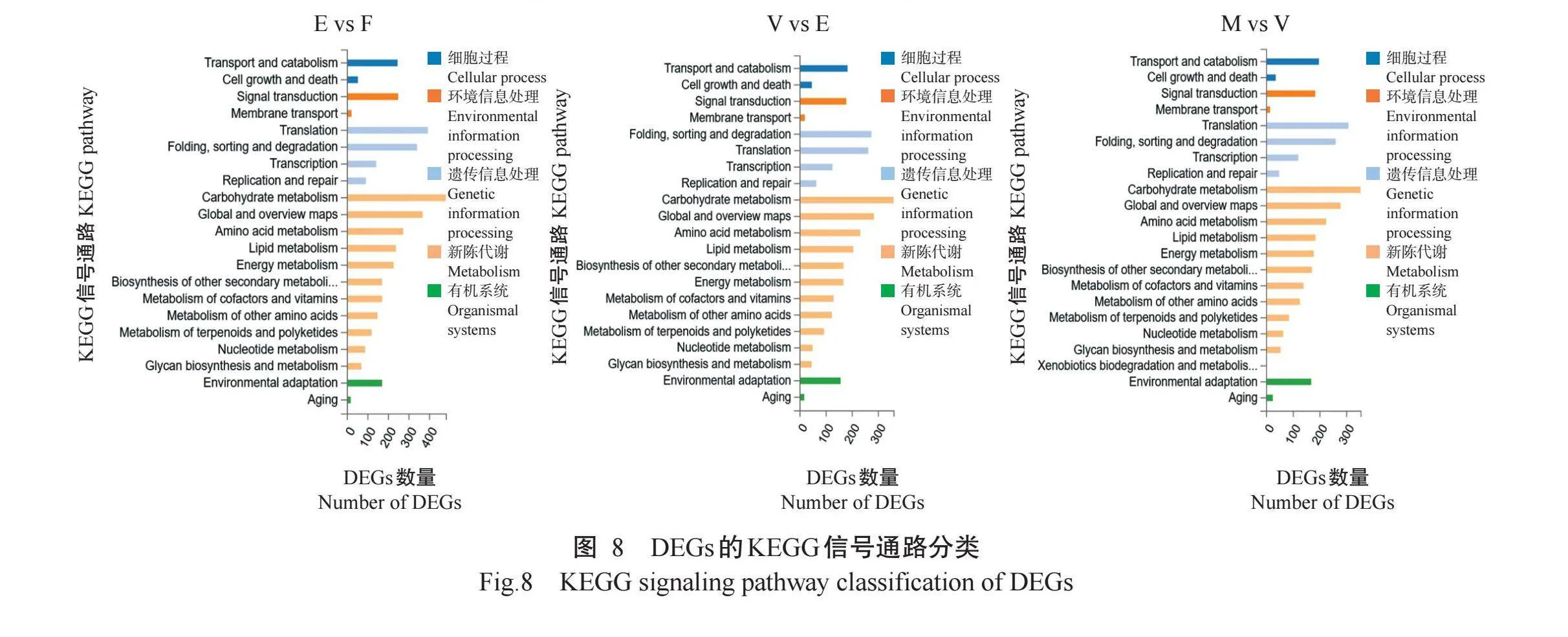
为了解DEGs参与的代谢途径及生物学功能,对各比较组DEGs涉及的KEGG信号通路进行分析。KEGG信号通路分类如图8所示,多数DEGs注释到的信号通路与细胞过程(Cellular processes)、环境信息处理(Environmental information processing)、遗传信息处理(Genetic information processing)、新陈代谢(Metabolism)和有机系统(Organismal systems)等紧密相关。进一步对DEGs进行KEGG信号通路富集分析,结果(图9)显示,在花后45d与花后20d比较组中,DEGs显著富集在氨基酸的生物合成(Bio-synthesis of amino acids)、糖酵解/糖异生(Glycolysis/gluconeogenesis)、脂肪酸代谢(Fatty acid metabo-lism)、嘧啶代谢(Pyrimidine metabolism)、丙酮酸代谢(Pyruvate metabolism)及蛋白质在内质网中的加工过程(Protein processing in the endoplasmic reticu-lum)等信号通路,表明在花后20 d至花后45d期间,葡萄果实充分积累营养物质以供给生长发育。在花后75 d与花后45d比较组中,DEGs在类黄酮生物合成(Flavonoid biosynthesis)信号通路显著富集,这与转色这一生物学过程密切相关,此外,DEGs还在丙酮酸代谢、黄酮和黄酮醇的生物合成(Flavone and flavonol biosynthesis)及脂肪酸代谢等信号通路显著富集,这与转色过程中的果实品质形成相吻合。
葡萄果皮着色与类黄酮这一重要的次生代谢产物密切相关。由KEGG信号通路富集分析结果可知,花后75 d与花后45 d比较组、花后100 d与花后75 d比较组的DEGs均在类黄酮生物XSSxVNK8sBXm6AI5Wjd3Mg==合成信号通路显著富集(图9)。查耳酮合酶(Chalcone synthase,CHS)由CHS基因编码,在类黄酮合成途径中发挥重要作用。从富集在类黄酮生物合成信号通路的DEGs中筛选出2个与马瑟兰葡萄果实发育过程有关的CHS基因。分别为CHS1(LOC100263443)和CHS2(LOC 100232843),均在花后45 d至花后75 d期间上调表达(图10),推测可导致类黄酮合成增多。黄烷酮-3-羟化酶(Flavanone-3-hydroxylase,F3H)也是类黄酮合成途径中重要的合成酶,其调控基因F3H(LOC 100233079)也在花后45 d至花后75 d期间上调表达,在花后75 d至花后100d期间下调表达,结果表明CHS和F3H基因在马瑟兰葡萄果皮着色过程中起重要的调控作用。
3讨论
本研究中,随着发育阶段的推移,马瑟兰葡萄果实可溶性固形物含量等品质变化十分明显,了解其果实生长发育动态变化的分子机制对提高马瑟兰葡萄果实品质有重要意义。目前,已有不少有关葡萄果实发育转录组分析的研究(da Silva et al.,2005;Ma etal.,2020)。Sweetman等(2012)对花后3周(幼果期)、花后10周和花后11周(相当于转色期早期和晚期)及花后17周(成熟期)的设拉子葡萄进行转录组测序,结果发现4185个在单个发育阶段上调的转录本,包括161个转录因子,根据不同的转录模式对转录本进行聚类发现有机酸、芪类化合物和萜类化合物代谢等代谢途径具有协调性,在苯丙烷/芪类化合物生物合成途径中,与转色期和未成熟浆果相比,成熟浆果中至少有46种转录产物上调,并在单个样品中检测到12种萜烯合酶。本研究从不同发育阶段葡萄果实转录组中筛选出33517个DEGs,各比较组共有的DEGs为3976个;多数DEGs显著富集在与果实发育成熟相关的信号通路,如氨基酸的生物合成、糖酵解/糖异生、脂肪酸代谢、类黄酮生物合成等。类黄酮生物合成是重要的次生代谢产物形成途径,查耳酮、黄酮醇、花青素等次生代谢产物是葡萄品质形成的基础(Petrussaetal.,2013)。色泽也是评价葡萄果实成熟度的重要依据,有研究报道糖类可诱导葡萄浆果中花青素的积累和F3H基因的表达,F3H基因在花青素的生物合成中起关键作用,糖类还可增加其他植物中花青素的积累和F3H基因的表达(Zhenget al.,2009);本研究结果与上述研究结果相符,马瑟兰葡萄果实的可溶性固形物含量随着发育阶段的推移呈上升趋势,F3H基因在花后45 d至花后75 d期间上调表达。CHS催化花青素生物合成,花青素也是影响葡萄酒品质的重要因素(Goto-Yamamoto et al.,2002),Harris等(2013)研究发现葡萄3个VvCHS基因的转录水平与浆果皮中花青素含量的增加相关,表明其在花青素合成中发挥关键作用。本研究从不同发育阶段葡萄果实间DEGs中筛选出2个参与马瑟兰葡萄果实发育过程的CHS基因,且2个CHS基因均在花后45 d至花后75 d期间上调表达,推测可导致类黄酮合成增多。本研究结果表明F3H和CHS基因在马瑟兰葡萄果实着色方面发挥重要作用。综上所述,马瑟兰葡萄果实发育过程伴随着一系列生理生化指标及基因表达的变化,更具体的基因功能分析仍待进一步研究。
4结论
马瑟兰葡萄生长发育过程中伴随着果实色泽加深、果粒体积增大和生化成分的动态变化。类黄酮生物合成信号通路在葡萄转色过程中起重要作用,CHS和F3H基因影响马瑟兰葡萄果实着色及品质形成。
参考文献(References):
陈光宇.2023.银川市葡萄酒全产业链发展与乡村振兴耦合协调研究[D].杨凌:西北农林科技大学.[Chen G Y.2023.Coupling and coordination research on the develop-ment of the whole wine industry chain and rural revitaliza-tion in Yinchuan City[D].Yangling:Northwest A&F Uni-versity.]doi:10.27409/d.cnki.gxbnu.2023.000677.
杜远鹏,张一帆,黄文尉,李响,朱化平,唐美玲,王赵盼,高振,翟衡.2022.葡萄栽培生态指标体系建设及生态区划[J].中外葡萄与葡萄酒,(4):1-7.[Du Y P,Zhang Y F,Huang W W,Li X,Zhu H P,Tang M L,Wang Z P,Gao Z,Zhai H.2022.Construction of viticulture ecological indexsystem and ecological regionalization[J].Sino-Overseas Grapevine&Wine,(4):1-7.]doi:10.13414/j.cnki.zwpp.2022.04.001.
郭志君,杨红丽,王薇,房玉林.2023.‘马瑟兰’葡萄研究进展及品种优势[J].中外葡萄与葡萄酒,(5):103-110.[Guo Z J,Yang H L,Wang W,Fang Y L.2023.Research progress and varietal advantages of‘Marselan’grapes[J].Sino-Overseas Grapevine&Wine,(5):103-110.]doi:10.13414/j.cnki.zwpp.2023.05.015.
贾昌路,张瑶,朱玲,张锐.2015.转录组测序技术在生物测序中的应用研究进展[J].分子植物育种,13(10):2388-2394.[Jia C L,Zhang Y,Zhu L,Zhang R.2015.Applica-tion progress of transcriptome sequencing technology in biological sequencing[J].Molecular Plant Breeding,13(10):2388-2394.]doi:10.13271/j.mpb.013.002388.
刘帅,张亚红,徐伟荣,刘鑫,袁苗,胡泽军.2021.基于转录组研究光质对转色期红地球葡萄果实着色及品质的影响[J].果树学报,38(12):2045-2058.[Liu S,Zhang Y H,Xu W R,Liu X,Yuan M,Hu Z J.2021.Effects of light quality on the berry coloration and quality of Red Globe grape during veraison based on transcriptome sequencing[J].Journal of Fruit Science,38(12):2045-2058.]doi:10.13925/j.cnki.gsxb.20210307.
宋希贤,单守明,刘成敏,李映龙.2019.中国主要酿酒葡萄产区环境条件与栽培方式比较分析[J].农业科学研究,40(4):13-16.[Song X X,Shan S M,Liu C M,Li Y L.2019.Comparative analysis of environmental conditions and cultivation system of main wine grape producing areasin China[J].Journal of Agricultural Sciences,40(4):13-16.]doi:10.13907/j.cnki.nykxyj.2019.04.003.
孙红,孙田雨,许丽丽,杜远鹏,姚玉新.2017.长期低盐处理对葡萄果实品质及转录组的影响[J].植物生理学报,53(12):2197-2205.[Sun H,Sun T Y,Xu L L,Du Y P,Yao Y X.2017.Effects of the long-term treatment of low-concentrated salt on grape berry quality and transcriptome[J].Plant Physiology Journal,53(12):2197-2205.]doi:10.13592/j.cnki.ppj.2017.0388.
王梦婷.2022.南京地区重要鲜食葡萄花果发育动态调查及其品质性状分析[D].南京:南京农业大学.[Wang M T.2022.Dynamic investigation of flower and fruit develop-ment and analysis of quality characters of important table grapes in Nanjing[D].Nanjing:Nanjing Agricultural Uni-versity.]doi:10.27244/d.cnki.gnjnu.2022.000618.
魏世超.2021.不同生态区酿酒葡萄果实“生青味”相关物质差异的研究[D].杨凌:西北农林科技大学.[Wei S C.2021.Studying on the“Green odor”-related compounds of wine grape berries in different ecological regions[D].Yang-ling:Northwest A&F University.]doi:10.27409/d.cnki.gxbnu.2021.002036.
许泽华,牛锐敏,沈甜,黄小晶,徐美隆,陈卫平.2023.贺兰山东麓葡萄果实品质及其与环境因子的相关性分析[J].中外葡萄与葡萄酒,(5):34-41.[Xu Z H,Niu R M,Shen T,Huang X J,Xu M L,Chen W P.2023.Grape fruit quality and its correlation with environmental factors in the eas-tern foot of Helan Mountains[J].Sino-Overseas Grapevine&Wine,(5):34-41.]doi:10.13414/j.cnki.zwpp.2023.05.005.
Azuma A,Kobayashi S,Mitani N,Shiraishi M,Yamada M,Ueno T,Kono A,Yakushiji H,Koshita Y.2008.Genomic and genetic analysis of Myb-related genes that regulate anthocyanin biosynthesis in grape berry skin[J].Theoreti-cal and Applied Genetics,117(6):1009-1019.doi:10.1007/s00122-008-0840-1.
da Silva F G,Iandolino A,Al-Kayal F,Bohlmann M C,Cush-man M A,Lim H,ErgulA,Figueroa R,Kabuloglu E K,Osborne C,Rowe J,Tattersall E,Leslie A,Xu J,Baek J,Cramer G R,Cushman J C,Cook D R.2005.Characteri-zing the grape transcriptome.Analysis of expressedsequence tags from multiple Vitis species and development of a compendium of gene expression during berry develop‐ment[J].Plant Physiology,139(2):574-597.doi:10.1104/pp.105.065748.
Downey M O,Harvey J S,Robinson S P.2003.Synthesis offla‐vonols and expression of flavonol synthase genes in the developing grape berries of Shiraz and Chardonnay(Vitis vinifera L.)[J].Australian Journal of Grape and Wine Research,9(2):110-121.doi:10.1111/j.1755-0238.2003.tb00261.x.
Goto-Yamamoto N,Wan G H,Masaki K,Kobayashi S J.2002.Structure and transcription of three chalcone synthase genes of grapevine(Vitis vinifera)[J].Plant Science,162(6):867-872.doi:10.1016/S0168-9452(02)00042-0.
Harris N N,Luczo J M,Robinson S P,Walker A R.2013.Tran‐scriptional regulation of the three grapevine chalcone syn‐thase genes and their role in flavonoid synthesis in Shiraz[J].Australian Journal of Grape and Wine Research,19(2):221-229.doi:10.1111/ajgw.12026.
Ilieva F,Veličkovska S K,Dimovska V,Spasov H.2016.The impact of some wine-making practices on the quality of Vranec red wines from Macedonia producedb113fc94f7b0b7d910175a768d9083cda2df91988381ef0d36f01c18d272f378 by the newly-selected local strain“F-78”[J].Food Chemistry,194:1123-1131.doi:10.1016/j.foodchem.2015.08.088.
Kennedy J A,Jones G P.2001.Analysis of proanthocyanidincleavage products following acid-catalysis in the presenceof excess phloroglucinol[J].Journal of Agricultural andFood Chemistry,49(4):1740-1746.doi:10.1021/jf001030o.
Ma L,Sun L J,Guo Y S,Lin H,Liu Z D,Li K,Guo X W.2020.Transcriptome analysis of table grapes(Vitis vinifera L.)identified a gene network module associated with berryfirmness[J].PLoS One,15(8):e0237526.doi:10.1371/journal.pone.0237526.
Ma Z H,Li W F,Mao J,Li W,Zuo C W,Zhao X,Dawuda M M,Shi X Y,Chen B H.2019.Synthesis of light-inducible and light-independent anthocyanins regulated by specific genes in grape‘Marselan’(V.vinifera L.)[J].PeerJ,7:e6521.doi:10.7717/peerj.6521.
Petrussa E,Braidot E,Zancani M,Peresson C,Bertolini A,Patui S,Vianello A.2013.Plant flavonoids—Biosynthesis,transport and involvement in stress responses[J].Interna‐tional Journal of Molecular Sciences,14(7):14950-14973.doi:10.3390/ijms 140714950.
Sweetman C,Wong D C,Ford C M,Drew D P.2012.Transcrip‐tome analysis at four developmental stages of grape berry(Vitis vinifera cv.Shiraz)provides insights into regulated and coordinated gene expression[J].BMC Genomics,13:691.doi:10.1186/1471-2164-13-691.
Theine J,Holtgräwe D,Herzog K,Schwander F,Kicherer A,Hausmann L,Viehöver P,Töpfer R,Weisshaar B.2021.Transcriptomic analysis of temporal shifts in berry deve-lopment between two grapevine cultivars of the Pinot fa-mily reveals potential genes controlling ripening time[J].BMC Plant Biology,21(1):327.doi:10.1186/s 12870-021-03110-6.
Zheng Y J,Tian L,Liu H T,Pan Q H,Zhan J C,Huang W D.2009.Sugars induce anthocyanin accumulation and flava‐none 3-hydroxylase expression in grape berries[J].Plant Growth Regulation,58:251-260.doi:10.1007/s 10725-009-9373-0.
(责任编辑刘可丹)

