柯乐猪BMP7基因SNP位点与繁殖性能的关联分析




摘要:【目的】明确骨形态发生蛋白7基因(BMP7)单核苷酸多态性(SNP)位点与柯乐猪繁殖性能的关联性,挖掘柯乐猪繁殖性状的分子辅助标记,为加速柯乐猪繁殖性能提升及推进其品种改良进程提供技术支撑。【方法】选取150头健康经产柯乐母猪为研究对象,采用Sanger测序法筛查鉴定BMP7基因SNP位点,计算各SNP位点的群体遗传参数,并通过SPSS 22.0中的一般线性模型(GLM)分析SNP位点与柯乐猪总产仔数、初生窝重、平均初生重、断奶仔猪数、断奶窝重及平均断奶重等6个繁殖性状指标的关联性。【结果】在柯乐猪BMP7基因上共发现5个SNPs位点:g.57602289C>T(第2外显子)、g.57602334C>T(第2外显子)、g.57602404C>T(第2内含子)、g.57602418C>T(第2内含子)和g.57602561G>T(第2内含子),均存在3种基因型;5个SNPs位点的优势基因型分别为CT、CT、CT、CT和GT,对应的多态信息含量(PIC)介于0.358~0.375,均表现为中度多态(0.25<PIC<0.50)。5个SNPs位点均符合Hardy-Weinberg平衡状态(PHWE>0.05),且各SNP位点间均存在强连锁不平衡关系[LD系数(D,)>0.800,相关系数(R2)>0.330]。关联分析结果显示,g.57602289C>T、g.57602334C>T和g.57602418C>T等3个位点TT基因型个体的初生窝重均显著高于CC基因型个体(P<0.05),TT基因型个体的断奶仔猪数极显著高于CC基因型和CT基因型个体(P<0.0 下同);g.57602404C>T位点TT基因型个体的总产仔猪数极显著高于CC基因型个体;g.57602561G>T位点TT基因型个体的总产仔猪数极显著高于GG基因型个体。此外,双倍型H2H2和H3H3个体的总产仔数、初生窝重、断奶仔猪数和断奶窝重均高于其他双倍型个体,尤其是H2H2个体在断奶仔猪数和初生窝重方面表现出明显优势。【结论】在柯乐猪BMP7基因上发现的5个SNPs位点均与其繁殖性能存在较强的关联性,BMP7基因可作为柯乐猪繁殖性状的候选基因,而双倍型H2H2可作为繁殖性状分子标记辅助选择的参考。
关键词:柯乐猪;BMP7基因;SNP位点;繁殖性能;关联分析
中图分类号:S828.89文献标志码:A文章编号:2095-1191(2024)08-2495-09
Association analysis of BMP7 gene SNP loci with reproductive performance in Kele pig
XIANG Jin,WU Yan,WANG Chun-yuan,ZHAO Yong,FU HONG-mei,DINGYi-jie,ZHANG Yi-yu*
(College of Animal Science,Guizhou University/Key Laboratory of Animal Genetics,Breeding and Reproduction in thePlateau Mountainous Region,Ministry of Education/Key Laboratory of Animal Genetics,Breeding and Reproduction ofGuizhou Province/Xiang Pigs Research Institute of Guizhou University,Guiyang,Guizhou 550025,China)
Abstract:【Objective】The study aimed to identify the association between single nucleotide polymorphisms(SNP)loci of bone morphogenetic protein 7 gene(BMP7)and the reproductive performance of Kele pig,to explore molecular marker-assisted selection for reproductive traits in Kele pig,and to provide reference for accelerating the improvement of reproductive performance and the breed improvement process of Kele pig.【Method】A total of 150 healthy multiparous Kele sows were selected as the study subjects.SNP loci of the BMP7 gene were screened and identified using the Sanger sequencing method,and the population genetic parameters for each SNP locus were calculated.The association betweenSNP loci and 6 reproductive traits of Kele pigs,including total litter size,litter weight at birth,average birth weight,number of weaned piglets,litter weight at weaning,and average weaning weight,was analyzed using the general linear model(GLM)in SPSS 22.0.【Result】Five SNPs loci were identified in the BMP7 gene of Kele pigs:g.57602289C>T(exon No.2),g.57602334C>T(exon No.2),g.57602404C>T(intron No.2),g.57602418C>T(intron No.2)and g.57602561G>T(intron No.2),all of which exhibited 3 genotypes.The dominant genotypes for the 5 SNP loci were CT,CT,CT,CT and GT respectively,with corresponding polymorphism information content(PIC)ranging from 0.358to 0.375,all exhibiting moderate polymorphism(0.25<PIC<0.50).All five SNP loci conformed to Hardy-Weinberg equi-librium(PHWE>0.05),and strong linkage disequilibrium[LD coefficient(D,)>0.800,correlation coefficient(R2)>0.330]was observed among all SNP loci.The results of the association analysis showed that individuals with the TT geno-type at the 3 loci,g.57602289C>T,g.57602334C>T and g.57602418C>T,had significantly higher litter weight at birth compared to those with the CC genotype(P<0.05).The number of weaned piglets in TT genotype individuals was ex-tremely significantly higher than in those with the CC and CT genotypes(P<0.0 the same below).The total litter size with the TT genotype individuals at the g.57602404C>T locus was extremely significantly higher than that of individuals with the CC genotype.The total litter size with the TT genotype at the g.57602561G>T locus was extremely significantly higher than that of individuals with the GG genotype.Additionally,individuals with the H2H2 and H3H3 diplotypesshowed higher total litter size,litter weight at birth,number of weaned piglets,and weaning litter weight compared to other diplotypes,with H2H2 individuals demonstrating a particularly notable advantage in the number of weaned piglets and litter weight at birth.【Conclusion】Five SNPs loci identified in the BMP7 gene of Kele pigs are strongly associated with their reproductive performance.BMP7 gene can be considered a candidate gene for reproductive traits of Kele pigs,and the diplotype H2H2 can serve as a reference for reproductive traits molecular marker-assisted selection.
Key words:Kele pig;BMP7 gene;SNP locus;reproductive performance;association analysis
Foundation items:National key Research and Development Program of China(2022YFD1100308);Guizhou Scien-ce and Technology Plan Project(QKHPTRC〔2021〕5630);Construction Project of Pig Industry Technology System in Guizhou(GZSZCYJSTX-03)
0引言
【研究意义】我国是世界上养猪数量最多的国家,也是猪肉消费量最大的国家。柯乐猪是我国贵州省的重要地方猪品种之一,属于云贵高原乌蒙乌金猪类群,具有耐粗饲、抗病力强、肉质鲜美及口感软糯等特点,符合消费者对高品质猪肉的要求,同时是宣威火腿制作的重要原材料(杨莲等,2021;郭小江等,2023;杨酸等,2023)。随着人们生活水平的提高,消费者对猪肉的需求量和品质提出了更高要求。因此,如何提高猪肉胴体品质和肉质特性已成为猪繁殖育种及品种改良的工作重点。【前人研究进展】骨形态生成蛋白(Bone morphogenetic protein,BMP)家族是转化生长因子(Transforming growth factor-beta,TGF-B)超家族的一个亚家族(Chen et al.,2004),由一组多功能的生长因子组成,参与多种生物学过程,尤其在骨骼和组织的发育过程中发挥重要作用(Zhang et al.,2014)。按照基因结构及其功能特征,BMP家族基因可划分为不同亚家族,其中BMP2、BMP4、BMP5、BMP6、BMP7、BMP8a和BMP8b属于BMP亚家族,彼此间共享相似的结构与功能,具有促进骨骼发育及细胞分化的特性(Vukicevicet al.,1996;White et al.,2007;Lavery et al.,2008)。在再生医学和组织工程领域,BMP家族蛋白在骨骼和软骨的生长修复中发挥关键作用。Marie等(2002)研究发现,BMP2可促进骨折愈合、软骨修复及其他组织再生;Bandyopadhyay等(2006)研究表明,BMP2和BMP4基因的缺失会导致小鼠成骨严重受损,进一步揭示了BMP家族基因在四肢发育和骨骼形成过程中的重要性。此外,Vukicevic等(1996)研究发现,BMP7基因可促使肾脏发育过程中的间充质细胞转变为肾源性间充质细胞,表明BMP7基因在肾脏的形成与发育过程中扮演关键角色;Peretto等(2002)在小鼠嗅觉系统中检测到BMP4、BMP6和BMP7等基因mRNA和蛋白表达,表明BMP家族蛋白在中枢神经系统中也发挥重要作用,且这些蛋白的存在已在成年小鼠大脑中以神经可塑性为特征的区域得到证实;Piccirillo等(2006)研究表明,BMP-BMPR信号系统(控制正常脑干细胞活性)可作为人类胶质母细胞瘤中肿瘤启动干细胞样细胞的关键抑制调节因子,其中BMP4作为一种新型的无细胞毒性治疗效应物,可用于防止胶质母细胞瘤生长和复发。还有研究证实,血管损伤、高血压或动脉粥样硬化导致的血管稳态紊乱会影响BMP基因表达,故推测BMP在异常血管反应中发挥重要作用(Lowery and de Caestecker,2010;Cai et al.,2012)。【本研究切入点】BMP家族基因在雌性动物卵巢中高表达,尤其在卵泡和黄体中,BMP基因对激素合成及卵母细胞的生长与分化起重要调节作用(Shimasaki et al.,1999)。高若男等(2020)研究发现BMP7基因的A83509G和G84966A突变位点对大白猪眼肌面积和生长速度有显著影响,但至今鲜见BMP7基因与猪繁殖性能关联的研究报道。【拟解决的关键问题】以柯乐猪为研究对象,运用Sanger测序法鉴定BMP7基因外显子单核苷酸多态性(Single nucleotide poly-morphism,SNP)位点,并分析SNP位点与柯乐猪繁殖性能的关联性,旨在挖掘柯乐猪繁殖性状的分子辅助标记,为加速柯乐猪繁殖性能提升及推进其品种改良进程提供技术支撑。
1材料与方法
1.1试验动物
选择150头来自贵州优农谷生态产业有限公司的健康经产柯乐母猪,统计所选母猪群体的总产仔数、初生窝重、平均初生重、断奶仔猪数、断奶窝重及平均断奶重等繁殖性状指标。使用耳钳采集经产柯乐母猪的耳组织约0.25 g,置于含75%乙醇的离心管中临时保存,及时送回实验室,-40℃保存备用。动物试验由贵州大学动物伦理委员会批准,批准号EAE-GZU-2022-P049。
1.2 DNA提取
使用组织DNA提取试剂盒(D3396-3,贵州西宝商贸有限公司)提取150份柯乐猪耳组织DNA,通过NanoDrop 2000超微量分光光度计检测DNA浓度和纯度,合格的DNA样品-20℃保存备用。
1.3 PCR扩增
在NCBI网站(https://www.ncbi.nlm.nih.gov/)检索猪BMP7基因全序列(NC_010459.5),利用Permer 5.0针对BMP7基因设计4对扩增引物(表1),并委托生工生物工程(上海)股份有限公司合成。PCR反应体系20.0μL:2×Taq PCR Master Mix 10.0μL,上、下游引物(10μmol/L)各1.0μL,DNA模板1.0μL,RNase-free H2O 7.0μL。扩增程序:95℃预变性10 min;95℃30 s,60℃30 s,72℃30 s,进行35个循环;72℃延伸10min,4℃结束反应。
1.4 SNP位点筛选
PCR扩增产物经1.5%琼脂糖凝胶检测合格后,挑选特异性良好的扩增产物送至生工生物工程(上海)股份有限公司测序,采用DNASTAR中的Meg-Align和SeqMan程序并结合人工校验,对测序获得的核苷酸序列进行比对,筛选出SNP位点。
1.5统计分析
使用WPS对柯乐猪BMP7基因所有SNP位点进行统计,计算各SNP位点的基因型频率、等位基因频率、观测杂合度(He)、有效等位基因数(Ne)及多态信息含量(PIC)等,并通过卡方(χ2)适合性检验Hardy-Weinberg平衡性;利用SHEsis(http://analysis.bio-x.cn/myAnalysis.php)进行SNP位点连锁不平衡分析和单倍型分析,采用SPSS 22.0中的一般线性模型(GLM)分析SNP位点与柯乐猪繁殖形状指标的关联性。
2结果与分析
2.1柯乐猪BMP7基因SNP位点鉴定结果
在柯乐猪BMP7基因上共发现5个SNPs位点,分别是g.57602289C>T、g.57602334C>T、g.57602404 C>T、g.57602418C>T和g.57602561G>T,且均存在3种基因型(图1)。其中,g.57602404C>T、g.57602418 C>T和g.57602561G>T等3个SNPs位点位于第2内含子;g.57602289C>T位点位于第2外显子,导致其密码子由GCT突变为GCC,但编码氨基酸均为丙氨酸(A),属于同义突变;g.57602334C>T位点也位于第2外显子,其密码子由AAT突变为AAC,编码氨基酸均为天冬酰胺(N),也属于同义突变。
2.2柯乐猪BMP7基因SNP位点遗传学分析结果柯乐猪BMP7基因SNP位点遗传学特性见表2。g.57602289C>T、g.57602334C>T、g.57602404C>T、g.57602418C>T、g.57602561G>T等5个SNPs位点的优势基因型为分别为CT、CT、CT、CT和GT,对应的优势等位基因分别为C、C、C、C和G。5个SNPs位点的He介于0.468~0.500,表明遗传多样性较丰富,群体变异程度较低;5个SNPs位点的Ne介于1.879~1.999,表明等位基因的群体分布较均匀;5个SNPs位点的PIC介于0.358~0.375,均表现为中度多态(0.25<PIC<0.50),能提供一定的遗传信息。此外,卡方(χ2)合适性检验结果表明,5个SNPs位点均符合Hardy-Weinberg平衡状态(PHWE>0.05)。
2.3柯乐猪BMP7基因SNP位点连锁不平衡分析结果
通过SHEsis对柯乐猪BMP7基因SNP位点进行连锁不平衡分析,结果(表3)显示,g.57602289C>T、g.57602334C>T、g.57602404C>T、g.57602418C>T和g.57602561G>T等5个SNPs位点间满足LD系数(D,)>0.800且相关系数(R2)>0.330,表明各SNP位点间均存在强连锁不平衡关系。
2.4柯乐猪BMP7基因SNP位点单倍型和双倍型分析结果
对柯乐猪BMP7基因5个SNPs位点进行单倍型和双倍型分析,结果显示共检测到3种单倍型和6种双倍型(表4)。在单倍型中,H1的频率(0.513)最高,为优势单倍型;H3的频率(0.113)最低,属于劣势单倍型。在双倍型中,H1H2的频率(c306f3df88d5df452ead36bfd5c35f02816ab3ea72e2ac303934625168a0c2d00.453)最高,为优势双倍型;其次为H1H1(0.240)和H2H2(0.120);H3H3的频率(0.040)最低,属于劣势双倍型。
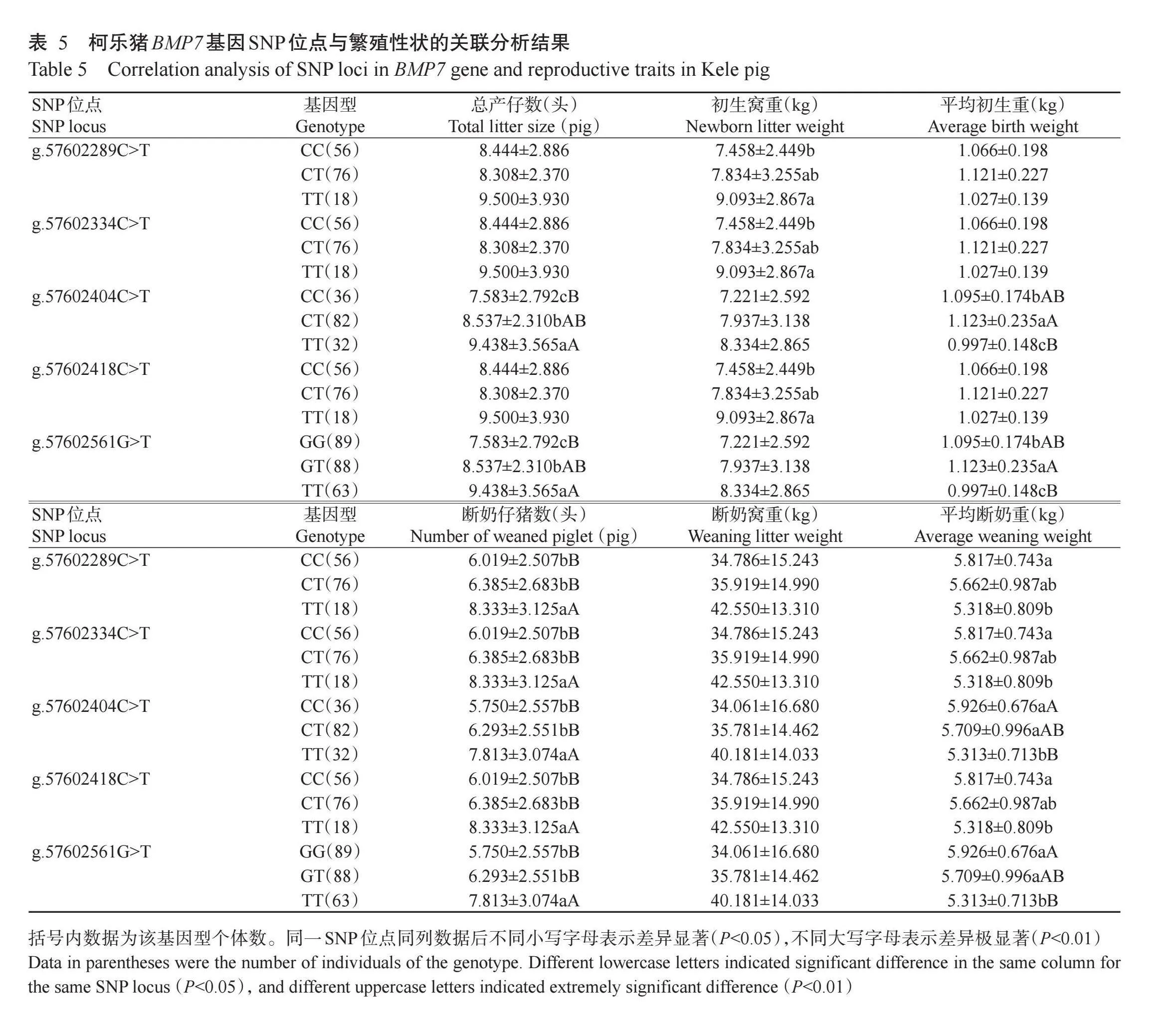
2.5柯乐猪BMP7基因SNP位点与其繁殖性状的关联性
采用SPSS 22.0中的一般线性模型(GLM)分析BMP7基因5个SNPs位点与柯乐猪繁殖性状的关联性,结果(表5)显示,g.57602289C>T、g.57602334C>T和g.57602418C>T位点TT基因型个体的初生窝重均显著高于CC基因型个体(P<0.05,下同),TT基因型个体的断奶仔猪数均极显著高于CC基因型和CT基因型个体(P<0.0 下同),而CC基因型个体的平均断奶重显著高于TT基因型个体;g.57602404C>T位点TT基因型个体的总产仔数极显著高于CC基因型个体,CT基因型个体的平均初生重极显著高于TT基因型个体,TT基因型个体的断奶仔猪数极显著高于CC基因型和CT基因型个体,CC基因型个体的平均断奶重极显著高于TT基因型个体;g.57602561G>T位点TT基因型个体的总产仔数极显著高于GG基因型个体,GT基因型个体的初生平均重极显著高于TT基因型个体,TT基因型个体的断奶仔猪数极显著高于GG基因型和GT基因型个体,GG基因型个体的平均断奶重极显著高于TT基因型个体。
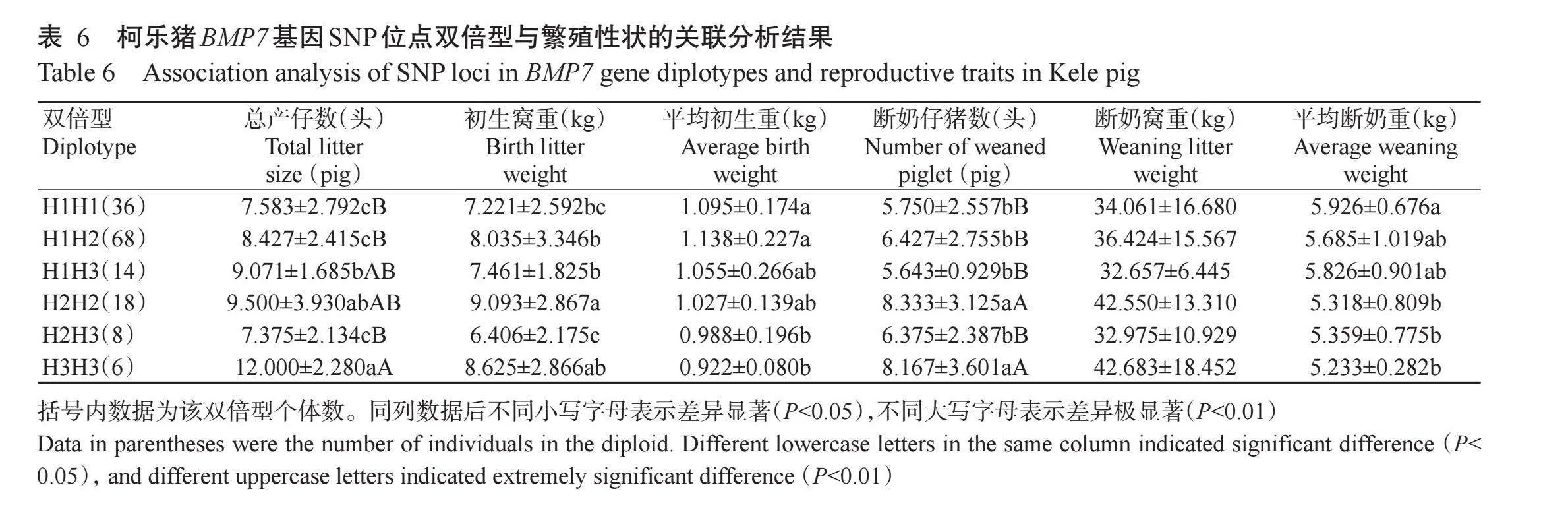
2.6柯乐猪BMP7基因SNP位点双倍型与其繁殖性状的关联性
柯乐猪BMP7基因双倍型与其繁殖性状的关联分析结果(表6)显示,H3H3个体的总产仔数极显著高于H1H1、H1H2和H2H3个体,H2H2个体的总产仔数显著高于H1H1、H1H2和H2H3个体;H2H2个体的初生窝重显著高于H1H1、H1H2、H1H3和H2H3个体;H1H1、H1H2个体的平均初生重显著高于H2H3和H3H3个体;H2H2、H3H3个体的断奶仔猪数极显著高于H1H1、H1H2、H1H3和H2H3个体;H1H1个体的平均断奶重显著高于H2H2、H2H3和H3H3个体。
2.7柯乐猪BMP7基因mRNA二级结构预测结果
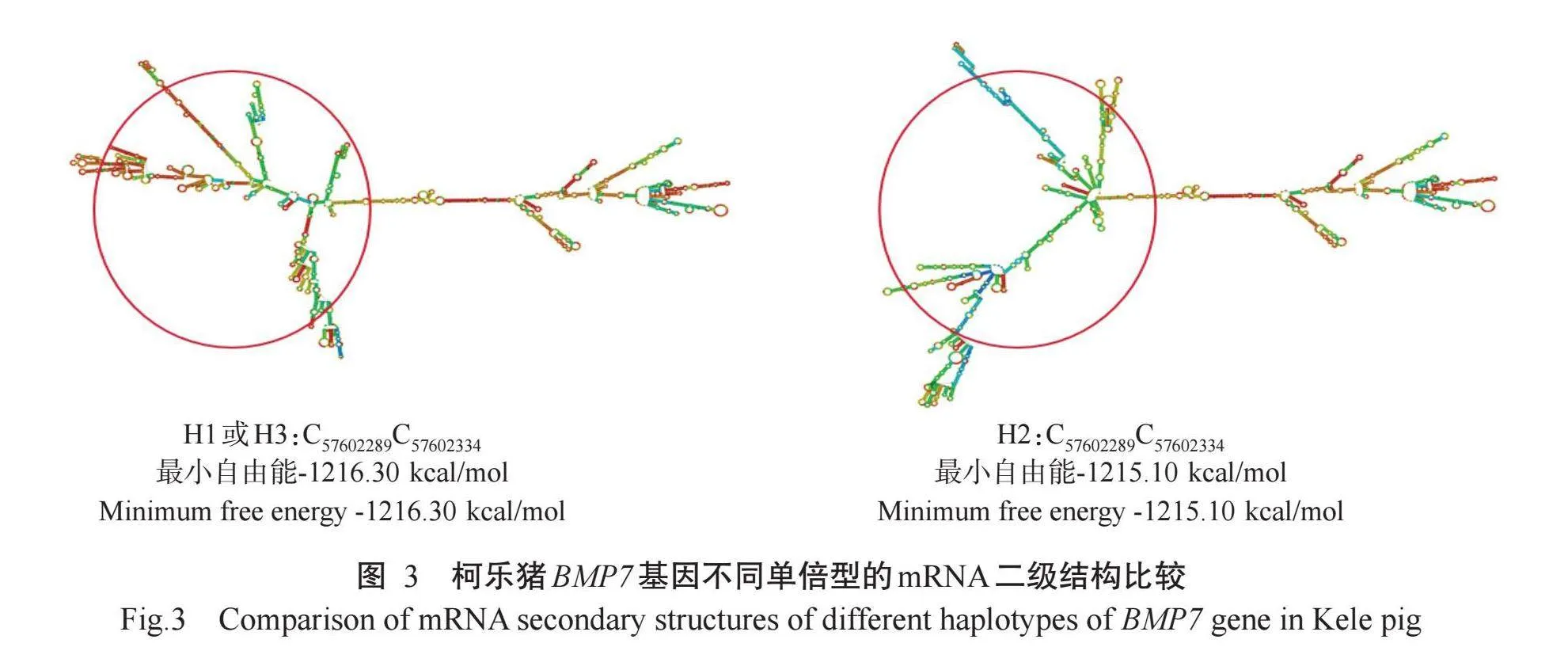
使用RNAfold(http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi)预测柯乐猪BMP7基因第2外显子g.57602289C>T和g.57602334C>T位点突变对不同单倍型mRNA二级结构的影响,结果(图3)显示,g.57602289C>T和g.57602334C>T位点突变均引起柯乐猪BMP7基因mRNA二级结构的变化,其中,单倍型H2的最小自由能为-1215.10 kcal/mol,单倍型H1和H3的最小自由能均为-1216.30 kcal/mol,即单倍型H1或H3较单倍型H2更稳定。综上所述,g.57602289C>T和g.57602334C>T位点的突变能促使柯乐猪BMP7基因mRNA二级结构最小自由能变小,新的二级结构更加稳定。
3讨论
近年来,由于杂交猪种的推广养殖,导致地方猪种的生存空间逐年缩小,究其原因主要是地方猪种繁殖力较低,生长速度缓慢,育种周期更长(崔世泉等,2007)。相对于大部分国外猪种而言,柯乐猪也存在产仔数较少、性成熟早及繁殖率较低等缺陷,因此提高地方猪种繁殖力已成为我国畜禽繁殖学研究工作的重要内容之一。BMP7基因属于BMP亚家族成员,是一种多功能型生长因子。在雌性哺乳动物中,BMP7基因在下丘脑、垂体、卵巢和子宫等生殖相关器官组织中均有表达,即BMP7基因在生殖系统中扮演着重要的生理调节角色,对雌性哺乳动物的生殖功能起调控作用(Cheng et al.,2003)。del Cambre Amaral Weller等(2016)研究发现,在牛的青春期发育过程中BMP7基因通过相互作用并调节卵泡内类固醇的生成及卵泡对促性腺激素的反应;张壮彪等(2018)研究发现,BMP7基因在小尾寒羊垂体、大脑、下丘脑、输卵管和卵巢等组织中的相对表达量均高于苏尼特羊。可见,BMP7作为一种重要的生长因子,在雌性动物的繁殖过程中发挥重要调控作用,包括卵巢发育、生殖激素的合成与释放、子宫内膜准备及胚胎植入等环节,进而影响其繁殖性能。
本研究以BMP7基因作为柯乐猪繁殖性状的分子遗传标记辅助选择基因,通过Sanger测序法筛查鉴定BMP7基因SNP位点,结果共发现5个SNPs位点:g.57602289C>T(第2外显子)、g.57602334C>T(第2外显子)、g.57602404C>T(第2内含子)、g.57602418C>T(第2内含子)和g.57602561G>T(第2内含子)。PIC是遗传学中衡量遗传位点多态性程度的重要指标之一,常用于研究人类与动植物种群及其亲缘关系的遗传多样性和变异性(Serrote et al.2020;阮涌等,2022)。本研究中,柯乐猪BMP7基因5个SNPs位点均表现为中度多态(0.25<PIC<0.50),群体变异程度较大,具有一定遗传的信息量。卡方(χ2)合适性检验发现,5个SNPs位点的基因型分布均未偏离Hardy-Weinberg平衡状态,推测柯乐猪群体尚未受到突变、选择或遗传漂变等因素的显著影响。另一种可能性:虽然柯乐猪群体曾经受到这些因素影响,但由于长期的人工选择和大规模扩群,群体已重新达到新的平衡状态。连锁不平衡分析是遗传学中的常用分析方法,多用于研究2个或多个遗传位点间的关联程度(李小楷等,2021;Good,2022;Huang et al.,2022)。本研究中,柯乐猪BMP7基因5个SNPs位点间均存在强连锁不平衡关系(D,>0.800,R2>0.330),与柯乐猪BMP7基因SNP位点单倍型和双倍型分析相互佐证,共发现3种单倍型和6种双倍型。此外,mRNA二级结构直接影响基因的表达、稳定性和翻译,进而影响蛋白表达(Wan et al.,2012)。本研究的柯乐猪BMP7基因mRNA二级结构预测结果显示,g.57602289C>T和g.57602334C>T位点的突变均导致柯乐猪BMP7基因mRNA二级结构发生变化,且这些突变导致其最小自由能变小,致使新的二级结构更加稳定。
李新建等(2013)研究表明,杜洛克猪和豫南黑猪BMP7基因上的T98C位点基因型与其繁殖性能相关性较强,各基因型个体间的总产仔数、产活仔猪数、初生窝重、断奶头数及21日龄窝重均存在差异极显著。尹杭等(2021)研究证实,苏淮猪BMP7基因3'非编码区(3'-UTR)的c.*273A>G位点与其产仔数性状显著关联。孟科等(2022)研究发现,BMP2基因g.48462350C>T位点、BMP4基因g.63454744 T>G位点和BMP7基因g.58171856C>G位点均不适用于杜泊羊、滩寒杂交羊、杂一代、杂二代和横交一代等5个绵羊群体多羔性状的选育。本研究结果表明,柯乐猪BMP7基因5个SNPs位点与其繁殖性能间存在较强的关联性,尤其是TT基因型个体的繁殖性能整体上优于其他基因型个体,故推测TT基因型可能是5个SNPs位点中的有利基因型,在总产仔数、初生窝重和断奶仔猪数等繁殖性状的培育过程中,TT基因型可作为分子标记辅助选择的参考。综合柯乐猪BMP7基因SNP位点双倍型与其繁殖性状的关联分析结果可知,H2H2和H3H3个体的总产仔数、初生窝重、断奶仔猪数和断奶窝重均高于其他双倍型个体,且H2H2个体整体上优于H3H3个体(H3H3个体数较少,不具有代表性),尤其是H2H2个体在断奶仔猪数和初生窝重方面表现出明显优势,因此认为H2H2为有利双倍型,可作为柯乐猪繁殖性状分子标记辅助选择的参考。
4结论
在柯乐猪BMP7基因上发现的5个SNPs位点均与其繁殖性能存在较强的关联性,BMP7基因可作为柯乐猪繁殖性状的候选基因,而双倍型H2H2可作为繁殖性状分子标记辅助选择的参考。
参考文献(References):
崔世泉,李剑虹,崔卫国,包军.2007.母猪哺乳初期的母性行为与催乳素受体基因多态性关系的初探[J].遗传,29(1):47-51.[Cui S Q,Li J H,Cui W G,Bao J.2007.Pre-liminary study on the relationship between sow maternal behaviour during early lactation and polymorphism of PRLR gene[J].Genetic,29(1):47-51.]doi:10.3321/j.issn:0253-9772.2007.01.009.
高若男,陈亚楠,黄涛,唐中林.2020.BMP7基因多态对大白猪生长性状的影响[J].石河子大学学报(自然科学版),38(3):299-302.[Gao R N,Chen Y N,Huang T,Tang Z L.2020.Influence of BMP7 polymorphisms on growthtraits of Yorkshire pigs[J].Journal of Shihezi University(Natural Science),38(3):299-302.]doi:10.13880/j.cnki.65-1174/n.2020.22.019.
郭小江,熊力,谭元成,杨红文,杨齐心,杨酸,向进,张依裕.2023.柯乐猪TAC3第1内含子多态对繁殖性状的影响[J].中国猪业,18(3):90-93.[Guo X J,Xiong L,Tan Y C,Yang H W,Yang Q X,Yang S,Xiang J,Zhang Y Y.2023.Effects of TAC3 intron 1 polymorphism on reproduc-tive traits in Kele pigs[J].China Swine Industry,18(3):90-93.]doi:10.16174/j.issn.1673-4645.2023.03.018.
李小楷,黄全奎,奉玲丽,郭亚芬,梁晶,兰干球.2021.广西巴马小型猪与长白猪的BMP2和FGFR3基因序列及表达差异分析[J].南方农业学报,52(6):1709-1718.[Li X K,Huang Q K,Feng L L,Guo Y F,Liang J,Lan G Q.2021.Sequence and expression differences of BMP2 and FGFR3 genes in Guangxi Bama mini pig and Landrace pig[J].Journal of Southern Agriculture,52(6):1709-1718.]doi:10.3969/j.issn.2095-1191.2021.06.032.
李新建,吕刚,李改英,任广志.2013.BMP7基因单核苷酸多态性与猪繁殖性状的关联分析[J].西北农业学报,22(3):6-10.[Li X J,LüG,Li G Y,Ren G Z.2013.Associa-tion between polymorphism of BMP7 and reproductivetraits of pigs[J].Acta AgriculturaeBoreali-Occidentalis Sinica,22(3):6-10.]
孟科,荣轩,梁鹏,强浩,冯登侦.2022.绵羊BMP2、BMP4和BMP7基因多态性与产羔数的关联分析[J].中国畜牧杂志,58(5):113-118.[Meng K,Rong X,Liang P,Qiang H,Feng D Z.2022.Polymorphism of sheep BMP BMP4 and BMP7 genes and its association with litter size[J].Chinese Journal of Animal Science,58(5):113-118.]doi:10.19556/j.0258-7033.20210618-06.
阮涌,陈祥,田贵刚,安冬伟,邹启顺.2022.F3代波杂山羊XKR4基因多态性与生长性状的关联分析[J].南方农业学报,53(6):1752-1758.[Ruan Y,Chen X,Tian G G,An D W,Zou Q S.2022.Correlation analysis of XKR4 gene polymorphism and growth traits in F3 generation Boza goats[J].Journal of Southern Agriculture,53(6):1752-1758.]doi:10.3969/j.issn.2095-1191.2022.06.029.
杨莲,燕志宏,黄维江,杨仕钰,吴光松,顾丽菊,林鹏飞,杨蓉,李平,任丽群,张芸.2021.纯种柯乐猪与巴×柯杂交猪肠道菌群结构的研究[J].动物营养学报,33(3):1359-1371.[Yang L,Yan Z H,Huang W J,Yang S Y,Wu G S,Gu L J,Lin P F,Yang R,Li P,Ren L Q,Zhang Y.2021.Study on intestinal microflora structure of pure-bred Kele pigs and berkshirex Kele hybrid pigs[J].Chinese Journal of Animal Nutrition,33(3):1359-1371.]doi:10.3969/j.issn.1006-267x.2021.03.019.
杨酸,郭小江,杨红文,熊力,李晨,谭元成,王春源,张依裕.2023.柯乐猪PRLR基因多态性与繁殖性状的关联性[J].浙江农业学报,35(3):556-564.[Yang S,Guo X J,Yang H W,Xiong L,Li C,Tan Y C,Wang C Y,Zhang Y Y.2023.Correlation of PRLR gene polymorphisms andreproductive traits in Kele pig[J].Acta Agriculturae Zhe-jiangensis,35(3):556-564.]doi:10.3969/j.issn.1004-1524.2023.03.08.
尹杭,杜星,潘增祥,李强,刘红林,李齐发.2021.苏淮猪BMP7基因3'-UTR多态性分析[J].南京农业大学学报,44(2):346-352.[Yin H,Du X,Pan Z X,Li Q,Liu H L,Li Q F.2021.Polymorphism of the 3'-UTR of BMP7 gene in Suhuai pigs[J].Journal of Nanjing Agricultural Univer-sity,44(2):346-352.]doi:10.7685/jnau.202008033.
张壮彪,狄冉,刘秋月,胡文萍,王翔宇,田志龙,张效生,张金龙,储明星.2018.5个基因在小尾寒羊和苏尼特羊性腺轴相关组织中表达分析[J].中国农业科学,51(24):4710-4719.[Zhang Z B,Di R,Liu Q Y,Hu W P,Wang X Y,Tian Z L,Zhang X S,Zhang J L,Chu M X.2018.Expression analysis of five genes in the gonadal axis of Small Tail Han sheep and Sunite sheep[J].Scientia Agri-cultura Sinica,51(24):4710-4719.]doi:10.3864/j.issn.0578-1752.2018.24.0116Vv0njsbJS3OCgDH0lcVHgt8h2ZsEFARK2OiONk4HLY=.
Bandyopadhyay A,Tsuji K,Cox K,Harfe B D,Rosen V,Tabin C J.2006.Genetic analysis of the roles of BMP BMP4,and BMP7 in limb patterning and skeletogenesis[J].PLoS Genetics,2(12):e216.doi:10.1371/journal.pgen.0020216.
Cai J,Pardali E,Sánchez-Duffhues G,ten Dijke P.2012.BMP signaling in vascular diseases[J].FEBS Letters,586(14):1993-2002.doi:10.1016/j.febslet.2012.04.030.
Chen D,Zhao M,Mundy G R.2004.Bone morphogenetic pro-teins[J].Growth Factors,22(4):233-241.doi:10.1080/08977190412331279890.
Cheng H W,Jiang W,Phillips F M,Haydon R C,Peng Y,Zhou L,Luu H H,An N,Breyer B,Vanichakarn P,Szatkowski JP,Park J Y,He T C.2003.Osteogenic activity of the four-teen types of human bone morphogenetic proteins(BMPs)[J].The Journal of Bone&Joint Surgery,85(8):1544-1552.doi:10.2106/00004623-200308000-00017.
del Cambre Amaral Weller M M,Fortes M R S,Porto-Neto L R,Kelly M,Venus B,Kidd L,do Rego J P A,Edwards S,Boe-Hansen G B,Piper E,Lehnert S A,Guimarães S E F,Moore S S.2016.Candidate gene expression in Bos indi-cus ovarian tissues:Prepubertal and postpubertal heifers in diestrus[J].Frontiers in Veterinary Science,3:94.doi:10.3389/fvets.2016.00094.
Good B H.2022.Linkage disequilibrium between rare muta-tions[J].Genetics,220(4):iyac004.doi:10.1093/genetics/iyac004.
Huang K,Dunn D W,Li W K,Wang D,Li B G.2022.Linkage disequilibrium under polysomic inheritance[J].Heredity,128(1):11-20.doi:10.1038/s41437-021-00482-1.
Lavery K,Swain P,Falb D,Alaoui-Ismaili M H.2008.BMP-2/4 and BMP-6/7 differentially utilize cell surface receptors to induce osteoblastic differentiation of human bone marrow-derived mesenchymal stem cells[J].Journal of Biological Chemistry,283(30):20948-20958.doi:10.1074/jbc.M800850200.
Lowery J W,de Caestecker M P.2010.BMP signaling in vascu-lar development and disease[J].Cytokine&Growth Fac-tor Reviews,21(4):287-298.doi:10.1016/j.cytogfr.2010.06.001.
Marie P J,Debiais F,HaÿE.2002.Regulation of human cranial osteoblast phenotype by FGF- FGFR-2 and BMP-2 sig-naling[J].Histology and Histopathology,17(3):877-885.doi:10.14670/HH-17.877.
Peretto P,Cummings D,Modena C,Behrens M,Venkatraman G,Fasolo A,Margolis F L.2002.BMP mRNA and protein expression in the developing mouse olfactory system[J].Journal of Comparative Neurology,451(3):267-278.doi:10.1002/cne.10343.
Piccirillo S G M,Reynolds B A,Zanetti N,Lamorte G,Binda E,Broggi G,Brem H,Olivi A,Dimeco F,Vescovi A L.2006.Bone morphogenetic proteins inhibit the tumori-genic potential of human brain tumour-initiating cells[J].Nature,444(7120):761-765.doi:10.1038/nature05349.
Serrote C M L,Reiniger L R S,Silva K B,dos Santos Rabaiolli S M,Stefanel CBMiCT4/n9JuxMnJF3BvZqw== M.2020.Determining the polymorphism information content of a molecular marker[J].Gene,726:144175.doi:10.1016/j.gene.2019.144175.
Shimasaki S,Zachow R J,Li D M,Kim H,Iemura S I,Ueno N,Sampath K,Chang R J,Erickson G F.1999.A func-tional bone morphogenetic protein system in the ovary[J].Proceedings of the National Academy of Sciences of the United States of America,96(13):7282-7287.doi:10.1073/pnas.96.13.7282.
Vukicevic S,Kopp J B,Luyten F P,Sampath T K.1996.Induc-tion of nephrogenic mesenchyme by osteogenic protein 1(bone morphogenetic protein 7)[J].Proceedings of theNational Academy of Sciences of the United States ofAmerica,93(17):9021-9026.doi:10.1073/pnas.93.17.9021.
Wan Y,Qu K,Ouyang Z Q,Kertesz M,Li J,Tibshirani R,Makino D L,Nutter R C,Segal E,Chang H Y.2012.Genome-wide measurement of RNA folding energies[J].Molecular Cell,48(2):169-181.doi:10.1016/j.molcel.2012.08.008.
White A P,Vaccaro A R,Hall J A,Whang P G,Friel B C,McKee M D.2007.Clinical applications of BMP-7/OP-1 in fractures,nonunions and spinal fusion[J].International Orthopaedics,31(6):735-741.doi:10.1007/s00264-007-0422-x.
Zhang X,Guo J,Zhou Y S,Wu G.2014.The roles of bone mor-phogenetic proteins and their signaling in the osteogenesis of adipose-derived stem cells[J].Tissue Engineering.Part B:Reviews,20(1):84-92.doi:10.1089/ten.TEB.2013.0204.
(责任编辑兰宗宝)

