不同葡萄砧木品种需冷量及低温时长对芽休眠相关基因表达的影响





摘要:【目的】探究不同葡萄砧木品种需冷量及低温时长对芽休眠相关基因表达的影响,为筛选热区葡萄低需冷量砧木品种及探究葡萄萌芽进程调控机制提供理论依据。【方法】以15个葡萄砧木品种的冬季修剪枝梢为试验材料,进行不同低温时长处理,处理温度为(4±1)℃,测定各砧木品种的需冷量,统计各葡萄砧木品种萌芽进程;并研究需冷量有差异的葡萄砧木品种,在低温处理打破休眠过程中枝梢中可溶性总糖和淀粉含量变化;通过实时荧光定量PCR检测砧木芽中休眠相关基因的相对表达量。【结果】贝达、SO4、101-14、110R、188-08、3309C、140R、Valliant、山河2号、BR No.2、Fercal和5C等12个品种需冷量为0 h,1103P需冷量为168 h。1103P砧木枝梢中可溶性总糖含量随着低温处理时长增加呈显著增加趋势(P<0.05,下同);在低温处理304 h时,可溶性总糖含量最高,达2.55μg/g,此时枝梢中淀粉含量显著降低,仅0.06μg/g,低需冷量的3309C枝梢中淀粉含量在3个低温时长处理间无显著差异(P>0.05,下同)。1103P砧木随着低温处理时长增加,胼胝体合成酶基因VvCALLOSE SYNTHASE1的相对表达量呈显著下降趋势,未低温处理的1103P冬芽中VvCALLOSE SYNTHASE1基因的相对表达量显著高于3309C。3个低温时长处理中,1103P芽中β-1,3-葡聚糖酶基因VvGLU1、ABA合成关键酶基因VvNCED1、GA20-氧化酶基因VvGA20ox-2、响应低温胁迫的重要转录因子基因VvbHLH92和开花抑制基因VvSVP的相对表达量在低温处理304 h时最高。未进入内休眠的3309C在低温处理过程中,VvCALLOSE SYNTHASE1和VvSVP基因的相对表达量无显著变化,未经低温处理时的3309C芽中VvGLU1基因、ABA合成诱导因子基因VvXERICO和VvbHLH92基因的相对表达量最高。3个低温时长下1103P芽中VvSVP基因的相对表达量均显著高于3309C。【结论】筛选出贝达、SO4、101-14、110R、188-08、3309C、140R、Valliant、山河2号、BR No.2、Fercal和5C等12个不需经低温处理即可萌芽的砧木品种,葡萄的萌芽受品种需冷量、营养和休眠相关基因的共同调控。
关键词:葡萄砧木;需冷量;低温处理;休眠解除;基因表达
中图分类号:S663.1文献标志码:A文章编号:2095-1191(2024)08-2237-11
Effects of chilling requirement and chilling duration on theexpression of bud dormancy-related genes in differentgrape rootstock varieties
XIAO Li-bing ZHONG Ting-wei LI Lin-lin LU Xiu-bian LIN Qin-xiong HAN Jia-yu ZHANG Yan-hui3,JIA Hai-feng BAI Xian-jin WANG Bo1*
(1College of Agriculture,Guangxi University,Nanning,Guangxi 530004,China;2Grape and Wine Research Institute,Guangxi Academy of Agricultural Sciences,Nanning,Guangxi 530007,China;3Guangxi Zhencheng Agricultural Co.,Ltd.,Nanning,Guangxi 530105,China)
Abstract:【Objective】This study aimed to investigate the effects of chilling requirement and chilling duration on the expression of bud dormancy-related genes in different grape rootstock varieties,providing theoretical basis for screeninglow-chilling rootstock varieties suitable for tropical and subtropical regions and exploring the regulatory mechanisms of grape germination.【Method】Winter pruning bud-wood of 15 grape rootstock varieties were used as test materials,andsubjected to different chilling duration treatments at(4±1)℃.The chilling requirement of each grape rootstock variety was detected,and the germination process was recorded.The changes of total soluble sugar and starch content in branches with different chilling requirements were analyzed during dormancy release induced by chilling requirement.The relative expression levels of dormancy-related genes in the buds were determined using real-time fluorescence quantitative PCR.【Result】The chilling requirement of 12 grape varieties including Bayda,SO4,101-14,110R,188-08,3309C,140R,Valliant,Shanhe No. BR No. Fercal and 5C was 0 h,while the chilling requirement of 1103P was 168 h.The totalsoluble sugar content in the branches of 1103P rootstocks increased significantly with chilling duration added(P<0.05,the same below),reaching a maximum of 2.55μg/g at 304 h of chilling duration,and the starch content in branches decreased significantly to 0.06μg/g.In contrast,there was no significant difference in starch content in branches of 3309 C with low chilling requirement among the three chilling duration treatments(P>0.05,the same below).With in-creasing chillinng duration treatment,the relative expression of VvCALLOSE SYNTHASE1 in 1103P decreased signifi-cantly.The relative expression of callosal synthase gene VvCALLOSE SYNTHASE1 in 1103P winter buds without chillingtreatment was significantly higher than that in 3309C.Among the three chilling duration treatments,the relative expres-sion levels ofβ-1,3-glucanase gene VvGLU ABA synthesis key enzyme gene VvNCED GA20-oxidase gene VvGA20ox- key transcription factor gene responding to cold stress VvbHLH92 and flowering inhibitory gene VvSVP in 1103P buds were the highest at 304 h of chilling treatment.In 3309C which did not enter endodormancy,the relative ex-pression levels of VvCALLOSE SYNTHASE1 and VvSVP genes did not change significantly.The relative expression levels of VvGLU1 gene,ABA biosynthesis inducer VvXERICO gene and VvbHLH92 in 3309C buds were the highest without chilling treatment.The relative expression of VvSVP gene in 1103P buds was significantly higher than that in 3309C under all three chilling duration treatments.【Conclusion】The twelve grape rootstock varieties,including Bayda,SO4,101-14,110R,188-08,3309C,140R,Valliant,Shanhe No. BR No. Fercal and 5C,are identified as rootstock varieties notrequiring chilling requirement for germination.Grape germination is co-regulated by chilling requirement,nutrients and dormancy-related genes.
Key words:grape rootstock;chilling requirement;chilling treatment;dormancy release;gene expression
Foundation items:National Natural Science Foundation of China(31960572);Guangxi Natural Science Foundation(2023GXNSFBA026047);Guangxi Key Research and Development Project(Guike AB21196042);Innovation and En-trepreneurship Project for Undergraduates of Guangxi(S202410593403)
0引言
【研究意义】葡萄为落叶果树,落叶后芽进入自然休眠,休眠芽需要经过一定时长的低温春化作用才能萌芽整齐。解除自然休眠所需的有效低温时数即为需冷量(Chilling requirement)。需冷量具有遗传特性,不同葡萄品种的需冷量不同,国内外应用较广泛估算需冷量的3种模型分别为≤7.2℃模型、犹他模型和动力学模型(章镇等,2002;张玉斌和王惠萍,2004;王海波等,2017;刘天华,2021;黄泳碧,2023)。近年来,我国热区葡萄发展迅速,由于新模式、新技术、新设施的不断完善,葡萄种植效益逐年提高,热区葡萄产区已成为我国鲜食葡萄生产的重要力量。近20年来与全国增速相比,热区葡萄种植面积及产量的增幅均超过全国平均水平(刘俊等,2020)。但由于热区冬季温暖的气候难以满足需冷量高的葡萄品种解除休眠的低温需求,会导致春季萌芽难或萌芽不整齐、花芽发育不良等问题。目前热区主栽葡萄品种如阳光玫瑰和巨峰等需冷量均较高(章镇等,2002;刘天华,2021),因此,探究不同葡萄砧木品种需冷量及低温时长对芽休眠相关基因表达的影响,对筛选热区葡萄低需冷量砧木品种及探究葡萄萌芽进程调控机制具有重要意义。【前人研究进展】嫁接是葡萄生产上普遍采用的苗木繁殖方式,研究表明除葡萄(何爱华,2006;王海波等,2019)外,油桃(汪晓云和马永柱,2005)、梨(李璇等,2011;赵丹丹等,2015)等落叶果树的砧木也会影响砧、穗组合的需冷量。藤稔葡萄嫁接在高需冷量砧木品种DE上需冷量升高,嫁接在低需冷量砧木SO4上需冷量降低(何爱华,2006);夏黑和87-1等2个葡萄品种嫁接在101-14M砧木上其需冷量均显著低于嫁接在5C砧木上(王海波等,2019)。然而,目前有关葡萄砧木品种的需冷量的研究较少。葡萄的自然休眠为内休眠,即为休眠芽本身因素(如冷温需求和光周期影响)控制的生长停滞现象(Lang,1987),并受多种因素综合调控,其形成、维持和解除不仅受到光照、温度、水分等外界环境因素的影响,还受树体内激素、酶、糖类等内部因素调控(王新超等,2011;李瑭等,2023)。糖作为信号分子调控植物生长发育进程(Gibson,2005),在芽休眠过程中,淀粉与脱落酸(ABA)协同调控芽休眠,而糖参与赤霉素(GA)合成对芽休眠进行调控的过程(Perata etal.,1997)。葡萄在休眠期间枝梢韧皮部的碳水化合物主要以淀粉为主,随着休眠解除淀粉转化为可溶性糖,可溶性糖含量上升而淀粉含量下降,芽恢复到活跃的生长状态(Mohamed et al.,2010)。ABA促进芽的休眠诱导,芽休眠时ABA含量显著上升(Li etal.,2018),Zheng等(2015)的研究结果表明,ABA诱导因子基因VvXERICO与ABA合成关键酶基因VvNCED1的表达下调,ABA含量降低,能促进葡萄芽休眠解除。在落叶果树和杨树中,开花抑制基因SVP受ABA调节,SVP蛋白为整合ABA信号、GA生物合成和分解代谢的转录因子,以此参与落叶果树和杨树的休眠过程(Yang et al.,2021)。ABA和GA在拮抗调节芽休眠诱导、维持和解除过程中发挥重要作用,高水平ABA是维持芽休眠的首要因素,而GA负责内休眠解除(Yang et al.,2021)。GAs生物合成由多种酶共同调控,GA20-氧化酶(GA20ox)基因是GAs生物合成中的关键酶基因,可催化形成活性GAs(张加强等,2019)。由胼胝体沉积引起的胞间连丝闭合会导致植物休眠,胼胝体合成酶(CALLOSE SYNTHASE)促使胼胝质沉积,从而阻断促进萌芽的植物信号,使细胞保持休眠状态;CALLOSE SYNTHASE1能介导胞间连丝闭合以促进休眠(Singh etal.,2019)。β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)在休眠解除过程中参与胞间连丝运转状态的转变(Rinne etal.,2011),VvGLU蛋白在葡萄芽的休眠解除过程中参与胞间连丝的打开,葡萄休眠芽GLU基因家族成员中受乙烯和HC显著调控的VvGLU1基因在葡萄芽休眠解除过程中其相对表达量上升(施招婉,2019)。转基因拟南芥响应低温胁迫的重要转录因子基因LcbHLH92通过负调控花青素/原花青素的合成,从而抑制ABA合成,促使种子打破休眠(Zhao et al.,2019)。【本研究切入点】砧木品种的选择会影响葡萄接穗品种的需冷量,但目前有关不同葡萄砧木品种需冷量及低温时长对芽休眠相关基因表达影响的研究鲜见报道。【拟解决的关键问题】以贝达、5BB、SO4、101-14、110R、188-08、1103P、3309C、140R、Valliant、山河2号、BR No.2、Rupestris du Lot、Fercal和5C等15个葡萄砧木品种为试验材料,对其冬季修剪枝梢进行不同时长低温处理,用水培观察萌芽率法调查其需冷量,并测定需冷量差异较大的2个砧木品种不同低温处理下枝梢中可溶性总糖和淀粉含量及芽休眠相关基因的相对表达量,为筛选热区葡萄低需冷量砧木品种及探究葡萄萌芽进程调控机制提供理论依据。
1材料与方法
1.1试验材料
以种植于广西南宁东盟经济开发区广西真诚农业有限公司基地(23°12′2″N,108°9′9″E)的15个3年生葡萄砧木品种为试验材料,分别为贝达、5BB、SO4、101-14、110R、188-08、1103P、3309C、140R、Val-liant、山河2号、BR No.2、Rupestris du Lot、Fercal和5C,钢架大棚避雨栽培,树势健壮,管理良好。主要试剂:大生M45(80%代森锰锌)可湿性粉剂购自先正达(苏州)作物保护有限公司;多糖多酚植物总RNA提取试剂盒购自天根生化科技(北京)有限公司;PrimeScriptTM Reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒和TB Green®Pre-mix E×TaqTM II(Tli RNaseH Plus)试剂盒购自宝日医生物技术(北京)有限公司。
1.2试验方法
1.2.1试验设计于2024年1月15日冬季修剪时采样,各葡萄砧木品种选取木质化的1年生枝梢,采集自基部起第2~8节位枝梢,用浓度为0.2%的大生M45(80%代森锰锌)可湿性粉剂进行消毒,风干后将枝梢剪口两端蜡封装进自封袋中密封,放入(4±1)℃冷库中进行低温处理,预试验结果表明,低温处理216 h后,大部分砧木品种的枝段萌芽率显著高于50%,因此将低温时长处理分别设置为0、114、168、216、304、360、504、648、792和936 h,其中5BB、1103P、3309C和Repestris du Lot等4个砧木品种因枝梢数量较少,设置0、114seBr1ouzihKPgddqOhBCrA==、168和304 h等4个低温时长处理。每时长处理每品种分别随机选择10个枝梢剪成单芽段用于萌芽状态评估试验。根据需冷量测定结果选择需冷量差异较大的葡萄砧木品种测定休眠相关基因表达情况并测定淀粉和可溶性总糖含量。取10个枝梢,随机切取15个芽迅速液氮冷冻处理后置于-80℃冰箱保存,用于休眠相关基因表达测定。用于取芽的10个枝梢经烘箱干燥后磨成粉状,常温密封保存,用于测定淀粉和可溶性总糖含量,每处理每品种3个生物学重复。
1.2.2芽休眠状态评估取15个葡萄砧木品种的枝梢剪成单芽段后随机混合。去除坏芽和干瘪芽,选择完整、饱满的芽进行水培。以10个单芽段为1个重复,每处理3个重复。放入人工气候培养箱进行水培,培养条件如表1所示。每隔7 d统计1次萌芽率,3 d换水1次,连续4周观察并根据公式计算贝达、5BB、SO4、101-14、110R、188-08、1103P、3309C、140R、Valliant、山河2号、BR No.2、Rupestris du Lot、Fercal和5C等15个葡萄砧木品种各低温时长处理的萌芽率,以第4周萌芽率判断芽休眠状态,萌芽率保持在50%以上则说明休眠解除。芽萌发的判断依据为芽鳞片裂开并露出绿色组织(Or etal.,2002)。
萌芽率(%)=萌芽数/总芽数×100
1.2.3不同葡萄砧木品种抽梢期萌芽情况调查
15个葡萄砧木品种各选取生长状态一致的3株树,每株树随机选取15个冬芽作为1个重复,每品种3个重复。于2024年3月28日(萌芽抽梢期)调查并记录冬芽萌发情况及各萌发枝梢所处的发育阶段,统计处于各阶段冬芽所占比率。冬芽萌发枝梢的发育阶段分为6个阶段:休眠芽、绒毛期、初展叶、3叶、4叶和5叶,各阶段判定标准见图1。
1.2.4可溶性总糖和淀粉含量测定可溶性总糖和淀粉含量测定参考黄泳碧等(2023)的方法。
1.2.5 7个休眠相关基因的相对表达量测定从NCBI数据库查询获得7个休眠解除相关基因序列,参考序列均来源于欧亚种葡萄,以葡萄VvActin作为内参基因。部分基因(VvActin、VvCALLOSE SYNTHASE1、VvGLU1、VvNCED1和VvXERICO)的引物序列设计参考黄泳碧等(2023)的方法,其余基因在NCBI中采用Primer-BLAST设计引物,引物序列见表 进行实时荧光定量PCR检测。根据多糖多酚植物总RNA提取试剂盒说明提取样本的总RNA,以获得样品的总RNA为模板,采用PrimeScriptTM Reagent Kit with gDNA Eraser(Perfect Real time)反转录试剂盒合成第一链cDNA。反应体系20.0μL:2×TB Green®Premix E×TaqTM II(Tli RNaseH Plus)10.0μL,10μmol/L上、下游引物各0.8μL,50×ROX Reference DyeⅡ0.4μL,cDNA模板2.0μL,ddH2O 6.0μL。扩增程序:95℃预变性30 s;95℃5 s,60℃30 s,65~95℃60 min,进行40个循环。每样品设3个生物学重复,采用2-ΔΔCt法计算目的基因的相对表达量。
1.3统计分析
使用Excel 2019整理并分析数据,运用SPSS 27.0进行差异显著性分析,采用Origin 2021作图。
2结果与分析
2.1 15个葡萄砧木品种需冷量分析结果
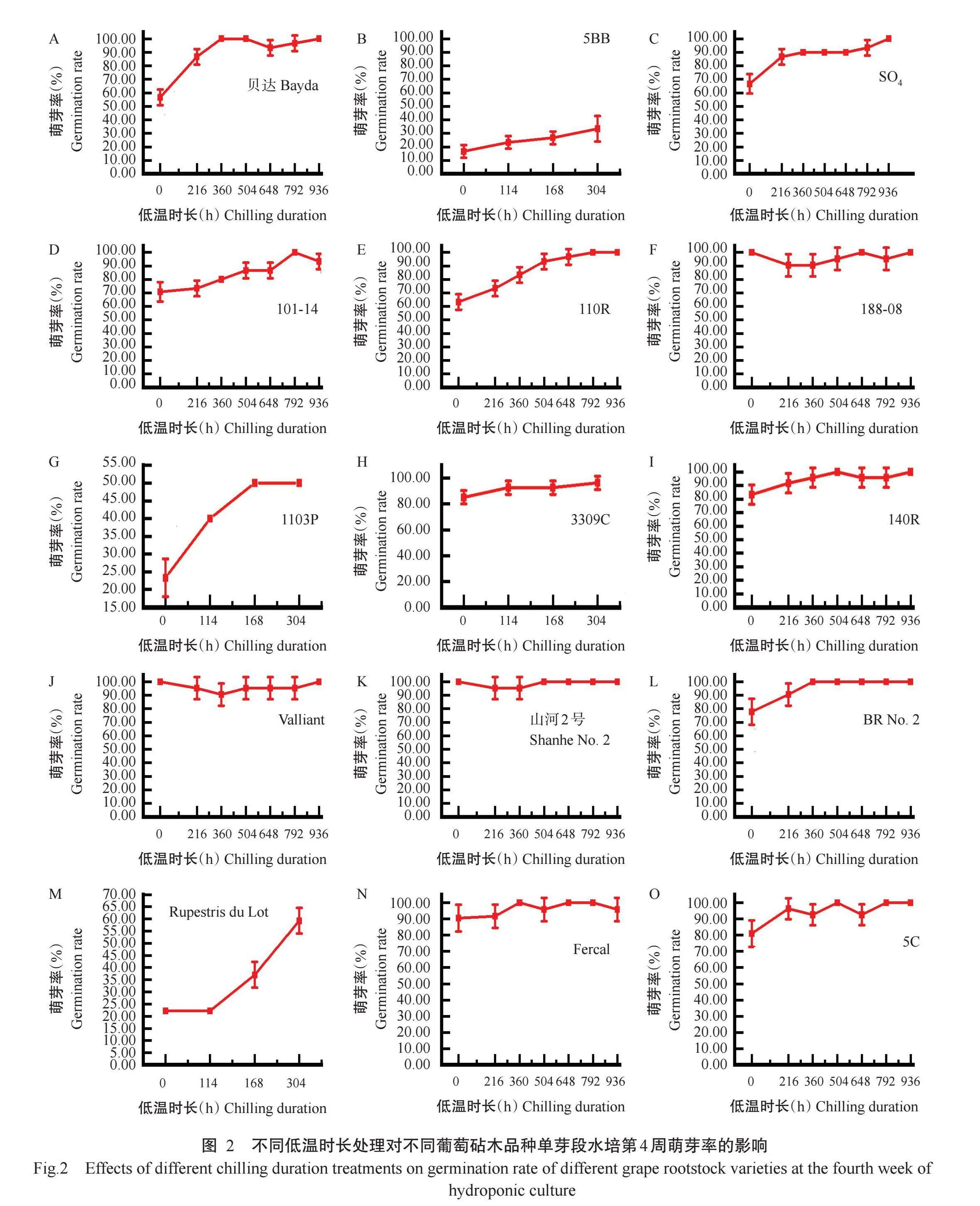
为统计不同葡萄砧木的需冷量,基于前期预试验结果设置0~936 h的不同低温时长处理,以水培第4周萌芽率大于50%作为芽休眠解除的判断标准。由图2可知,贝达、SO4、101-14、110R、188-08、3309C、140R、Valliant、山河2号、BR No.2、Fercal和5C未经低温处理的单芽段水培第4周的萌芽率均高于50.00%,分别达56.67%,66.67%、70.83%、63.33%、100.00%、85.82%、83.33%、100.00%、100.00%、77.78%、90.48%和80.95%;1103P低温处理168和304 h后的水培第4周的萌芽率均高于50.00%;Rupestris du Lot低温处理304h后的水培第4周的萌芽率达59.39%;5BB低温处理304 h,萌芽率仍低于50.00%。贝达、SO4、101-14、110R、188-08、3309C、140R、Valliant、山河2号、BR No.2、Fercal和5C不需要经过低温处理就能萌芽,因此这12个葡萄砧木品种需冷量为0h,1103P需冷量为168 h,Rupestris du Lot的需冷量为304 h,5BB的需冷量则大于304h。
综合15种葡萄砧木品种的需冷量表现,选择需冷量有差异的1103P(需冷量为168 h)和3309C(需冷量为0 h)2个葡萄砧木品种进行后续的可溶性总糖和淀粉含量测定以及休眠相关基因表达分析试验。
2.2 15个葡萄砧木品种抽梢期萌芽比率分析结果
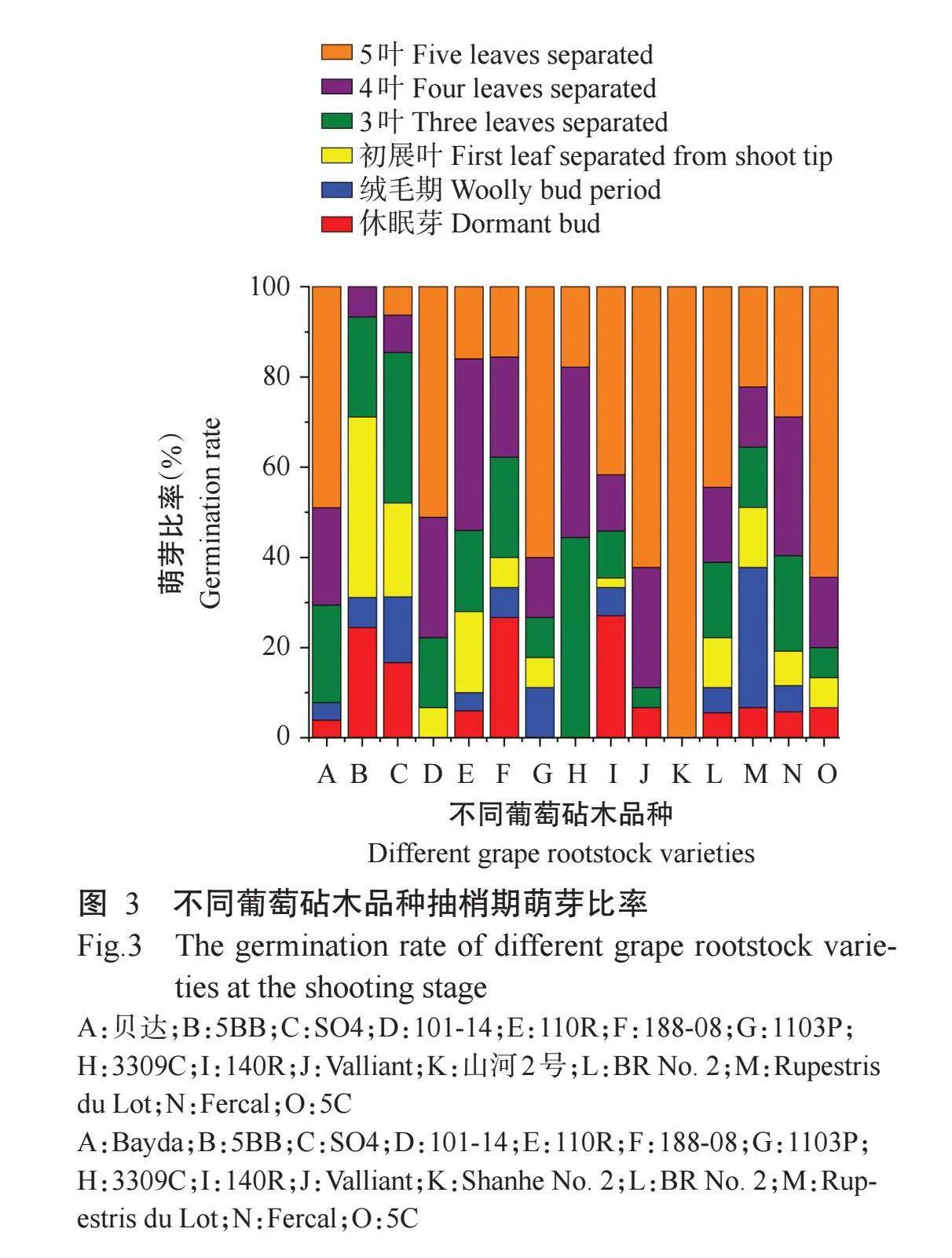
为了解15个葡萄砧木品种春季萌芽快慢的进程差异,在抽梢期(2024年3月28日)调查各品种处于不同萌芽抽梢进程的冬芽比例。由图3知,15个品种中萌芽进程最快的是山河2号,调查时其冬芽均萌发抽梢,且枝梢均处于5叶期。其他萌芽进程较快的砧木品种依次是3309C、101-14、1103P、Val-liant、5C和贝达,均有超过80%冬芽抽出的新梢处于3叶期或以上。15个品种中萌芽进程最慢的是5BB,尚未有进入5叶期的新梢,188-08和SO4萌芽较慢,均有超过30%的冬芽还处于休眠芽和绒毛期。
2.3不同低温时长对2个葡萄砧木品种枝梢中可溶性总糖及淀粉含量的影响
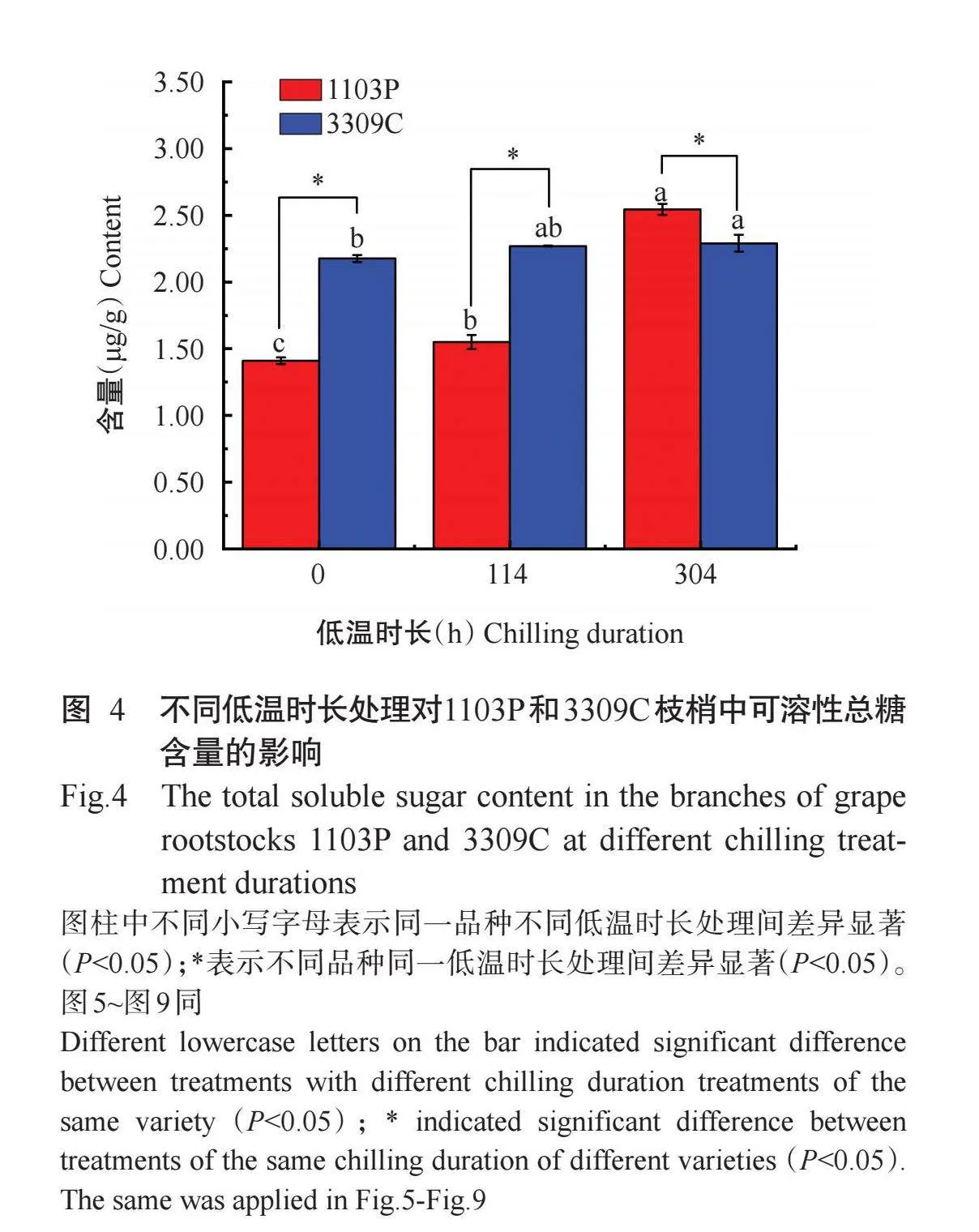
由图4可知,葡萄砧木品种1103P枝梢中可溶性总糖含量随着低温时长处理增加呈显著增加趋势(P<0.05,下同),在低温处理304h时,该品种处于休眠解除状态,枝梢中可溶性总糖含量最高,达2.55μg/g。低需冷量砧木品种3309C在测定的3个时期均处于休眠解除状态,可溶性总糖含量均在2.00~2.25μg/g范围。在未低温处理和低温处理114h时,3309C枝梢中可溶性总糖含量均显著高于1103P,低温处理304h后,3309C枝梢中可溶性总糖含量显著低于1103P,说明枝梢中可溶性总糖含量可以表征休眠解除。
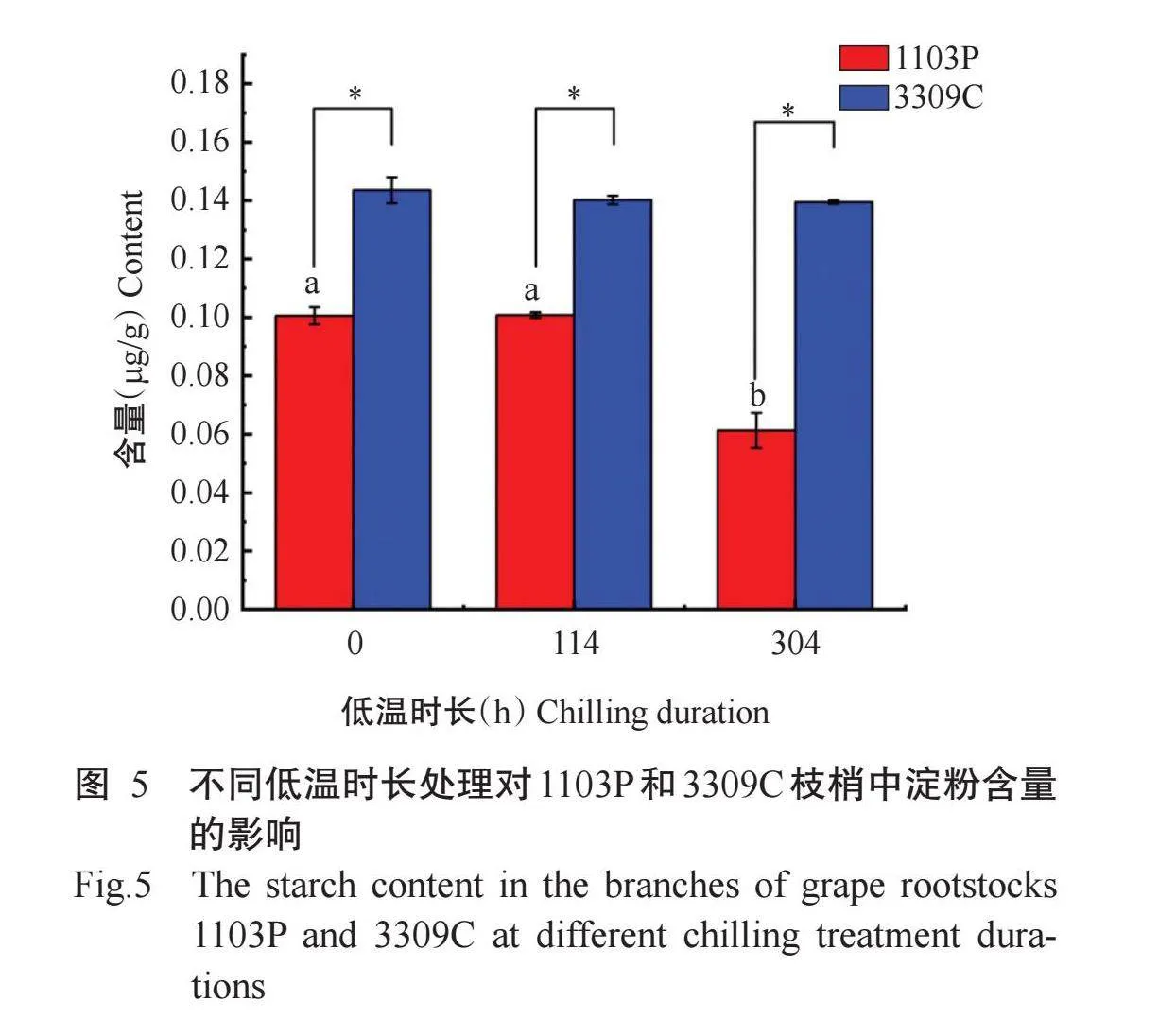
由图5可知,葡萄砧木品种1103P在未低温处理和低温处理114 h处于休眠状态时淀粉含量均为0.10μg/g,低温处理304 h,该砧木枝梢中淀粉含量显著降低,仅0.06μg/g。低需冷量的3309C在3个低温时长处理下均处于休眠解除状态,淀粉含量在
3个低温时长处理间无显著差异(P>0.05,下同)。在3个低温时长处理下3309C的淀粉含量均显著高于1103P。
2.4不同低温时长对2个葡萄砧木品种芽休眠相关基因表达的影响
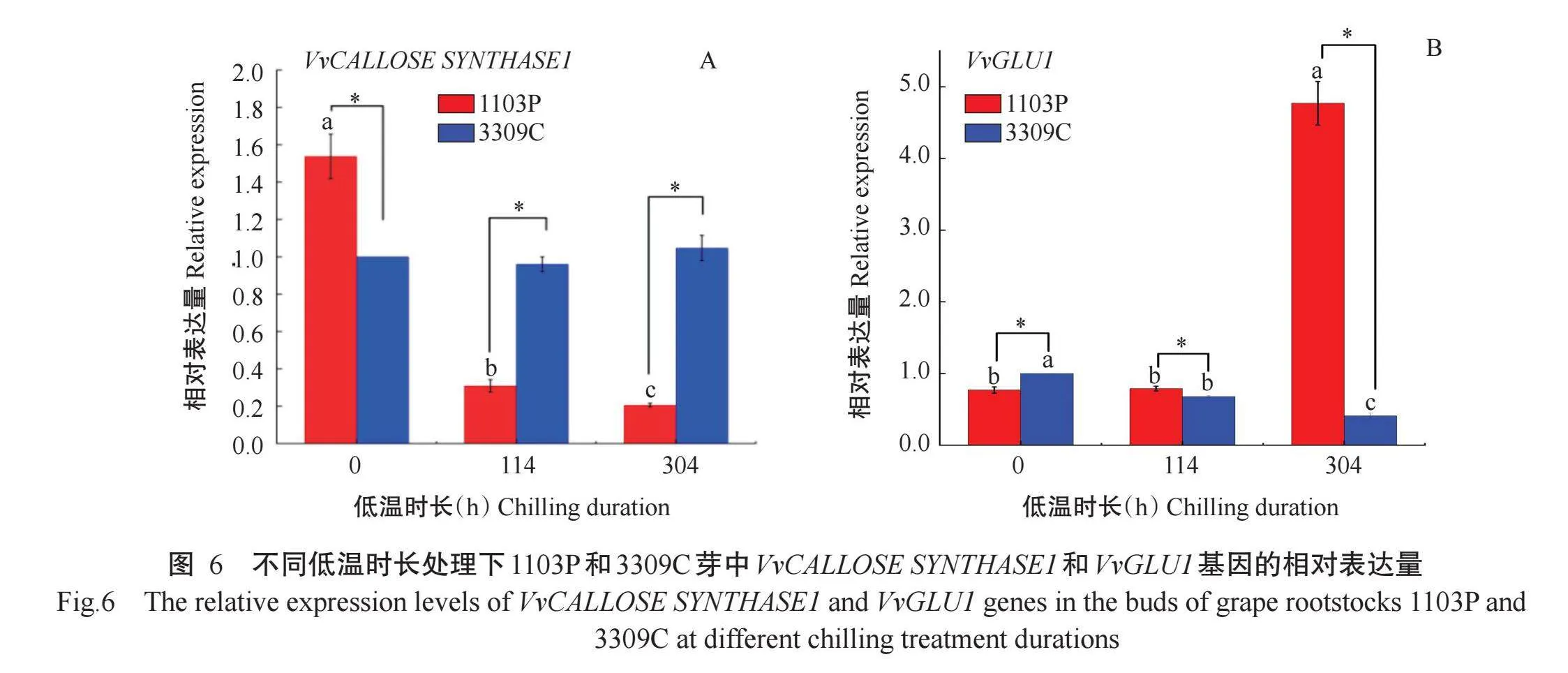
2.4.1与胞间连丝结构相关基因的表达模式由图6-A可知,葡萄砧木品种1103P随着低温时长处理的增加,VvCALLOSE SYNTHASE1基因的相对表达量显著下降。3309C在3个低温时长处理下均处于休眠解除状态,VvCALLOSE SYNTHASE1基因的相对表达量无显著变化。未低温处理的处于休眠期的1103P冬芽中VvCALLOSE SYNTHASE1基因的相对表达量均显著高于处于休眠解除状态的3309C;在低温处理114和304 h时,是需冷量为168 h的1103P休眠解除过程,VvCALLOSE SYNTHASE1基因的相对表达量均显著低于3309C。说明随着1103P芽休眠解除,芽中VvCALLOSE SYNTHASE1基因表达量下调,解除休眠的3309C芽VvCALLOSE SYNTHASE1基因表达量维持在一定水平。由图6-B可知,1103P芽中VvGLU1基因在未低温处理和低温处理114 h处于休眠状态时相对表达量较低,显著低于在低温处理304 h休眠解除时的相对表达量,说明1103P解除休眠过程中芽的VvGLU1基因的相对表达量升高。3309C芽中VvGLU1基因的相对表达量随着低温时长处理增加呈显著降低趋势。未经低温处理尚处于休眠期的1103P芽中VvGLU1基因的相对表达量显著低于处于已休眠解除状态的3309C,随着1103P休眠逐渐解除,到低温处理304h时,1103P芽中VvGLU1基因相对表达量显著高于3309C。
2.4.2 ABA合成相关基因的表达模式由图7-A可知,1103P砧木芽中VvXERICO基因的相对表达量在未低温处理时最高,随着休眠逐渐解除在低温处理114和304 h时,该基因的相对表达量均显著低于未低温处理。3309C芽中VvXERICO基因的相对表达量的变化趋势与1103P相似,即未低温处理芽中VvXERICO基因的相对表达量最高,低温处理114和304 h时VvXERICO基因的相对表达量无显著差异。而1103P低温处理114 h该基因的相对表达量显著低于低温处理304h。3个低温时长处理下3309C芽中VvXERICO基因的相对表达量均显著低于1103P。由图7-B可知,1103P芽中VvNCED1基因的相对表达量受低温时长增加的诱导显著升高,而3309C芽中VvNCED1基因的相对表达量在未低温处理和低温处理304 h时差异不显著,低温处理114 h时该基因的相对表达量显著低于其他2个低温时长处理。低温处理114和304 h时,1103P芽中VvNCED1基因的相对表达量均显著高于3309C。
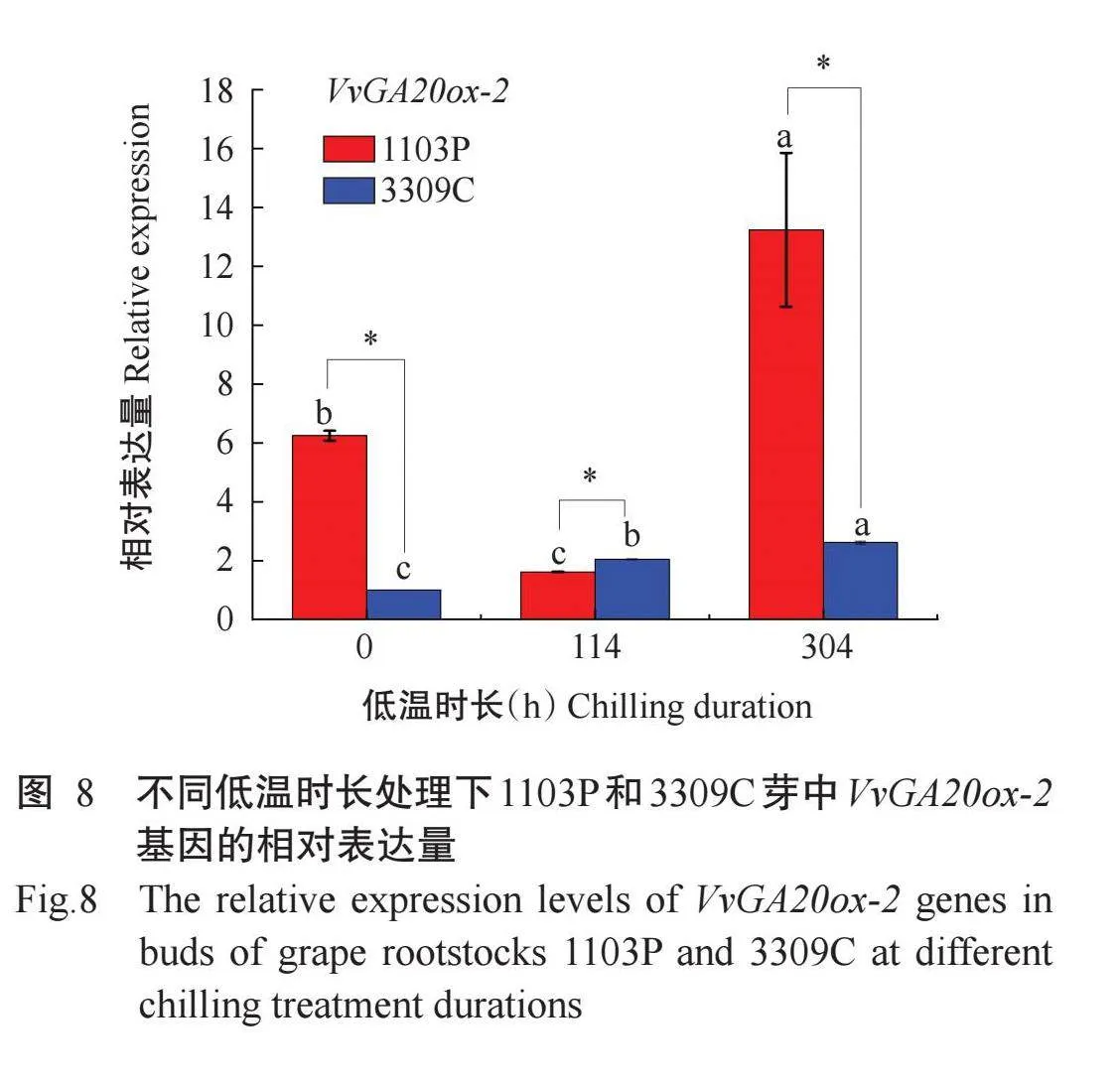
2.4.3 GA合成相关基因的表达模式由图8可知,1103P葡萄砧木芽中VvGA20ox-2基因的相对表达量在低温处理304h处于休眠解除状态时,显著高于处于休眠状态时的未低温处理和低温处理114 h。说明VvGA20ox-2基因在1103P芽休眠解除后相对表达量升高。3309C芽中VvGA20ox-2基因的相对表达量随着低温时长的增加呈显著上升趋势,说明在解除休眠的3309C中随低温时长增加该基因的相对表达量也增加。除114 h低温时长1103P芽中VvGA20ox-2基因的相对表达量显著低于3309C外,未低温处理和低温处理304h 1103P芽中VvGA20ox-2基因的相对表达量均显著高于3309C。
2.4.4其他休眠相关基因的表达模式由图9-A可知,1103P砧木芽中VvbHLH92基因的相对表达量随着低温时长处理增加呈显著上升趋势,说明Vvb-HLH92基因在1103P芽休眠解除过程中相对表达量升高。3309C芽中VvbHLH92基因的相对表达量在未低温处理时最高,显著高于114和304h低温时长处理。3个低温时长处理下1103P芽中VvbHLH92基因的相对表达量均显著高于3309C。由图9-B可知,1103P砧木在3个低温时长处理下,呈先显著降低后显著增加的变化趋势,1103P芽中VvSVP基因的相对表达量在低温处理114h最低,显著低于未低温处理和304 h时长处理,低温处理304 h的芽中该基因的相对表达量显著高于未经低温处理和低温处理114 h。3309C芽中VvSVP基因的相对表达量在3个低温时长处理间无显著差异。3个低温时长下1103P芽中VvSVP基因的相对表达量均显著高于3309C。
3讨论
油桃、梨和葡萄等果树的研究表明砧木对嫁接后的砧穗组合需冷量影响明显(汪晓云和马永柱,2005;何爱华,2006;李璇等,2011;赵丹丹等,2015;王海波等,2019)。葡萄砧木的需冷量因品种的遗传特性、根系活力不同而有所差异(王海波等,2019)。随着全球气温的上升,亟需开展对葡萄砧木品种需冷量的筛选研究,尤其是南方热区,低需冷量砧木是热区葡萄的栽培成功的基础。本研究中,贝达、SO4、101-14、110R、188-08、3309C、140R、Valliant、山河2号、BR No.2、Fercal和5C等12个砧木品种在不经过低温处理单芽段水培第4周萌芽率均在50%以上,1103P在低温处理168 h后萌芽率高于50%,Rupestris du Lot在低温处理304 h后萌芽率达到59.39%。由此可断定葡萄砧木贝达、SO4、101-14、110R、188-08、3309C、140R、Valliant、山河2号、BRNo.2、Fercal和5C的需冷量为0 h,1103P需冷量为168 h,Rupestris du Lot的需冷量为304 h,5BB的需冷量则高于304 h。本研究设置的低温时长处理未能预估出5BB砧木的需冷量,5BB是目前葡萄嫁接苗常用的砧木品种(韩晓等,2022),因此有关该砧木需冷量还有待进一步研究。本研究所用的葡萄砧木品种多为低需冷量品种,后续可进一步研究这些品种在热区的推广效果并作为资源进行低需冷量种质创制工作。
为观察不同需冷量砧木品种春季萌芽情况,本研究跟踪调查了各砧木春季萌芽情况,结果显示需冷量为0 h的各砧木品种中,山河2号萌芽最快,其他萌芽进程较快的砧木品种依次是3309C、101-14、1103P、Valliant、5C和贝达,需冷量为168 h的1103P其萌芽进程与需冷量为0的101-14相差不大,而需冷量等于或高于304 h的Rupestris du Lot和5BB萌芽进程均较慢。由此可见需冷量会影响葡萄砧木品种的萌芽进程,而需冷量相近的低需冷量品种之间的萌芽进程也有较大差异,说明低需冷量葡萄品种的萌芽生长除受需冷量影响外还受其他因素调节。
淀粉和可溶性糖在植物解除休眠的过程中存在转化关系,淀粉随着休眠解除,可转化为可溶性糖而其本身含量降低,可溶性糖含量随之上升。桃树在休眠结束时枝梢内的可溶性糖含量迅速上升,而淀粉含量则迅速下降(高东升等,1999);自然休眠解除期的甜樱桃品种拉宾斯中葡萄糖和果糖含量升高,淀粉含量迅速降低(李勃,2011)。葡萄休眠解除过程中,淀粉转化为可溶性糖,可溶性糖含量上升而淀粉含量下降(Mohamed et al.,2010)。本研究中葡萄砧木1103P和3309C在解除休眠过程中枝梢内淀粉和可溶性总糖的含量变化趋势与前人的研究结果一致,表明葡萄砧木在解除休眠过程中需要将淀粉转化为可溶性总糖,为葡萄芽萌发提供能量。
ABA和GA是调控芽休眠,维持和解除休眠的2种最重要的激素,高水平ABA是维持芽休眠的主要因素,而GA则负责芽休眠的解除(Yang,et al.,2021);在模式植物杨树中,SVP-like(SVL)作为整合ABA信号、ABA合成、GA合成、GA分解代谢和细胞分裂的中心转录因子,维持芽休眠(Singhetal.,2018;Singhetal.,2019;Azeez etal.,2021)。Yang等(2021)总结了落叶果树以DAM/SVP为中心的内休眠调控网络,结果表明ABA能促进SVP蛋白合成以维持芽休眠,SVP反过来也可以增强NCED蛋白的合成进而促进ABA的合成,同时SVP抑制GA20ox进行GA的生物合成。ABA会上调VvCALLOSE SYNTHASE1基因的表达,而VvCALLOSE SYNTHASE1促使胼胝质的沉积,从而阻断促进萌芽的植物信号(Tyle-wiczetal.,2018;Singh,et al.,2019)。Zheng等(2015)的研究结果表明,基因VvXERICO与VvNCED1相对表达量下调会降低葡萄芽中ABA含量,促进葡萄芽休眠解除。本研究结果表明,1103P葡萄砧木在休眠解除过程中芽中VvSVP基因的相对表达量先显著下降后显著上升,且在114~304 h低温范围内,是需冷量为168h的1103P休眠解除过程,此过程中,VvSVP基因受低温诱导相对表达量升高幅度最大,且VvNCED1基因的相对表达量在1103P砧木芽的休眠解除过程中显著上升,与Yang等(2021)的研究结果一致;VvGA20ox-2基因在1103P芽休眠解除后相对表达量升高,也与Yang等(2021)的研究结果一致。较未经低温处理,1103P芽VvXERICO基因相对表达量在低温处理114 h时下调,与Zheng等(2015)的研究结果一致,不同的是VvNCED1基因的表达受低温时长处理增加的诱导下显著升高,原因可能是VvNCED1基因的表达受低温时长增加诱导升高,与黄泳碧等(2023)对妮娜皇后葡萄低温处理后芽VvNCED1基因在休眠解除过程中相对表达量上升的研究结果一致,其研究还发现在休眠解除后,葡萄芽中VvNCED1基因相对表达量开始下降。本研究发现VvCALLOSE SYNTHASE1基因在1103P葡萄芽休眠解除的过程中相对表达量显著降低,与Singh等(2019)的研究结果一致。葡萄GLU家族成员中的VvGLU1基因在葡萄芽休眠解除的过程中起到重要的调节作用(施招婉,2019),本研究发现VvGLU1和VvbHLH92基因在1103P葡萄芽休眠解除的过程中相对表达量均升高,与Zhao等(2019)在转基因拟南芥中发现LcbHLH92促进种子休眠解除的结果一致,但其具体调控机制有待进一步研究。
4结论
本研究筛选出贝达、SO4、101-14、110R、188-08、3309C、140R、Valliant、山河2号、BRNo.2、Fercal和5C等12个不需经低温处理即可萌芽的砧木品种,葡萄的萌芽受品种需冷量、营养和休眠相关基因的共同调控。
参考文献(References):
高东升,夏宁,王兴安.1999.休眠桃树枝条中碳水化合物的含量变化和外源生长调节剂对破除休眠的效应(简报)[J].植物生理学通讯,(1):10-12.[Gao D S,Xia N,Wang X A.1999.Changes of carbohydrate content and effects of exogenous growth regulators on dormancy-breaking du-ring dormant period of peach shoots[J].Plant Physiology Journal,(1):10-12.]doi:10.13592/j.cnki.ppj.1999.01.003.
韩晓,邢婷婷,王军,何非.2022.不同葡萄砧穗组合硬枝嫁接亲和性及生长差异性比较[J].中外葡萄与葡萄酒,(3):1-7.[Han X,Xing T T,Wang J,He F.2022.Comparison of branch graft compatibilities and growth differences between different combinations of grapes[J].Sino-Overseas Grapevine&Wine,(3):1-7.]doi:10.13414/j.cnki.zwpp.2022.03.001.
何爱华.2006.不同砧木对藤稔葡萄需冷量的影响及休眠期内源多胺的代谢[D].扬州:扬州大学.[He AH.2006.Effects of different rootstocks on chilling requirement and endogenous polyamines metabolism during dormant period‘Fujiminori’grapes[D].Yangzhou:Yangzhou University.]doi:10.7666/d.Y927377.
黄泳碧,覃园媛,陆秀边,白扬,韩佳宇,曹雄军,白先进,廖原,张延晖,王博.2023.妮娜皇后葡萄需冷量及休眠解除过程中相关基因表达分析[J].南方农业学报,54(11):3165-3173.[Huang Y B,Qin Y Y,Lu X B,Bai Y,Han J Y,Cao X J,Bai X J,Liao Y,Zhang Y H,Wang B.2023.Chilling requirement and related gene expression analysis during dormancy release of Queen Nina grape[J].Journal of Southern Agriculture,54(11):3165-3173.]doi:10.3969/j.issn.2095-1191.2023.11.004.
李勃.2011.上海地区甜樱桃生物学特性及单氰胺打破休眠研究[D].上海:上海交通大学.[Li B.2011.Studies on the biological characteristics of sweet cherry in Shanghai and the effect of hygrogen cyanamide on dormancy brea-king[D].Shanghai:Shanghai Jiaotong University.]
李瑭,白瑞雯,邹利人,闫可,申海林,齐晓光,温景辉.2023.葡萄采后摘叶处理对诱导休眠的影响[J].中外葡萄与葡萄酒(2):30-36.[Li T,Bai R W,Zou L R,Yan K,Shen H L,Qi X G,Wen J H.2023.Effects of leaf picking on post-harvest grapevine inducing dormancy[J].Sino-Overseas Grapevine&Wine,(3):30-36.]doi:10.13414/j.cnki.zwpp.2023.02.005.
李璇,孙权,赵辉,陆新敏,冯轶,韦军.2011.砧木对梨叶芽休眠的影响及其与多胺代谢的关系[J].植物生理学报,47(5):463-467.[Li X,Sun Q,Zhao H,Lu X M,Feng Y,Wei J.2011.Effects of rootstocks on the dormancy of leaf buds in pear trees(Pyrus serotina cv.‘Housui’)and itsrelation to polyamine metabolism[J].Plant Physiology Jour-nal,47(5):463-467.]doi:10.13592/j.cnki.ppj.2011.05.005.
刘俊,晁无疾,亓桂梅,刘寅喆,汉瑞峰.2020.蓬勃发展的中国葡萄产业[J].中外葡萄与葡萄酒,(1):1-8.[Liu J,Chao W J,Qi G M,Liu Y Z,Han R F.2020.Booming develop-ment of Chinese grape industry[J].Sino-Overseas Grape-vine&Wine,(1):1-8.]doi:10.13414/j.cnki.zwpp.2020.01.001.
刘天华.2021.不同成熟期葡萄品种需冷量比较分析与生物标记开发[D].南京:南京农业大学.[Liu T H.2021.Comparative analysis and biomarker development of grape varieties in different maturity stages[D].Nanjing:Nanjing Agricultural University.]doi:10.27244/d.cnki.gnjnu.2021.001098.
施招婉.2019.葡萄芽休眠解除过程中乙烯合成与信号途径关键基因的筛选与功能分析[D].广州:华南农业大学.[Shi Z W.2019.Screening and functional analysis of key genes involved in ethylene biosynthesis and signaling path-ways during grape bud dormancy release[D].Guangzhou:South China Agricultural University.]doi:10.27152/d.cnki.ghanu.2019.000945.
汪晓云,马永柱.2005.日光温室栽培油桃中间砧木休眠特性对接穗开花和果实成熟期的影响[J].农村实用工程技术(温室园艺),(11):24-25.[Wang X Y,Ma Y Z.2005.Effects of dormancy characteristics of nectarine interstockson scion flowering and fruit ripening in greenhouse[J].Rural Practical Engineering Technology(Greenhouse Hor‐ticulture),(11):24-25.]doi:10.3969/j.issn.1673-5404-B.2005.11.006.
王海波,韩晓,王孝娣,史祥宾,王宝亮,郑晓翠,王志强,冀晓昊,刘凤之.2019.不同砧木对87-1和‘夏黑’设施葡萄品种需冷量的影响研究[J].中国果树,(5):46-49.[Wang H B,Han X,Wang X D,Shi X B,Wang B L,Zheng X C,Wang Z Q,JiH82Y/ZFvEPlRIMP/QoM78GAdiKTqoCw87MCN6afrvPI= X H,Liu F Z.2019.Effect of different root‐stocks on chilling requirement of 87-1 and‘Summer Black’grape cultivars in greenhouse[J].China Fruits,(5):46-49.]doi:10.16626/j.cnki.issn 1000-8047.2019.05.010.
王海波,刘凤之,韩晓,谢计蒙,王孝娣,王宝亮.2017.葡萄需冷量和需热量估算模型及设施促早栽培品种筛选[J].农业工程学报,33(17):187-193.[Wang H B,Liu F Z,Han X,Xie J M,Wang X D,Wang B L.2017.Grape chil-ling requirement estimated models and heat requirement estimated models and selection of early cultivars in green‐house[J].Transactions of the Chinese Society of Agricul‐tural Engineering,33(17):187-193.]doi:10.11975/j.issn.1002-6819.2017.17.025.
王新超,马春雷,杨亚军.2011.多年生植物的芽休眠及调控机理研究进展[J].应用与环境生物学报,17(4):589-595.[Wang X C,Ma C L,Yang Y J.2011.Progress in research on bud dormancy and its regulation mechanisms in peren‐nial plants[J].Chinese Journal of AppliedV4Qhmu1XtXNs6vxSvEjAjoN2cKVsj/Gf2LcWBHZmkwE= and Environ‐mental Biology,17(4):589-595.]
张加强,刘慧春,周江华,谭晨,朱开元.2019.植物赤霉素氧化酶GA20ox基因的生物信息学分析[J].分子植物育种,17(15):4986-5002.[Zhang J Q,Liu H C,Zhou J H,Tan C,Zhu K Y.2019.Bioinformatics analysis of gibberellin oxidase GA20ox gene in plants[J].Molecular Plant Bree-ding,17(15):4986-5002.]doi:10.13271/j.mpb.017.004986.
张玉斌,王惠萍.2004.设施葡萄主栽品种需冷量测定及其应用研究[J].甘肃林业科技,(1):25-27.[Zhang Y B,Wang H P.2004.Measurement and practical study on cold requirement of major culture varieties in the culture of greenhouse grape[J].Journal of Gansu Forestry Science and Technology,(1):25-27.]doi:10.3969/j.issn.1006-0960.2004.01.008.
章镇,高志红,盛炳成,周莉莉,王璐,聂赟.2002.葡萄不同品种需冷量研究初报[J].中国果树,(3):18-20.[Zhang Z,Gao Z H,Sheng B C,Zhou L L,Wang L,Nie Y.2002.Pre‐liminary study on chilling requirement of different grape varieties[J].China Fruits,(3):18-20.]doi:10.16626/j.cnki.issn 1000-8047.2002.03.008.
赵丹丹,赵辉,吴自然,柯增增,苏杨映兰,韦军.2015.砧木对梨叶芽休眠的影响及其需冷量估算方法的统计评价[J].西北农业学报.24(6):67-74.[Zhao D D,Zhao H,Wu Z R,Ke Z Z,Su YY L,Wei J.2015.Effects of rootstocks on dormancy of pear leaf buds and statistic evaluation foresti‐mating methods of chilling requirement[J].Acta Agricul‐turaeBoreali-Occidentalis Sinica,24(6):67-74.]doi:10.7606/j.issn.1004-1389.2015.06.011.
Azeez A,Zhao Y C,Singh R K,Yordanov Y S,Dash M,Mis‐kolczi P,StojkovičK,Strauss S H,Bhalerao R P,Busov V B.2021.EARLY BUD-BREAK1 and EARLY BUD-BREAK3 control resumption of poplar growth after winter dormancy[J].Nature Communications,12(1):1123.doi:10.1038/s41467-021-21449-0.
Gibson S I.2005.Control of plant development and gene expression by sugar signaling[J].Current Opinion in Plant Bio82bf5a7fa13bc61a21d004db0ba1ddd3logy,8(1):93-102.doi:10.1016/j.pbi.2004.11.003.
Lang G,Early J,Martin G,Darnell R.1987.Endo-,para-,and ecodormancy:Physiological terminology and classification for dormancy research[J].Hortscience,22(3):371-377.doi:10.21273/HORTSCI.22.3.371.
Li J Z,Xu Y,Niu Q F,He L F,Teng Y W,Bai S L.2018.Abscisic acid(ABA)promotes the induction and mainte‐nance of pear(Pyrus pyrifolia white pear group)flower bud endodormancy[J].International Journal of Molecular Sciences,19(1):310.doi:10.3390/ijms 19010310.
Mohamed H B,Vadel A M,Geuns J M C,Khemira H.2010.Biochemical changes in dormant grapevine shoot tissues in response to chilling:Possible role in dormancy release[J].Scientia Horticulturae,124(4):440-447.doi:10.1016/j.scie-nta.2010.01.029.
Or E,Vilozny I,Fennell A,Eyal Y,Ogrodovitch A.2002.Dor‐mancy in grape buds:Isolation and characterization of cata‐lase cDNA and analysis of its expression following chemi‐cal induction of bud dormancy release[J].Plant Science,162(1):121-130.doi:10.1016/S0168-9452(01)00542-8.
Perata P,Matsukura C,Vernieri P,Yamaguchi J.1997.Sugar repression of a gibberellin-dependent signaling pathway in barley embryos[J].Plant Cell,9(12):2197-2208.doi:10.1105/tpc.9.12.2197.
Rinne P L H,Welling A,Vahala J,Ripel L,Ruonala R,Kangas‐jarvi J,Schoot C V D.2011.Chilling of dormant buds hyperinduces FLOWERING LOCUS T and recruits GA-inducible 1,3-beta-glucanases to reopen signal conduits and release dormancy in Populus[J].Plant Cell,23(1):130-146.doi:10.1105/tpc.110.081307.
Singh R K,Maurya J P,AzeezA,Miskolczi P,Tylewicz S,Sto‐jkovičK,Delhomme N,Busov V,Bhalerao R P.2018.A genetic network mediating the control of bud break in hybrid aspen[J].Nature Communications,9(1):4173.doi:10.1038/s41467-018-06696-y.
Singh R K,Miskolczi P,Maurya J P,Bhalerao R P.2019.Atree ortholog of SHORT VEGETATIVE PHASE floralrepressor mediates photoperiodic control of bud dormancy[J].Current Biology,29(1):128-133.doi:10.1016/j.cub.2018.11.006.
Tylewicz S,PetterleA,Marttila S,Miskolczi P,AzeezA,Singh R K,Immanen J,Mähler N,Hvidsten T R,Eklund D M,Bowman J L,Helariutta Y,Bhalerao R P.2018.Photope-riodic control of seasonal growth is mediated by ABA acting on cell-cell communication[J].Science,360(6385):212-215.doi:10.1126/science.aan8576.
Yang Q S,Gao Y H,Wu X Y,Moriguchi T,Bai S L,Teng Y W.2021.Bud endodormancy in deciduous fruit trees:Advances and prospects[J]dfGRxZ3WE4+kvikHdfbteg==.Horticulture Research,8(1):139.doi:10.1038/s41438-021-00575-2.
Zhao P C,Li X X,Jia J T,Yuan G X,Chen S Y,Qi D M,Cheng L Q,Liu G S.2019.bHLH92 from sheepgrass acts as a negative regulator of anthocyanin/proanthocyandin accumulation and influences seed dormancy[J].Journal of Experimental Botany,70(1):269-284.doi:10.1093/jxb/ery335.
Zheng C L,Halaly T,Acheampong A K,Takebayashi Y,Jiku‐maru Y,Kamiya Y,Or E.2015.Abscisic acid(ABA)regu‐lates grape bud dormancy,and dormancy release stimuli may act through modification of ABA metabolism[J].Jour‐nal of Experimental Botany,66(5):1527-1542.doi:10.1039/jxb/eru519.
(责任编辑李洪艳)

