复方玉液汤通过调控PI3K/Akt 信号通路抑制糖尿病大鼠心肌细胞凋亡和炎症反应
摘要:目的 运用网络药理学技术分析复方玉液汤防治糖尿病心肌病(DCM)的作用机制,并通过动物实验进行验证。方法 利用TCMSP数据库检索复方玉液汤所含6种中药(黄芪、山药、知母、葛根、五味子、天花粉)中的化学成分,根据口服生物利用度(OB)和药物相似性(DL)筛选出活性化学成分以及与DCM相关的靶点;利用Drugbank、Gene Cards、OMIM和PharmGKb数据库获取与DCM相关靶点;STRING数据库对核心靶点进行PPI网络的构建和分析;Metascape进行核心靶点的GO和KEGG富集分析;利用Cytoscape3.9.1构建“中药-关键成分-核心靶点-关键通路”网络,并对核心靶点对接的关键成分进行分子对接。建立糖尿病心肌病Wistar 大鼠动物模型,将大鼠分为正常组、模型组、玉液汤低剂量组(YYT-低组,0.29 g/kg)、玉液汤高剂量组(YYT-高组,1.15 g/kg),15只/组,药物剂量为生药含量。给药8周后观察各组大鼠的心脏组织病理切片,检测各组大鼠心脏电生理变化、血清中的LDH、CK、CK-MB含量变化以及心脏组织中PI3K、P-PI3K、Akt、P-AKT、BAX、IL-6、TNF-α 蛋白的表达情况。结果 筛选后得到复方玉液汤中61个活性化合物,1057个靶点;3682个DCM相关疾病靶点,共同靶点551个。根据筛选获得的核心靶点富集得到的核心通路发现,凋亡和炎症及相关PI3K/Akt信号通路可能是治疗DCM的关键信号通路;分子对接结果显示,金色酰胺醇酯、山柰酚等活性成分与AKT1和PIK3R1的结合活性较好。利用动物实验对筛选的靶点及通路进行验证,结果显示,与DCM模型组大鼠比较,复方玉液汤能改善模型大鼠心肌组织细胞紊乱及炎性浸润的病理特征,降低模型大鼠血清中LDH、CK、CK-MB水平及模型大鼠心脏组织中BAX、IL-6、TNF-α的蛋白含量并升高P-PI3K和P-AKT的蛋白含量(Plt;0.05)。结论 复方玉液汤防治DCM是多成分、多靶点和多信号通路共同作用的结果。复方中主要活性成分金色酰胺醇酯、山柰酚等通过调控PI3K/Akt信号通路,抑制DCM发病过程中心肌细胞凋亡及炎症反应,发挥对DCM的保护作用。
关键词:网络药理学;复方玉液汤;糖尿病心肌病
目前,西药对于糖尿病心肌病(DCM)的治疗尚无特效药物,临床上主要通过降血糖、降血脂、调节血压和促进胰岛素分泌来降低罹患DCM的风险[1]。研究证实中药黄芪、葛根、丹参和当归[2-4],以及复方丹参饮、活血降糖饮、黄芪养血方等广泛用于DCM的预防与治疗中,且取得良好的疗效[5, 6]。
复方玉液汤出自张锡纯所著的《医学衷中参西录》,该方由黄芪、山药、葛根、知母、五味子、天花粉和鸡内金共7味中药组成,该方具有益气生津,补脾固肾的功效[7]。以复方玉液汤为基础进行加减的复方可通过益气滋阴、培补脾肾法,防治DCM因气阴两虚导致的虚火内生、气虚乏力、胸闷心痛等症,为复方玉液汤防治DCM提供了中医理论支撑[8, 9]。有实验研究表明,通络玉液汤可以通过降低转化生长因子(TGF-β1)的表达抑制心肌纤维化,降低超氧化合物歧化酶(SOD)的水平抑制氧化应激反应,减轻DCM的心肌损伤,改善心功能[10]。尽管现有研究对复方玉液汤防治DCM已经作出了一些解释,但对于其防治DCM的具体作用机制仍不不明确,是否还存在其它途径可改善DCM仍不清晰,需进一步探索。
本研究拟采用网络药理学技术探讨复方玉液汤防治DCM的作用及机制,并通过动物实验进一步验证,为防治DCM的新药研究以及复方玉液汤的开发利用提供理论依据。
1 材料和方法
1.1 网络药理学方法
1.1.1 复方玉液汤中化学成分的检索
利用TCMSP信息数据平台,以“黄芪”、“山药”、“知母”、“葛根”、“五味子”和“天花粉”为关键词对上述中药的化学成分进行检索,对检索结果进一步设置筛选条件:口服生物利用度(OB)≥30%,药物相似性(DL)≥0.18,筛选所获得的化学成分即为复方玉液汤的主要活性成分。利用SwissTargetPrediction数据库对所得活性成分进行靶点预测,所得即为复方玉液汤中活性成分的潜在作用靶点。
1.1.2 复方玉液汤防治DCM 潜在靶点的筛选
以“Diabetic cardiomyopathy”为关键词,利用Drugbank、Gene Cards、OMIM和PharmGKb 数据库对DCM疾病的相关靶点进行检索。将预测所得的复方玉液汤作用靶点与DCM作用靶点进行筛选,去除重复靶点后,导入在线的交互式韦恩图分析平台中进行分析,二者交集部分即为复方玉液汤防治DCM的潜在作用靶点。
1.1.3 PPI互作网络的构建
将筛选获得的交集靶点对应的基因名称导入“STRING”数据库中,物种选择“人”进行分析,为确保所得数据的准确性,设置最小相互作用得分高于0.9的置信区间,去除游离靶点。将所得数据以TSV数据格式导出并导入Cytoscape3.9.1软件中,利用插件CytoNCA中的Degree 值算法对核心靶点进行排序,筛选出核心靶点。分别对排名前100、前38和前10的蛋白进行可视化处理。
1.1.4 GO生物功能和KEGG通路富集分析
将所获得的551个交集部分基因导入到Metascape数据库中,物种选择“人”,进行GO和KEGG富集分析。筛选排名前5的BP、CC、MF以及排名前20的信号通路利用微生信在线生物信息分析平台进行可视化处理。
1.1.5 “中药-关键活性成分-核心靶点-关键通路”网络图的构建
依据PPI筛选得到的前100个核心靶点与成分进行对接,根据度值筛选得到排名前15 的关键活性成分。将关键成分、核心靶点和排名前10 的信号通路导入到Cytoscape3.9.1软件中,进行“中药-关键成分-核心靶点-关键通路”的网络图可视化。
1.1.6 分子对接
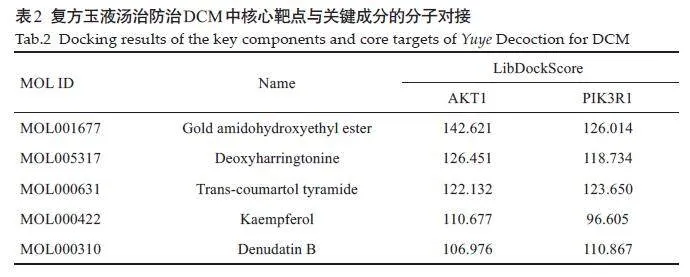
基于Discovery Studio软件,对筛选能与核心靶点结合度最高的化合物进行分子对接。从Pubchem数据库中获取关键成分的mol2 结构,RCSBPDB 数据库中获取核心蛋白的晶体结构。利用Discovery Studio 2019 软件对蛋白质和化合物的结构进行处理。LibDock插件对结合度进行评分,评分越高说明蛋白与化合物的结合性越好,对分子对接结果进行可视化,绘制2D和3D结合图。
1.2 动物实验
1.2.1 实验材料
中药饮片(新疆维吾尔族自治区百草堂大药房);高糖高脂饲料(66.5%普通饲料,20%蔗糖,10%猪油,2.5%胆固醇,1%胆酸盐)(北京博爱港生物技术有限公司);链脲佐菌素(STZ,meilunbio);兔抗Bax 和GAPDH(武汉三鹰生物技术有限公司);兔抗IL-6 和TNF-α(Affinity)。全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司);血糖仪(鱼跃医疗设备有限公司);生物组织脱水机、包埋机、切片机(益迪医疗设备有限公司)。
1.2.2 动物饲养
85 只SPF级雄性Wistar大鼠,体质量200±20 g,购于新疆医科大学动物实验中心[生产许可证号:SCXK(新)2018-0002;使用许可证号:SCXK(新)2018-0003;伦理审批号:IACUC-20210303-09],饲养于新疆医科大学动物实验中心屏障环境内。
1.2.3 复方玉液汤供试品的制备
按照课题组前期优化后的工艺(10倍量的水,回流提取2.5 h,回流2次)对复方玉液汤进行提取,冷冻干燥后备用[11]。
1.2.4 造模及给药方法
将85 只大鼠分为正常组(n=15)、模型组(n=70),普通饲料适应性喂养3 d。模型组大鼠更换高糖高脂饲料持续性喂养4 周后,单次腹腔柠檬酸缓冲液配置的STZ(25 mg/kg),正常组腹腔注射等体积的柠檬酸缓冲液。1 周后测量随机血糖值≥16.7 mmol/L视为糖尿病大鼠模型造模成功。模型组中共有57 只大鼠血糖值达标,排除因酮症酸中毒或低血糖症出现死亡或健康状态较差的大鼠,从中选取45只血糖达标且较为健康的大鼠作为进一步给药干预实验并继续喂养8周。模型建立后,按照体质量和血糖将模型组大鼠随机分为DCM模型组、复方玉液汤低剂量组(YYT-低组,0.29 g/kg)和复方玉液汤高剂量组(YYT-高组,1.15 g/kg)(药物剂量为生药含量),15只/组,继续高脂饲料喂养8周,正常组给予普通饲料喂养8周。期间,复方玉液汤组按照5 mL/kg连续灌胃给药8周,正常组和模型组灌胃相同体积的生理盐水。8周后对模型组大鼠进行心电图检测,结果显示模型组大鼠心电图中ST段显著抬高,QRS间期和QT间期延长,说明模型组大鼠心功能异常,DCM大鼠模型建立成功。
1.2.5 大鼠血糖的动态监测
每周固定时间点对所有大鼠进行血糖检测。检测前用酒精试纸将大鼠尾尖擦拭干净,酒精挥发后,手术剪将大鼠尾尖1~2 mm处剪开一小口,自然流出的血液滴到血糖试纸上(保证血液和血糖试纸干净),血糖仪进行检测读数,记录好血糖数据。动态监测各组大鼠的血糖变化。
1.2.6 样本采集
8 周后,腹腔注射2%的戊巴比妥钠(50 mg/kg)麻醉大鼠。腹主动脉取血,置于不加抗凝剂的采血管中,室温静置30 min,离心,取上层血清于-80 ℃冰箱保存待测。取出大鼠心脏,生理盐水冲洗净,取部分固定于4%的多聚甲醛中,剩余部分置于液氮中快速冷冻,转移至-80 ℃冰箱中保存。
1.2.7 心脏的组织病理学观察
取出固定于4%多聚甲醛中的心脏组织,脱水、包埋、切片,于60 ℃的烘箱中脱蜡后进行HE染色,在光镜下观察大鼠心脏组织的病理学变化。
1.2.8 大鼠心脏电生理数据
利用心电图仪联合BL-420S生物机能实验系统采集各组大鼠的心电图,并分别记录各组大鼠的心率(HR)、QRS间期、ST段波幅和QT间期数值。
1.2.9 大鼠血清中生理指标的测定
利用全自动生化分析仪检测各组大鼠血清中LDH、CK、CK-MB的含量变化。
1.2.10 Western blotting
取冻存的大鼠心肌组织,称取约50 mg,加入RIPA组织裂解液,提取大鼠左心室总蛋白。BCA法进行蛋白定量分析。配置分离胶与浓缩胶,心肌组织总蛋白以20 μg/孔上样进行电泳分离、转膜、5%脱脂奶粉封闭2 h、一抗4 ℃孵育过夜、二抗室温孵育1 h;滴加ECL发光液曝光显影。Image J软件分析条带灰度值。
1.3 统计学分析
采用SPSS 23.0对实验数据进行统计分析,所有数据均采用均数±标准差表示。多组间比较采用单因素方差分析,若方差齐采用LSD 法,若方差不齐采用Tamhane's T2统计结果,以Plt;0.05为差异有统计学意义。
2 结果
2.1 复方玉液汤中活性化合物的筛选
从TCMSP数据库中,以OB≥30%和DL≥0.18为筛选条件,共得到复方玉液汤中61种活性成分,其中黄芪19种,山药14种,知母15种,葛根3种,五味子8种,天花粉2种。
2.2 复方玉液汤和DCM的交集靶点
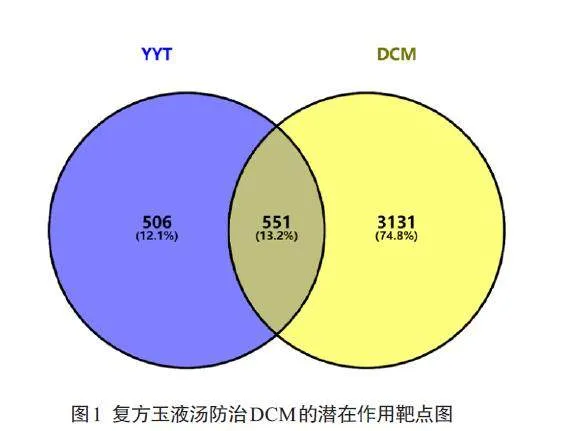
将复方玉液汤活性成分的作用靶点和DCM疾病相关靶点取交集,得到交集靶点551 个,运用Venny 在线分析平台进行绘图(图1)。
2.3 PPI互作网络的构建和分析
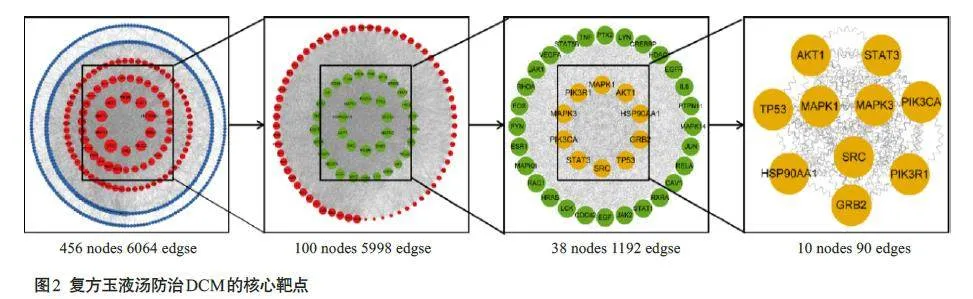
PPI分析获得排名前100的蛋白共包括5998条边,前38的蛋白包括1192条边,前10的蛋白包括90条边。最终获得网络中关联度最强的10 个蛋白靶点分别是AKT1、STAT3、TP53、MAPK1、MAPK3、PIK3CA、SRC、HSP90AA1、PIK3R1、GRB2(图2)。
2.4 GO富集分析及KEGG通路富集分析
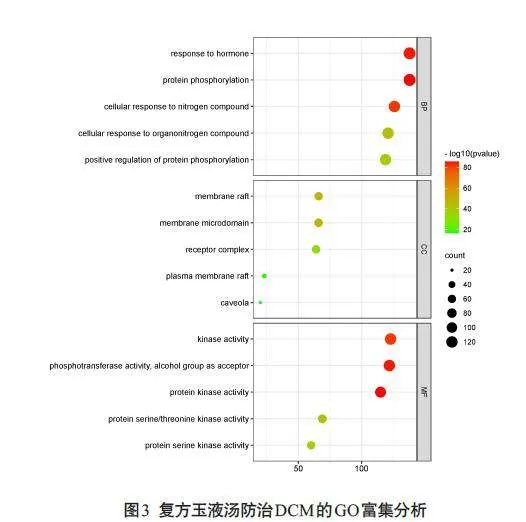
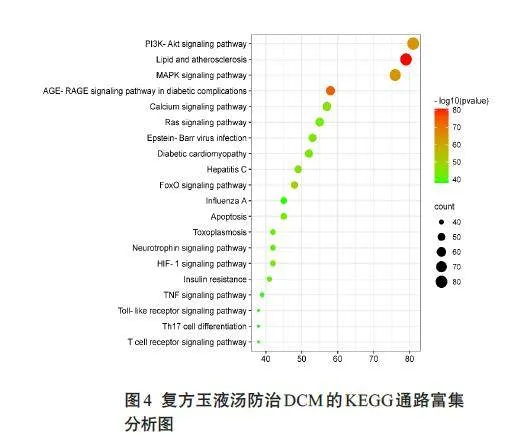
GO分析结果发现:参与生物过程(BP)的有8301项,包括对蛋白质磷酸化、激素反应、细胞对氮化合物反应等生物过程的调控上;792个细胞组分(CC),主要以膜筏、膜微区和质膜筏为主;1743项与分子功能(MF)相关,体现在蛋白激酶活性、醇基为受体的磷酸转移酶活性和激酶活性等功能(图3)。KEGG富集得到314条信号通路,其中前20条的信号通路,主要涉及脂质和动脉粥样硬化、PI3K-Akt 信号通路、糖尿病并发症中的AGE-RAGE信号通路、凋亡及TNF-α等炎症信号通路(图4)。
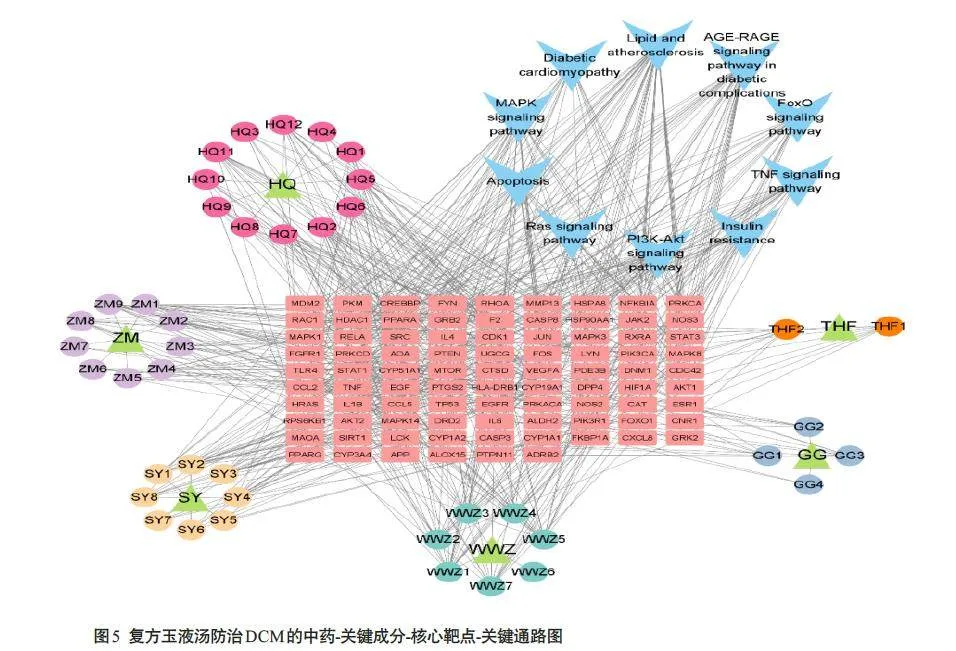
2.5 中药-关键成分-核心靶点-关键通路网络构建
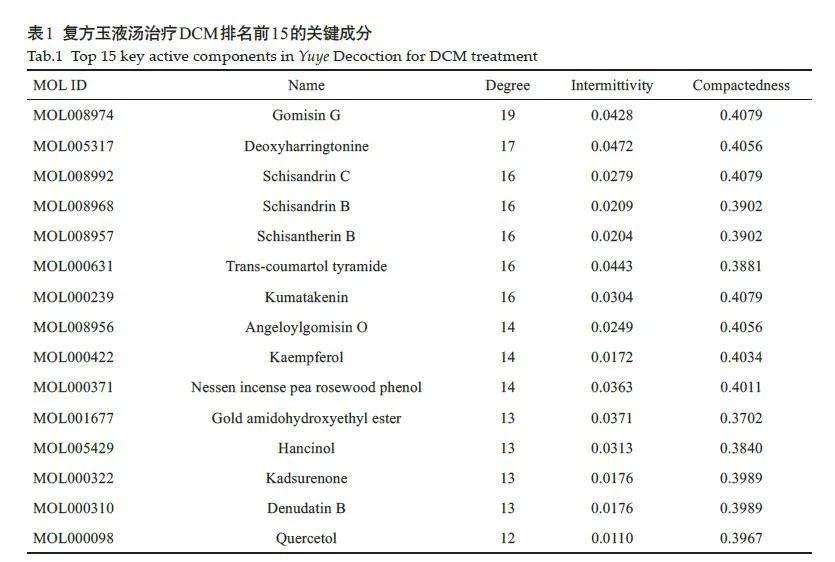
将获得的87个核心靶点、42个关键成分、6种中药和10 条信号通路导入Cytoscape 软件,构建中药-关键成分-核心靶点-关键通路网络的可视化分析(图5)。Network Analyzer分析获得排名前15的关键成分(表1)。
2.6 分子对接验证
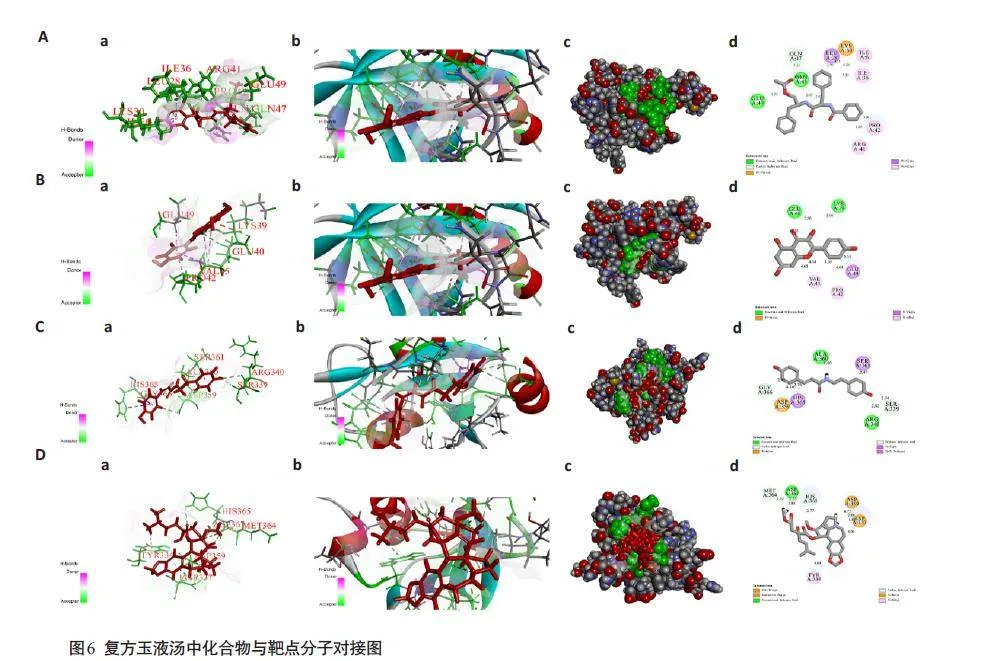
关键成分金色酰胺醇酯、山柰酚、反式香豆酰酪胺和脱氧三尖杉酯碱与核心靶点AKT1 和PIK3R1 的Libdockscore 评分较高(表2),对接结果良好。选取其中的金色酰胺醇酯和山柰酚与AKT1、反式香豆酰酪胺和脱氧三尖杉酯碱与PIK3R1 的对接结果进行可视化处理,绘制对接的3D与2D模式图(图6)。
2.7 复方玉液汤对DCM大鼠的影响
2.7.1 动态血糖变化
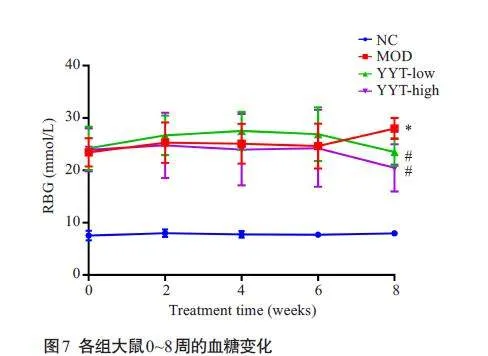
0~8周,正常组大鼠的随机血糖值稳定且均低于10 mmoL/L,而模型组和给药组大鼠在注射STZ后随机血糖值均高于20 mmoL/L。经8 周给药后,与模型组大鼠相比,正常组大鼠的随机血糖值降低(Plt;0.05);同时与模型组大鼠相比,YYT-低组和YYT-高组大鼠的随机血糖值也降低(Plt;0.05,图7)。
2.7.2 大鼠心肌组织的病理学分析
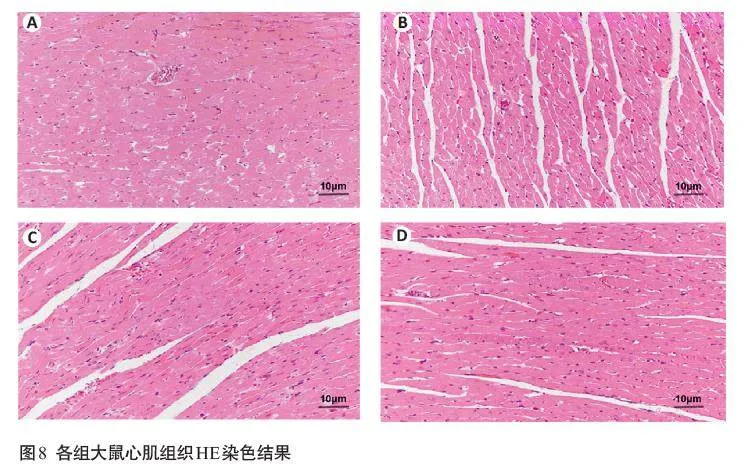
HE染色结果显示(图8),正常组大鼠的心肌组织正中心肌细胞排列整齐紧密,心肌束形态完整,心肌纤维分布均匀。模型组大鼠的心肌细胞排列紊乱且间隙增大、行走方向各异,心肌细胞有明显肥大,且有心肌纤维断裂坏死的现象,并有炎性细胞浸润。与模型组相比,YYT-低组、YYT-高组对于大鼠心肌组织出现的病理现象均有不同程度的缓解,其中YYT-高组的治疗作用更为明显。
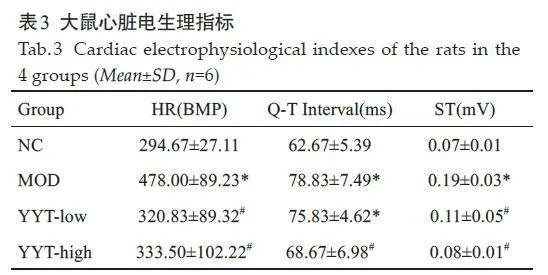
2.7.3 大鼠心脏电生理指标变化
与正常组比较,模型组大鼠心率、QT间期和ST段波幅升高(Plt;0.05,表3)。而复方玉液汤低剂量、高剂量均能在一定程度降低模型大鼠心率、缩短QT间期时间、降低ST段波幅的升高。
2.7.4 各组大鼠血清生化指标的变化
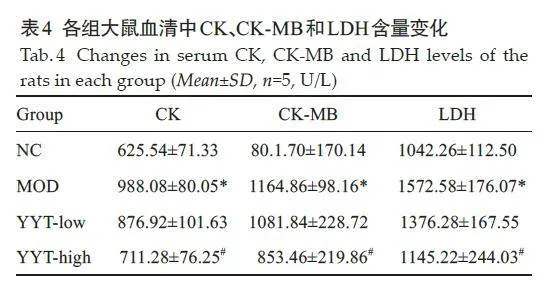
模型组大鼠血清中的CK、CK-MB和LDH的水平均显著高于正常组大鼠,而YYT-高组显著降低模型大鼠血清CK、CK-MB和LDH水平(Plt;0.05,表4)。
2.7.5 各组大鼠心肌组织中相关蛋白表达情况
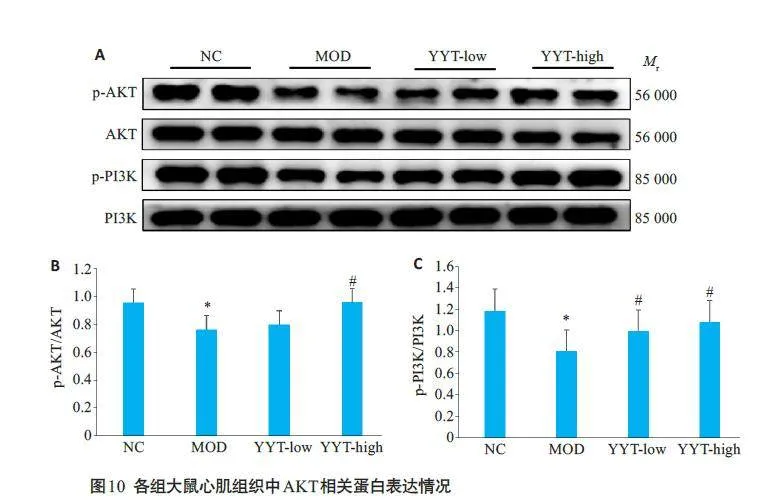
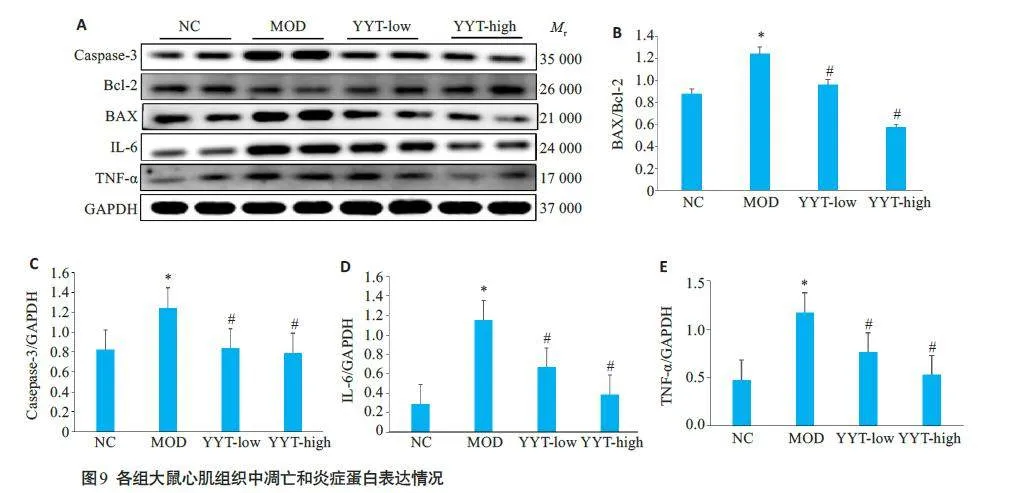
与正常组大鼠相比,模型组大鼠心脏组织中的BAX/Bcl-2、Caspase-3、IL-6和TNF-α蛋白表达含量升高,p-AKT和p-PI3K蛋白表达降低(Plt;0.05)。复方玉液汤能降低DCM大鼠心肌组织中BAX/Bcl-2、Caspase-3、IL-6 和TNF-α蛋白的表达,升高p-AKT 和p-PI3K 蛋白表达(Plt;0.05,图9、10)。
3 讨论
本研究网络药理学分析发现,复方玉液汤防治DCM 的靶点包括AKT1、MAPK1、MAPK3、SRC、PIK3CA、PIK3R1、IL-6、TNF- α、BAX、STAT3 和JUN等。PI3K-Akt 信号通路、MAPK信号通路、Apoptosis信号通路、TNF 信号通路等信号通路可能是其防治DCM的关键通路[12-16]。有研究发现GLUT-4作为PI3KAkt信号通路的下游靶点,具有减轻血浆中葡萄糖水平的作用,而激活PI3K-Akt 信号通路可以抑制GLUT-4的膜转位从而刺激GLUT-4 发挥生物活性作用,降低DCM患者血糖水平[17]。还有研究表明激活PI3K-Akt信号通路可以抑制NF-kB的表达,从而减轻炎症反应,保护心肌细胞免受炎症介质IL-6和TNF-α等的破坏[18]。此外,PI3K-Akt信号通路上的AKT蛋白可以抑制凋亡基因BAX、caspase-3 等的转录,减轻心肌细胞凋亡[19]。IL-6和TNF-α是DCM患者的血清标志物,它们通过增加氧化应激和配体-受体细胞死亡信号诱导心肌细胞凋亡,从而增加心力衰竭的风险[20]。TNF-α作为一种炎症因子可以和细胞膜上的TNF-α受体结合激活丝裂原蛋白激酶,促进Bax表达上调导致心肌细胞凋亡[21]。糖尿病大鼠心脏中PI3K-Akt信号通路蛋白表达显著降低,伴随抗凋亡因子BAX、caspase-3 及炎症因子IL-6 和TNF-α的异常高表达[22]。由此可见,PI3K-Akt信号通路在DCM心肌组织炎症反应及心肌细胞凋亡的发生发展过程中具有关键调控作用。Western blotting结果表明,复方玉液汤能显著升高DCM大鼠心肌组织中p-PI3K和p-Akt蛋白表达,同时下调炎症因子IL-6和TNF-α以及凋亡相关蛋白BAX的表达。说明复方玉液汤可能通过激活PI3K/Akt通路,抑制炎症反应,并激活抗凋亡基因的转录,抑制细胞凋亡,减轻DCM大鼠心肌组织损伤,与网络药理学的预测结果具有一致性。
本文分子对接结果发现,复方玉液汤可能通过槲皮素、金色酰胺醇酯、反式香豆酰酪胺和山奈酚等关键成分发挥防治DCM的作用。既往研究表明[23],类黄酮类化合物槲皮素作为一种有效的抗氧化剂,已被证明可以通过激活Nrf1/Nrf2转录途径介导Prx-3的释放,从而抑制心脏肥大和纤维化,恢复因DCM而造成的心脏舒张功能障碍。另有发现槲皮素还具有抗炎作用[24],通过诱导miR-369-3p 调节C/EBP-β蛋白减少IL-6、IL-1β和IL-18等炎症因子的释放,抑制NLRP3介导的心脏炎症反应并增强DCM小鼠的心脏功能。山奈酚通过改善外周胰岛素敏感性、刺激肝脏GLUT-4 表达、增加外周葡萄糖摄取和抑制肝脏糖异生来发挥降血糖作用[25]。山奈酚还具有抗氧化和抗炎的作用,通过Nrf2、NF-kB等信号通路,抑制心肌细胞氧化应激及炎症因子表达[22, 25]。然而金色酰胺醇酯、反式香豆酰酪胺的药理作用,目前尚未报道,有待于进一步研究。
临床及实验研究已证实复方玉液汤在治疗病因复杂、机制多样的糖尿病及其并发症中具有良好的疗效[26],复方玉液汤可能通过ALB、INS、IL6、AKT1 靶点调控糖脂代谢、细胞氧化应激、细胞功能障碍发挥治疗作用,且活性成分主要为为槲皮素、山柰酚、芒柄花素等。但上述研究仅限于网络药理学的预测分析,并未进行系统的实验验证阐明预测结果的准确性[27, 28]。本研究将网络药理学预测和体内实验验证相结合,系统阐明了复方玉液汤防治DCM的作用靶点、机制、活性成分,并对复方玉液汤防治DCM的药效学及预测靶点进行验证,确保了预测结果的准确性。既往研究指出,在玉液汤原方基础上加生晒参、麦冬、丹参等组成的通络玉液汤通过降低DCM小鼠心肌组织BAX、caspase-3蛋白表达,阻止模型小鼠心肌细胞凋亡;通过抑制TGF-β1蛋白表达,阻止心肌细胞纤维化,减轻模型小鼠心肌损伤,改善心功能[29, 30]。然而,复方玉液汤原方防治DCM的确切疗效及机制尚未见报道。本研究明确了复方玉液汤防治DCM的作用,并证明了其作用机制可能与抗心肌细胞凋亡、抑制炎症反应、改善糖脂代谢相关的BAX/Caspase-3、IL-6、TNF-α和PI3K/Akt 等信号通路有关。上述结果在证明了先前研究的基础上,进一步丰富了复方玉液汤防治DCM的科学内涵,为其临床应用提供更全面合理的理论支撑。
综上所述,本研究运用网络药理学技术预测出复方玉液汤防治DCM 的潜在靶点为AKT1、MAPK1、MAPK3、SRC、PIK3CA、PIK3R1、IL-6、TNF- α、BAX等;明确了复方玉液汤防治DCM的关键成分金色酰胺醇酯、山柰酚、反式香豆酰酪胺和脱氧三尖杉酯碱等可能通过调节PI3K/Akt通路改善DCM大鼠心肌组织炎症反应及细胞凋亡过程防治DCM的发生发展。
参考文献:
[1] 佟红娜, 张晨阳, 韩美欣, 等. 糖尿病心肌病的发病机制及药物干预研究进展[J]. 中国实验方剂学杂志, 2022, 28(2): 257-65.
[2] 郭丽娜, 王单单, 裴 媛, 等. 葛根主要活性成分及作用机制的网络药理学研究[J]. 药物评价研究, 2019, 42(9): 1741-8.
[3] 徐文华, 郑景辉, 赵 阳, 等. 基于网络药理学和生物信息学的丹参酮ⅡA治疗冠心病的分子生物学机制分析[J]. 中草药, 2019, 50(5):1131-40.
[4] 徐慧琳, 徐郭王君, 姚 君, 等. 阿魏酸对糖尿病小鼠心肌病变的影响及其机制[J]. 中国应用生理学杂志, 2018, 34(3): 238-41.
[5] 田春礼, 杨莉丽. 黄芪养血方对糖尿病心肌病心功能不全患者心脏功能、血糖及中医症状的影响[J]. 实用糖尿病杂志, 2020, 16(5):104-6.
[6] 杨金伟, 赵 灿, 吴勇军, 等. 基于网络药理学探讨丹参饮治疗糖尿病心肌病的分子机制[J]. 中国中医药信息杂志, 2020, 27(3): 78-83.
[7] 杨芸艺, 雷 涛, 沙雯君, 等. 从“气阴两虚” 论探讨玉液汤治疗2型糖尿病研究进展[J]. 中华中医药学刊, 2022, 40(12): 212-7.
[8] 李淑贞, 杨艳梅, 杨晓晖, 等. 通络玉液汤对2型糖尿病心肌病大鼠心功能及心肌纤维化的影响[J]. 中国老年学杂志, 2018, 38(13):3227-30.
[9] 李淑贞, 张兰兰, 姜 盼. 通络玉液汤对2型糖尿病心肌病大鼠心功能及心肌结构的影响[J]. 中国老年学杂志, 2018, 38(10): 2480-2.
[10]Miyamoto N, Izumi H, Miyamoto R, et al. Quercetin induces theexpression of peroxiredoxins 3 and 5 via the Nrf2/NRF1transcription pathway[J]. Invest Ophthalmol Vis Sci, 2011, 52(2):1055-63.
[11]张文祥, 郭 凤, 陈鹏德, 等. 正交试验法优化复方玉液汤提取工艺及对小鼠的急性毒性研究[J]. 化学试剂, 2022, 44(6): 865-71.
[12]宋 玲, 赵泉霖. 中医药防治糖尿病心肌病的研究探讨[J]. 中国中西医结合影像学杂志, 2021, 19(3): 298-300.
[13]王贞贞, 赵泉霖, 宋亚一, 等. 中医药防治糖尿病心肌病进展[J]. 中国中医急症, 2020, 29(4): 728-31.
[14]薛建军, 范 强, 杨丽霞, 等. 糖尿病心肌病发病机制及中医药治疗概述[J]. 中国实验方剂学杂志, 2017, 23(22): 211-7.
[15]常 晓. 活血降糖饮对糖尿病心肌病氧化应激的作用和临床研究[D]. 广州: 广州中医药大学, 2017.
[16]王成朋, 黄生维, 王淑美, 等. 玉液汤治疗糖尿病及其并发症临床应用概述[J]. 实用中医药杂志, 2022, 38(5): 886-8.
[17]Ramachandran V, Saravanan R. Glucose uptake through translocationand activation of GLUT4 in PI3K/Akt signaling pathway by Asiaticacid in diabetic rats[J]. Hum Exp Toxicol, 2015, 34(9): 884-93.
[18]黄家喜, 鲍翠玉, 李 晶. PI3K/Akt通路在糖尿病心肌病中的研究进展[J]. 中国药理学通报, 2019, 35(9): 1202-5.
[19]范亮亮, 马立宁, 彭元亮, 等. PI3K/AKT信号通路与心力衰竭[J]. 生命科学研究, 2015, 19(1): 85-90.
[20]Abdelrahman AH, Salama II, Salama SI, et al. Role of some serumbiomarkers in the early detection of diabetic cardiomyopathy[J].Future Sci OA, 2021, 7(5): FSO682.
[21]温晨东, 李 兴. TNF-α在糖尿病心肌病变中的表达[J]. 临床医药实践, 2013, 22(4): 271-3.
[22]Wang Y, Sun H, Zhang JW, et al. Streptozotocin-induced diabeticcardiomyopathy in rats: ameliorative effect of PIPERINE via Bcl2,Bax/Bcl2, and caspase-3 pathways[J]. Biosci Biotechnol Biochem,2020, 84(12): 2533-44.
[23]Arkat S, Umbarkar P, Singh S, et al. Mitochondrial Peroxiredoxin-3protects against hyperglycemia induced myocardial damage inDiabetic cardiomyopathy[J]. Free Radic Biol Med, 2016, 97:489-500.
[24]Galleggiante V, de Santis S, Liso M, et al. Quercetin-induced miR-369-3p suppresses chronic inflammatory response targeting C/EBP-Β[J]. Mol Nutr Food Res, 2019, 63(19): e1801390.
[25]Chen XM, Qian JC, Wang LT, et al. Kaempferol attenuateshyperglycemia-induced cardiac injuries by inhibiting inflammatoryresponses and oxidative stress[J]. Endocrine, 2018, 60(1): 83-94.
[26]胡锦浩, 石 岩. 玉液汤药物降糖成分与方剂降糖机制研究进展[J].辽宁中医药大学学报, 2024, 26(4): 116-23.
[27]任 洁, 王雪纯, 陈燕清, 等. 基于网络药理学的玉液汤治疗2型糖尿病的作用机制研究[J]. 中医临床研究, 2022, 14(18): 10-5.
[28]刘坚辉, 陈楚仪, 杨帏勋, 等. 基于网络药理学探析玉液汤对2型糖尿病的作用机制[J]. 中成药, 2021, 43(9): 2534-9.
[29]孙 霞, 罗 宁, 吴 霞, 等. 通络玉液汤对糖尿病合并心肌病小鼠心肌细胞凋亡的改善作用及相关信号通路的影响[J]. 解剖科学进展,2023, 29(4): 399-402.
[30]李淑贞, 杨晓晖, 崔茂香, 等. 通络玉液汤对糖尿病性心肌病大鼠心功能及氧化指标的影响[J]. 现代中西医结合杂志, 2018, 27(14):1488-90, 1596.
(编辑:林 萍)
基金项目:新疆维吾尔自治区自然科学基金(2022D01C198);新疆维吾尔自治区天山英才计划第三期(2021241)

