脑多肽对PCPA诱导的睡眠障碍小鼠5-羟色胺系统和肠道菌群的影响


摘" 要:为探究脑多肽对昆明小鼠睡眠和肠道菌群的影响,通过小鼠神经递质含量和氧化应激水平的变化,分析肠道菌群与睡眠之间的联系.腹腔注射对氯苯丙氨酸(PCPA)建立睡眠障碍模型,连续灌胃给药7 d,通过戊巴比妥钠睡眠协同实验、悬尾和明暗箱实验以及小鼠神经递质和氧化应激水平的变化,分析脑多肽对睡眠障碍小鼠镇静催眠功能的影响;苏木精-伊红染色法(Hamp;E)和糖原染色法(AB-PAS)观察小鼠海马及结肠组织病理变化;收集粪便,进行16S rRNA基因测序,分析小鼠肠道菌群丰度的变化.结果表明:脑多肽高、低剂量组小鼠睡眠时间显著增加,睡眠潜伏期显著缩短,MDA含量显著降低,5-HT、GABA、MT含量、GSH-Px和SOD酶活均显著升高(Plt;0.05);小鼠海马CA1区神经元细胞排列整齐,胞核固缩深染现象改善,结肠组织中炎症细胞浸润减少;脑多肽高剂量组拟杆菌门丰度显著升高,乳杆菌属、双歧杆菌属丰度显著升高(Plt;0.05),拟杆菌属丰度与GSH-Px的变化趋势呈显著正相关,乳杆菌属丰度与5-HT、MT、SOD的变化趋势呈显著正相关(Plt;0.05).脑多肽通过调节肠道菌群正向调节血清内神经递质和脑组织氧化应激水平,有效治疗PCPA诱导的小鼠睡眠障碍症状,随着剂量增加治疗效果明显提高.
关键词:脑多肽;5-羟色胺;肠道菌群;氧化应激;睡眠障碍
中图分类号:R917""" 文献标志码:A""" 文章编号:10001565(2024)05048312
DOI:10.3969/j.issn.10001565.2024.05.005
Effects of brain peptides on 5-hydroxytryptamine system and intestinal flora in PCPA induced sleep disorder mice
HUANG Xinran, WANG Linna, DAI Jiaqi, SONG Nannan, ZHOU Chengyan
(Key Laboratory of Pharmaceutical Quality Control of Hebei Province, College of Pharmacy Sciences, Hebei University, Baoding 071002, China)
Abstract: This work studied the impact of brain peptide (BP) on sleep and intestinal microbiota in mice, and analyzed the relationship between intestinal microbiota and sleep through changes in neurotransmitter content and oxidative stress levels in mice. The insomnia model was established by peritoneal injection of p-chlorophenylalanine (PCPA), which was administered via continuous gavage for 7 days. The sedative and hypnotic effects of brain peptides on insomniac mice were analyzed by using a pentobarbital sodium sleep coordination test, tail suspension test(TST),light and dark box test (LDB), along with measurements of
收稿日期:20240404;修回日期:20240518
基金项目:
河北省自然科学基金资助项目(H2020201291);贵州医科大学省部共建药用植物功效与利用国家重点实验室资助项目(FAMP202006K)
第一作者:黄欣然(2003—),女,河北大学在读硕士研究生,主要从事睡眠疾病菌群相关研究以及药物分析方向研究.E-mail:huang18132083386@163.com
通信作者:周程艳(1976—),女,河北大学副教授,主要从事代谢组学、菌群、脂质组学以及相关药理作用机制研究.E-mail:xuefanone@163.com
neurotransmitter levels and oxidative stress markers. Hematoxylin-eosin staining (Hamp;E) and glycogen staining (AB-PAS) were used to observe histopathological changes in the hippocampus and colon of mice. The stool was collected and 16S rRNA gene was sequenced to analyze the changes of intestinal flora abundance in mice. Compared with the model group, the sleep latency of mice in the high-dose and low-dose brain polypeptide groups was significantly shortened, and the sleep time was significantly increased. MDA content decreased significantly, 5-HT, GABA and MT content, the enzyme activity of GSH-Px and SOD increased significantly in high-dose brain polypeptide group(Plt;0.05). The neuronal cells in CA1 region of hippocampus of mice were arranged neatly, the phenomenon of nuclear shrinkage and deep staining was improved, and the infiltration of inflammatory cells in colon tissue was reduced. 16S rRNA results showed that compared with the model group, the abundance of Bacteroidetes was significantly increased in the high-dose BP group at the phylum level, and the abundance of Lactobacillus and Bifidobacterium at the genus level was significantly increased (Plt;0.05). Pearson correlation analysis showed that the abundances of Bacteroides was positively correlated with the trends of GSH-Px, and the abundances of Lactobacillus was positively correlated with the trend of 5-HT, MT and SOD (Plt;0.05). Brain polypeptide can effectively treat PCPA induced insomnia in mice by regulating intestinal flora and positively regulating serum neurotransmitter and brain tissue oxidative stress level, and the therapeutic effect is better with the increase of dose.
Key words: brain polypeptide;5-hydroxytryptamine;intestinal flora;oxidative stress;somnipathy
睡眠是中枢神经系统调节下机体周期性、反复性的生理活动,在恢复体力、维持身体生存、保护脑功能以及正常生理活动方面发挥重要作用[1].当睡眠-觉醒机制出现异常时,机体就会发生睡眠障碍,发生一系列睡眠和觉醒状态相关的以睡眠过多或不足为主要表现的疾病.睡眠障碍已成为中国社会公共卫生问题,中国有近4亿人患有睡眠障碍,睡眠障碍机制问题亟待解决[2].研究表明,睡眠-觉醒周期主要受中枢神经系统调控,而这一过程涉及中枢神经系统与肠道菌群等微生物的复杂相互作用.机体中通过脑-肠轴的免疫、神经调节和内分泌,达到调控睡眠的目的.研究证实机体发生睡眠障碍时会出现昼夜节律紊乱和睡眠不足,进而产生生理压力并且能够改变肠道菌群丰度和肠道通透性[3],提示中枢神经系统与睡眠之间存在复杂联系,这种联系在入睡前后肠道微生物的活动、肠道菌群的变化之中可以显现[4-5].
动物大脑中含有多种具有神经调节功能的脑多肽(BP),它们在调节神经网络和促进神经信息传递中发挥着极为重要的作用.从猪中提取的脑组织匀浆制备的脑多肽注射液具有保护中枢神经系统免受侵害、改善记忆系统、促进大脑成熟、提高脑组织抗缺氧能力等作用[6].本实验主要以猪源脑多肽为研究对象,探究是否能够通过调节脑-肠轴改善睡眠.
为进一步探究脑多肽能否通过脑-肠轴机制调控肠道菌群改善相关神经递质调节睡眠,本研究通过分析脑多肽营养液对睡眠障碍小鼠睡眠相关生理指标的影响,采用16S rRNA基因测序技术分析正常组(NC),模型组(INS),脑多肽高、低剂量组(BP、BP-L)小鼠肠道菌群的变化,探究睡眠障碍的发生与肠道菌群之间的联系.
1" 材料
1.1" 实验动物
18~22 g的雄性SPF级KM小鼠购自北京维通利华实验动物技术有限公司,实验动物许可证编号:SCXK(京)2021-0011.
1.2" 药品与仪器
脑多肽营养液(河北智同生物制药有限公司,批号20220601);艾司唑仑(规格:1 mg/片,上海信谊药厂有限公司,生产批号20200619);对氯苯丙氨酸(PCPA,上海麦克林生化科技有限公司,批号C14214611);谷胱甘肽过氧化物酶(GSH-Px) 测定试剂盒、总超氧化物歧化酶(SOD)测定试剂盒、丙二醛(MDA)测定试剂盒(南京生物建成工程研究所);小鼠5-羟色胺(5-HT)和褪黑素(MT)和γ-氨基丁酸(GABA)的酶联免疫吸附测定试剂盒(武汉酶免生物科技有限公司,批号均为202307).
高速冷冻离心机(上海卢湘仪离心机仪器有限公司);高速低温组织研磨仪(武汉赛维尔生物科技有限公司);YD-A2生物组织摊片机、YD-B生物组织烤片机、YD-6L生物组织包埋机、YD-335石蜡切片机(金华市益迪医疗设备有限公司).
2" 方法
2.1" 动物分组、造模及给药
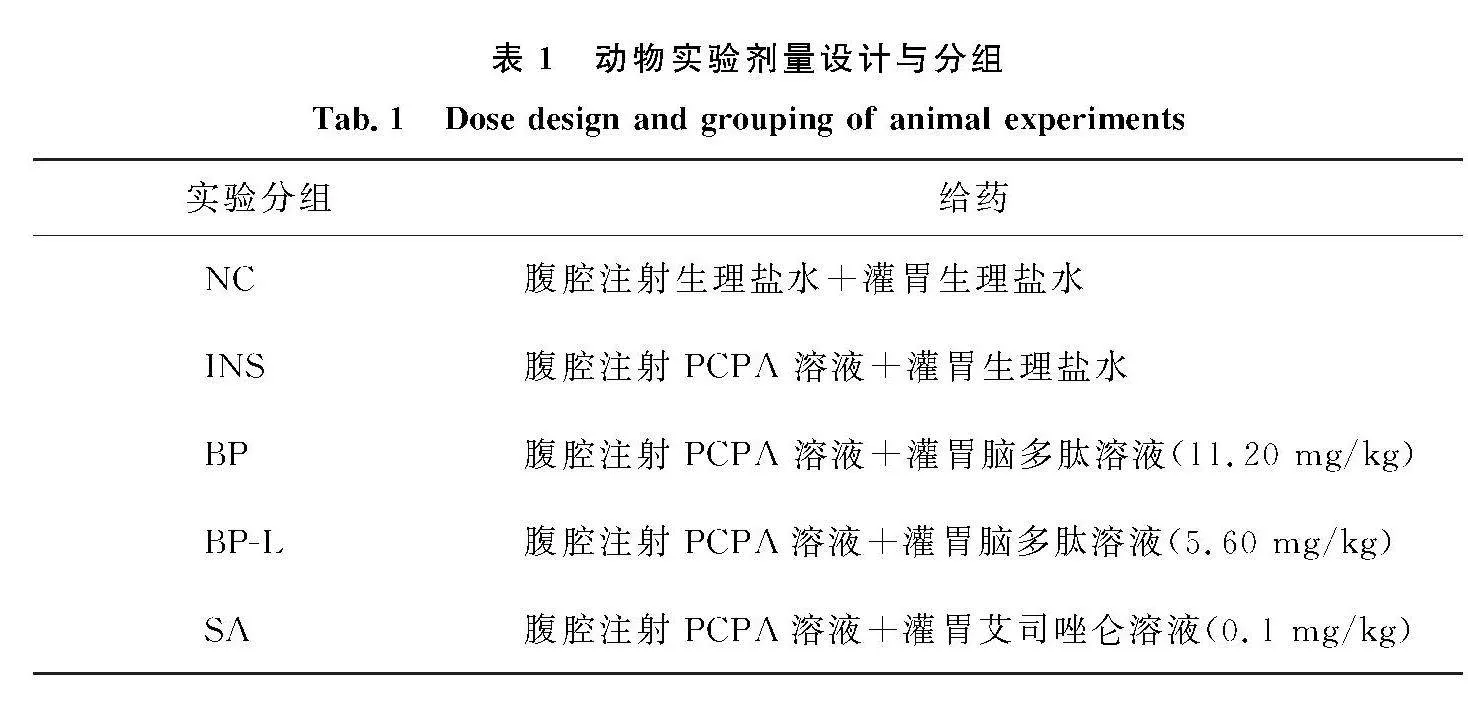
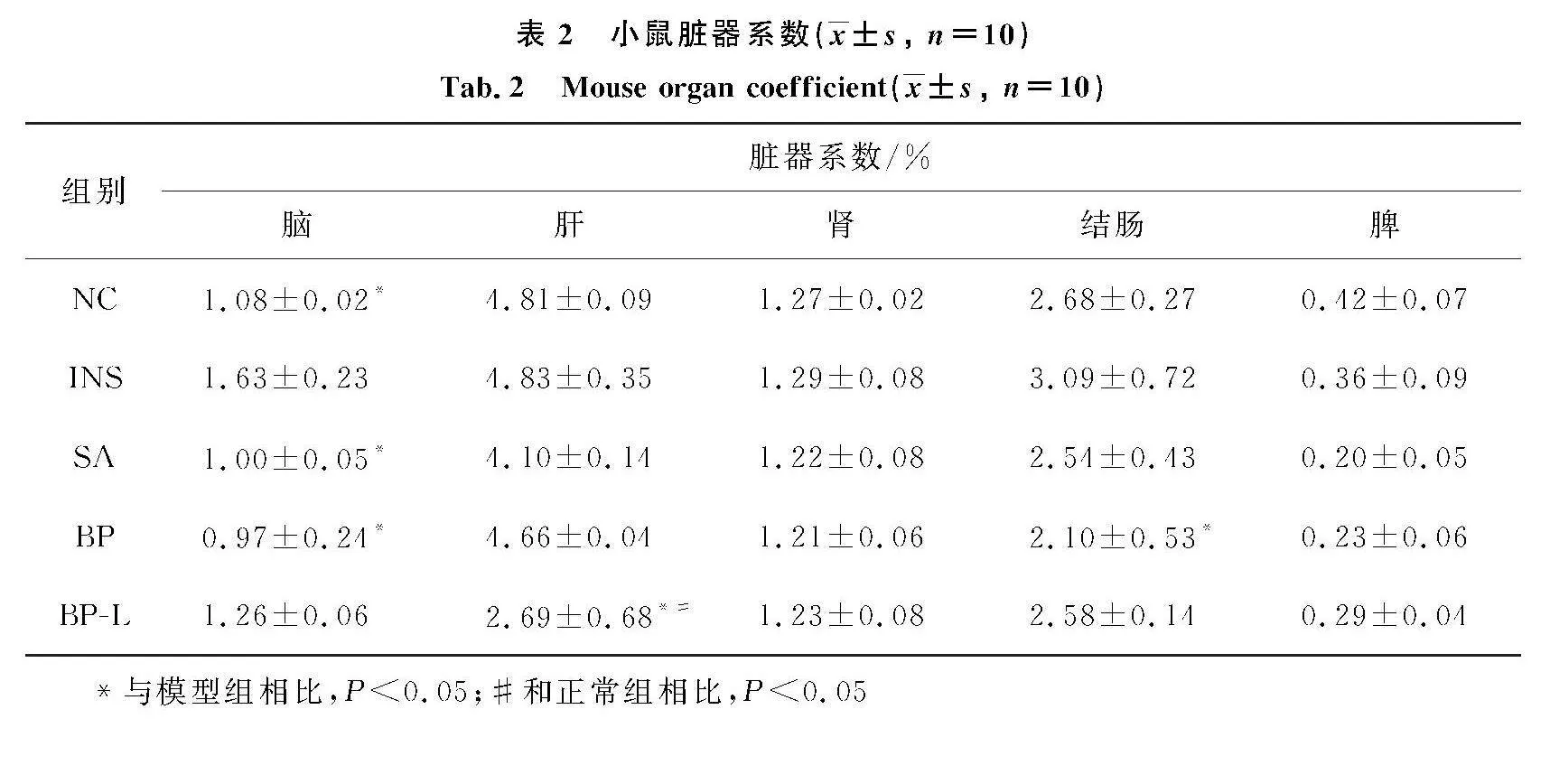
适应性喂养7 d后,将50只雄性昆明小鼠随机分为5组,为正常组(NC)、模型组(INS)、艾司唑仑组(SA)、脑多肽高剂量组(BP)、脑多肽低剂量组(BP-L),每组10只.除正常组外其余小鼠建立睡眠障碍模型,于每日早晨8—9点连续3 d腹腔注射PCPA混悬液(300 mg/kg,10 mg/mL).当小鼠出现坐立不安、躁动、日间活动增加等现象,表明造模成功[7].对造模成功的小鼠于次日上午开始给药,连续7 d,剂量设计与分组见表1.实验过程观察记录小鼠每日摄食量、摄水量、体质量的变化、外貌及精神状态等.实验结束后,小鼠脱颈处死,眼眶取血,离心收集血清,低温储存备用,取出脑、肝、脾、肾、结肠,滤纸擦拭并称量,根据公式计算相应脏器系数.脏器系数=脏器质量/小鼠体质量×100%.
2.2" 脑多肽对睡眠障碍小鼠行为学影响
2.2.1" 明暗穿梭箱实验(LDB)
摄像记录小鼠从箱体正中格开始5 min 内的行为,以及小鼠进入明箱次数、明箱停留时间;更换小鼠时,应提前清洗箱体地面及内壁,减少余留信息,减小实验误差[8].
2.2.2" 悬尾实验(TST)
用医用胶带将小鼠尾巴(距尾尖约1 cm)固定在挂钩上,使小鼠头自然垂下,头距离地面约30 cm,用摄像设备正对小鼠,记录5 min内小鼠的状态.本实验主要通过小鼠在悬挂状态下不断挣扎以及累计出现的间断性相对静止时间来评价小鼠的绝望状态.实验记录了首次达到静止状态的时间,以及相对静止期(特指四肢仅有小幅度抖动或完全静止的状态)的持续时间和占总观察时间的百分比.
2.2.3" 脑多肽对睡眠障碍小鼠睡眠协同实验的影响
末次给药之后,进行戊巴比妥钠睡眠协同实验,同时评估造模和药物干预效果.腹腔注射0.01 mL/g戊巴比妥钠(55 mg/kg),通过翻正反射实验,观察并记录小鼠睡眠潜伏期和睡眠持续时间[9].
2.3" 脑多肽对睡眠障碍小鼠神经递质含量及氧化应激水平的影响
采用 ELISA 试剂盒检测血清中的GABA、5-HT、MT水平,检测脑组织匀浆中MDA的含量和 SOD、GSH-px的酶活性.
2.4" 脑多肽对PCPA睡眠障碍小鼠组织病理学变化的影响
每组随机抽取3只小鼠的结肠组织和脑组织,施行梯度脱水、常规石蜡包埋、切片,进行苏木精和伊红染色(H&E),光学显微镜下观察染色切片并拍照[10].另外取结肠组织进行 AB-PAS 染色,进行组织病理学分析.
2.5" 脑多肽对睡眠障碍小鼠粪便16S rRNA基因测序的分析
采用随机数字表法在3组中随机挑选6只小鼠的粪便标本进行16S rRNA基因测序分析.设计16S rDNA V3-V4区域的引物,在Illumina平台对群落DNA片段进行双端测序,进一步对高质量测序数据解析生物信息[11].
主要采用Chao1指数和Shannon指数进行Alpha多样性分析,分析不同组别小鼠菌群均匀度和丰富度的变化;采用主坐标分析(principal coordinates analysis,PCoA)阐述Beta多样性分析,评估不同组别菌群组成和分布的相似性与差异性;绘制门、属水平群落结构堆叠图,比较各组肠道菌群种类与丰度,进行LEfSe分析寻找差异菌群;采用冗余分析法,阐述血清中神经递质、脑组织中氧化应激水平与肠道菌群的关系,进一步采用Spearman相关系数绘制关联网络分析图及关联热图,精确呈现菌群与睡眠相关因子的关系.
2.6" 统计学分析
采用SPSS 26.0 统计软件进行分析,计量资料以均数±标准差(x±s)表示.采用单因素方差分析法(One-way ANOVA)进行多组间分析、LSD法进行组间两两比较,P<0. 05时具有统计学意义.
3" 结果
3.1" 脑多肽对睡眠障碍小鼠体质量、摄食量、摄水量及脏器的影响
实验过程中NC组小鼠毛发、饮食、节律正常,具有良好精神状态.腹腔注射PCPA 造模后,模型组小鼠白天活动减少,昼夜节律紊乱,毛发干枯,饮食减少.与造模前相比,除NC组外其余小鼠每日体质量显著降低,各组小鼠摄水量、摄食量均显著降低(Plt;0.05),造模成功.给药最后1 d体质量与造模后体质量相比,BP组体质量为(20.15±2.13) g,SA组为(19.99±2.95) g,NC组为(20.56±1.48) g,均显著增高,说明脑多肽给药后,睡眠障碍小鼠体质量回升[6].
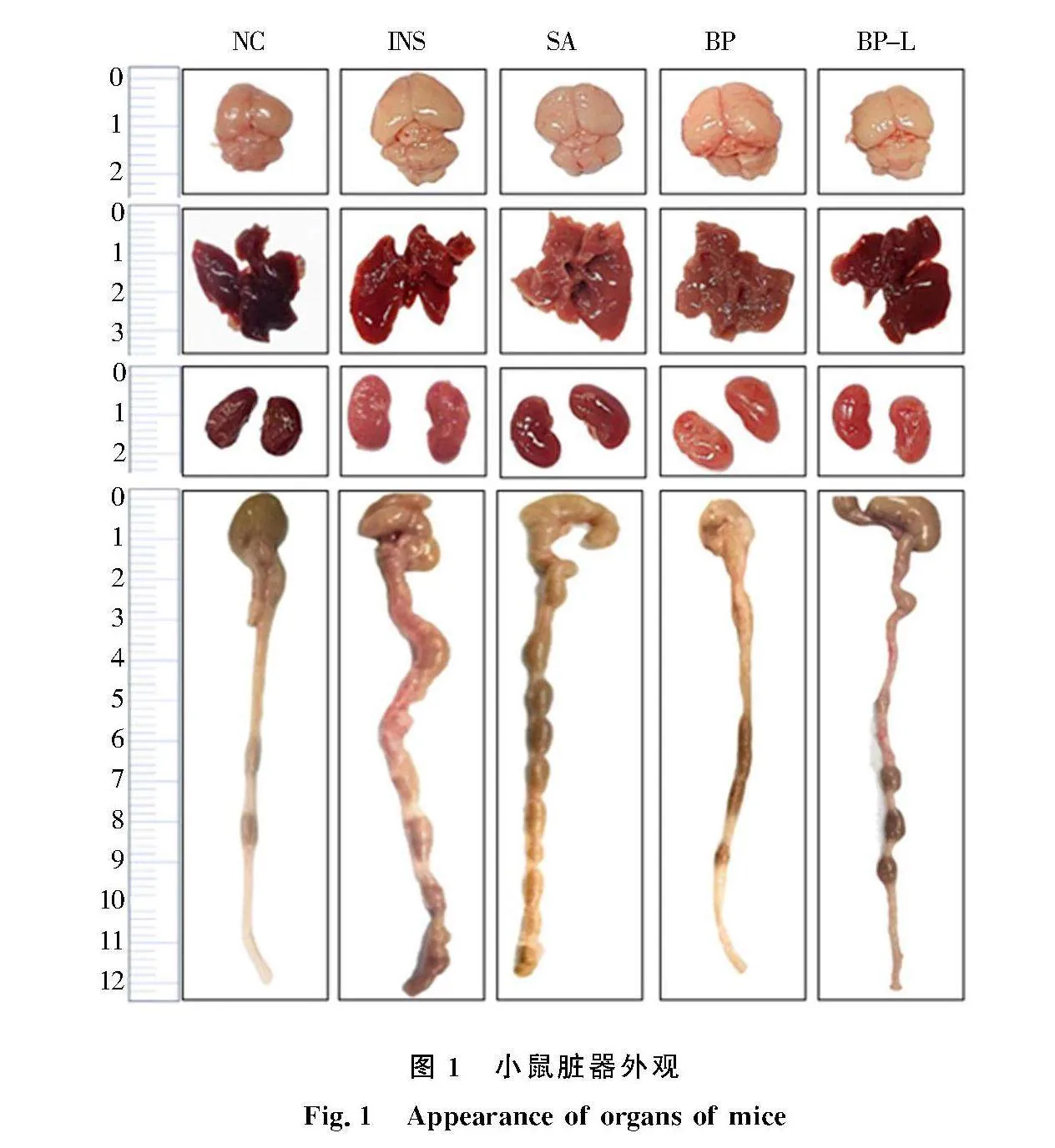
与NC组相比,INS组小鼠脑和结肠脏器系数升高(P>0.05);与INS组相比,给药后BP组小鼠脑组织和结肠组织系数均显著降低(P<0.05)(表2).脏器外观见图1,INS组小鼠肠腔中有深红色血便出现,同时伴有结肠肠壁变薄;BP组结肠炎症稍微缓解,结肠颜色呈淡红色,粪便基本成形,肠腔不再出血;脑多肽给药在一定程度上可以有效缓解结肠炎症,改善脏器状态.
3.2" 脑多肽对睡眠障碍小鼠的行为及睡眠质量改善情况
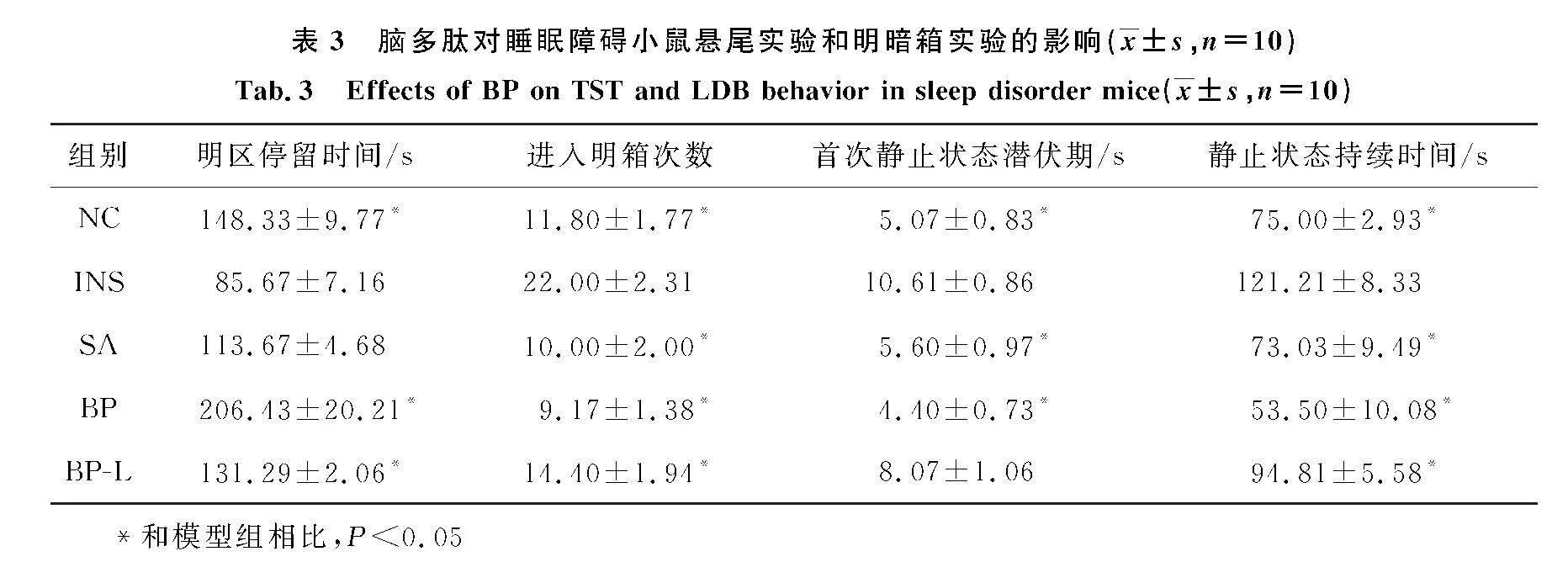
实验采用明暗箱实验,评估药物的抗焦虑和镇静作用[12].脑多肽给药后,BP、BP-L组明箱停留时间较模型组均显著延长(Plt;0.05)(表3),表明脑多肽用药后可以镇静催眠,减轻小鼠焦虑样行为.悬尾实验是最经典的评价药物镇静催眠作用、抗抑郁作用、兴奋性作用的动物行为学实验方法之一,悬尾实验不动时间延长也作为PCPA睡眠障碍小鼠模型评价标准之一[13].与INS组相比,BP组的静止状态持续时间显著缩短(Plt;0.05)(表3),随着脑多肽给药剂量增加,持续时间继续缩短,说明脑多肽治疗后,小鼠活动能力明显改善,睡眠障碍绝望的行为减少[14].
本研究根据《保健食品功能检验与评价方法》(2023版)中规定,睡眠协同实验采用戊巴比妥钠进行[15].在戊巴比妥钠(55 mg/kg)的诱导催眠下,与INS相比,BP组、BP-L组睡眠潜伏期均显著降低(Plt;0.05),并且随着脑多肽给药量增加,睡眠动物数增加,小鼠睡眠潜伏期缩短,睡眠时间加长(表4),说明脑多肽(12 mg/kg)有改善睡眠的功能[5].
3.3" 脑多肽对睡眠障碍小鼠血清内神经递质、脑组织氧化应激水平的影响
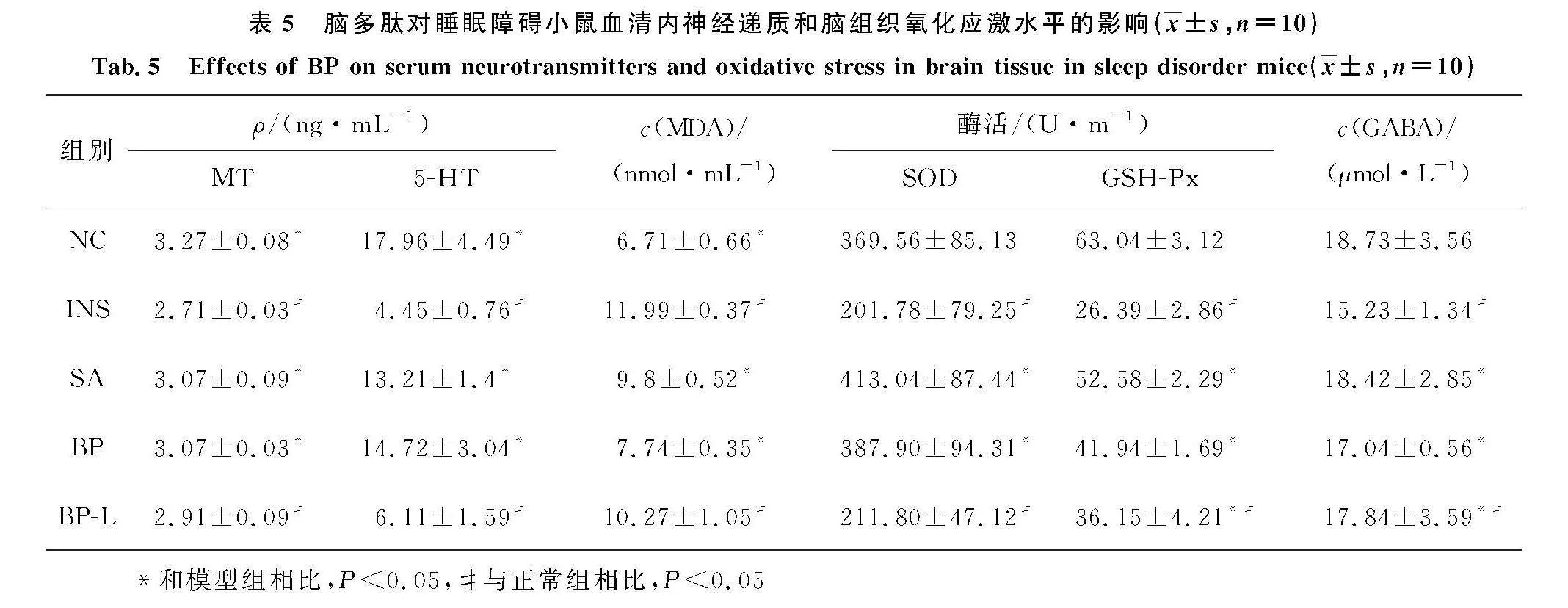
与NC组相比,INS组小鼠血清内5-HT、MT、GABA的含量均显著降低(Plt;0.05)(表5).与INS组相比,BP组小鼠神经递质中 5-HT、MT和GABA的含量显著提升(Plt;0.05).这与徐飞飞等[16]的研究结果一致,证明脑多肽有利于提高小鼠血清和神经递质中5-HT、MT和GABA的含量.
与INS组相比(表5),BP、BP-L组小鼠脑组织中MDA的含量降低、GSH-Px、SOD 的酶活性升高(Plt;0.05).这与李莉等[17]的研究结果一致,脑多肽能够在改善睡眠相关神经递质进而改善睡眠质量的同时降低脑组织中MDA含量、提高小鼠脑组织中GSH-Px、SOD 酶活性,改善小鼠氧化应激水平.提示脑多肽可调理睡眠障碍小鼠体内的氧化应激水平.
3.4" 脑多肽对睡眠障碍小鼠结肠及脑组织病理变化的影响
使用H&E和AB-PAS 2种染色方法对小鼠结肠组织进行病理学观察,和NC组相比,INS组小鼠结肠组织杯状细胞减少,细胞炎症浸润明显,炎症症状明显;和INS组相比,BP组结肠组织杯状细胞排列较整齐,细胞炎症浸润减少,炎症症状得到改善[18].
睡眠障碍作为中枢神经系统疾病,与脑组织关系密切,其中,海马体、大脑皮质、下丘脑作为中枢神经系统代表性脑区,与睡眠障碍相关性更强.海马体是中枢神经系统的重要组成部分,在调节睡眠-觉醒过程中有十分重要的作用[19],进行海马区H&E染色,观察各组病理变化.NC组小鼠CA1区神经元细胞的排列规律整齐,未出现细胞核固缩现象;INS组海马CA1区神经元排列十分不规则,并且伴随出现严重的细胞核固缩现象;和INS组相比,BP组海马区神经元细胞排列较为整齐规则,细胞核固缩现象减少(图2),说明脑多肽在一定程度上改变小鼠结肠病理表征,有效改善了睡眠.
3.5" 脑多肽对睡眠障碍小鼠肠道菌群的影响
3.5.1" Alpha多样性和Beta多样性分析
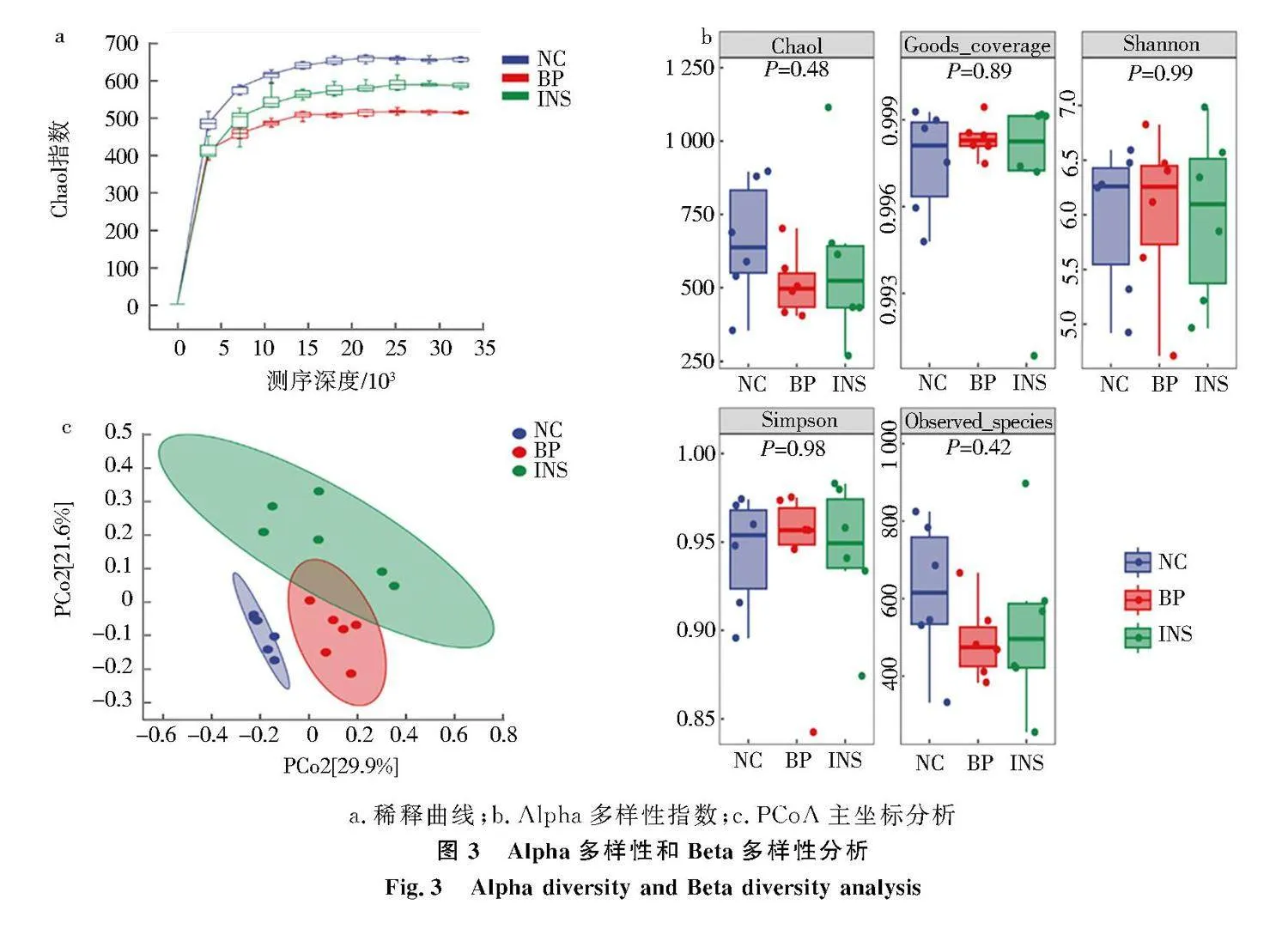
平缓的 Alpha 多样性稀释曲线表明本实验测序样本足够,测序结果能充分反映当前样本所包含的微生物信息(图3a).Alpha多样性是局部均匀生物环境下的物种在丰富度、多样性和均匀度等方面的指标,本研究评估小鼠肠道菌群物种均匀、丰富度采用Shannon 和Simpson 指数,评估小鼠肠道菌群中包含物种的数目采用Chao1和Observed-species指数[5].INS组的Chao1、Observed-species、Simpson 和Shannon指数显现降低趋势,BP组Observed-species、Simpson和Shannon指数呈现升高趋势,但均无明显差异(Pgt;0.05)(图3b).本实验采用主坐标分析法反映Beta多样性,睡眠障碍造模成功后,BP组小鼠肠道菌群的结构较正常组发生明显变化,组间差异较大,说明脑多肽给药后改变了睡眠障碍小鼠体内的肠道菌群,菌群多样性发生变化(图3c).
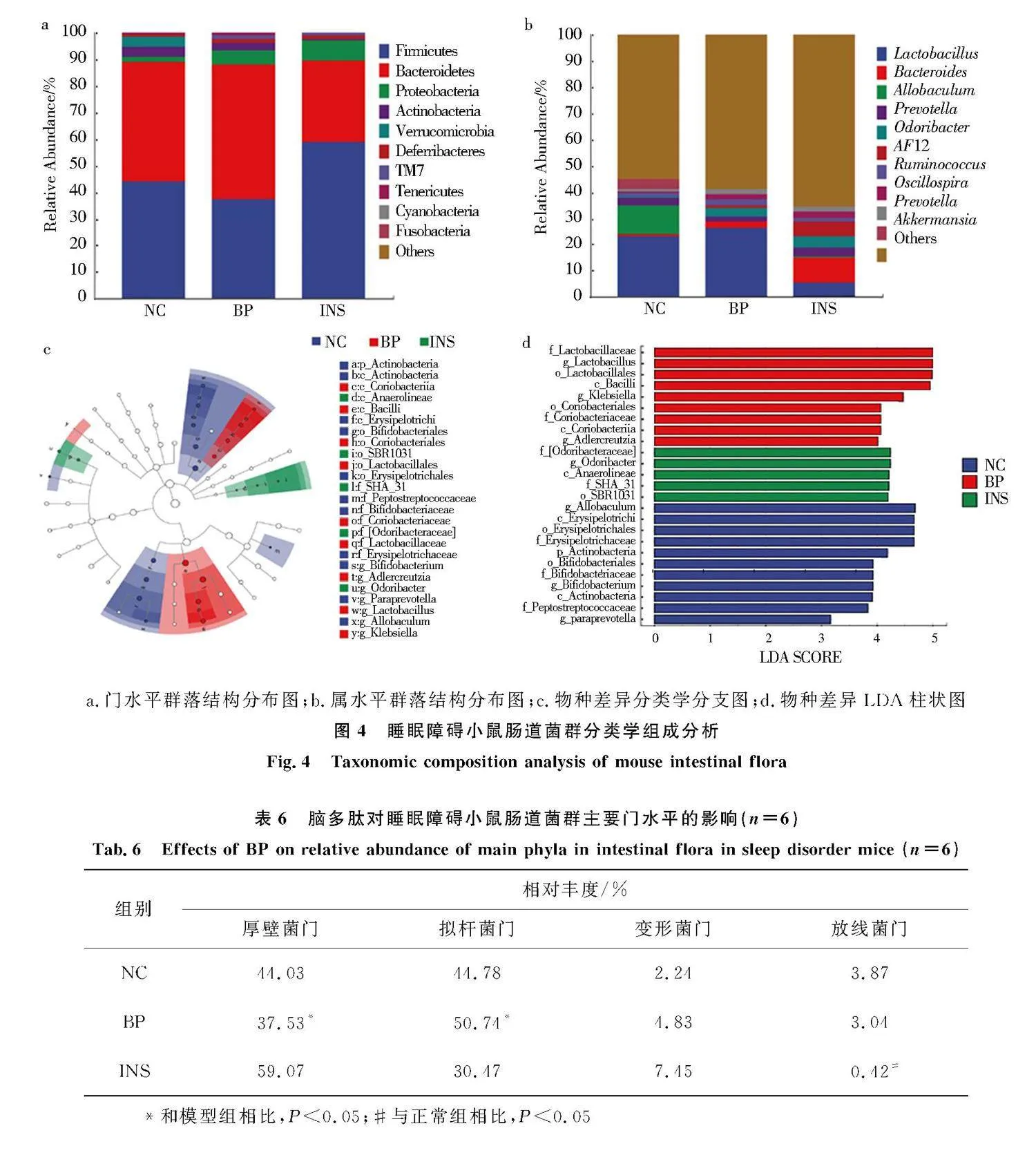
3.5.2" 睡眠障碍小鼠肠道菌群分类学组成分析
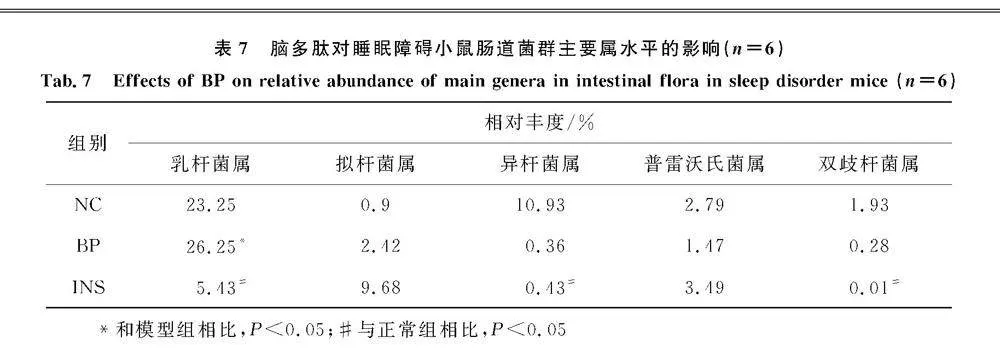
16S rRNA 基因测序结果,3组小鼠肠道菌群共注释到23个门,57个纲,91个目,150个科,244个属,316个种[5].在门水平上(图4a),3组小鼠的优势菌群为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)[5].BP组的厚壁菌门相对丰度显著降低,拟杆菌门相对丰度显著升高(Plt;0.05)(表6).属水平上(图4b),乳杆菌属(Lactobacillus)、异杆菌属(Allobaculum)、普雷沃氏菌属(Prevotella)、双歧杆菌属(Bifidobacterium)、拟杆菌属(Bacteroides)等占比较高[20].INS组乳杆菌属、异杆菌属、双歧杆菌属相对丰度显著性降低,BP组乳杆菌属相对丰度显著性升高(Plt;0.05)(表7).
采用LEfSe(LDA Effect Size)分析寻找差异菌群,在属水平上,BP组克雷伯氏菌属(Klebsiella)、乳杆菌属(Lactobacillus)、放线菌属的Adlercreutzia菌群丰度具有显著性差异变化,菌群丰度均表现升高(图4c、4d).
3.5.3" 血清中神经递质、脑组织中氧化应激水平与肠道菌群的相关性分析
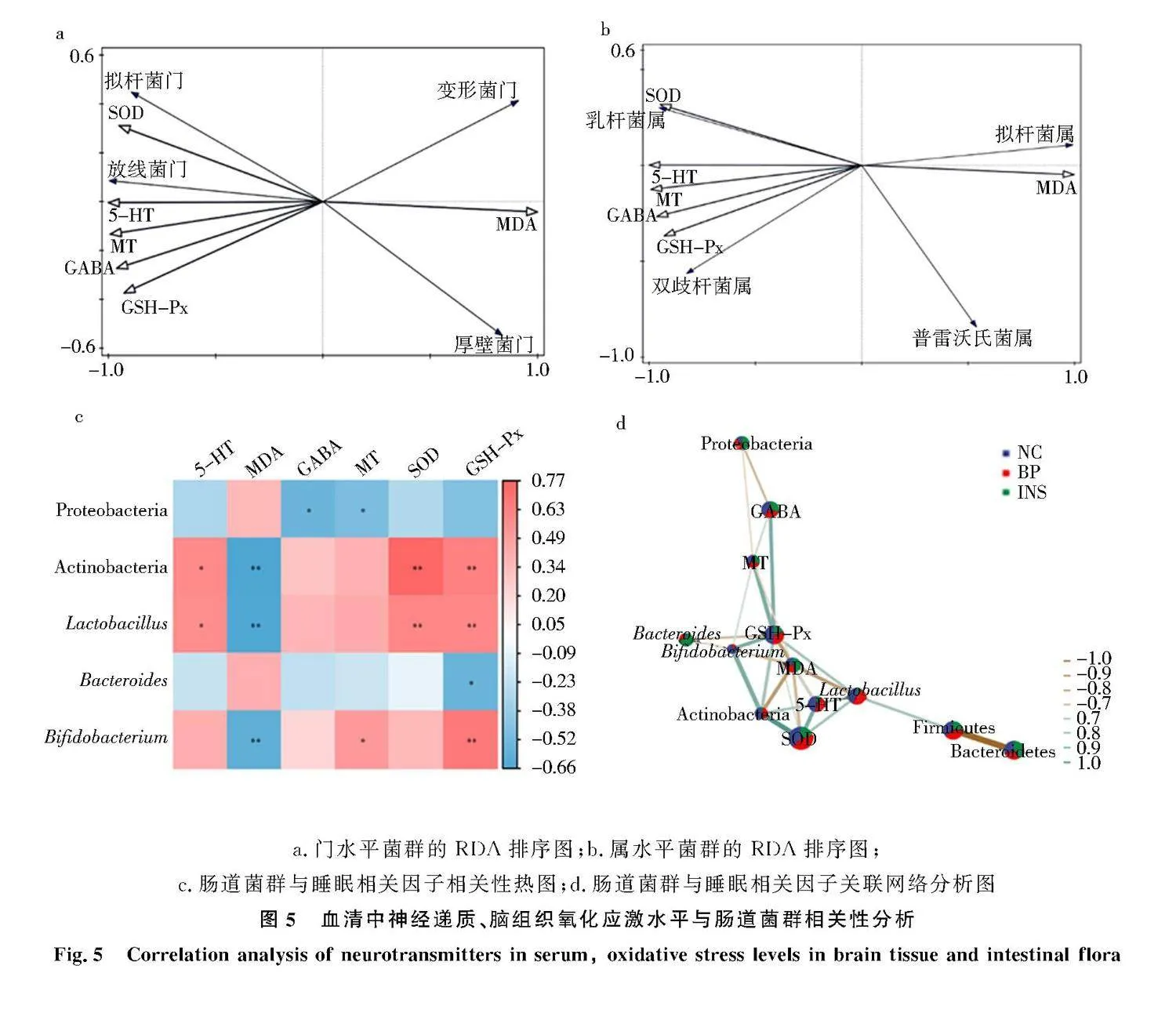
门水平上,拟杆菌门、放线菌门与5-HT、GABA、MT的含量及SOD、GSH-Px的酶活性呈正相关,与MDA的含量负相关[20](图5a).属水平上,乳杆菌属、双歧杆菌属与5-HT、GABA、MT的含量及SOD、GSH-Px的酶活性呈正相关,与MDA呈负相关(图5b).相关性热图中,变形菌门与GABA、MT显著正相关,乳杆菌属与5-HT、MT、SOD、GSH-Px呈显著正相关,拟杆菌属与GSH-Px的变化趋势呈显著正相关,放线菌门与5-HT、MT、SOD、GSH-Px显著正相关,双歧杆菌属与MDA、MT、GSH-Px显著正相关(Plt;0.05)(图5c、5d).
4" 讨论
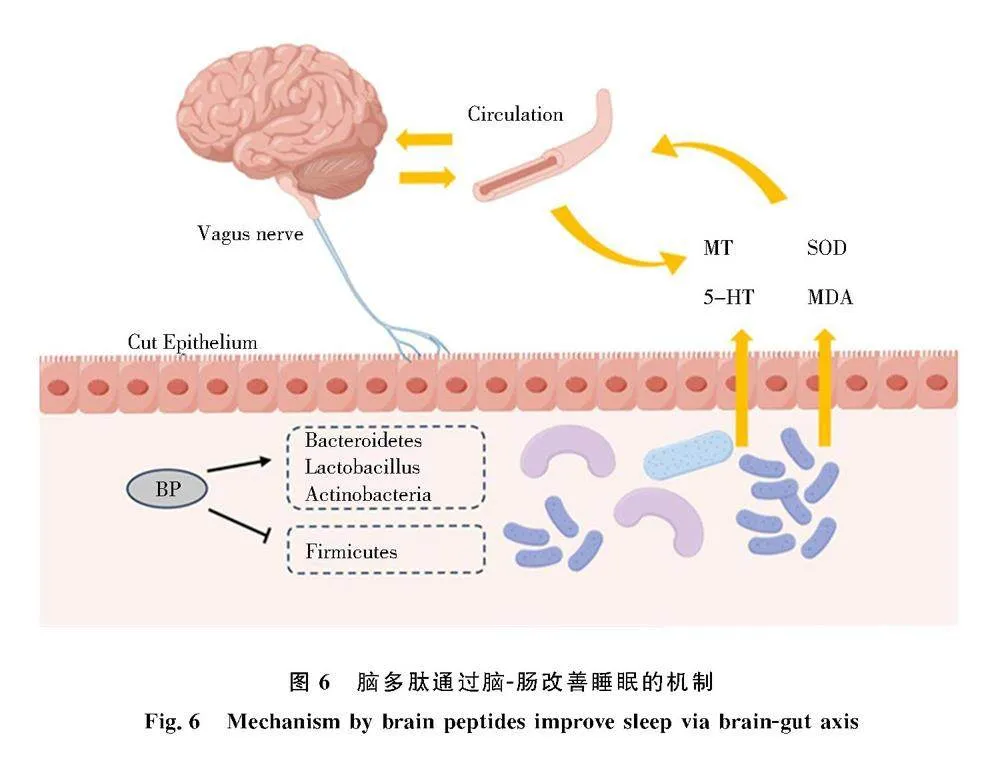
睡眠发生是中枢神经系统的一个主动过程,发生睡眠障碍的物质基础可能与睡眠-觉醒机制有关神经递质含量的变化相关[21].肠道菌群同时能够对睡眠障碍产生影响[4],微生物的代谢产物可能在其中发挥重要作用,一些细菌能产生多巴胺、血清素、乙酰胆碱、γ-氨基丁酸及其他类似神经系统的神经调节物质[22].这类神经递质中5-HT对调节睡眠、痛觉等生理功能有一定影响,MT分泌量直接影响睡眠质量和节律,GABA 是脑内最重要的抑制性神经递质,能够促进觉醒向睡眠转化,正向调节神经递质就能够正向调节睡眠[22].提示大脑与肠道微生物之间存在双向性的关系,本文用微生物群-肠-脑轴的机制来探究睡眠机制(图6).
实验通过腹腔注射PCPA制备睡眠障碍小鼠模型,睡眠障碍小鼠体质量呈下降趋势,悬尾不动时间显著增加,明箱停留时间缩短,戊巴比妥钠诱导的协同睡眠实验小鼠的睡眠潜伏期延长,睡眠维持时间缩短,提示PCPA诱导的睡眠障碍小鼠模型复制成功.脑多肽高剂量治疗小鼠的5-HT、GABA、MT含量以及SOD、GSH-Px酶活性显著性升高,MDA含量显著性降低,提示脑多肽可能通过正向调节睡眠-觉醒神经递质改善睡眠[16-17].此外,肠道菌群在睡眠剥夺诱导的神经系统疾病中起关键作用[20].脑多肽治疗睡眠障碍小鼠肠道菌群Shannon指数和Chao1指数无显著性差异,菌群总体多样性无显著性变化,但3组小鼠菌群组成上存在显著性差异,脑多肽可能改善特定菌的丰度,对优势菌群进一步分析,将有助于理解脑多肽的作用机制.
拟杆菌门、双歧杆菌属、乳杆菌属是睡眠菌群研究中的常用指标,有学者发现睡眠剥夺后小鼠出现肠道拟杆菌门丰度减少,体内丁酸盐增多的现象,提示拟杆菌与神经发育正相关,是人体有益菌[23-24].同时在肠道菌群中,乳杆菌属是维持肠道稳态的有益菌,连续 24 h 剥夺睡眠可降低小鼠乳杆菌属的相对丰度[19].乳杆菌属丰度的增加不仅能改善睡眠障碍,同时能提高 5-HT 水平,推测乳杆菌属能够正向调节神经递质改善睡眠[20].菌群分类学组成表明,脑多肽可以增加拟杆菌门、双歧杆菌属、乳杆菌属这3类菌的丰度,同时本实验拟杆菌门与5-HT的变化趋势呈正相关,乳杆菌属与5-HT显著性正相关.推测脑多肽可能上调拟杆菌、乳杆菌属丰度,通过脑-肠轴调节脑内神经递质含量,改善睡眠障碍(图6).
文献[25]研究显示,罗汉果提取物能够通过调节血清内MDA、SOD浓度使机体恢复正常氧化平衡状态,从而改善睡眠,这与本实验结果一致.提示脑多肽可能通过调节氧化应激水平进行神经保护,改善睡眠.在研究黄芩素对肠道影响的报道中发现拟杆菌科可以减轻炎症,抑制有害菌和氧化应激[26].任璐婷等[27]在研究结肠炎症时发现乳杆菌属可以抑制促炎因子分泌缓解肠道炎症,提示拟杆菌和乳杆菌丰度的增加可以改善氧化应激.脑多肽高剂量治疗小鼠的SOD、GSH-Px酶活性显著性升高,MDA含量显著性降低,拟杆菌属与MDA的变化趋势呈正相关,乳杆菌属与SOD酶活性呈显著正相关,推测脑多肽可以在一定程度上通过改善菌群丰度,激活体内抗氧化酶SOD的活性,清除细胞内增多的过氧化产物MDA,正向调节氧化应激水平,进行神经保护,改善睡眠障碍.
5" 结论
本实验通过腹腔注射PCPA造模,进行戊巴比妥钠协同睡眠实验证实造模成功.通过16Sr RNA基因测序以及相关神经递质测定,推测脑多肽可能通过上调拟杆菌门、乳杆菌属丰度,并利用脑-肠轴通路上调5-HT的含量、SOD活性,下调MDA含量改善小鼠睡眠.
参" 考" 文" 献:
[1]" 郁阿翠,钟云,阮晓东.脑肠肽在睡眠障碍中的作用研究进展[J].新乡医学院学报, 2018, 35(3): 248-251. DOI: 10.7683/xxyxyxb.2018.03.022.
[2]" KRAUS S S, RABIN L A. Sleep America: managing the crisis of adult chronic insomnia and associated conditions[J]. J Affect Disord, 2012, 138(3): 192-212. DOI: 10.1016/j.jad.2011.05.014.
[3]" ISAIAH S, LOOTS D T, SOLOMONS R, et al. Overview of brain-to-gut axis exposed to chronic CNS bacterial infection(s) and a predictive urinary metabolic profile of a brain infected by Mycobacterium tuberculosis[J]. Front Neurosci, 2020, 14: 296. DOI: 10.3389/fnins.2020.00296.
[4]" REYNOLDS A C, PATERSON J L, FERGUSON S A, et al. The shift work and health research agenda: considering changes in gut microbiota as a pathway linking shift work, sleep loss and circadian misalignment, and metabolic disease[J]. Sleep Med Rev, 2017, 34: 3-9. DOI: 10.1016/j.smrv.2016.06.009.
[5]" 陈天赐,武少兰,杨国辉,等.无柄灵芝醇提物对小鼠睡眠及肠道菌群的影响[J].生物技术通报, 2022, 38(8): 225-232. DOI: 10.13560/j.cnki.biotech.bull.1985.2021-1470.
[6]" LIU Y T, CHENG F Y, TAKEDA S, et al. Effects of porcine brain hydrolysate on impairment of cognitive learning ability in amyloid β(1-40)-infused rats[J]. Anim Sci J, 2019, 90(2): 271-279. DOI: 10.1111/asj.13054.
[7]" 龙盼,胡晓霞,胡琦兰,等.天麻素对氯苯丙氨酸(PCPA)致失眠小鼠的镇静催眠作用研究[J].中药药理与临床, 2021, 37(5): 33-38. DOI: 10.13412/j.cnki.zyyl.2021.05.007.
[8]" 谢懂君,吴旭玲,董楝,等.甘露特钠对慢性癫痫大鼠认知功能障碍的影响[J].中国神经精神疾病杂志, 2023, 49(6): 351-356. DOI: 10.3969/j.issn.1002-0152.2023.06.006.
[9]" 姚玉静,张书敏,任艳艳,等.酸枣仁提取物、龙眼肉提取物、γ-氨基丁酸和酪蛋白水解物复配制剂改善睡眠功能[J].食品工业科技, 2023, 44(7): 406-410. DOI: 10.13386/j.issn1002-0306.2022100103.
[10]" 刘玉凤,黄枚,南丽红,等.古方半夏秫米汤对正常小鼠最大给药量及其对失眠模型大鼠作用的实验研究[J].中药药理与临床, 2023, 39(8): 12-18. DOI: 10.13412/j.cnki.zyyl.20230524.007.
[11]" 张振宇,米传靓,李思迪,等.基于16S rRNA测序分析脂多糖结合蛋白基因敲除对小鼠肠道菌群的影响[J].中国医药生物技术, 2023, 18(2): 110-115. DOI: 10.3969/j.issn.1673-713X.2023.02.003.
[12]" 侯金良,张媛媛,张浩,等.沉香片剂小鼠口鼻吸入给药抗焦虑和催眠功效实验研究[J].山东中医药大学学报, 2021, 45(1): 113-119. DOI: 10.16294/j.cnki.1007-659x.2021.01.018.
[13]" 高荣静,黄红,姜宁,等.大豆异黄酮对脂多糖诱导小鼠抑郁样行为的改善作用研究[J].大豆科学, 2021, 40(4): 539-545. DOI: 10.11861/j.issn.1000-9841.2021.04.0539.
[14]" 王瑞英,苏丹,李惠珍,等.生、酒五味子对失眠小鼠神经-内分泌-免疫网络的影响及机制[J].中国药房, 2023, 34(5): 525-530. DOI: 10.6039/j.issn.1001-0408.2023.05.03.
[15]" 范恩宇,魏振华,范秋领,等.黑柄炭角菌(乌灵菌)粉改善睡眠作用以及对小鼠大脑神经递质及其受体的影响[J].菌物学报, 2022, 41(9): 1498-1505. DOI: 10.13346/j.mycosystema.210491.
[16]" 徐飞飞,田雅娟,李钦青,等.酸枣仁-茯苓-党参水提物对小鼠睡眠的改善作用及机制研究[J].食品工业科技, 2021, 42(11): 300-308. DOI: 10.13386/j.issn1002-0306.2020070005.
[17]" 李莉,刘茹,何晶,等.温胆汤方剂对睡眠剥夺小鼠氧化应激及炎症反应的影响[J].中国免疫学杂志, 2022, 38(3): 308-312. DOI: 10.3969/j.issn.1000-484X.2022.03.009.
[18]" 李欣益,刘春妍,黄建,等.益生菌V9对高脂饮食诱导的NAFLD大鼠肝功能、氧化应激及脂代谢的影响及作用机制[J].中国免疫学杂志, 2019, 35(23): 2822-2826. DOI: 10.3969/j.issn.1000-484X.2019.23.002.
[19]" 郭鹏.左旋丁基苯酞对血管性痴呆大鼠神经功能、线粒体氧化应激及海马组织胶质细胞源性神经营养因子表达的影响[J].中国老年学杂志, 2019, 39(6): 1444-1447. DOI: 10.3969/j.issn.1005-9202.2019.06.052.
[20]" 刁华琼,魏丹,丁海月,等.黄连阿胶汤对睡眠剥夺大鼠5-羟色胺系统和肠道菌群的影响[J].中国实验方剂学杂志, 2023, 29(21): 49-58. DOI: 10.13422/j.cnki.syfjx.20231043.
[21]" 万叶敏.基于肠-脑轴PI3K/AKT/mTOR自噬通路探讨加味通便汤改善STC的临床疗效及作用机制[D].南京:南京中医药大学, 2022. DOI:10.27253/d.cnki.gnjzu.2022.000029.
[22]" BEAR T L K, DALZIEL J E, COAD J, et al. The role of the gut microbiota in dietary interventions for depression and anxiety[J]. Adv Nutr, 2020, 11(4): 890-907. DOI: 10.1093/advances/nmaa016.
[23]" 陈抒鹏,唐娜娜,王思梦,等.肝郁脾虚方对抑郁失眠模型大鼠结肠组织GABA能信号系统及肠道菌群的影响[J].中医杂志, 2023, 64(12): 1273-1281. DOI: 10.13288/j.11-2166/r.2023.12.014.
[24]" 屈婉,刘硕,朱华伟,等.酸枣仁水提物对焦虑大鼠症状的改善及其对肠道菌群的影响[J].现代食品科技, 2019, 35(11): 30-36. DOI: 10.13982/j.mfst.1673-9078.2019.11.005.
[25]" 杨烨,徐兴军,李浩雨,等.罗汉果山柰苷对慢性睡眠剥夺小鼠抗氧化能力的影响[J].动物营养学报, 2023, 35(12): 8083-8096. DOI: 10.12418/CJAN2023.732.
[26]" 陈雪梅,胡博,唐晓姝,等.紫苏籽油对小鼠肠道微生物及抗氧化能力的影响[J].食品与发酵工业,2024,50(16):271-277.DOI: 10.13995/j.cnki.11-1802/ts.037422.
[27]" 任璐婷,夏满盈,罗瑞琳,等.苹果发酵物对溃疡性结肠炎小鼠肠道菌群的调节作用[J].食品与发酵工业,2024,50(15):33-40.DOI: 10.13995/j.cnki.11-1802/ts.039431.
(责任编辑:梁俊红)

