一种含SNAP-tagTM底物的硫醇荧光探针


摘" 要:合成了一种同时含α, β-不饱和酮活性位点和SNAP-tagTM底物的香豆素母体探针香豆素-烯酮-苯甲氨基鸟嘌呤(CAKBG).通过测试探针CAKBG的紫外-可见吸收光谱和荧光发射光谱,发现探针CAKBG在极性溶剂(例如, 甘油、乙二醇、水、DMSO)中有更长的吸收波长,且探针CAKBG对溶液的pH变化不敏感.此外,光谱实验发现生物硫醇Cys和Hcy均能引起探针CAKBG的最大吸收波长发生蓝移,且当激发波长为405 nm时,Cys和Hcy均能导致探针CAKBG在487 nm处的荧光发射峰明显增强.细胞成像结果表明,含有SNAP-tagTM底物的硫醇荧光探针CAKBG在活细胞中可以对Cys、Hcy进行荧光成像.综上,SNAP-TagTM蛋白标签技术有望今后在硫醇荧光探针的细胞成像中得到推广应用.
关键词:α, β-不饱和酮;SNAP-TagTM底物;硫醇荧光探针;细胞成像
中图分类号:O622.4""" 文献标志码:A""" 文章编号:10001565(2024)05050409
DOI:10.3969/j.issn.10001565.2024.05.007
A thiol fluorescent probe containing SNAP-tagTM substrate
LIN Lixia1, GUO Chunqing1, WANG Libin1, ZHAO Zibiao1, XIONG Kangming2,3
(1. Department of Security, Shanxi Police College, Taiyuan 030401, China; 2. Key Laboratory of Nano-imaging and Drugloaded Preparation of Shanxi Province, Shanxi Bethune Hospital, Taiyuan 030032, China; 3. CAS Key Laboratory of Separation Science for Analytical Chemistry, Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, China)
Abstract: A coumarin-based probe coumarin-alkene ketone-benzylaminoguanine (CAKBG) containing both α, β-unsaturated ketone and SNAP-tagTM substrate was synthesized. By testing the UV-Vis absorption spectra and fluorescence emission spectra of the probe CAKBG, the results show that the probe CAKBG has a longer absorption wavelength in polar solvents ( such as glycerol, ethylene glycol, water, DMSO), and the probe CAKBG is not sensitive to the pH change of the solutions. In addition, spectral experiments show that both Cys and Hcy can cause a blue shift in the maximum absorption wavelength of the probe CAKBG, and when the excitation wavelength is 405 nm, both Cys and Hcy can cause the fluorescence emission peak of the probe CAKBG at 487 nm to be significantly enhanced. Cell imaging results show that the thiol fluorescent probe CAKBG containing SNAP-tagTM substrate can image Cys and Hcy in living cells. The above results indicate that SNAP-TagTM protein labeling technology is expected to be widely
收稿日期:20230615;修回日期:20230912
基金项目:
国家自然科学基金资助项目(22008232);山西省基础研究计划青年科学研究项目(202203021212512)
第一作者:林利霞 (1991—),女,山西警察学院讲师,博士,主要从事有机小分子的光谱性能研究.
E-mail:1552774577@qq.com
通信作者:熊康明 (1990—),男,山西白求恩医院副研究员,博士,主要从事荧光探针的传感识别研究.
E-mail:1187994460@qq.com
used in cell imaging of thiol fluorescent probes in the future.
Key words: α, β-unsaturated ketone; SNAP-TagTM substrate; thiol fluorescent probes; cell imaging
小分子生物硫醇主要包括半胱氨酸(Cys)、同型半胱氨酸(Hcy)和还原型谷胱甘肽(GSH).在生命体中,它们的浓度异常与多种疾病密切相关[1-3].因此,监测生物体内小分子生物硫醇浓度的变化非常有意义.目前检测生物硫醇的方法有高效液相色谱法[4]、分光光度法[5]、伏安法[6]、质谱法[7]以及荧光探针法[8]等,其中荧光探针法相比其他检测方法具有灵敏度高、特异性强等特点,从而受到越来越多科研工作者的关注.目前为止,虽然已报道了大量荧光探针用于细胞内硫醇的检测[9-13],但对于其中绝大多数的硫醇荧光探针来说,由于它们不含有靶向特定细胞器的基团,直接导致探针在多种细胞器中广泛分布,不利于细胞内硫醇的精准定位成像.目前有些科研工作者也开发出了一些通过引入能够靶向特定细胞器的基团到硫醇荧光探针分子中[14-16],从而实现细胞内硫醇的精准定位成像,但是目前这种方法所构建出来的硫醇荧光探针仍然存在问题,例如:探针靶向到细胞器之后不能长时间停留,继而发生部分探针逃逸,造成细胞内其他位置的荧光背景较强.因此,开发出能够稳定靶向特定细胞器的探针成为当前硫醇荧光探针研究的新热点.
SNAP-TagTM作为蛋白标签技术中最常用的一种,具有高度的自标记特异性、稳定性及配体的多样性.SNAP-tagTM蛋白所带的活性巯基位点通过与荧光探针结构中具有侧链苯甲基基团的苯甲基鸟嘌呤反应之后,可以将探针的荧光团绑定到SNAP-tagTM蛋白上,并且释放出的苯甲基鸟嘌呤在生物体内十分稳定,没有其他蛋白质会与其反应,因此自标记是高度特异的.此外,SNAP-tagTM自标记形成的硫醚键具有高度的稳定性.通过SNAP-TagTM蛋白标签技术将硫醇荧光探针绑定到特定细胞器膜的表面,有望解决探针从细胞器中逃逸而导致细胞内其他位置荧光背景强的问题.
考虑到香豆素母体具有良好的生物相容性,有较强的稳定荧光发射和良好的结构灵活性,本研究工作合成出了一种同时含α,β-不饱和酮活性位点和SNAP-tagTM底物的香豆素母体荧光探针香豆素-烯酮-苯甲氨基鸟嘌呤(CAKBG),并初步探究含有硫醇反应位点的荧光探针携带上SNAP-tagTM底物之后,是否还能够在体外及体内识别检测生物硫醇,进而为SNAP-tagTM蛋白标签技术在硫醇荧光探针中的推广应用,提供相关实验依据.
1" 实验部分
1.1" 仪器和试剂
1.1.1" 仪器
Agilent Cary 60紫外-可见分光光度计(安捷伦科技(中国)有限公司);Agilent Cary Eclipse荧光分光光度计(安捷伦科技(中国)有限公司);400MHz BrukerAvance核磁共振波谱仪(布鲁克公司);HP1100LC/MSD质谱仪(安捷伦科技(中国)有限公司);安道尔活细胞共聚焦成像平台(安道尔科技有限公司).
1.1.2" 试剂
1-甲基吡啶烷、2-氨基-6氯嘌呤、三氟乙酸乙酯、对羧基苯甲醛(北京伊诺凯科技有限公司);1-羟基苯并三唑、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(上海阿达玛斯试剂有限公司);N,N-二甲基甲酰胺、无水碳酸钠、乙腈、四氢呋喃(天津市科密欧化学试剂有限公司);4-氰基苯甲醛、叔丁醇钾(百灵威科技有限公司);氢化铝锂(萨恩化学技术有限公司);各种氨基酸(Sigma-Aldrich有限公司).
1.2" 测量方法
用DMSO配制浓度为2 mmol/L的探针CAKBG储备液.用去离子水制备相应的分析物(HPO2-4、SO2-4、Cl-、NO-3、CO2-3、L-Asp、L-Ala、L-Arg、L-Trp、L-Met、L-Thr、L-Gly、L-Ile、L-Cys、DL-Hcy、L-GSH、Ca2+、Mg2+、Zn2+、K+、Na+)储备液,使其浓度为20 mmol/L.将上述这些储备溶液进一步稀释至所需的浓度以进行相应的实验.测试溶液的制备如下:将适当浓度的探针CAKBG溶液,或适当浓度的探针CAKBG与分析物混合溶液加入石英比色皿中,用DMSO或PBS (10 mmol/L) 将相应的溶液稀释至2 mL.光谱数据在室温下被记录.
1.3" 探针CAKBG的制备与表征
探针的合成需要通过多步反应得到,具体合成路线如图1所示.
1.3.1" 苯甲氨基鸟嘌呤(BG)的合成及表征
苯甲氨基鸟嘌呤的合成方法见参考文献[17-18],其表征数据:1H NMR (400 MHz, DMSO-d6):δ 7.82 (s, 1H), 7.44 (d, J=7.4 Hz, 2H), 7.35 (d,J=6.4 Hz, 2H), 6.28 (s, 2H), 5.45 (s, 2H), 3.74 (s, 2H).
1.3.2" 香豆素-烯酮(CAK)的合成及表征
将化合物香豆素-酮(CK)(0.259 1 g, 1.0 mmol)、对羧基苯甲醛(0.165 1 g, 1.1 mmol)溶于5 mL乙醇和5 mL乙腈的混合溶剂中,加入100 μL哌啶回流48 h.随后将反应液的溶剂减压旋蒸除去,粗产物通过硅胶柱色谱分离提纯 (洗脱剂为二氯甲烷-乙酸乙酯,体积比3∶1),最终可得到0.143 8 g的橙红色固体化合物CAK(产率36.8%).化合物香豆素-烯酮的表征数据:1H NMR (400 MHz, DMSO-d6) δ 8.62 (s, 1H), 8.05 (d, J=15.8 Hz, 1H), 7.99 (d, J=8.2 Hz, 2H), 7.82 (d, J=8.2 Hz, 2H), 7.72 (d, J=3.8 Hz, 1H), 7.69 (d, J=2.9 Hz, 1H), 6.83 (dd, J=9.0, 2.1 Hz, 1H), 6.62 (d, J=1.9 Hz, 1H), 3.51 (q, J=6.9 Hz, 4H), 1.15 (t, J=7.0 Hz, 6H); 13C NMR (400 MHz, DMSO-d6)δ 185.89、167.42、160.42、158.78、153.62、149.07、140.85、139.32、132.95、130.35、128.82、127.58、115.71、110.79、108.42、96.41、44.97、12.84. HRMS m/z: [M+H]+ calculated for C23H22NO+5: 392.1493; measured: 392.1488.
1.3.3" CAKBG的合成及表征
将CAK(0.078 3 g, 0.2 mmol)、BG(0.054 0 g, 0.2 mmol)、1-羟基苯并三唑(0.027 0 g, 0.2 mmol)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(0.038 3 g, 0.2 mmol)溶于无水N,N-二甲基甲酰胺 (2 mL)中,滴加三乙胺(0.040 5 g, 0.4 mmol)后在室温下搅拌48 h,随后减压旋蒸除去溶剂,粗产物用硅胶柱色谱提纯(洗脱剂为二氯甲烷-甲醇,体积比50∶1),可得到0.0361 g的橙黄色固体化合物CAKBG (产率28.1%).化合物CAKBG的表征数据:1H NMR (400 MHz, DMSO-d6) δ 12.42 (s, 1H), 9.13 (t, J=5.9 Hz, 1H), 8.61 (s, 1H), 8.03 (d, J=15.8 Hz, 1H), 7.96 (d, J=8.3 Hz, 2H), 7.81 (d, J=8.4 Hz, 3H), 7.71 (d, J=4.7 Hz, 1H), 7.68 (d, J=1.6 Hz, 1H), 7.47 (d, J=8.1 Hz, 2H), 7.35 (d, J=8.1 Hz, 2H), 6.82 (dd, J=9.0, 2.1 Hz, 1H), 6.61 (d, J=1.9 Hz, 1H), 6.26 (s, 2H), 5.46 (s, 2H), 4.50 (d, J=5.7 Hz, 2H), 3.50 (q, J=6.8 Hz, 4H), 1.15 (t, J=7.0 Hz, 6H); 13C NMR (400 MHz, DMSO-d6) δ 185.95、166.05、160.40、160.07、158.76、153.57、151.03、149.06、149.01、141.11、139.87、138.00、135.97、135.73、132.91、129.03、128.72、128.39、127.78、127.01、115.81、110.76、108.41、96.41、67.02、44.95、42.99、12.84. HRMS m/z: [M+H]+ calculated for C36H34N7O+5: 644.2616; measured: 644.2599.
1.4" 细胞培养和成像
将HeLa细胞培养在含有体积分数10%胎牛血清(FBS,Hyclone)的Dulbecco改良的Eagle培养基(DMEM,Gibco)中,并置于37 ℃、体积分数为5%CO2和95%空气混合的培养箱中培养.在进行成像实验之前,将HeLa细胞接种到细胞培养皿的底部,孵育上1~2 d,然后将细胞用于进一步的实验.
将培养好的HeLa细胞分别用1 mL DMEM培养基培养,分别往空白组和实验组中加入终浓度为1.0 μmol/L的探针CAKBG,于37 ℃、体积分数为5%CO2和95%空气混合的培养箱中孵育1 h.随后空白组继续孵育30 min,之后直接进行细胞成像;实验组分别加入60.0 μmol/L的Cys或Hcy继续孵育30 min,之后直接进行细胞成像.细胞成像通过安道尔活细胞共聚焦成像平台获得.在405 nm的激发光源下,选择417~470 nm处的波段作为输出的蓝色信号通道;在488 nm的激发光源下,选择500~550 nm处的波段作为输出的绿色信号通道.
2" 结果与讨论
2.1" 探针CAKBG的紫外-可见吸收光谱和荧光发射光谱
2.1.1" 探针CAKBG在不同极性溶剂中的光谱情况
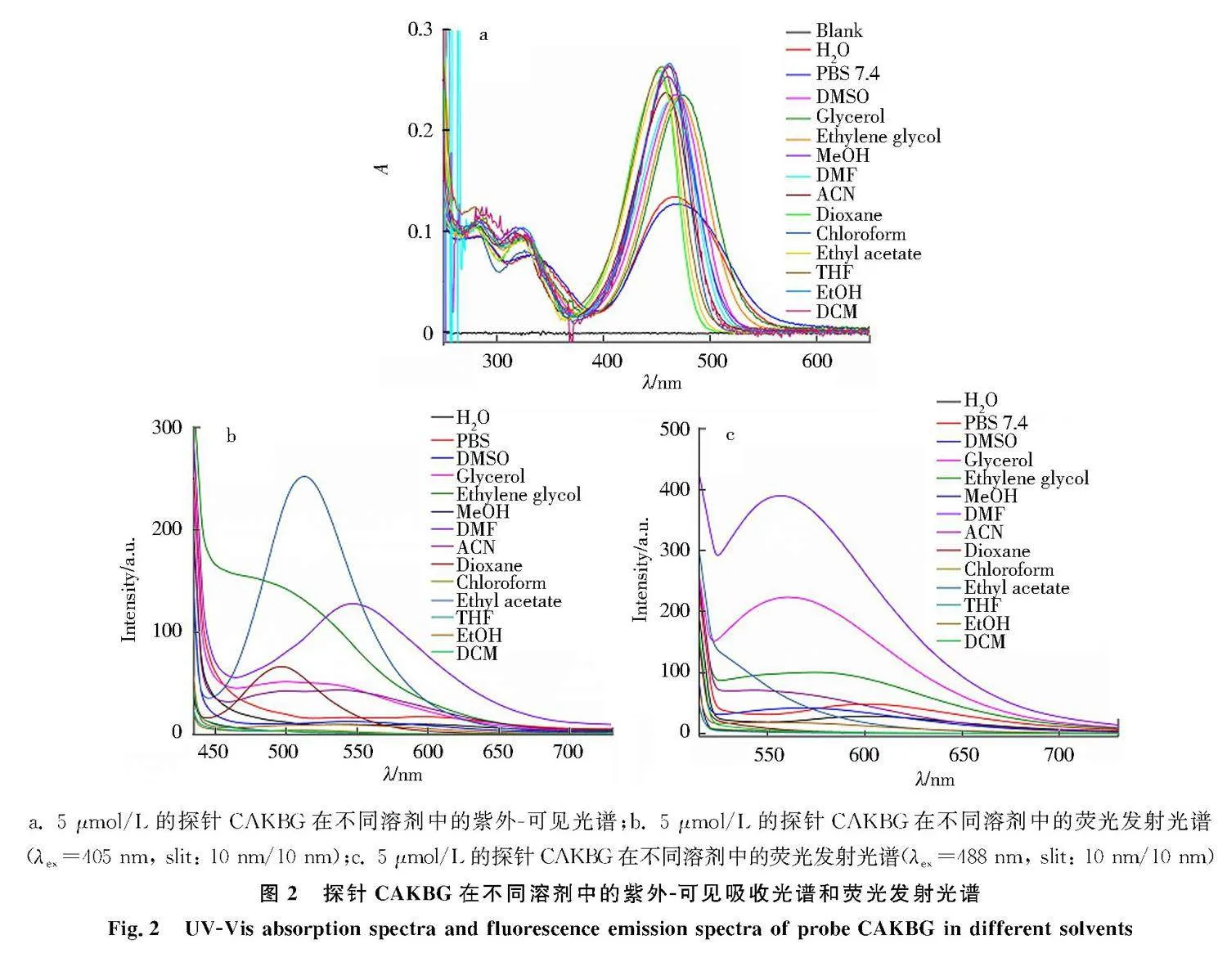
通过紫外-可见吸收光谱法和荧光发射光谱法探究了CAKBG探针在不同溶剂中的光谱情况.如图2a所示,探针CAKBG在极性溶剂(甘油、乙二醇、水、DMSO)中会有更长的吸收波长,在弱极性溶剂(乙酸乙酯、1,4-二氧六环)中会有更短的吸收波长.随后测试了探针CAKBG在不同溶剂中的荧光发射光谱.如图2b所示,当激发波长为405 nm时,探针CAKBG在大部分溶剂中的最大发射波长为497~550 nm,此时以绿色荧光为主.如图2c所示,当激发波长为488 nm时,探针CAKBG在大部分溶剂中的最大发射波长为556~605 nm,此时以黄绿色荧光为主.
a. 5 μmol/L的探针CAKBG在不同溶剂中的紫外-可见光谱;b. 5 μmol/L的探针CAKBG在不同溶剂中的荧光发射光谱(λex=405 nm, slit: 10 nm/10 nm);c. 5 μmol/L的探针CAKBG在不同溶剂中的荧光发射光谱(λex=488 nm, slit: 10 nm/10 nm)
2.1.2" 探针CAKBG在不同pH溶液中的光谱情况
研究了探针CAKBG在不同pH溶液中的紫外-可见吸收光谱和荧光发射光谱.从图3中可知,探针CAKBG在不同的pH溶液中,吸收波长移动变化的并不明显,主要是引起很小的吸收强度变化.探针CAKBG在激发波长为405 nm或488 nm时,在不同pH溶液中仅仅引起荧光强度的变化,基本上对其发射波长的移动没有影响.由此可见,探针CAKBG对溶液的pH变化不敏感.
a. 5 μmol/L的探针CAKBG在不同pH溶液中的紫外-可见吸收光谱;b. 5 μmol/L的探针CAKBG在不同pH溶液中的荧光发射光谱(λex=405 nm, slit: 10 nm/10 nm;);c. 5 μmol/L的探针CAKBG在不同pH溶液中的荧光发射光谱(λex=488 nm, slit: 10 nm/10 nm)
2.1.3" 探针CAKBG在不同分析物溶液中的光谱情况
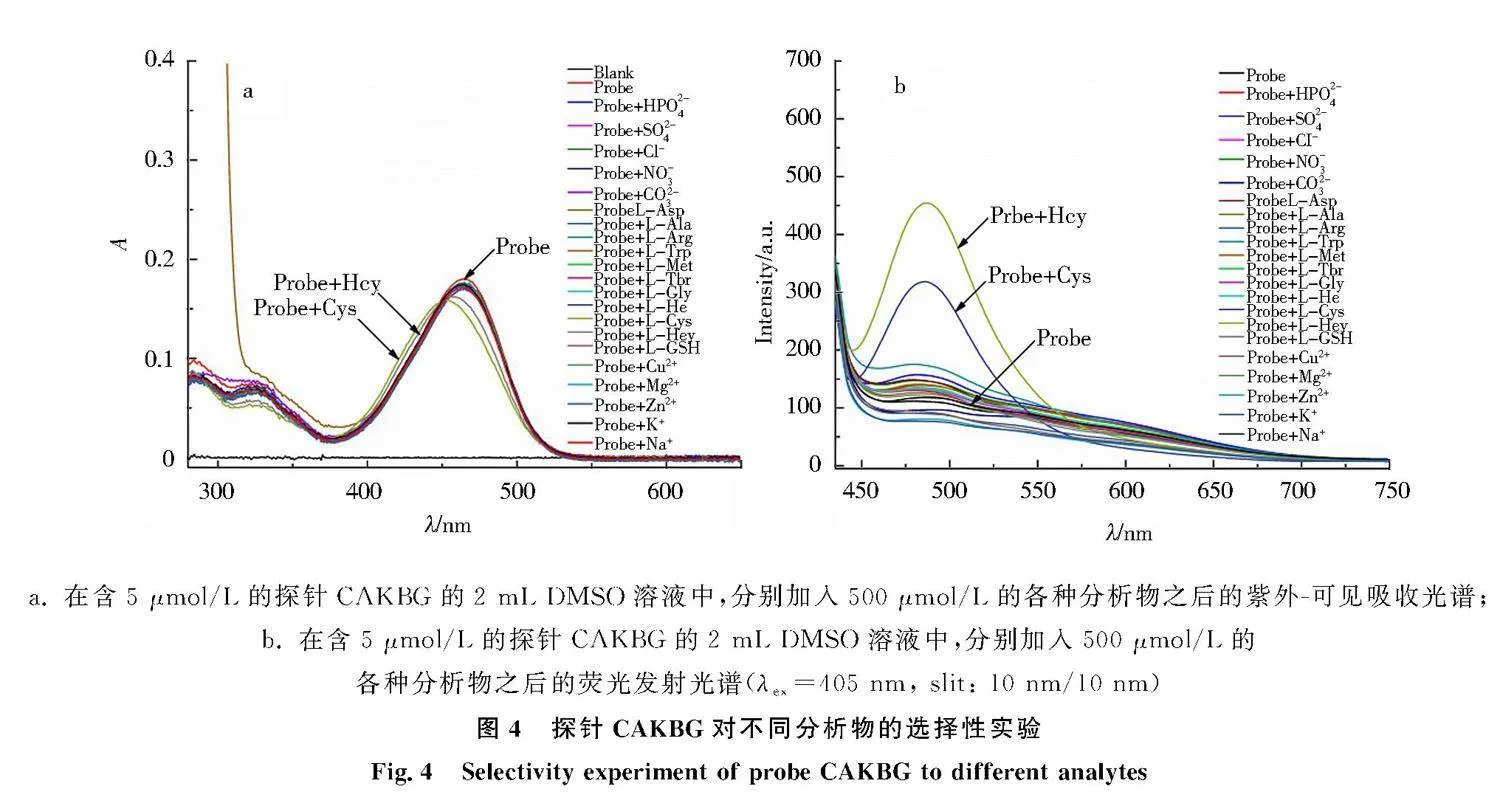
为了探究探针CAKBG在溶液中是否对一些阴离子、阳离子或氨基酸有响应,在2 mL 的DMSO溶液中分别测试了5 μmol/L探针CAKBG加入500 μmol/L的不同分析物 (HPO2-4、SO2-4、Cl-、NO-3、CO2-3、L-Asp、L-Ala、L-Arg、L-Trp、L-Met、L-Thr、L-Gly、L-Ile、L-Cys、DL-Hcy、L-GSH、Ca2+、Mg2+、Zn2+、K+、Na+) 之后的紫外-可见吸收光谱和荧光发射光谱.如图4a所示,当2 mL的DMSO溶液中分别加入5 μmol/L的探针CAKBG和500 μmol/L的不同分析物之后,观察到Cys和Hcy引起了探针CAKBG的紫外-可见吸收光谱变化,其最大吸收波长均发生了蓝移.相应地从图4b中可以看到,当激发波长为405 nm时,Cys和Hcy引起了探针CAKBG荧光发射光谱的明显变化,在487 nm处出现了很强的发射峰.由此可见,探针CAKBG对Cys和Hcy的荧光检测具有较好的选择性.
a. 在含5 μmol/L的探针CAKBG的2 mL DMSO溶液中,分别加入500 μmol/L的各种分析物之后的紫外-可见吸收光谱;b. 在含5 μmol/L的探针CAKBG的2 mL DMSO溶液中,分别加入500 μmol/L的各种分析物之后的荧光发射光谱(λex=405 nm, slit: 10 nm/10 nm)
2.1.4" 探针CAKBG溶液中加入Cys、Hcy、GSH后的光谱情况
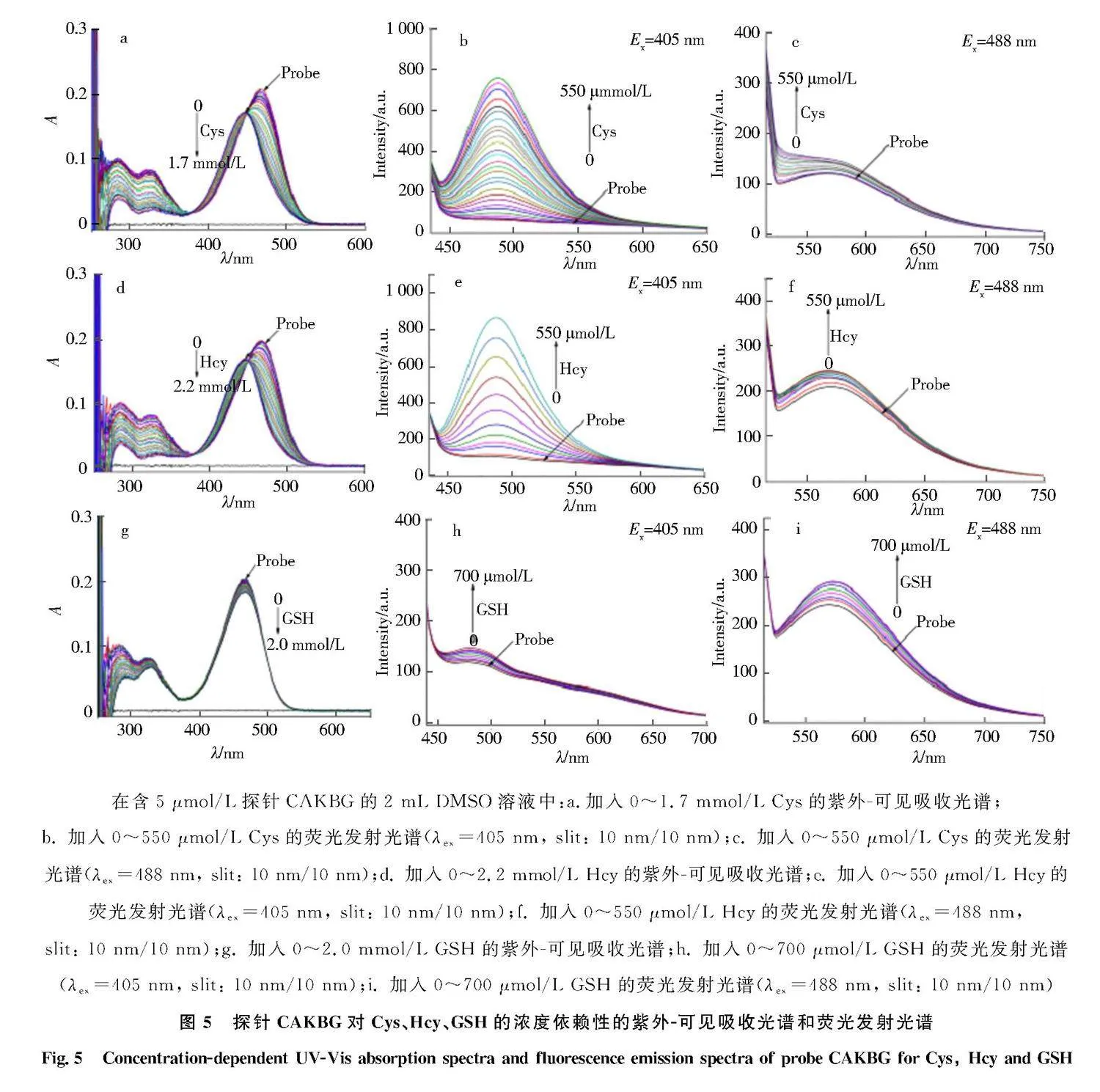
由于探针CAKBG中含有α,β-不饱和酮结构,因此该位置有可能作为亲核加成反应的识别位点.随后,通过浓度依赖性的紫外-可见吸收光谱和荧光发射光谱,研究了探针CAKBG的DMSO溶液中分别加入Cys、Hcy、GSH后的光谱变化情况.图5a显示:添加Cys后的紫外-可见吸收光谱的变化.随着体系中Cys浓度(0~1.7 mmol/L)的增加,探针CAKBG在467 nm处的吸收峰发生了蓝移,并在445 nm处出现了1个新的吸收峰.图5d显示:添加Hcy后的紫外-可见吸收光谱的变化.随着体系中Hcy浓度(0~2.2 mmol/L)的增加,探针CAKBG在467 nm处的吸收峰发生了蓝移,并在445 nm处出现了1个新的吸收峰.图5g显示:添加GSH后的紫外-可见吸收光谱的变化.随着体系中GSH浓度(0~2.0 mmol/L)的增加,探针CAKBG在467 nm处的吸收峰只发生了轻微的降低,这可能是由于GSH的空间位阻相对于Cys、Hcy来说更大,不利于亲核加成反应所导致的.图5b显示:探针CAKBG对Cys的荧光响应.选择405 nm作为激发波长,随着体系中Cys浓度(0~550 μmol/L)的增加,487 nm处出现了明显的荧光发射峰.图5c显示:探针CAKBG对Cys的荧光响应.选择488 nm作为激发波长,随着体系中Cys浓度(0~550 μmol/L)的增加,572 nm处的荧光发射峰略微增强.图5e显示:探针CAKBG对Hcy的荧光响应.选择405 nm作为激发波长,随着体系中Hcy浓度(0~550 μmol/L)的增加,487 nm处出现了明显的荧光发射峰.图5f显示:探针CAKBG对Hcy的荧光响应.选择488 nm作为激发波长,随着体系中Hcy浓度(0~550 μmol/L)的增加,572 nm处的荧光发射峰略微增强.图5h显示:探针CAKBG对GSH的荧光响应.选择405 nm作为激发波长,随着体系中GSH浓度(0~700 μmol/L)的增加,482 nm处出现了较弱的荧光发射峰.图5i显示:探针CAKBG对GSH的荧光响应.选择488 nm作为激发波长,随着体系中GSH浓度(0~700 μmol/L)的增加,572 nm处的荧光发射峰略微增强.以上实验表明,探针CAKBG对Cys、Hcy具有较好的荧光增强响应.同时也进一步表明含有硫醇反应位点的荧光探针携带上SNAP-tagTM底物之后,在体外仍然可以识别检测生物硫醇.
在含5 μmol/L探针CAKBG的2 mL DMSO溶液中:a.加入0~1.7 mmol/L Cys的紫外-可见吸收光谱;b. 加入0~550 μmol/L Cys的荧光发射光谱(λex=405 nm, slit: 10 nm/10 nm);c. 加入0~550 μmol/L Cys的荧光发射光谱(λex=488 nm, slit: 10 nm/10 nm);d. 加入0~2.2 mmol/L Hcy的紫外-可见吸收光谱;e. 加入0~550 μmol/L Hcy的荧光发射光谱(λex=405 nm, slit: 10 nm/10 nm);f. 加入0~550 μmol/L Hcy的荧光发射光谱(λex=488 nm, slit: 10 nm/10 nm);g. 加入0~2.0 mmol/L GSH的紫外-可见吸收光谱;h. 加入0~700 μmol/L GSH的荧光发射光谱(λex=405 nm, slit: 10 nm/10 nm);i. 加入0~700 μmol/L GSH的荧光发射光谱(λex=488 nm, slit: 10 nm/10 nm)
2.2" 探针CAKBG在活细胞中的成像
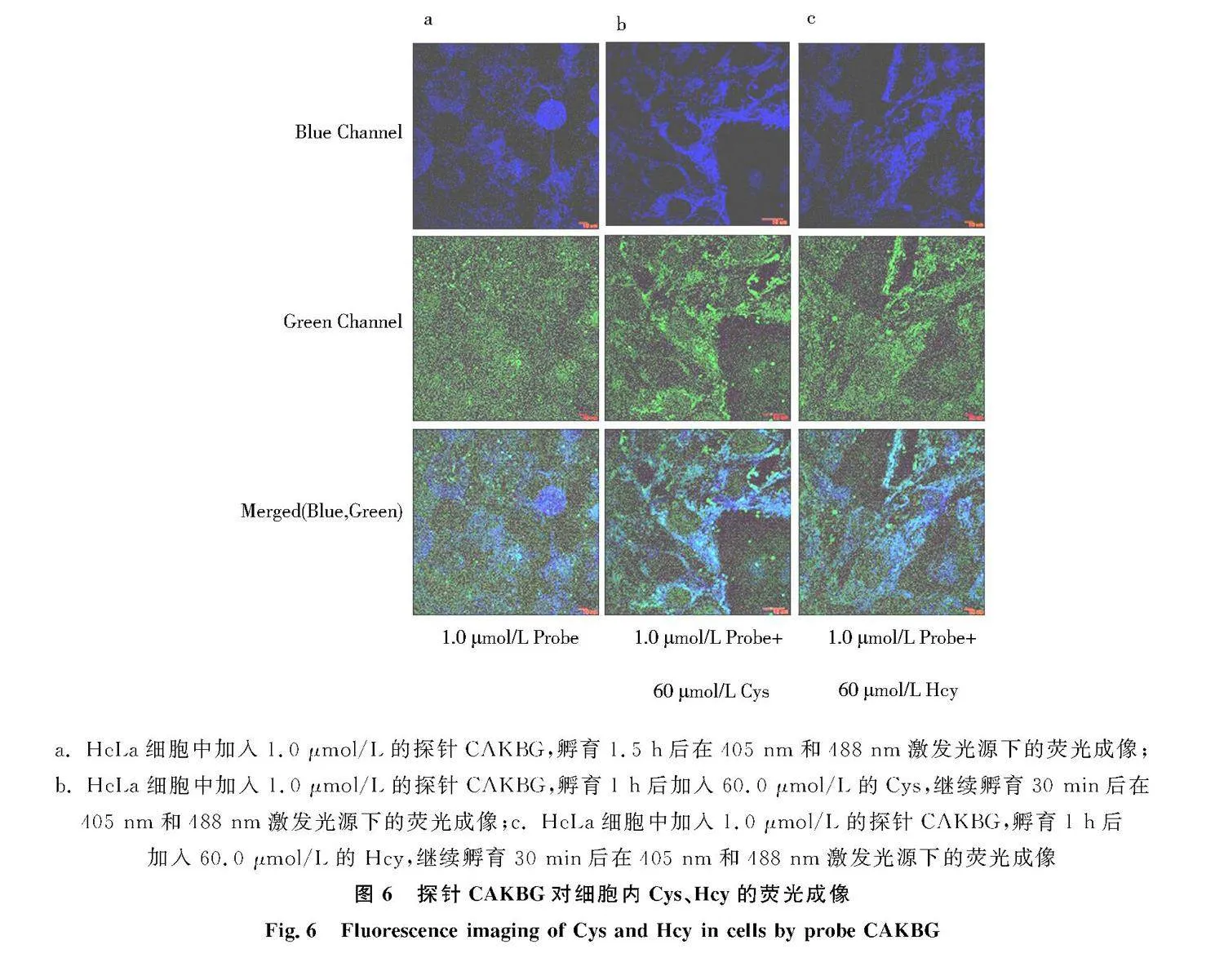
探针CAKBG在分子设计的时候,引入了含α,β-不饱和酮位点,可以与具有较强亲核性的巯基官能团发生反应,从而引起硫醇探针荧光的变化.在本实验中,将1.0 μmol/L的探针CAKBG加入到HeLa细胞中,孵育1.5 h之后,通过安道尔活细胞共聚焦成像平台进行荧光成像.如图6a所示,探针CAKBG在蓝色信号通道和绿色信号通道下出现微弱的荧光,这可能是由于探针CAKBG与细胞内含量较少的Cys、Hcy反应之后引起的荧光增强.为了进一步证实探针CAKBG能与细胞内的Cys、Hcy反应,分别将1.0 μmol/L的探针CAKBG加入到HeLa细胞中,孵育1 h之后,分别再加入60.0 μmol/L的Cys或Hcy继续孵育30 min,随后通过安道尔活细胞共聚焦成像平台进行荧光成像.从图6b和图6c中可以看到,蓝色信号通道和绿色信号通道中的荧光均有了明显的增强,说明含有SNAP-tagTM底物的硫醇荧光探针CAKBG在活细胞中可以与Cys、Hcy发生反应,进而对其进行荧光成像.
a. HeLa细胞中加入1.0 μmol/L的探针CAKBG,孵育1.5 h后在405 nm和488 nm激发光源下的荧光成像;b. HeLa细胞中加入1.0 μmol/L的探针CAKBG,孵育1 h后加入60.0 μmol/L的Cys,继续孵育30 min后在405 nm和488 nm激发光源下的荧光成像;c. HeLa细胞中加入1.0 μmol/L的探针CAKBG,孵育1 h后加入60.0 μmol/L的Hcy,继续孵育30 min后在405 nm和488 nm激发光源下的荧光成像
3" 结论
本研究合成了一种同时含α,β-不饱和酮活性位点和SNAP-tagTM底物的香豆素母体染料探针CAKBG.通过测试探针CAKBG的紫外-可见吸收光谱和荧光发射光谱,发现含SNAP-tagTM底物的探针CAKBG对Cys和Hcy具有较好的荧光增强响应.在随后的细胞成像实验中,证实了含有SNAP-tagTM底物的硫醇荧光探针CAKBG在活细胞中可以与Cys、Hcy发生反应,进而对其进行荧光成像.因此,SNAP-TagTM蛋白标签技术有望今后在硫醇荧光探针的细胞成像中得到推广应用,并有望解决探针从细胞器中逃逸而导致细胞内其他位置荧光背景强的问题.尽管如此,探针CAKBG在细胞透膜、荧光量子产率等方面仍存在着一些不足之处,希望通过后期探针分子结构的优化,获得性能更好的含SNAP-tagTM底物的硫醇荧光探针.
参" 考" 文" 献:
[1]" SHAHROKHIAN S. Lead phthalocyanine as a selective carrier for preparation of a cysteine-selective electrode[J]. Anal Chem, 2001, 73(24): 5972-5978. DOI: 10.1021/ac010541m.
[2]" SESHADRI S, BEISER A, SELHUB J, et al. Plasma homocysteine as a risk factor for dementia and Alzheimer’s disease[J]. N Engl J Med, 2002, 346(7): 476-483. DOI: 10.1056/NEJMoa011613.
[3]" DALTON T P, SHERTZER H G, PUGA A. Regulation of gene expression by reactive oxygen[J]. Annu Rev Pharmacol Toxicol, 1999, 39: 67-101. DOI: 10.1146/annurev.pharmtox.39.1.67.
[4]" VACEK J, KLEJDUS B, PETRLOV J, et al. A hydrophilic interaction chromatography coupled to a mass spectrometry for the determination of glutathione in plant somatic embryos[J]. Analyst, 2006, 131(10): 1167-1174. DOI: 10.1039/b606432a.
[5]" LIANG G L, RONALD J, CHEN Y X, et al. Controlled self-assembling of gadolinium nanoparticles as “smart” molecular magnetic resonance imaging contrast agents[J]. Angew Chem Int Ed Engl, 2011, 50(28): 6283-6286. DOI: 10.1002/anie.201007018.
[6]" KACZYSKA A, PELSERS M M A L, BOCHOWICZ A, et al. Plasma heart-type fatty acid binding protein is superior to troponin and myoglobin for rapid risk stratification in acute pulmonary embolism[J]. Clin Chim Acta, 2006, 371(1/2): 117-123. DOI: 10.1016/j.cca.2006.02.032.
[7]" MACCOSS M J, FUKAGAWA N K, MATTHEWS D E. Measurement of homocysteine concentrations and stable isotope tracer enrichments in human plasma[J]. Anal Chem, 1999, 71(20): 4527-4533. DOI: 10.1021/ac990541a.
[8]" WANG Y T, YAN H M, YUE Y K, et al. GSH and H2O2 dynamic correlation in the ferroptosis pathways revealed by engineered probe in tumor and kidney injury[J]. Chem Eng J, 2023, 464: 142496. DOI: 10.1016/j.cej.2023.142496.
[9]" 孟美荣,阴彩霞.一种荧光增强型的GSH荧光探针[J].河北大学学报(自然科学版), 2019, 39(1): 49-55. DOI: 10.3969/j.issn.1000-1565.2019.01.009.
[10]" LIU Y, WU Y X, ZHANG D L, et al. Rational design of in situ localization solid-state fluorescence probe for bio-imaging of intracellular endogenous cysteine[J]. Talanta, 2020, 220: 121364. DOI: 10.1016/j.talanta.2020.121364.
[11]" CHEN J, LI Y W, FENG X K, et al. An ICT-based fluorescent probe guided by theoretical calculation for selectively mapping endogenous GSH in living cells[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2021, 246: 119041. DOI: 10.1016/j.saa.2020.119041.
[12]" CAI S T, LIU C, JIAO X J, et al. A lysosome-targeted near-infrared fluorescent probe for imaging endogenous cysteine (Cys) in living cells[J]. J Mater Chem B, 2020, 8(11): 2269-2274. DOI: 10.1039/C9TB02609F.
[13]" HE R K, ZHANG Y C, MADHU S, et al. BODIPY based realtime, reversible and targeted fluorescent probes for biothiol imaging in living cells[J]. Chem Commun, 2020, 56(93): 14717-14720. DOI: 10.1039/d0cc06313d.
[14]" ZHU Y D, PAN H T, SONG Y Y, et al. Mitochondria-targeted fluorescent probe for rapid detection of thiols and its application in bioimaging[J]. Dyes Pigm, 2021, 191: 109376. DOI: 10.1016/j.dyepig.2021.109376.
[15]" LIANG B B, WANG B Y, MA Q J, et al. A lysosome-targetable turn-on fluorescent probe for the detection of thiols in living cells based on a 1, 8-naphthalimide derivative[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2018, 192: 67-74. DOI: 10.1016/j.saa.2017.10.044.
[16]" ZHANG X, LIU C Y, CAI X Y, et al. A highly specific Golgi-targetable fluorescent probe for tracking cysteine generation during the Golgi stress response[J]. Sens Actuat B Chem, 2020, 310: 127820. DOI: 10.1016/j.snb.2020.127820.
[17]" LENG S, QIAO Q L, MIAO L, et al. A wash-free SNAP-tag fluorogenic probe based on the additive effects of quencher release and environmental sensitivity[J]. Chem Commun, 2017, 53(48): 6448-6451. DOI: 10.1039/c7cc01483j.
[18]" OHYANAGI T, SHIMA T, OKADA Y, et al. Compact and stable SNAP ligand-conjugated quantum dots as a fluorescent probe for single-molecule imaging of dynein motor protein[J]. Chem Commun, 2015, 51(80): 14836-14839. DOI: 10.1039/c5cc05526a.
(责任编辑:梁俊红)

