黄芪多糖、皂苷及益生菌复合物对感染大肠杆菌肉鸡肠道的保护作用
摘 要: 旨在评价黄芪多糖(APS)、皂苷(AS)与益生菌的复合物对肉鸡抗大肠杆菌感染能力的影响。选取1日龄的白羽肉鸡200只,随机分为空白组、受试物组、阳性组和模型组,每组50只鸡,试验期42 d。1~21 d,空白组和模型组雏鸡每日饲喂基础日粮并灌服生理盐水0.2 mL·只-1,受试物组饲喂含APS(1 g·kg-1)与AS(10 mg·kg-1)的试验日粮,并灌服益生菌复合菌液0.2 mL·只-1(非解乳糖链球菌∶植物乳杆菌∶枯草芽孢杆菌=1∶1∶1,菌液浓度均为1×109 CFU·mL-1),阳性组雏鸡每天饲喂基础日粮中添加了50 mg·kg-1盐酸多西环素可溶性粉的试验日粮。21 d时,受试物组、阳性组和模型组试验鸡均灌服0.2 mL·只-1大肠杆菌O78菌液(6×108 CFU·mL-1)。在感染第0、1、7、14和21天(即试验期第21、22、28、35和42天)检测十二指肠和空肠组织结构、sIgA、炎性因子和氧化指标,同时检测盲肠内容物细菌数量。结果显示:1)除感染第0天外,模型组盲肠大肠杆菌数量均显著高于空白组、受试物组和阳性组(P<0.05),感染后第0、1、7、14和21天,受试物组鸡乳酸菌数量显著高于空白组、阳性组和模型组(P<0.05)。2)感染1和7 d时,受试物组和阳性组鸡十二指肠和空肠组织sIgA含量显著高于空白组和模型组(P<0.05);感染14 d时,受试物组鸡空肠组织sIgA含量显著高于空白组和模型组(P<0.05)。3)感染1和7 d时,受试物组和阳性组十二指肠、空肠的TNF-α含量显著低于模型组(Plt;0.05);感染7 d时,受试物组和阳性组十二指肠和空肠IL-10含量显著高于模型组(Plt;0.05);感染14和21 d时,受试物组和阳性组空肠组织IL-10含量显著高于模型组(Plt;0.05)。4)感染1、7、14、21 d时,受试物组、阳性组的十二指肠、空肠组织MPO活力显著高于空白组(P<0.05);感染1 d时,受试物组和阳性组空肠组织SOD显著高于模型组(Plt;0.05);感染7、21 d时,受试物组和阳性组十二指肠和空肠组织T-AOC显著高于模型组(Plt;0.05)。综上,在本试验条件下,APS、AS与益生菌复合物联合使用能增强雏鸡抗大肠杆菌感染能力,有替代抗生素的作用。
关键词: 黄芪多糖;黄芪皂苷;益生菌;肉鸡肠道;保护作用
中图分类号:S858.315.11
文献标志码:A""" 文章编号:0366-6964(2024)05-2241-12
收稿日期:2023-06-28
基金项目:益生菌发酵黄芪工艺研究及制剂开发(2022YFD1801104);中兽医与临床科技创新工程(CAAS-ASTIP-2015-LIHPS)
作者简介:刘佳惠(1998-),女,河南尉氏人,硕士生,主要从事兽医学研究,E-mail:13608696346@163.com;吴开开(1994-),男,山西稷山人,硕士生,主要从事兽医学研究,E-mail:2719807875@qq.com。刘佳惠和吴开开为同等贡献作者
*通信作者:张景艳,主要从事中兽医及免疫研究,E-mail:zwzh1223@126.com;李建喜,主要从事兽医临床诊断学/中兽医免疫,E-mail:lzjianxil@163.com
Protective Effects of Astragalus Polysaccharides, Saponins and Probiotic Compounds
on Intestinal Tract of Broilers Infected with E.coli
LIU" Jiahui, WU" Kaikai, WANG" Lei, ZHANG" Kang, HAN" Songwei, CHEN" Fubin, XU" Guowei,
GUO" Zhiting, GU" Xueyan, ZHANG" Jingyan*, LI" Jianxi*
(Lanzhou Institute of Animal Husbandry and Veterinary Medicine, Chinese Academy of
Agricultural Sciences, Lanzhou 730050," China)
Abstract:" The aim of this study was to evaluate the effects of Astragalus polysaccharide (APS), saponins (AS) and probiotics on the resistance to E. coli infection in broilers. A total of 200 1-day-old white-feathered broiler chickens were randomly divided into blank group, test group, positive group and model group, with 50 chickens in each group. The experiment lasted for 42 d. From 1 to 21 days, chicks in the blank group and model group were fed a basic diet and each of them was given 0.2 mL of normal saline every day, while chicks in the test group were fed a basic diet containing APS (1 g·kg-1) and AS (10 mg·kg-1), and each of them was given 0.2 mL of probiotic complex bacterial solution (Streptococcus alactolyticus∶Lactobacillus plantae∶Bacillus subtilis=1∶1∶1, the concentration of bacterial liquid was 1×109 CFU·mL-1), and chicks in the positive group were fed a basal diet containing 50 mg·kg-1 doxycycline hydrochloride soluble powder every day. At the 21st day, chickens in test group, positive group and model group each were given 0.2 mL Escherichia coli O78 bacterial solution (6×108 CFU·mL-1). Duodenum and jejunum tissue structure, sIgA, inflammatory factors, and oxidation markers were detected at days 0, 1, 7, 14, and 21 of infection (i.e., days 21, 22, 28, 35, and 42 of the trial period), as well as bacterial count in cecum contents. The results were showed as follows: 1) The number of E. coli in model group (except for the 0 day of infection) was significantly higher than that in blank group, test group and positive group (Plt;0.05), and the number of chicken lactic acid bacteria in test group was significantly higher than that in blank group, positive group and model group (Plt;0.05). 2) After 1 and 7 days of infection, the sIgA content in duodenum and jejunum tissues of test group and positive group was significantly higher than that of blank group and model group (Plt;0.05); After 14 days of infection, the sIgA content of jejunum tissue in test group was significantly higher than that in blank group and model group (Plt;0.05). 3) When infected for 1 and 7 d, the TNF-α content of duodenum and jejunum in the test group and the positive group was significantly lower than that in the model group (Plt;0.05); When infected for 7 days, the content of duodenum and jejunum IL-10 in the test group and the positive group was significantly higher than that in the model group (Plt;0.05); After 14 and 21 days of infection, the content of IL-10 in jejunal tissue in the test group and the positive group was significantly higher than that in the model group (Plt;0.05). 4) When infected for 1, 7, 14 and 21 days, the MPO activity of duodenal and jejunal tissues in the test group and the positive group was significantly higher than that in the blank group (Plt;0.05).When infected for 1 d, the SOD of jejunal tissues in the test group and the positive group was significantly higher than that in the model group (Plt;0.05), and when infected after 7 and 21 days, the T-AOC of duodenal and jejunal tissues in the test group and the positive group was significantly higher than that in the model group (Plt;0.05). In conclusion, under the condition of the current experiment, the combination of APS, AS and probiotic complex can enhance the ability of chicks to resist E. coli infection, and have the effect of replacing antibiotics.
Key words: Astragalus polysaccharides; Astragalus saponins; probiotics; broiler intestines; protective effect
*Corresponding authors: ZHANG Jingyan,E-mail:zwzh1223@126.com;LI Jianxi,E-mail:lzjianxi@163.com
我国是养鸡业大国,也是鸡肉、鸡蛋产品的消费大国。但我国在该领域的产出投入比较低,如雏鸡死淘率、全期料肉比、料蛋比等要高于美国等养鸡业发达国家。致病性大肠杆菌能够破坏雏鸡肠道屏障功能,从而引起肠道损伤[1]。由于雏鸡早期抗病力差,临床中多使用抗生素进行大肠杆菌病的预防与治疗。自2020年我国全面实施饲料端禁抗、养殖端限抗以来,如何筛选出安全、有效防治鸡大肠杆菌病的兽药产品是近年来的研究热点。黄芪多糖(Astragalus polysaccharides,APS)和黄芪皂苷(Astragalus saponins,AS)是中药材黄芪的主要活性成分,具有调节免疫、抗氧化、降血糖、抗炎、抗病毒、抗肿瘤等多种药理学作用,其中APS主要由己糖醛酸、果糖等组成[2],AS主要由黄芪皂苷(Ⅰ~Ⅶ)、异黄芪皂苷(Ⅰ、Ⅱ)等组成[3]。研究表明,日粮添加APS、AS可提高畜禽的生长性能和免疫功能,并可降低致病菌对机体的损伤程度[4]。孙波等[5]研究发现,肉鸡日粮中添加500和1 000 mg·kg-1的APS,能显著增加肠道中双歧杆菌和乳酸杆菌等有益菌的数量,而且沙门菌和大肠杆菌等有害菌数量显著减少。Song等[6]发现,日粮中添加APS可以改善肠道菌群,促进肠道健康。黄芪皂苷Ⅳ在浓度达到5 μL·mL-1时,可以在体外提高异嗜性粒细胞吞噬杀伤大肠杆菌O78的作用[7]。益生菌是一种或多种能够维持正常胃肠道菌群活动的有益微生物[8],其可以改善胃肠道黏膜完整性、营养物质消化能力、机体免疫功能,并竞争性抑制致病菌生长,从而提高动物生长性能和抗病力[9-10]。研究证实,许多中药和益生菌在预防、治疗疾病的过程中可发挥协同生物学作用[11]。如刘明生等[12]发现,在蛋鸡日粮中联合使用APS和益生菌可以显著提高蛋鸡的生产性能,改善机体抗体水平和抗氧化功能。王巍等[13]发现,中药联合益生菌可通过抑制小肠组织及血液TNF-α和IL-6 mRNA的过度表达,降低小肠组织及血清TNF-α和IL-6含量,改善肠腺变性和黏膜炎性细胞浸润以及小肠绒毛和微绒毛损伤,从而对大肠杆菌致小鼠腹泻起到保护作用。由此猜想,APS、AS联合益生菌能提高雏鸡对致病性大肠杆菌的抵抗力,发挥抗生素替代作用。然而相关研究尚未见报道。因此,本研究通过对比APS、AS及益生菌的复合物与多西环素对大肠杆菌O78菌液感染肉鸡的十二指肠和空肠的肠道保护作用,旨在评价黄芪活性成分与益生菌的协同替代抗生素的效果,为家禽疾病防控技术提供引导和数据支撑。
1 材料与方法
1.1 试验仪器与材料
光学显微镜(OLYMPUS),切片机(LEICA RM2265),超净工作台(北京东联哈尔仪器制造有限公司),多功能微孔板检测仪(Synergy LX)。甲醛、磷酸二氢钠和磷酸氢二钠为分析纯,盐酸多西环素可溶性粉(10%,福建贝迪药业有限公司),黄芪多糖(≥90%,北京生泰尔科技股份有限公司,2304291),AS(≥98%,上海源叶生物科技有限公司,N13HB201030),鸡分泌型免疫球蛋白(sIgA)、白细胞介素-1(IL-1)、肿瘤坏死因子-α(TNF-α)与白细胞介素-10(IL-10)检测试剂盒(上海酶联生物科技有限公司),髓过氧化物酶MPO测试盒、谷胱甘肽过氧化物酶(GSH-Px)测试盒、超氧化物歧化酶(SOD)测试盒和总抗氧化能力(T-AOC)测试盒购自南京建成生物工程研究所。非解乳糖链球菌FGM菌株(GenBank登录号JX435470),大肠杆菌O78(CVCC1418)购自中国兽医微生物菌种保藏管理中心,植物乳杆菌(CICC 20871),枯草芽孢杆菌(ATCC6633)。基础日粮按照NRC(1994)肉鸡饲养标准,结合我国《鸡饲养标准》(NY/T 33—2004)配制。
1.2 试验动物及分组
白羽肉鸡购自甘肃省酒泉市肃州区旺苗种禽养殖场,饲养于中国农业科学院兰州畜牧与兽药研究所标准化动物实验房,鸡舍内初始温度为35℃,每周降低3℃直至26℃,湿度为50%~60%。雏鸡饲喂基础日粮,按常规免疫程序进行免疫,自由采食和饮水。试验选取1 d的白羽肉鸡200只,随机分成4组,分别是空白组、受试物组、阳性组和模型组,每组6个重复,其中每个重复8~10只鸡。1~21 d时,空白组和模型组雏鸡每日饲喂基础日粮并灌服0.2 mL生理盐水,受试物组雏鸡每天灌服益生菌复合菌液0.2 mL(非解乳糖链球菌∶植物乳杆菌∶枯草芽孢杆菌=1∶1∶1,菌液浓度均为1×109 CFU·mL-1)[14-15],同时饲喂含APS(1 g·kg-1)与AS(10 mg·kg-1)的基础日粮[16-17],阳性组雏鸡每天饲喂基础日粮中添加了50 mg·kg-1盐酸多西环素可溶性粉的日粮。21 d时,受试物组、阳性组和模型组试验鸡均灌服0.2 mL·只-1大肠杆菌O78菌液(6×108 CFU·mL-1),空白组雏鸡每日饲喂基础日粮并灌服0.2 mL·只-1生理盐水。试验期为42 d。
1.3 样品采集及石蜡切片制作
试验第21、22、28、35和42天[即感染第0(未灌服大肠杆菌O78菌液之前)、1、7、14和21天]时,每个重复选取1只体重接近该重复平均体重的肉鸡(共24只),颈静脉放血处死,取雏鸡剖腹分离出盲肠段,取盲肠内容物于1.5mL冻存管中用于乳酸菌和大肠杆菌数量检测;采集十二指肠和空肠,于10%中性福尔马林溶液中固定,参考文献[18]制备组织切片,取约2 cm十二指肠和空肠组织于液氮速冻后-80 ℃保存,用于sIgA含量、相关炎性因子的检测和氧化指标GSH-Px、SOD、T-AOC及MPO的检测。
1.4 检测指标及方法
1.4.1 盲肠内容物乳酸菌和大肠杆菌数量检测
称取1 g盲肠内容物,用无菌生理盐水依次进行1×10-1 ~1×10-6倍稀释,每个稀释度取0.1 mL稀释液分别接种于MRS培养基和伊红美蓝培养基中,平板培养法测定乳酸菌(MRS培养基培养48 h)和大肠杆菌(伊红美蓝培养基培养24 h)菌落数,结果以1 g肠道内容物中细菌菌落的对数表示(lg CFU·g-1)。
1.4.2 sIgA含量检测
称取0.1 g鸡十二指肠和空肠组织,置于1.5 mL离心管中,加入0.9 mL的PBS,匀浆后,5 000 r·min-1离心10 min,取上清,备用。取ELISA试剂盒进行检测,检测步骤严格按照试剂盒说明书进行。用多功能微孔板检测仪检测各孔的OD值(波长450 nm),计算sIgA含量。
1.4.3 细胞因子IL-1、TNF-α与IL-10含量检测
按“1.4.2”处理取上清然后用ELISA试剂盒检测IL-1、TNF-α和IL-10含量,检测步骤严格按照试剂盒说明书进行。用多功能微孔板检测仪检测各孔的OD值(波长450 nm),计算IL-1、TNF-α和IL-10含量。
1.4.4 氧化指标GSH-Px、SOD、T-AOC及MPO检测
称取0.1 g鸡十二指肠或空肠组织,按照重量(g)∶体积(mL)=1∶9的比例加入0.9 mL生理盐水,冰水浴制备组织匀浆,3 000 r·min-1离心10 min,取上清液按照测试盒说明书检测GSH-Px活力、SOD活力。同上处理取组织匀浆12 000 r·min-1离心5 min,取上清液按照测试盒说明书检测T-AOC。称取0.1 g鸡十二指肠或空肠组织,按照重量(g)∶体积(mL)=1∶19的比例加入1.9 mL匀浆介质制备成5%的组织匀浆,按照MPO测试盒说明书检测MPO活力。
1.5 数据分析
所有数据均用SPSS20.0软件对数据进行One-way-ANOVA分析,再用LSD法进行多重比较,并绘图。试验结果以“平均值±标准差(mean±SD)”表示,Plt;0.05表示显著差异,Plt;0.01表示极显著差异。
2 结 果
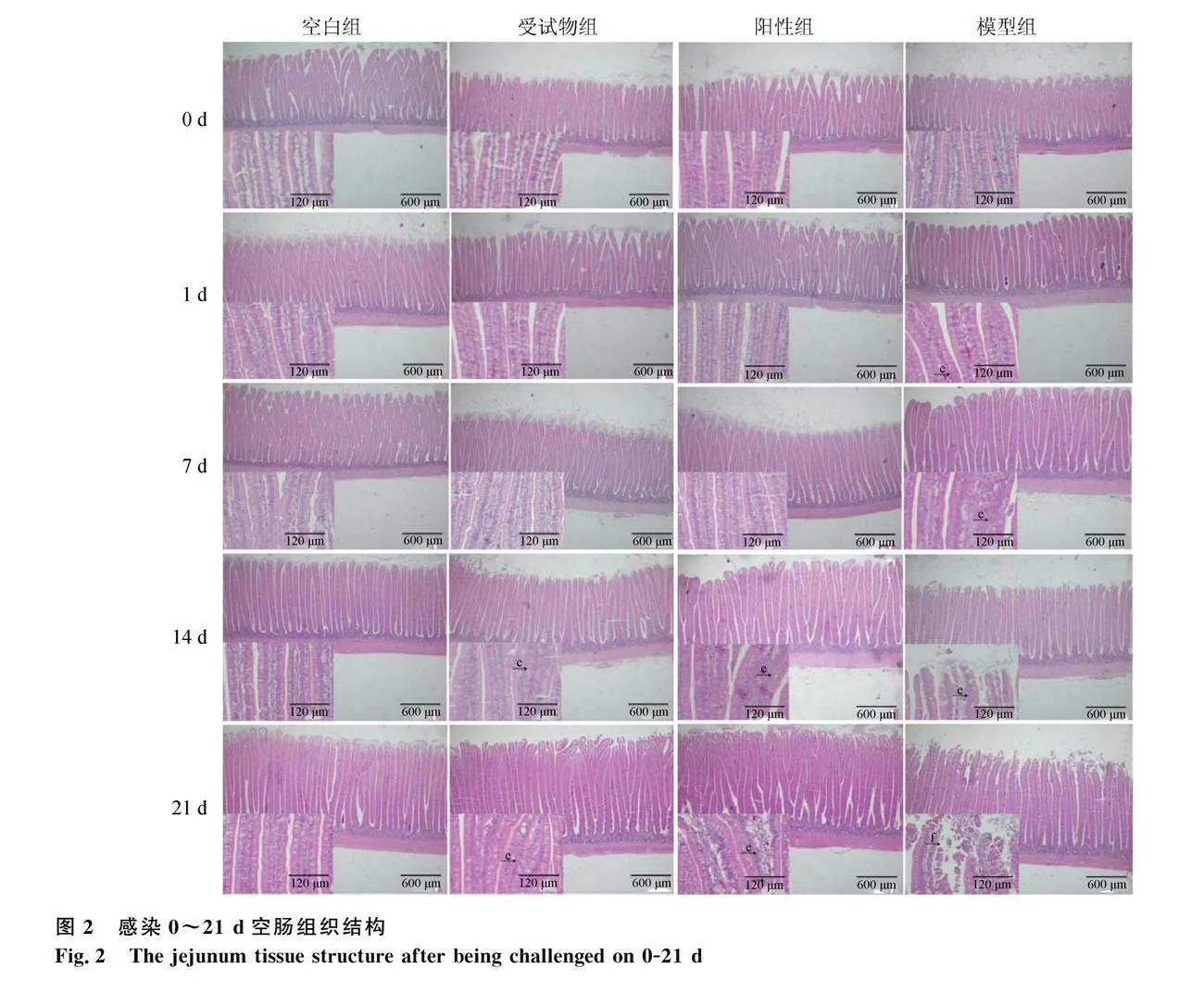
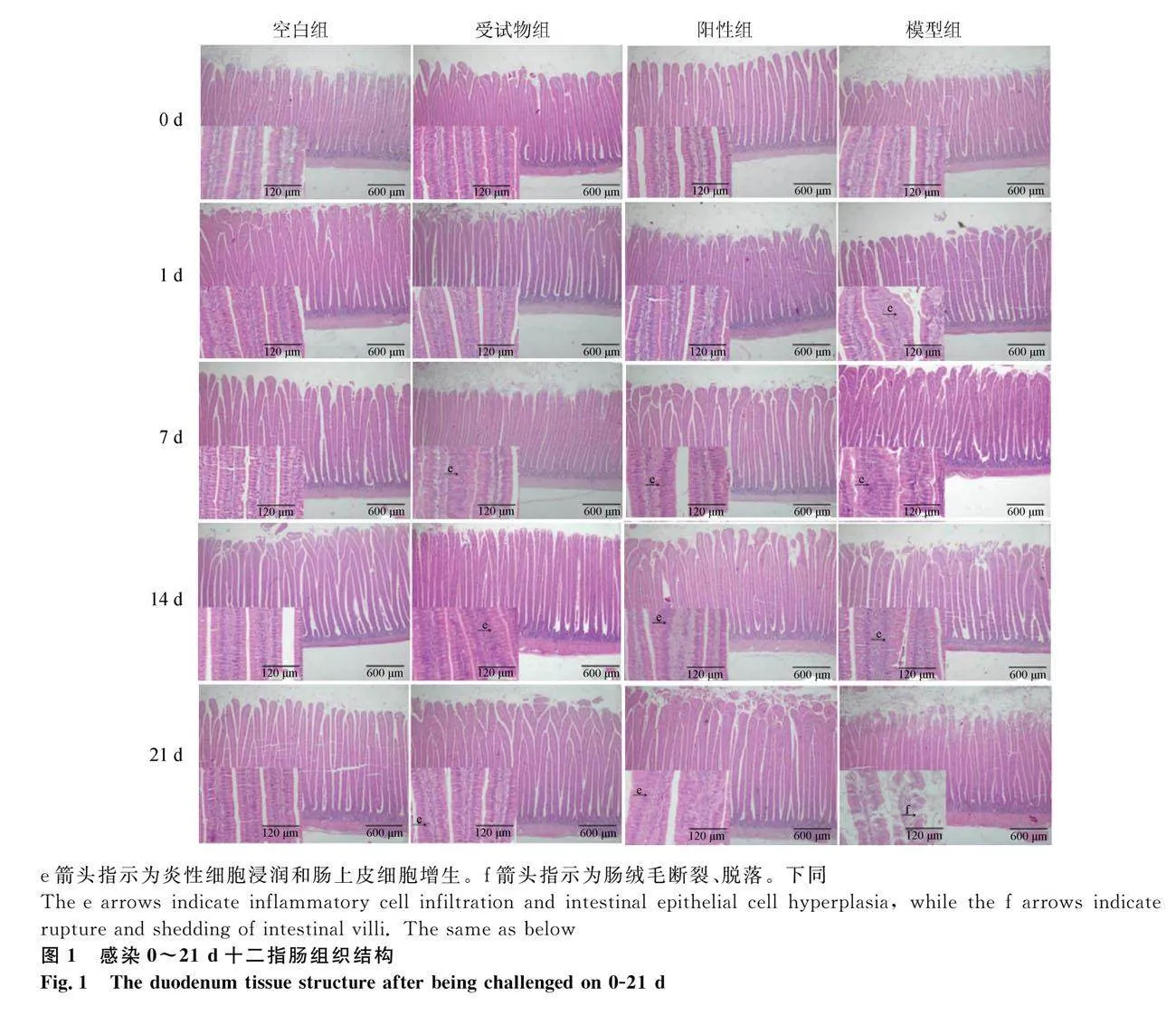
2.1 十二指肠和空肠组织结构
显微镜下观察各组肉鸡十二指肠和空肠组织结构变化,结果如图1和图2所示。感染第0天时,各组雏鸡十二指肠和空肠组织结构正常。感染第1、7、14和21天时,空白组鸡十二指肠和空肠组织结构均正常;受试物组和阳性组鸡十二指肠和空肠组织结构较为完整;模型组鸡十二指肠和空肠有出血、炎性细胞浸润、肠上皮细胞增生和绒毛断裂、脱落等病变。
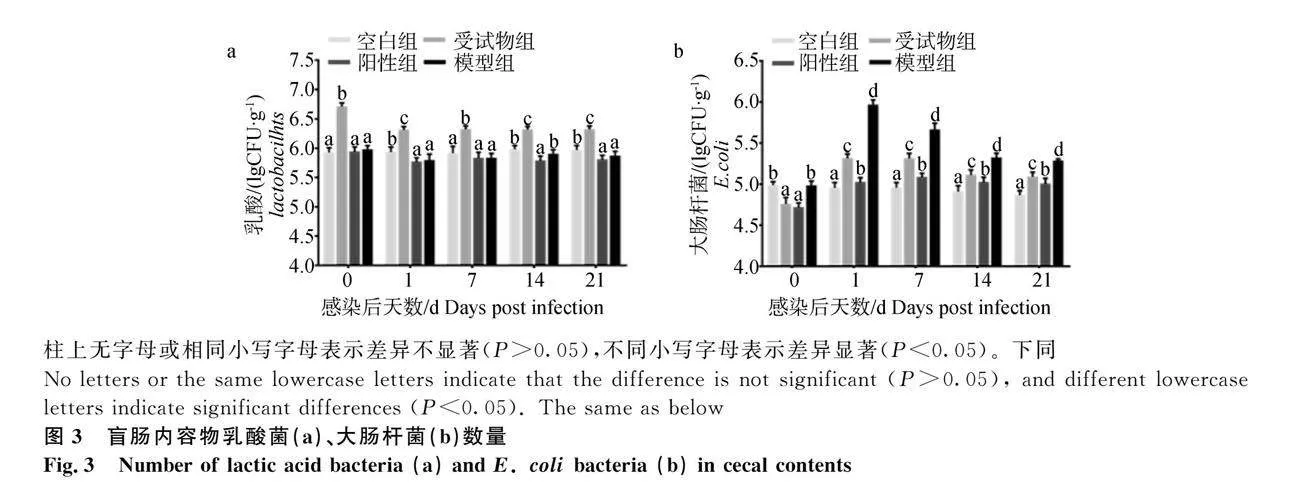
2.2 盲肠内容物乳酸菌和大肠杆菌数量
各组试验鸡盲肠内容物乳酸菌数量如图3a所示,感染第0、1、7、14和21天时,受试物组鸡盲肠乳酸菌数量显著高于空白组、阳性组和模型组(P<0.05);各组试验鸡盲肠内容物大肠杆菌数量如图3b所示,感染第0天,空白组和模型组大肠杆菌数量显著高于受试物组和阳性组(P<0.05),感染第1、7、14和21天时,模型组大肠杆菌数量显著高于空白组、受试物组和阳性组(P<0.05),且受试物组显著高于空白组(P<0.05)。
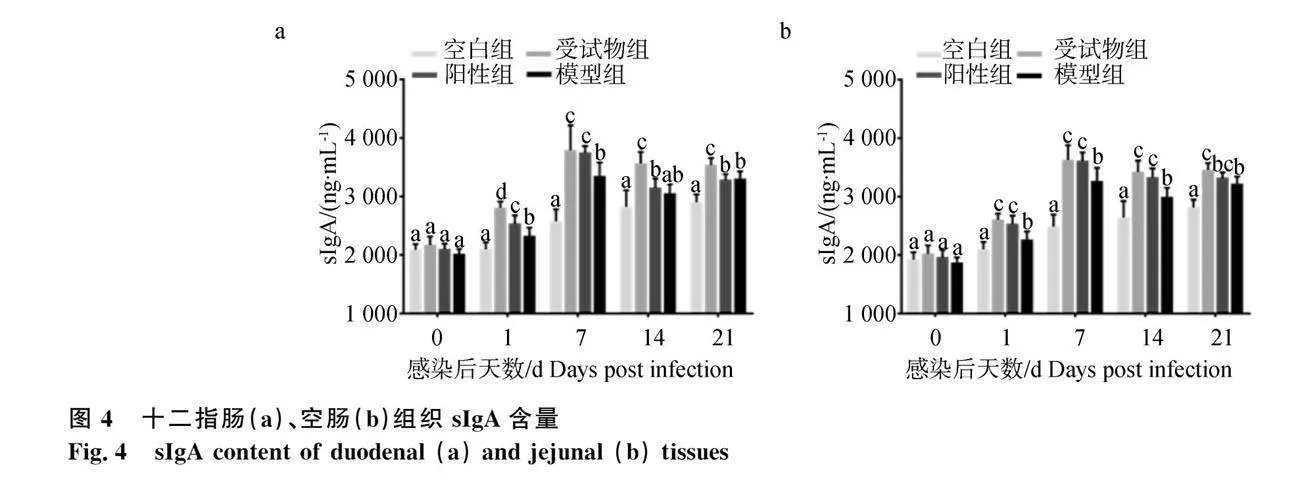
2.3 十二指肠和空肠组织sIgA含量
各组试验鸡十二指肠组织sIgA含量如图4a所示,感染第0天时,各组鸡十二指肠组织sIgA含量无显著差异(P>0.05);感染第1和7天时,受试物组和阳性组鸡十二指肠组织sIgA含量显著高于空白组和模型组(P<0.05);感染第14和21天时,受试物组鸡十二指肠组织sIgA含量显著高于其他3组(P<0.05),阳性组鸡十二指肠组织sIgA含量与模型组相比无显著性差异(P>0.05)。各组试验鸡空肠组织sIgA含量如图4b所示,感染第0天时,各组鸡空肠组织sIgA含量无显著差异(P>0.05);感染第1、7和14天时,受试物组和阳性组鸡空肠组织sIgA含量显著高于空白组和模型组(P<0.05);感染第21天时,受试物组鸡空肠组织sIgA含量显著高于空白组和模型组(P<0.05),阳性组鸡空肠组织sIgA含量与模型组相比无显著差异(P>0.05)。
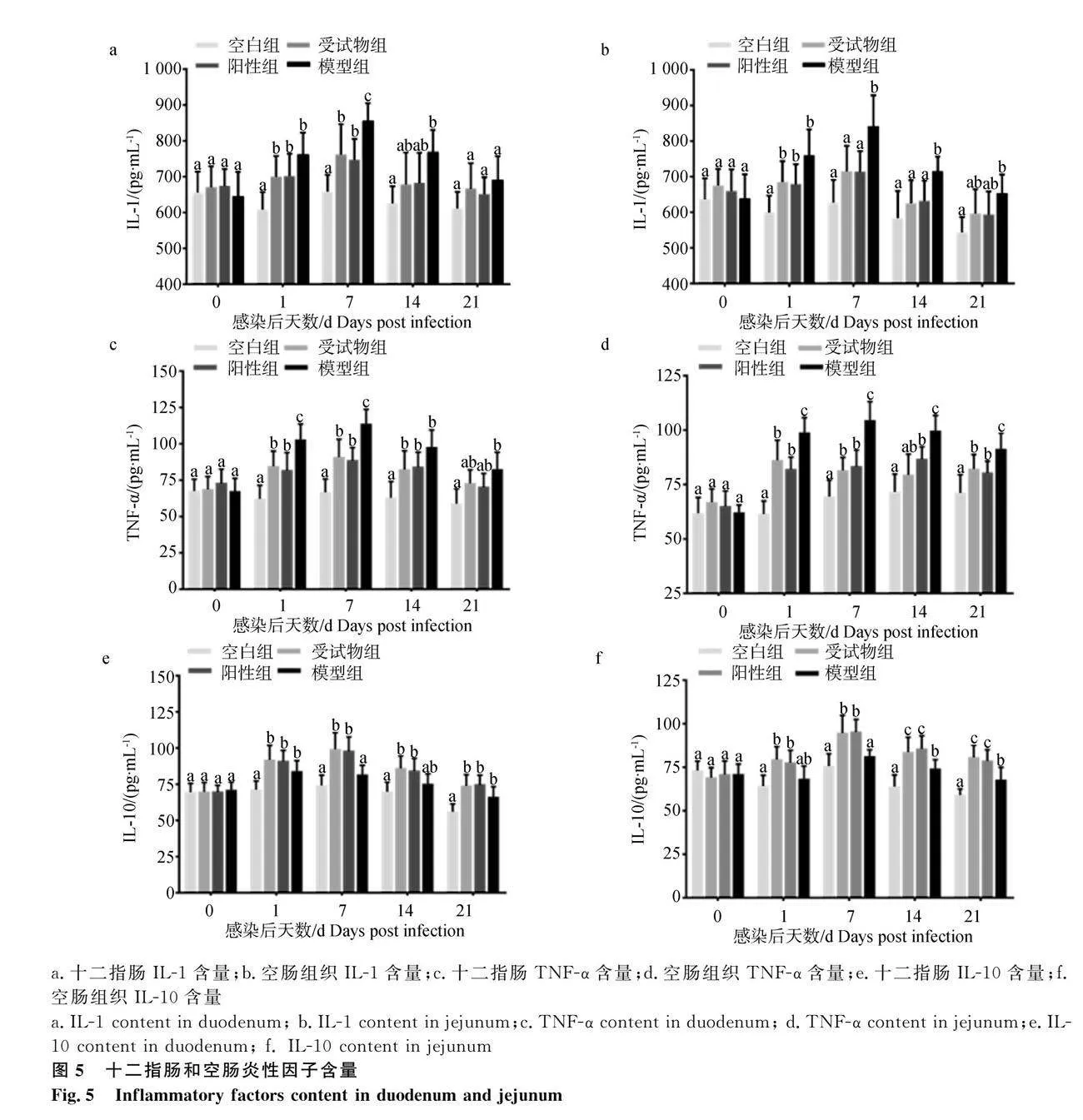
2.4 十二指肠和空肠组织炎性因子IL-1、TNF-α与IL-10含量
各组试验鸡十二指肠和空肠组织炎性因子IL-1、TNF-α与IL-10含量如图5所示,感染第0天时,各组鸡十二指肠和空肠组织炎性因子含量无显著差异(P>0.05)。感染第1天时(图5c、5d),受试物组和阳性组十二指肠、空肠的TNF-α含量显著低于模型组(Plt;0.05);感染第7天时(图5a、5b、5c、5d)受试物组和阳性组十二指肠和空肠的IL-1、TNF-α含量显著低于模型组(Plt;0.05),受试物组和阳性组十二指肠和空肠IL-10含量显著高于模型组(图5e、5f,Plt;0.05);感染第14天时(图5b、5d),受试物组和阳性组空肠组织IL-1含量和空肠组织TNF-α含量显著低于模型组(Plt;0.05),受试物组和阳性组空肠组织IL-10含量显著高于模型组(图5f,Plt;0.05);感染21 d时(图5d、5f),受试物组和阳性组空肠组织TNF-α含量显著低于模型组(Plt;0.05),受试物组和阳性组空肠组织IL-10含量显著高于模型组(Plt;0.05)。
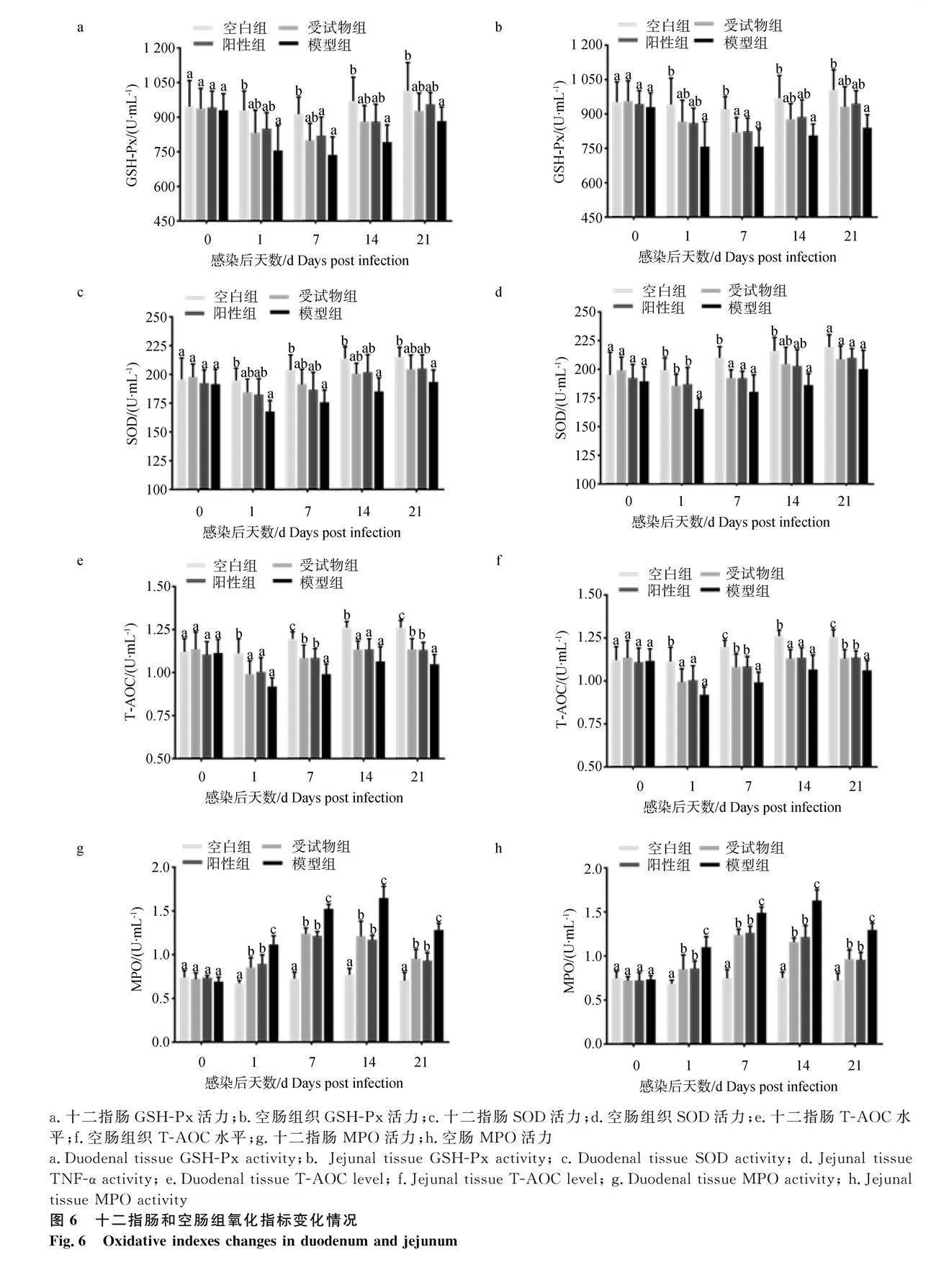
2.5 十二指肠和空肠组织GSH-Px、SOD、MPO活力与T-AOC水平
各试验组鸡十二指肠和空肠组织GSH-Px、SOD活力与T-AOC如图6所示,感染第0天时,各组鸡十二指肠和空肠组织GSH-Px、SOD活力、T-AOC与MPO活力无显著差异(P>0.05);感染1 d时(图6d),受试物组和阳性组空肠组织SOD活力显著高于模型组(Plt;0.05);感染第14天时(图6g、6h),受试物组和阳性组十二指肠、空肠的MPO活力低于模型组(Plt;0.05);感染第7、21天时(图6e、6f),受试物组和阳性组十二指肠、空肠T-AOC能力显著高于模型组(Plt;0.05),受试物组和阳性组空肠组织MPO活力显著低于模型组(图6h,Plt;0.05)。
3 讨 论
肠道具有消化、吸收、免疫和内分泌的功能[19],是机体抵抗病原微生物感染的重要组织器官。致病性大肠杆菌可以破坏肠道微生物屏障,损伤鸡肠道黏膜结构,影响肠道健康。肠道屏障被破坏后会影响鸡正常肠道功能的发挥,进而影响鸡的健康和生产性能,甚至影响食品安全和人类健康[20]。研究发现,大肠杆菌O78对雏鸡具有高致病性[21]。因此,本研究采用大肠杆菌O78菌液对雏鸡进行攻毒。已有文献报道,饲粮中添加APS可以显著减少雏鸡盲肠大肠杆菌数量、增加盲肠乳酸菌数量,改善肠道菌群,促进肠道健康[22]。AS可显著抑制大肠杆菌的生长,使菌悬液中核酸物质含量增多,表明AS可通过破坏菌体细胞膜的完整性、致使大分子物质外溢而发挥抑菌作用[23]。肉鸡饲喂枯草芽孢杆菌后,机体抗氧化能力显著增强,盲肠菌群中乳酸菌数量和总芽孢杆菌数量显著提高,大肠杆菌数量显著下降[24]。本研究发现,雏鸡感染大肠杆菌O78后,模型组盲肠的大肠杆菌数量升高,而乳酸菌数量降低,且十二指肠黏膜、空肠可见明显损伤;而受试物组和阳性组鸡大肠杆菌数量显著低于模型组,十二指肠、空肠的肠组织结构也较模型组更加完整;此外,受试物组盲肠的大肠杆菌数量、乳酸菌数量显著高于阳性组。结果表明,APS、AS与益生菌复合物联合使用后,可改善大肠杆菌导致的盲肠菌群失调、十二指肠损伤。
sIgA是机体黏膜防御系统的主要成分,覆盖在鼻、咽、气管、肠和膀胱黏膜的表面,它能抑制微生物在呼吸道上皮附着,减缓病毒繁殖,是黏膜重要屏障,对某些病毒、细菌和一般抗原具有抗体活性,是防止病原体入侵机体的第一道防线。有文献报道,AS能够促进小鼠肠黏膜sIgA的表达[25]。APS、AS与益生菌复合物联合使用后可增加鸡肠黏膜sIgA含量,增强肠黏膜免疫功能。本试验中,受试物组鸡感染大肠杆菌O78后十二指肠sIgA含量显著高于模型组,在感染第14、21天时其显著高于阳性组。结果表明,APS、AS与益生菌复合物联合使用后,可一定程度上改善雏鸡肠道的免疫功能。
促炎性细胞因子的过度产生(TNF-α、IL-1和IL-6等),可引起机体产生炎症反应,且能引发抗炎因子的高表达(IL-4、IL-10、G-CSF等)[26-27]。Yang等[28]与许航和孟林[29]的研究显示,APS和AS单独使用,均可通过降低肠组织促炎因子IL-1和TNF-α含量,减轻肠道炎症反应,降低肠黏膜损伤。研究发现,饲喂枯草芽孢杆菌也能降低肉鸡肠道促炎因子IL-1和升高抑炎因子IL-10水平,抑制炎症反应,减少肠黏膜损伤[30-31]。本试验中,与模型组相比,受试物组、阳性组鸡感染致病性大肠杆菌后,十二指肠IL-1和TNF-α含量均显著降低,IL-10含量均显著升高,其中受试物组与阳性组无显著性差异。结果表明APS、AS和3种复合益生菌联合使用,可通过抑制鸡肠道炎症反应保护大肠杆菌对肠组织的损伤。
机体受到病原微生物刺激时,氧化还原状态失衡引起抗氧化能力降低,发生氧化损伤[32]。雏鸡感染致病性大肠杆菌后,机体会出现炎症反应,炎性细胞会大量分泌MPO,MPO活性可反映炎性细胞的浸润程度[33]。已有研究发现,APS具有提高动物机体抗氧化能力的作用,可以提高肉鸡血清中GSH-Px和SOD的活力[34-35]。研究表明,在1~42日龄白羽肉鸡日粮添加一定量的植物乳杆菌,能提高生产性能和抗氧化功能,改善肠道结构,有利于营养物质的消化与吸收[36]。本试验中,APS、AS与益生菌复合物联合使用后,能够改善大肠杆菌O78引起的鸡十二指肠和空肠组织中GSH-Px、SOD和T-AOC的下降和MPO的升高,可有效保护大肠杆菌O78引起的鸡十二指肠和空肠氧化损伤,表明,APS和AS与益生菌复合物联合使用可以改善大肠杆菌引起的鸡肠道组织氧化应激。
4 结 论
联合使用APS、AS和非解乳糖链球菌、植物乳杆菌、枯草芽孢杆菌复合菌可通过减少肠组织损伤和炎症反应,改善肠道菌群结构、免疫力及氧化应激,增强雏鸡抗大肠杆菌感染能力,有替代抗生素的作用。
参考文献(References):
[1] 郭世伟,金 晓,徐元庆,等.植物源饲料添加剂缓解家禽大肠杆菌病的研究进展[J].动物营养学报,2023,35(9):5441-5452.
GUO S W,JIN X,XU Y Q,et al.Research progress of phytogenic feed additives alleviating colibacillosis in poultry[J].Chinese Journal of Animal Nutrition,2023,35(9):5441-5452.(in Chinese)
[2] 施 敏,魏佳明,袁 惠,等.黄芪活性成分治疗心力衰竭作用机制的研究进展[J].中国实验方剂学杂志,2024,30(3):208-217.
SHI M,WEI J M,YUAN H,et al.Mechanism of active ingredients of astragalus membranacus in treating heart failure:a review[J].Chinese Journal of Experimental Traditional Medical Formulae,2024,30(3):208-217.(in Chinese)
[3] 康东坤,高外毛,张红珍,等.黄芪总皂苷对脂多糖诱导的BV2小胶质细胞的抗炎机制[J].中国病理生理杂志,2022,38(2):276-283.
KANG D K,GAO W M,ZHANG H Z,et al.Anti-inflammatory mechanism of total Astragalus saponins in LPS-induced BV2 cells[J].Chinese Journal of Pathophysiology,2022,38(2):276-283.(in Chinese)
[4] 李璐璐,赵祥民,薛淑贞,等.饲粮添加黄芪和党参茎叶粉对肉仔鸡生长性能、屠宰性能、免疫功能的影响[J].饲料工业,2023,44(9):39-44.
LI L L,ZHAO X M,XUE S Z,et al.Effects of dietary astragalus and codonopsis stem and leaf powder on growth performance,slaughter performance and immune function of broilers[J].Feed Industry,2023,44(9):39-44.(in Chinese)
[5] 孙 波,陈 静,吴 娟,等.黄芪多糖对免疫抑制肉鸡生长性能、肠道菌群及免疫功能的影响[J].中国畜牧兽医,2014,41(8):101-106.
SUN B,CHEN J,WU J,et al.Effect of astragalus polysaccharin on growth performance,intestinal microflora and immune function of immunosuppression broilers[J].China Animal Husbandry amp; Veterinary Medicine,2014,41(8):101-106.(in Chinese)
[6] SONG X J,FENG Z F,ZHANG Y P,et al.Regulation of dietary astragalus polysaccharide (APS) supplementation on the non-specific immune response and intestinal microbiota of sea cucumber Apostichopus japonicus[J].Fish Shellfish Immunol,2019,94:517-524.
[7] 秦倩倩,付本懂,伊鹏霏,等.穿心莲内酯提高异嗜性粒细胞吞噬和杀伤鸡大肠杆菌O78功能的体外试验[J].中国兽医学报,2013,33(1):38-42.
QIN Q Q,FU B D,YI P F,et al.Effect of andrographolide on phagocytic and killing activities of chicken heterophils against Escherichia coli O78 in vitro[J].Chinese Journal of Veterinary Medicine,2013,33(1):38-42.(in Chinese)
[8] 张小欢.日本大高酵素对小鼠肠道菌群失衡的改善作用[D].新乡:新乡医学院,2022.
ZHANG X H.Improving effects of Japanese OhtakaKohso on intestinal microbiota imbalance in mice[D].Xinxiang:Xinxiang Medical College,2022.(in Chinese)
[9] 戴旭平.复合益生菌发酵黄芪的制备及应用[D].大连:大连海洋大学,2022.
DAI X P.The preparation and application of astragalus fermented using composite probiotics[D].Dalian:Dalian Ocean University,2022.(in Chinese)
[10] 任 雪.植物乳杆菌和复合益生菌对凡纳滨对虾生长、抗氧化及抗病力等的影响[D].大连:大连海洋大学,2022.
REN X.Effects of Lactobacillus plantarum and compound probiotics on thegrowth performance,antioxidation capacity and disease resistance of Litopenaeus vannamei[D].Dalian:Dalian Ocean University,2022.(in Chinese)
[11] 贾 锋,李 风,白凯淞,等.急性胰腺炎肠道微生态的研究现状与进展[J].世界华人消化杂志,2023,31(13):521-527.
JIA F,LI F,BAI K S,et al.Current status and advancements in research of gut microecology in acute pancreatitis[J].World Chinese Digestion Journal,2023,31(13):521-527.(in Chinese)
[12] 刘明生,蒋春茂,甘辉群,等.黄芪多糖和微生态制剂对蛋鸡生产性能和免疫机能的影响[J].江苏农业科学,2018,46(14):154-156.
LIU M S,JIANG C M,GAN H Q,et al.Effects of astragalus polysaccharides and probiotics on production performance and immune function of hens[J].Jiangsu Agricultural Sciences,2018,46(14):154-156.(in Chinese)
[13] 王 巍,李春洙,王沙沙,等.中药联合益生菌对大肠杆菌致小鼠腹泻保护机制研究[J].中国畜牧兽医,2023,50(2):779-788.
WANG W,LI C Z,WANG S S,et al.Study on the protective mechanism of traditional Chinese medicine combined with probiotics on diarrhea caused by e.coli in mice[J].China Animal Husbandry amp; Veterinary Medicine,2023,50(2):779-788.(in Chinese)
[14] 聂芙蓉,郭良兴,王新芳,等.复合益生菌对黄秋葵秸秆CNCPS组分的影响[J].现代牧业,2023,7(2):6-10.
NIE F R,GUO L X,WANG X F,et al.Effects of compound probiotics on the CNCPS components of okra straw[J].Modern Animal Husbandry,2023,7(2):6-10.(in Chinese)
[15] 刘永青,李锦连,张 凯.复合益生菌发酵对残次枣粉营养成分、毒素含量和抗氧化性的影响[J].中国畜牧杂志,2023,59(9):276-282.
LIU Y Q,LI J L,ZHANG K.Effects of compound probiotics on nutrient composition,toxin content and antioxidant activity of preserved jujube powder[J].Chinese Journal of Animal Science,2023,59(9):276-282.(in Chinese)
[16] 桂文龙,李巨银,苏治国.黄芪多糖对湖羊生长性能、血清生化指标及免疫功能的影响[J].饲料研究,2023,46(12):13-16.
GUI W L,LI J Y,SU Z G.Effect of Astragalus polysaccharide on growth performance,serum biochemistry indexes and immunity function of Hu sheep[J].Feed Research,2023,46(12):13-16.(in Chinese)
[17] 郑 恒,张聪子,徐金军,等.黄芪皂苷对病毒性心肌炎大鼠PI3K/AKT/mTOR信号通路和心肌细胞凋亡的影响[J].中华医院感染学杂志,2022,32(23):3521-3526.
ZHENG H,ZHANG C Z,XU J J,et al.Effects of saponins of astragalus on PI3K/AKT/mTOR signaling pathway and cardiomyocytes apoptosis in rats with viral myocarditis[J].Chinese Journal of Nosocomiology,2022,32(23):3521-3526.(in Chinese)
[18] 许俊卿,赵 丽,赵 华,等.常规石蜡切片、超声波快速石蜡切片在乳腺肿块病理诊断中的作用及特点[J].临床医学研究与实践,2023,8(2):78-81.
XU J Q,ZHAO L,ZHAO H,et al.Role and characteristics of conventional paraffin section and ultrasonic fast paraffin section in pathological diagnosis of breast masses[J].Clinical Research and Practice,2023,8(2):78-81.(in Chinese)
[19] 高瑞玲.植物精油胆盐复合制剂对幼龄山羊生长发育、血液指标及胃肠道屏障和微生物区系的影响[D].呼和浩特:内蒙古农业大学,2022.
GAO R L.Effects of compound preparation of plant essential oil and bile salton growth and development,blood indexes,gastrointestinal barrier and microflora of young goats[D].Hohhot:Inner Mongolia Agricultural University,2022.(in Chinese)
[20] ZHANG X L,AKHTAR M,CHEN Y,et al.Chicken jejunal microbiota improves growth performance by mitigating intestinal inflammation[J].Microbiome,2022,10(1):107.
[21] 施路一,鞠 丹,杨 娇,等.哈尔滨地区鸡大肠杆菌流行情况分析[J].家禽科学,2018(10):10-14.
SHI L Y,JU D,YANG J,et al.Epidemiological analysis of Chicken E. coli in Harbin[J].Poultry Science,2018(10):10-14.(in Chinese)
[22] 王秋云.黄芪多糖治疗雏鸡大肠杆菌病[J].湖北畜牧兽医,2019,40(11):12-13.
WANG Q Y.APS for the treatment of Escherichia coli in chicks[J].Hubei Journal of Animal and Veterinary Sciences,2019,40(11):12-13.(in Chinese)
[23] 郭丽丽,王小敏,秦 楠,等.黄芪茎叶总皂苷提取物的抑菌活性研究[J].现代食品科技,2019,35(1):82-88.
GUO L L,WANG X M,QIN N,et al.Study on the antibacterial activity of the total saponins extract from the stems and leaves of Astragalus membranaceus[J].Modern Food Science and Technology,2019,35(1):82-88.(in Chinese)
[24] 王 静,娄仪欣,杨家军.饲用益生菌抑制黄羽肉鸡大肠杆菌的探究[J].粮食与饲料工业,2023(2):46-50.
WANG J,LOU Y X,YANG J J.Study on the inhibition of feeding probiotic on Escherchia coli in intestine of yellow feathered broiler[J].Cereal amp; Feed Industry,2023(2):46-50.(in Chinese)
[25] 李雅倩,李克鑫,李道明,等.黄芪的活性成分、生物学功能及其在猪养殖中的应用[J].猪业科学,2022,39(7):102-106.
LI Y Q,LI K X,LI D M,et al.The active ingredients,biological function of Astragalus and its application in pig culture[J].Swine Industry Science,2022,39(7):102-106.(in Chinese)
[26] GREENHALGH D G,SAFFLE J R,HOLMES J H,et al.American Burn Association consensus conference to define sepsis and infection in burns[J].J Burn Care Res,2007,28(6):776-790.
[27] WILLIAMS F N,HERNDON D N,JESCHKE M G.The hypermetabolic response to burn injury and interventions to modify this response[J].Clin Plast Surg,2009,36(4):583-596.
[28] YANG M,LIN H B,GONG S T,et al.Effect of Astragalus polysaccharides on expression of TNF-α,IL-1β and NFATc4 in a rat model of experimental colitis[J].Cytokine,2014,70(2):81-86.
[29] 许 航,孟 林.黄芪活性成分调控相关信号通路治疗骨关节炎的机制[J].现代中西医结合杂志,2023,32(10):1443-1450.
XU H,MENG L.Mechanisms of Astragalus active ingredients in the treatment of osteoarthritis via regulating related signaling pathways[J].Modern Journal of Integrated Traditional Chinese and Western Medicine,2023,32(10):1443-1450.(in Chinese)
[30] RODRGUEZ S P,HERRERA A L,PARRA J E.Gene expression of pro-inflammatory (IL-8,IL-18,TNF-α,and IFN--γ) and anti-inflammatory (IL-10) cytokines in the duodenum of broiler chickens exposed to lipopolysaccharides from Escherichia coli and Bacillus subtilis[J].Vet World,2023,16(3):564-570.
[31] XU Y L,YU Y,SHEN Y Y,et al.Effects of Bacillus subtilis and Bacillus licheniformis on growth performance,immunity,short chain fatty acid production,antioxidant capacity,and cecal microflora in broilers[J].Poult Sci,2021,100(9):101358.
[32] WANG D L,LI L J,JI W L,et al.Online ascorbate sensing reveals oxidative injury occurrence in inferior colliculus in salicylate-induced tinnitus animal model[J].Talanta,2023,258:124404.
[33] 蔡 楠.基于SIRT1-NLRP3信号通路探究姜黄素调节细胞焦亡改善急性肺损伤的作用机制[D].南京:南京中医药大学,2022.
CAI N.Curcumin alleviates acute lung injury through regulating SIRT1-NLRP3 signaling mediated pyroptosis[D].Nanjing:Nanjing University of Chinese Medicine,2022.(in Chinese)
[34] SHI X H,JIA Y Y,ZHANG Z F,et al.The effects of Chinese herbal feed additives on physiological health and detoxification ability in the red claw crayfish,Cherax quadricarinatus,and evaluation of their safety[J].Aquaculture,2023,569:739394.
[35] WANG Q,WANG X F,XING T,et al.The combined impact of xylo-oligosaccharides and gamma-irradiated astragalus polysaccharides on the immune response,antioxidant capacity,and intestinal microbiota composition of broilers[J].Poultry Science,2022,101(9):101996.
[36] 刘斯斯,张金凤,于松涛,等.植物乳杆菌对肉鸡生产性能、抗氧化功能及肠道结构发育的影响[J].黑龙江畜牧兽医,2022(23):104-108.
LIU S S,ZHANG J F,YU S T,et al.Effects of Lactiplantibacillus plantarum on production performance,antioxidant function and development of intestinal structure in broilers[J].Heilongjiang Animal Science and Veterinary Medicine,2022(23):104-108.(in Chinese)
(编辑 范子娟)

