妊娠期奶牛黄体细胞的分离鉴定及培养特性





摘 要: 旨在研究妊娠期奶牛黄体细胞的分离、纯化、鉴定及体外培养生物学特性。本研究通过采集健康荷斯坦奶牛的妊娠期黄体组织,利用Ⅱ型与Ⅳ型胶原酶联合消化法分离奶牛黄体细胞(bovine luteal cells, BLCs),通过Percoll不连续密度梯度离心法纯化获得高纯度的BLCs。运用3β-HSD活细胞染色法、油红O脂滴染色法鉴定BLCs的纯度,借助免疫组织化学染色法、免疫荧光染色检测BLCs特异性标志物催产素和突触素。ELISA法检测细胞培养上清液中孕酮;G显带核型分析BLCs染色体、CCK-8法测定BLC生长曲线和血清依赖性结合流式细胞术检测细胞周期分析BLCs的体外培养特性。结果表明,1)利用胶原酶消化法和Percoll不连续密度梯度离心法可一次性分离纯化获得大量高纯度的BLCs;2)3β-HSD染色、油红O染色结果显示,分离纯化所得BLCs细胞类型均匀,其形态呈不规则多边形的典型上皮细胞样,胞核大,胞质丰富,有小脂滴弥散分布;3)免疫荧光结果表明,BLCs可表达催产素和突触素等黄体细胞的特异性标志物;4)BLCs培养上清中孕酮的浓度呈时间依赖性;5)核型分析结果显示,黄体细胞由30对染色体组成,包括29对常染色体和一对XX性染色体,CCK-8及流式结果显示,BLCs在体外培养过程中具有稳定的增殖活性。综上所述,本研究成功分离纯化获得具有典型生物学特性的高纯度BLCs,并提供了一套完善的BLCs分离、纯化、鉴定及体外培养的方法,可为体外研究黄体的发育、退化及其功能调控提供稳定的细胞模型和技术参考。
关键词: 奶牛;黄体细胞;分离培养;生物学特性
中图分类号: S852.61
文献标志码:A""" 文章编号:0366-6964(2024)05-2214-12
收稿日期:2023-08-24
基金项目:国家自然科学基金项目(32172811;32002242)
作者简介:费国庆(1998-),男,甘肃陇西人,硕士生,主要从事基础兽医学研究,E-mail:fgq10016615@163.com
*通信作者:陈树林,主要从事基础兽医学研究,E-mail:csl_1359@163.com;陈 鸿, 主要从事基础兽医学研究,E-mail:1356178675@qq.com
Isolation, Identification of Luteal Cells from Cows during Pregnancy and Investigation of Their Culture Characteristics
FEI" Guoqing, NING" Zhiyuan, ZHAO" Zefang, LIU" Yanqiu, LIU" Tengfei, LI" Xian, CONG" Rihua,
CHEN" Hong*, CHEN" Shulin*
(College of Veterinary Medicine, Northwest Agriculture and Forestry University, Yangling 712100,
China)
Abstract:" The aim was to study the isolation, purification, characterization and in vitro culture biological properties of luteal cells from cows during pregnancy. In this study, luteal tissues of healthy Holstein cows during pregnancy were collected, and bovine luteal cells (BLCs) were isolated by type II and type IV collagenase digestion. High-purity BLCs were purified by Percoll discontinuous density gradient centrifugation. The purity of BLCs was identified by 3β-HSD live cell staining and oil red O lipid droplet staining. The specific marker proteins of BLCs, oxytocin and synaptophysin, were detected by immunohistochemical staining and immunofluorescence staining. Progesterone in cell culture supernatant was detected by ELISA. G-banding karyotype analysis of BLCs chromosomes, CCK-8 assay of BLC growth curve and serum-dependent flow cytometry to detect cell cycle analysis of BLCs in vitro culture characteristics. The results showed that: 1) A large number of high-purity BLCs could be obtained by one-time separation and purification using collagenase digestion and Percoll discontinuous density gradient centrifugation. 2) The results of 3β-HSD staining and oil red O staining showed that the isolated and purified BLCs had uniform cell types, and their morphology was typical epithelial cell-like cells with irregular polygons. The nucleus was large, the cytoplasm was rich, and small lipid droplets were dispersed. 3) Immunofluorescence results showed that BLCs could express specific markers of luteal cells such as oxytocin and synaptophysin; 4) The concentration of progesterone in the culture supernatant of BLCs was time-dependent. 5) Karyotype analysis showed that luteal cells were composed of 30 pairs of chromosomes, including 29 pairs of autosomes and a pair of XX sex chromosomes. CCK-8 and flow cytometry results showed that BLCs had stable proliferation activity during in vitro culture. In summary, this study successfully isolated and purified high-purity BLCs with typical biological characteristics, and sorted out a set of scientific and perfect methods for the separation, purification, identification and in vitro culture of BLCs, which can provide a stable cell model and technical reference for the study of luteal development, degeneration and functional regulation in vitro.
Key words: cow; luteal cells; isolation and culture; biological characterization
*Corresponding authors:" CHEN Shulin, E-mail: csl_1359@163.com; CHEN Hong, E-mail: 1356178675@qq.com
黄体(corpus luteum, CL)是雌性哺乳动物排卵后由颗粒细胞、内膜细胞及周围血管共同形成的一个动态的暂时性内分泌组织。其主要生理功能由黄体细胞(luteal cells,LCs)承担,通过合成并分泌孕酮(progesterone, P4)、雌激素、不饱和脂肪酸和多肽类激素等,在调控雌性动物发情、受精卵着床以及妊娠维持等生殖活动中发挥直接作用[1];在家畜繁殖性能改良,生殖疾病机理研究等方面有着重要的研究价值[2]。此外,在体外胚胎生产过程中LCs可作为滋养层细胞[3]。在牛体外胚胎生产过程中,存在可用胚胎数量少、发育率低、妊娠率低等问题[4]。但在牛黄体细胞(bovine luteal cells, BLCs)与早期胚胎共培养的研究中发现,BLCs可增强早期胚胎活力,提高胚胎分化率[5]。因此完善且经济的黄体细胞分离培养方法或可为优化体外胚胎生产提供稳定的细胞模型[6]。但CL中除了LCs外,还包括红细胞、成纤维样细胞、血管内皮细胞等多种类型的细胞[7],虽然国内外有BLCs体外培养成功的案例[8-9],但缺少系统的BLCs分离纯化及鉴定方法为体外研究黄体功能调控提供高纯度均一细胞群模型[10-11]。
对于体外分离培养原代细胞,其分离纯化方法的简洁高效,便捷经济是其应用普及的重要因素[12,13]。Percoll是一种适用性广且操作灵活简单的低密度梯度分离液,可用来分离细胞、亚细胞颗粒,可实现受损细胞及其碎片与完整活细胞的分离[14-15]。优化Percoll密度梯度离心法BLCs纯化条件可为高效分离纯化BLCs,获得高活力、高纯度的BLCs提供重要技术参考[16-17]。
在LCs鉴定方面,通常将其类固醇合成特性作为鉴定依据,但大黄体细胞(large corpus luteum cells, LLCS)、小黄体细胞(small corpus luteum cells, SLCS)均具有类固醇合成功能,3β-羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase, 3β-HSD)染色均为阳性;因此,将能否合成类固醇作为LCs鉴定依据并不准确[16]。在先前的研究中发现,LCs属于弥散神经内分泌细胞(diffuse neuroendocrine cell, DNES cell)可特异性的表达OT和SYP,可作为其特异性的鉴定标志物[17-18]。
因此,本研究通过探究BLCs体外分离、纯化、鉴定及体外培养特性,拟建立一套系统完善的BLCs培养方法。获得生物学特征稳定、纯度高、适用于体外试验研究的BLCs,为CL功能相关体外研究提供稳定的细胞模型和技术参考。
1 材料与方法
1.1 试验动物及细胞
CL采自西安某奶牛屠宰场,妊娠期的健康荷斯坦奶牛。
1.2 主要试剂及仪器
催产素、突触素、波形蛋白抗体购自Abcam公司;山羊抗兔594荧光标记二抗、山羊抗鼠488荧光标记二抗购自武汉三鹰生物技术有限公司;胎牛血清(FBS)、DMEM/F12培养基、胰蛋白酶均购自Gibco公司;牛孕酮(PROG)ELISA检测试剂盒购自上海酶联生物科技有限公司;细胞增殖毒性检测试剂盒(cell counting kit-8,CCK-8)购自Biosharp公司;RNA提取试剂盒(MicroElute Total RNA Kit)购自Omega公司;RNA逆转录试剂盒购自南京诺唯赞生物科技有限公司;油红O染色试剂盒(细胞专用)购自索莱宝生物科技有限公司;去氢表雄酮购自赛默飞世尔(中国)有限公司。生物安全柜、CO2培养箱和CountessⅡ自动细胞计数仪均购自Thermo Scientific公司;倒置荧光显微镜、激光共聚焦显微镜购自日本Nikon公司;核酸蛋白分析仪购自赛默飞世尔(中国)有限公司;荧光定量PCR仪购自美国Bio-Rad公司;流式细胞仪购自美国BD公司。
1.3 BLCs的分离纯化
1.3.1 原代BLCs的分离
屠宰场采集妊娠期荷斯坦奶牛的卵巢组织,预冷的含2%双抗的PBS冲洗三次后,保存在预冷的PBS中,尽快带回实验室。在75%乙醇溶液中浸泡1 min,用含双抗的PBS冲洗3次后转移至超净台操作;将组织置于无菌小皿内,剥离表面被膜,暴露CL,将CL从卵巢上剥离,取部分组织充分剪碎(组织块体积≤1 mm3),用含双抗的PBS清洗至上清澄清。将剪碎的组织转移到15 mL无菌离心管中,用完全培养基配制含2 mg·mL-1 Ⅱ型胶原酶溶液和0.5 mg·mL-1 Ⅳ型胶原酶的组织消化液;V(消化液)∶V(组织)=10∶1,在37 ℃条件下消化1 h。待组织分散后用200 目细胞滤网过滤,收集细胞悬液于新的离心管中,1 000 r·min-1离心5 min,收集细胞沉淀,用完全培养基重悬细胞,用于下一步细胞纯化。
1.3.2 BLCs的纯化
制备不同密度的 Percoll 分离液(20%、30%、35%、37.5%、40%共5个密度),按密度由高到低的次序,依次向15mL离心管中加入Percoll分离液各2mL,在最上层加入2 mL细胞悬液后,1 000 r·min-1离心30 min。离心后可见细胞分层,收集各液相间的细胞悬液于新的离心管中,加入10倍体积的完全培养基,混匀后,1 000 r·min-1离心5min,弃去上清,重复上述步骤2次。加入适量完全培养基重悬细胞,调整细胞密度为1×106·mL-1,接种于细胞培养皿中,在37 ℃,5% CO2饱和湿度培养箱中培养,48 h后更换培养液。
1.4 BLCs的鉴定
1.4.1 3β-HSD活细胞染色
取P3代BLCs接种到35 mm培养皿中,待细胞密度约80%时,除去细胞培养液,用 PBS 漂洗2次,加入 1 mL 3β-HSD染液(3β-HSD 活性染液:1.0 mg·mL-1 氯化硝基蓝四唑150 μL,3.0 mg·mL-1 NAD 120 μL,10 mmol 去氢表雄酮50 μL,1.6 mg·mL-1 烟酰胺100 μL,0.01 mol·L-1 PBS 580 μL(pH=7.4)缓冲液,配制为1 mL溶液),置于培养箱中孵育4 h后,弃去染液,PBS清洗2 次后,加入1 mL 4%的多聚甲醛固定 20 min,用 PBS 清洗两次,倒置显微镜下观察拍照。
1.4.2 油红O脂滴染色
BLCs接种于35 mm培养皿,细胞密度达到 80%时,弃去细胞培养液,用 PBS 缓冲液清洗 3 次,加 4%的多聚甲醛固定20 min,PBS 洗3次;异丙醇脱水5 min;油红 O 染色30 min;异丙醇脱色30 s,PBS 漂洗2次,倒置显微镜下观察拍照。
1.4.3 P4合成相关基因引物合成及q-PCR检测
参照NCBI数据库中公布的STAR、3β-HSD、CYP11A1、PTGFR、FGG和GAPDH基因序列,利用NCBI系统Primer 引物设计程序设计实时荧光定量PCR引物,以GAPDH为内参基因,引物序列见表1。引物均由北京擎科生物科技有限公司合成。
首先使用 RNA提取试剂盒提取细胞的总RNA,接着利用反转录试剂盒合成对应cDNA,反转录产物于-20 ℃保存备用。以反转的cDNA为模板,在q-PCR管中依次加入cDNA模板2 μL、2×ChamQ SYBR qPCR Master Mix 5 μL、上下游引物各0.25 μL,用ddH2O补齐为10 μL反应体系。在q-PCR仪上进行扩增,扩增程序为95 ℃ 预变性30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环,最后95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。试验重复 3 次,用2-ΔΔCt法计算 STAR、3β-HSD、CYP11A1、PTGFR、FGG基因的相对表达量。
1.4.4 BLCs中OT、SYP表达与定位
免疫组织化学检测CL组织中催产素(oxytocin, OT)、突触素(synaptophysin, SYP)表达。黄体组织石蜡切片经二甲苯Ⅰ脱蜡处理5 min、二甲苯Ⅱ处理5 min;无水乙醇Ⅰ处理2 min、无水乙醇Ⅱ处理5 min,依次在95%、85%、75%的乙醇和双蒸水处理2 min;3% H2O2处理3 min,ddH2O清洗3 次,每次2 min;加入0.01 mol·mL-1柠檬酸钠缓冲液修复10 min,PBS液洗涤5 min,清洗2 次;室温下用0.3% Triton-X-100处理15 min,同上用PBS清洗2次;在室温下用5% BSA封闭30 min,擦干多余水分孵育抗体;分别加入OT和SYP抗体于组织上,于湿盒内4 ℃孵育12 h,用PBS充分洗涤3 次,加入辣根过氧化物酶标记的二抗室温孵育1 h,PBS洗涤3次;DAB显色后,苏木精复染细胞核,切片重新脱水封片,在显微镜下观察CL组织中OT、SYP蛋白表达情况。阴性对照组用PBS缓冲液代替一抗,其余操作步骤同试验组一致。
免疫荧光检测BLCs中OT、SYP表达。用激光共聚焦小皿培养BLCs,细胞密度达80%时,弃掉旧培养液,PBS漂洗2 遍,1mL多聚甲醛固定15 min,用PBS液清洗3次,每次5 min;加入0.3% Triton-x-100通透细胞膜30 min,用PBS清洗3次;加5% BSA 室温下封闭1 h,用吸水纸吸干,加入OT和SYP抗体,4 ℃孵育过夜;孵育结束后,用PBS清洗3 遍,黑暗条件下加入荧光二抗孵育1 h,同上操作PBS清洗,DAPI染核5 min,PBS清洗残留染液。激光共聚焦显微镜下观察细胞中OT和SYP蛋白的表达情况。
1.5 BLCs体外培养特性
1.5.1 ELISA测定细胞上清中P4含量
BLCs接种24 孔板培养,在细胞汇合度约为60%时更换培养液,定时收集上清,每个时间设置3 个重复孔,3 000 r·min-1离心10 min,0.45 μm的滤器过滤后,收集上清,按照上海酶联生物有限公司的(PROG)ELISA检测盒说明书要求测定不同时间段培养上清中P4的浓度。
1.5.2 Gmisa-染色体核型分析
消化重悬细胞,调整细胞密度为1×106·mL-1接种至60 mm培养皿中,24 h后,加入含有0.1 μg·mL-1秋水仙素碱的完全培养液,处理6h后。将细胞收集到15 mL EP离心管中,用预热过的0.075 mol·L-1 氯化钾吹打重悬,放入37℃静置30 min。弃去氯化钾,加入1 mL固定液(V(甲醇)∶V(乙酸)=3∶1,现用现配),1 500 r·min-1离心5 min。弃上清液,缓慢加入固定液边加入边震荡,1 500 r·min-1离心5min。弃上清液,缓慢加入固定液边加入边震荡,静置15 min,1 500 r·min-1离心5 min,弃上清液。加固定液重悬细胞后,将玻片从冰水浴中拿出,吸取重悬液从50 cm高处滴下一滴,在酒精灯上过火烤片。待玻片晾干后,使用10 g·L-1的Giemsa染液染色15 min,蒸馏水冲洗至无浮色,甘油明胶封片后显微镜下观察。
1.5.3 CCK-8 法测定BLCs生长曲线和血清依赖性
BLCs消化重悬,调整细胞密度,以1×104·孔-1接种于 96 孔板,每组5 个重复孔,预培养24 h后更换培养液,同时每孔加入10 μL CCK-8增强型溶液,培养箱孵育,每隔24 h用酶标仪测定一次OD450 nm值,连续监测8 d,绘制生长曲线。
BLCs消化重悬,调整细胞密度,以1×104·孔-1接种于96孔板,每组5个重复孔,设置两个重复组,预培养24 h后,更换培养液为DMEM/F12基础培养基,饥饿处理6 h后,将培养液更换为含不同浓度FBS的完全培养基(0、5%、10%、15%、20%),培养24 h后测定OD450 nm值。
1.5.4 流式细胞术检测细胞周期
P1与P5代BLCs消化重悬细胞,调整细胞密度约1×105·mL-1,接种6孔细胞培养板48h后,消化收集细胞,PBS 洗涤2 次,彻底弃去上清,缓慢加入1 mL DNA Staining solution和10 μL PI染液,振荡混匀后避光染色30 min,200 目细胞筛过滤,流式细胞仪在 488 nm 激发波长下计数15 000个细胞,流式数据分析。
1.6 数据统计分析
试验数据使用 SPSS 9.0 软件的单因素方差分析进行统计,用t检验进行多重比较,使用GraphPad Prism 9.0 软件绘图;通过 FlowJo 10.8.1 软件分析流式数据;数据以“平均值±标准差(x-±s)”表示,Plt;0.05 表示差异显著;Plt;0.01 表示差异极显著。
2 结 果
2.1 BLCs分选及形态特征
牛的妊娠期CL明显突出于卵巢表面,约占卵巢整体的3/4,外观呈红褐色,有大量血管分布;正中剖开可见,黄体组织呈橘红色,有结缔组织穿插其中,从中心向周围辐射(图1a)。组织切片观察可见,妊娠期CL主要由LCs和大量的血管与结缔组织构成,主要的功能细胞群以LLCs占比最多;LCs具有体积大,颜色淡,胞核高度分化和细胞质丰富的典型特征(图1b)。
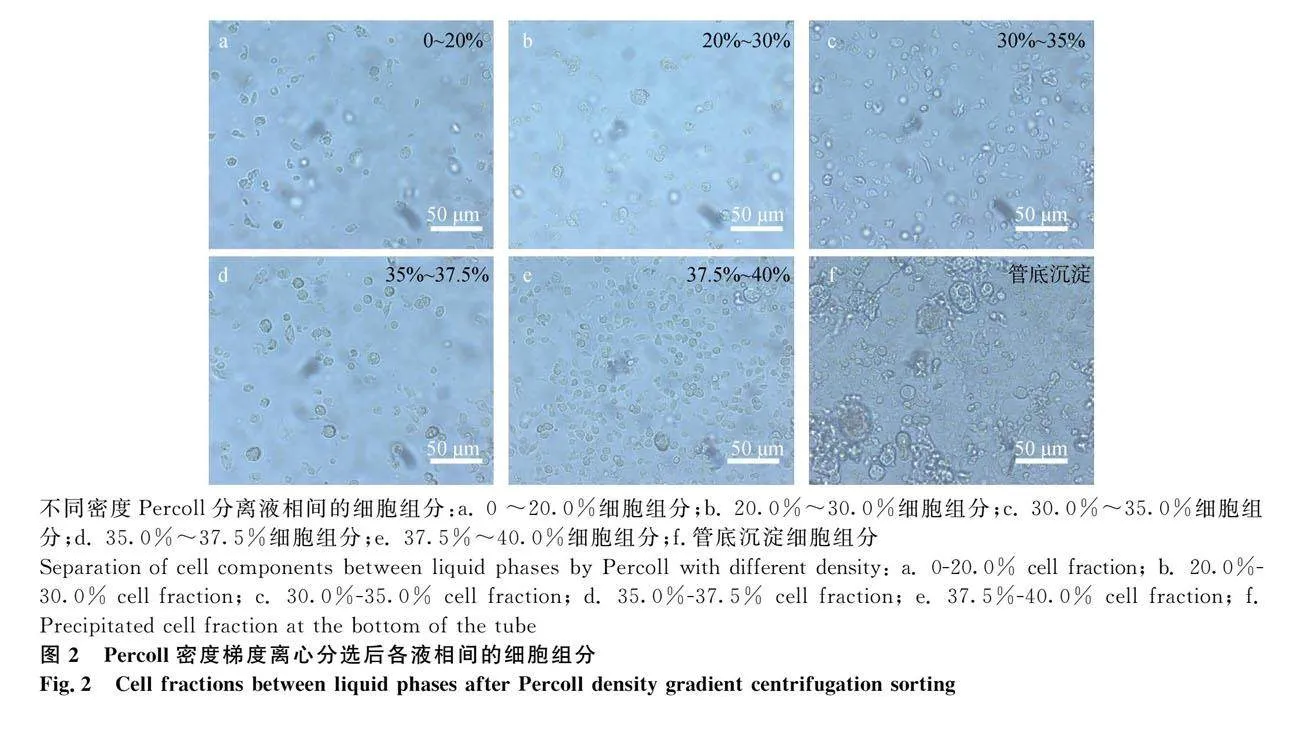
Percoll不连续密度梯度离心纯化后,可在各液相层富集到不同类型的细胞群,0~20%液相层主要富集红细胞及消化的组织间质(图2a);20%~30%液相层以碎裂的细胞及其胞核为主(图2b);30%~35%液相层以小黄体细胞为主(图2c);35%~37.5%间掺杂有大量的成纤维细胞和血管内皮细胞(图2d);37.5%~40%的液相层主要富集高纯度的黄体细胞,在显微镜下可见相较于其他细胞体积明显偏大的球形细胞(图2e),而管底沉淀以黏连细胞碎片和percoll中的杂质为主(图2f)。
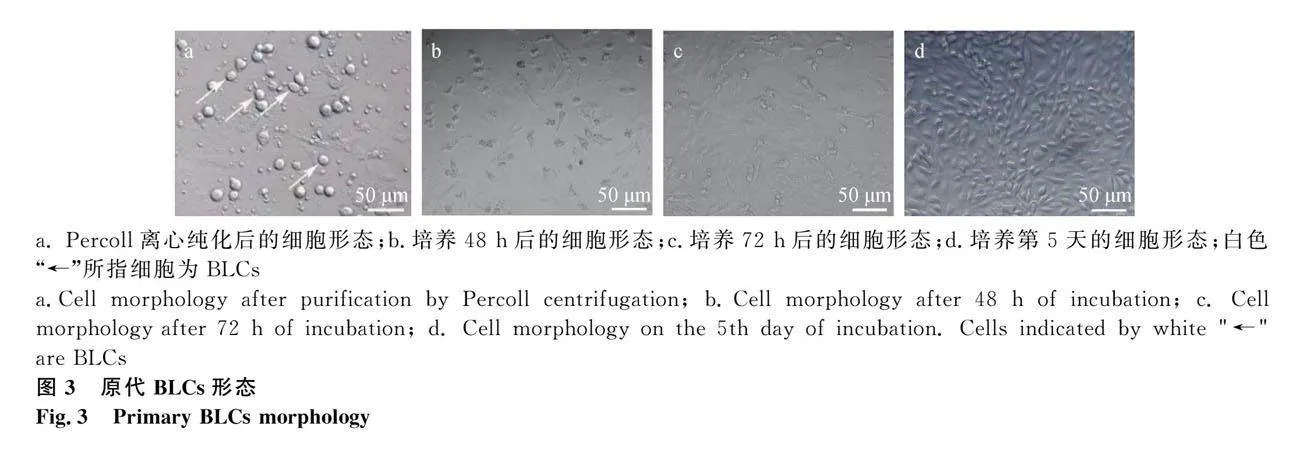
分离所得BLCs在培养48 h时细胞已经贴壁伸展(图3b),72h后细胞状态良好,镜下可见BLCs呈不规则多边形或梭形的典型上皮细胞形态,胞核大,胞浆丰富(图3c);培养至第5天时细胞单层分布,铺满瓶底(图3d)。
2.2 BLCs的鉴定
2.2.1 3β-HSD在BLCs中的分布
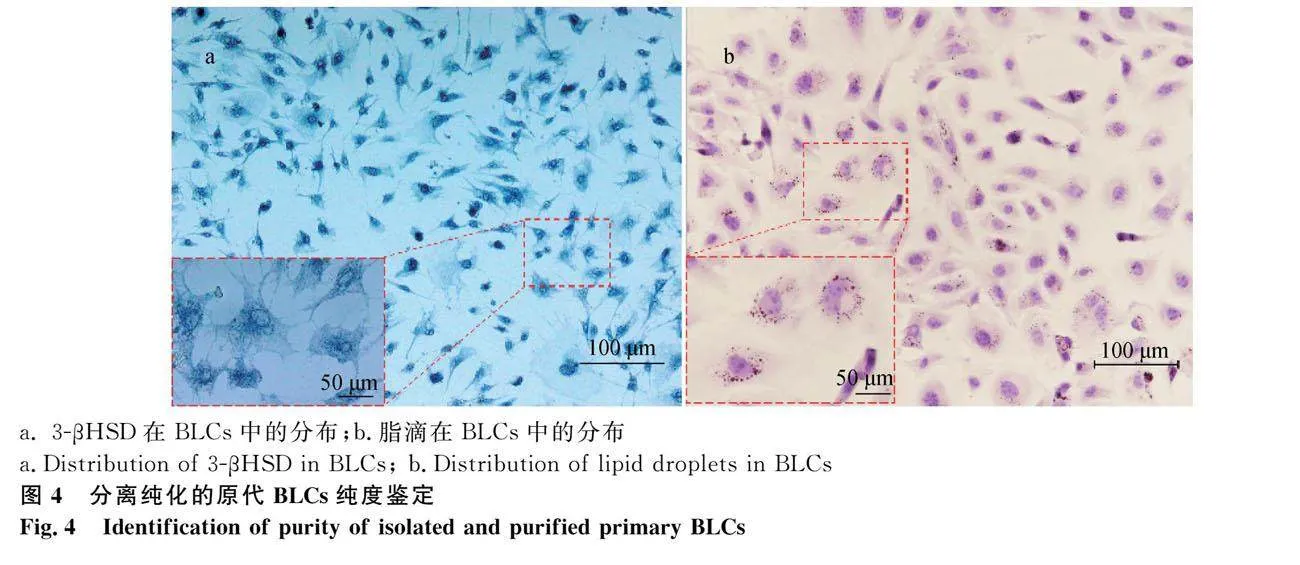
3β-HSD是类固醇细胞的标志物,通常附着于滑面内质网上,与染液结合后呈现蓝紫色。对分离的BLCs进行活细胞染色,镜下观察可见,细胞核未染色呈透明,蓝色" 主要富集于细胞的核周胞质;分离所得BLCs形态均一,阳性细胞率约95%(图4a)。
2.2.2 脂滴在BLCs中的分布
脂滴在类固醇合成的细胞中参与多种生物学过程,是类固醇生成细胞的标志物之一。油红O染色结果显示,脂滴在BLCs中主要分布于细胞质中,呈弥散性细小颗粒状,数量丰富(图4b)。
2.2.3 OT和SYP在BLCs中的分布
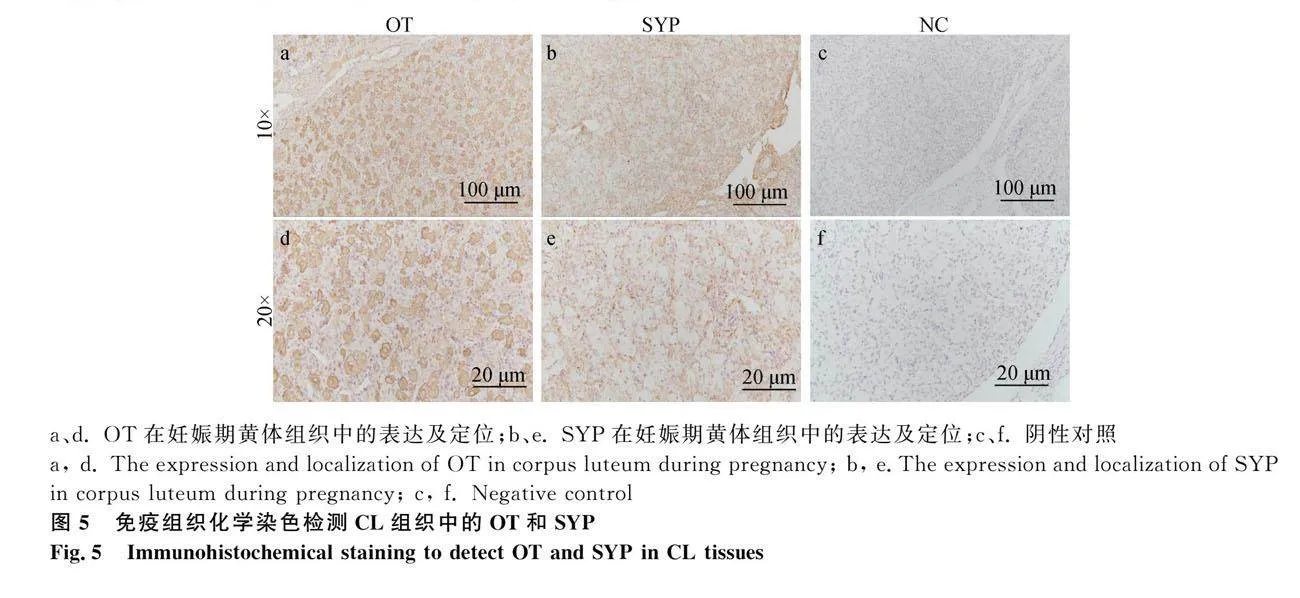
免疫组织化学染色结果显示,OT和SYP在黄体组织中其表达与分布具有特异性,主要分布在大LCs中,可作为体外培养BLCs的鉴定依据(图5)。免疫荧光结果表明,OT和SYP在BLCs中均有表达,OT主要分布在细胞膜和核周胞质,穿插于细胞骨架间,但表达量较低;而SYP分布在细胞核周胞质和胞膜上(图6)。
2.3 BLCs体外培养特性
2.3.1 BLCs体外培养过程中P4合成能力的测定
ELISA检测结果显示,BLCs在体外培养过程中可以持续稳定的分泌P4,且上清中P4浓度具有时间依赖性。在更换培养基后的9 h内细胞P4分泌旺盛,之后维持在相对稳定的一个水平,BLCs的P4分泌能力,即是鉴定依据,但更是其体外培养的关键功能指标(图7a)。
q-PCR检测P1和P5代BLCs中P4合成过程中的关键基因:STAR、3β-HSD、CYP11A1、PTGFR、FGG在BLCs内的表达情况。结果显示,在P1和P5代BLCs中可检测到P4合成关键基因的特异性检测片段,且表达水平无差异;即在体外培养过程中,BLCs可稳定合成P4,其主要生物学特性并不因离体培养而受到影响(图7b)。
2.3.2 BLCs生长曲线、细胞周期及血清依赖性
连续监测记录BLCs的生长曲线,在接种24 h后细胞增殖速度较快,呈线性增长,细胞处于对数生长期,第7天后细胞生长曲线平缓,生长进入平台期(图8a)。
流式细胞术检测P1与P5代BLCs的细胞周期,在相同处理条件下P1与P5代细胞相比较,P5代细胞处于G1、 G2期细胞数少,更多的处于S期。(图8b、c)。
BLCs在体外时,需要FBS的营养支持,呈浓度依赖性。不同浓度FBS条件下,与无血清组相比较5%、10%、15%、20%均可显著提高细胞活力(Plt;0.01);而15%与20%的血清间细胞活性无差异(Pgt;0.05)(图8d)。
2.3.3 BLCs的核型分析
将分裂中期的BLCs固定,分析其染色体核型。结果显示,BLCs有30对染色体,由29对常染色体和一对XX性染色体构成,核型与正常奶牛细胞核型一致(图8e)。
3 讨 论
研究发现,妊娠CL比周期CL体积更大,P4分泌能力更强;体外培养的妊娠期黄体细胞具有更强的增殖能力[19]。因此本研究选取妊娠期健康中国荷斯坦奶牛,采集其CL组织用于BLCs的体外分离培养。
细胞的分离方法主要有组织块培养法和酶消化法,两者各有其优缺点[20]。组织块培养法操作简单但耗时长、效率低,酶消化培养法则是利用胶原酶消化掉细胞周围基质分离出细胞,可以一次获得数量较多、杂质较少的细胞,有利于后续研究[21]。BLCs作为终末分化细胞,敏感性高且损伤修复能力差,相较于胰酶,胶原酶消化法对细胞的损伤更小是分离BLCs的更优选择[22-24]。已有研究证明胶原酶Ⅱ型对间质细胞分离效果明显,胶原酶Ⅳ型对上皮样细胞分离效果更显著[25]。本研究在细胞的分离过程中尝试了组织块培养法、胰蛋白酶冷消化法、及Ⅱ型和Ⅳ型胶原酶混合消化法,结合吕嘉顺等[22]研究发现,Ⅱ型和Ⅳ型胶原酶混合消化可在最短时间内获得更多高活力的原代BLCs[26]。
CL组织中除了LCs外,还有多种其他类型的细胞。因此,选择恰当的细胞纯化方法,可提供均一的细胞类型[27]。现用于纯化LCs的方法主要有淘洗法、自然沉降法和密度梯度离心法[28],此外还有免疫磁珠法、差速贴壁法和差速消化排除法等新兴技术[29]。淘洗法和免疫磁珠法虽然能得到数量较多、纯度较高的黄体细胞,但需要特殊的仪器设备操作[30];自然沉降法对设备要求低,但耗时长;至于差速贴壁法和消化排除法对操作人员水平要求高,耗时长,目前还没有统一的标准,纯化的细胞效果各异[31];而Percoll密度梯度离心法无设备要求、省时、省力,并且Percoll作为离心基质材料无毒害性易形成比色带,广泛应用于细胞分离纯化研究中[31]。本试验通过结合先前的研究,比较各液相层间的细胞群,发现BLCs主要分布于37.5%~40.0%Percoll分离液层间,而其他的杂细胞及细胞碎片则分布于其他的液相中;可简便高效纯化到活力较好的BLCs。
细胞的形态特点和生物学特征常作为细胞的鉴定依据。但由于体外培养时贴壁生长的细胞完全伸展,且易受到外界因素影响,很难维持典型的细胞特征性形态,因此通过分子生物学手段鉴定细胞内特异基因、蛋白的表达情况成为常用的细胞鉴定方式[32]。
胆固醇是合成类固醇激素的前体物质,定位于滑面内质网上的3β-HSD能够催化胆固醇转化为P4,在整个黄体化过程中稳定表达[28],是用于鉴定LCs的一种经典标志物。但卢习[16]用q-PCR检测山羊黄体细胞、卵巢颗粒细胞和卵巢间质细胞中3β-HSD的表达情况,结果显示,3β-HSD mRNA在3种细胞中有着不同程度的表达,由此可见仅依靠3β-HSD鉴定BLCs并不可靠,需要从多维度对BLCs进行鉴定[33]。同时,LLCs和SLCs含有不同程度的脂滴,由于维持妊娠需要较高浓度的P4,LCs合成分泌功能旺盛,不断将胆固醇转化为类固醇激素,所以在妊娠前期LCs中脂滴数量较少,随着妊娠时间增长,LCs中的脂滴数量增加,功能不断增强[29]。利用油红O脂肪染色法检测细胞中的脂滴,依据脂滴的含量及形态可对LCs的类固醇合成功能进行评估[30]。
现有研究已证实BLCs属于DNES细胞,能够合成4种经典神经内分泌物质[31-32]。通过免疫组化双重酶标染色对牛周期CL中的OT免疫反应产物进行定位,结果发现CL中的OT主要由大黄体细胞产生,同下丘脑产生的OT共同调节子宫和CL组织的活动[15,34]。因此,本研究发现对OT和SYP的免疫定位,可作为一种较准确的区分BLCs与其他细胞的方法。
CL的主要生理功能是合成P4调控生殖周期[33];在妊娠期,CL会合成分泌大量P4以维持妊娠状态、保障受精卵成功附植并正常生长发育,因此P4的合成分泌能力是评估BLCs的关键功能指标[35-36]。本研究发现,妊娠期BLCs在体外培养过程中可高效分泌P4,并随着时间的推移,培养基中的P4浓度趋向于维持在相对恒定的水平。但其体外的增殖能力随着体外培养代数的增加,而逐渐减弱,很难将其在体外培养超过10代。唐骏启[37]在体外分离培养BLCs和大鼠LCs过程中发现,BLCs的增殖能力明显弱于大鼠LCs,且BLCS无端粒酶活性,这可能是BLCs体外增殖能力较弱的重要原因。另外,在牛细胞高效永生化的研究中发现,不同物种的同种细胞的端粒长度不同,增殖能力也存在明显差异。这提示LCs的体外增殖能力存在物种间的差异[38-39]。
4 结 论
本研究利用Ⅱ型和Ⅳ型胶原酶联合消化法结合Percoll不连续密度梯度离心,成功分离纯化获得纯度较高的BLCs;利用3β-HSD染色、油红O染色及免疫荧光染色观察BLCs细胞形态及特征性标志物OT、SYP的表达与分布;检测BLCs 的P4合成分泌能力;并对BLCs体外培养条件进行补充完善;建立了一套科学系统、便捷经济的BLCs分离纯化、鉴定培养的方法。
参考文献(References):
[1] PATE J L. Roadmap to pregnancy during the period of maternal recognition in the cow: changes within the corpus luteum associated with luteal rescue[J]. Theriogenology, 2020, 150:294-301.
[2] 杨 恒, 李利财, 付 琳, 等. 前列腺素D2对山羊黄体细胞内分泌功能及其凋亡相关基因表达的影响[J]. 畜牧兽医学报, 2023, 54(4):1652-1663.
YANG H, LI L C, FU L, et al. Effect of prostaglandin D2 on endocrine function and expression of apoptosis-related genes in goat luteal cells[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(4):1652-1663. (in Chinese)
[3] THIBODEAUX J K, BROUSSARD J R, GODKE R A, et al. Stimulation of progesterone production in bovine luteal cells by co-incubation with bovine blastocy-ststage embryos or trophoblastic vesicles[J]. J Reprod Fertil, 1994, 101(3):657-662.
[4] TORRES A, BATISTA M, DINIZ P, et al. Embryo-luteal cells co-culture:an in vitro model to evaluate steroidogenic and prostanoid bovine early embryo-maternal interactions[J]. In vitro Cell Dev Biol Anim, 2013, 49(2):134-146.
[5] YOSHIOKA S, ABE H, SAKUMOTO R, et al. Proliferation of luteal steroidogenic cells in cattle[J]. PLoS One, 2013, 8(12):e84186.
[6] BATISTA M, TORRES A, DINIZ P, et al. Development of a bovine luteal cell in vitro culture system suitable for co-culture with early embryos[J]. In vitro Cell Dev Biol Anim, 2012, 48(9):583-592.
[7] 张金友, 曾申明, 赵 栓, 等. 干扰素α对离体奶牛黄体细胞孕酮合成的影响[J]. 东北农业大学学报, 2015, 46(6):56-60.
ZHANG J Y, ZENG S M, ZHAO S, et al. Effect of IFN-α on progesterone synthesis by bovine luteal cells in vitro[J]. Journal of Northeast Agricultural University, 2015, 46(6):56-60. (in Chinese)
[8] SARDAR V M, GUPTA M, KORDE J P, et al. Localization of orexin and its receptor in corpus luteum and in vitro effect of orexin on progesterone production from luteal cells in buffalo[J]. Indian J Anim Res, 2023, 57(1):12-17.
[9] MOTKOWSKA P, MARCINIAK E, ROSZKOWICZ-OSTROWSKA K, et al. Effects of allopregnanolone on central reproductive functions in sheep under natural and stressful conditions[J]. Theriogenology, 2020, 158:138-147.
[10] TREVISOL E, GARCA H D M, ACKERMANN C L, et al. Partial luteolysis during early diestrus in cattle downregulates VEGFA expression and reduces large luteal cell and corpus luteum sizes and plasma progesterone concentration[J]. Theriogenology, 2020, 158:188-195.
[11] BAITHALU R K, SINGH S K, GUPTA C, et al. Insulin stimulates progesterone secretion to a greater extent than LH in early pregnant buffalo luteal cells cultured in vitro[J]. Anim Reprod Sci, 2013, 142(3-4):131-136.
[12] WANG Z H, CHEN S L, MO H F, et al. A simple and economical method in purifying dairy goat luteal cells[J]. Tissue Cell, 2013, 45(4):269-274.
[13] 高 艺, 黄 泳, 冯贤辀, 等. 从江香猪睾丸支持细胞分离培养与鉴定[J]. 西南农业学报, 2022, 35(8):1948-1953.
GAO Y, HUANG Y, FENG X Z, et al. Isolation, culture and identification of Sertoli cells from the Congjiang Xiang pig testis[J]. Southwest China Journal of Agricultural Sciences, 2022, 35(8):1948-1953. (in Chinese)
[14] ARIKAN瘙塁, KALENDER H, SIMSEK O. Effects of cholesterol on progesterone production by goat luteal cell subpopulations at two different stages of the luteal phase[J]. Reprod Domest Anim, 2010, 45(6):e434-e439.
[15] MAURER F, JOHN T, MAKHRO A, et al. Continuous percoll gradient centrifugation of erythrocytes-explanation of cellular bands and compromised age separation[J]. Cells, 2022, 11(8):1296.
[16] 卢 习. 山羊黄体细胞的分离培养和鉴定方法的研究[D]. 杨凌:西北农林科技大学, 2011.
LU X. Isolation, culture and identification of luteal cell from goats[D]. Yangling: Northwest Aamp;F University, 2011. (in Chinese)
[17] PITIA A M, MINAGAWA I, ABE Y, et al. Evidence for existence of insulin-like factor 3 (INSL3) hormone-receptor system in the ovarian corpus luteum and extra-ovarian reproductive organs during pregnancy in goats[J]. Cell Tissue Res, 2021, 385(1):173-189.
[18] MOTKOWSKA P, MARCINIAK E, MISZTAL A, et al. Effect of neurosteroids on basal and stress-induced oxytocin secretion in luteal-phase and pregnant sheep[J]. Animals (Basel), 2023, 13(10):1658.
[19] DAGHASH S M, YASIN N A E, ABDELNABY E A, et al. Histological and hemodynamic characterization of corpus luteum throughout the luteal phase in pregnant and non-pregnant buffalos in relation to nitric oxide levels based on its anatomical determination[J]. Front Vet Sci, 2022, 9:896581.
[20] 王仲慧, 唐彩琰, 莫虹斐. 山羊黄体细胞的原代培养及鉴定[C]//中国畜牧兽医学会动物解剖学及组织胚胎学分会第十七次学术研讨会论文集(下). 太谷:中国畜牧兽医学会, 2012:150-157.
WANG Z H, TANG C Y, MO H F. Primary culture and characterization of goat luteal cells[C]//Proceedings of the 17th Symposium of the Branch of Animal Anatomy and Histoembryology of the Chinese Animal Husbandry and Veterinary Medical Association (Lower). Taigu:Chinese Society of Animal Husbandry and Veterinary Medicine, 2012:150-157. (in Chinese)
[21] LI Y T, JING J J, DANG W Q, et al. Effects of Notch2 on proliferation, apoptosis and steroidogenesis in bovine luteinized granulosa cells[J]. Theriogenology, 2021, 171:55-63.
[22] 吕嘉顺, 程佳瑞, 张瑞门, 等. 体外诱导猪颗粒细胞黄体化方法的比较研究[J]. 中国畜牧杂志, 2022, 58(11):175-179.
L J S, CHENG J R, ZHANG R M, et al. Comparative study of methods for inducing luteinization of porcine granulosa cells in vitro[J]. Chinese Journal of Animal Science, 2022, 58(11):175-179. (in Chinese)
[23] 程华琴, 袁钰洁, 罗 文, 等. 褪黑素对牦牛黄体细胞生长及功能影响的研究[J]. 畜牧兽医学报, 2022, 53(2):459-469.
CHENG H Q, YUAN Y J, LUO W, et al. Research on the effect of melatonin on the growth and function of yak luteal cells[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(2):459-469. (in Chinese)
[24] WOOLDRIDGE L K, KEANE J A, RHOADS M L, et al. Bioactive supplements influencing bovine in vitro embryo development[J]. J Anim Sci, 2022, 100(7):skac091.
[25] BAITHALU R K, SINGH S K, GUPTA C, et al. Cellular and functional characterization of buffalo (Bubalus bubalis) corpus luteum during the estrous cycle and pregnancy[J]. Anim Reprod Sci, 2013, 140(3-4):138-146.
[26] PRZYGRODZKA E, PLEWES M R, DAVIS J S. Luteinizing hormone regulation of inter-organelle communication and fate of the corpus luteum[J]. Int J Mol Sci, 2021, 22(18):9972.
[27] PLEWES M R, KRAUSE C, TALBOTT H A, et al. Trafficking of cholesterol from lipid droplets to mitochondria in bovine luteal cells:acute control of progesterone synthesis[J]. FASEB J, 2020, 34(8):10731-10750.
[28] BISHOP C V, SELVARAJ V, TOWNSON D H, et al. History, insights, and future perspectives on studies into luteal function in cattle[J]. J Anim Sci, 2022, 100(7):skac143.
[29] SOFFA D R, STEWART J W, ARNESON A G, et al. Reproductive and lactational responses of multiparous dairy cattle to short-term postpartum chromium supplementation during the summer months[J]. JDS Commun, 2023, 4(2):161-165.
[30] 张小宇, 胡俊杰, 张 勇, 等. 双峰驼黄体细胞的分离与培养[J]. 甘肃农业大学学报, 2015, 50(4):1-4.
ZHANG X Y, HU J J, ZHANG Y, et al. Isolation and primary culture of luteal cell from Bactrian camel[J]. Journal of Gansu Agricultural University, 2015, 50(4):1-4. (in Chinese)
[31] 左彦珍, 胡亚涛, 李玉红, 等. 不同分离纯化法建立人早孕滋养细胞模型的效果比较[J]. 广东医学, 2015, 36(5):665-669.
ZUO Y Z, HU Y T, LI Y H, et al. Isolation and culture of trophoblast cells from human placenta in first trimester with different methods[J]. Guangdong Medical Journal, 2015, 36(5):665-669. (in Chinese)
[32] 王强龙, 潘阳阳, 闫翠霞, 等. 雌性牦牛主要生殖器官中DBI的表达与定位分析[J]. 畜牧兽医学报, 2022, 53(1):169-178.
WANG Q L, PAN Y Y, YAN C X, et al. Expression and localization of DBI in main reproductive organs of female yaks[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(1):169-178. (in Chinese)
[33] 魏士昊, 戴天姝, 王 锋, 等. 奶牛早孕诊断技术研究进展[J]. 畜牧兽医学报, 2022, 53(7):2047-2056.
WEI S H, DAI T S, WANG F, et al. Research progress of early pregnancy diagnosis in dairy cows[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(7):2047-2056. (in Chinese)
[34] AN S M, KIM M J, JEONG J S, et al. Oxytocin modulates steroidogenesis-associated genes and estradiol levels in the placenta[J]. Syst Biol Reprod Med, 2023, 69(3):223-233.
[35] PLEWES M R, HOU X Y, TALBOTT H A, et al. Luteinizing hormone regulates the phosphorylation and localization of the mitochondrial effector dynamin-related protein-1 (DRP1) and steroidogenesis in the bovine corpus luteum[J]. FASEB J, 2020, 34(4):5299-5316.
[36] GRYCMACHER K, BORUSZEWSKA D, SINDEREWICZ E, et al. Prostaglandin F2α (PGF2α) production possibility and its receptors expression in the early- and late-cleaved preimplantation bovine embryos[J]. BMC Vet Res, 2019, 15(1):203.
[37] 唐骏启. 牛黄体细胞与C6胶质瘤细胞共培养及凋亡相关基因在大鼠黄体中的表达[D]. 杨凌:西北农林科技大学, 2009.
TANG J Q. Study on bovine luteal cells cocultured with C6 glioma cells and expression of apoptosis-related genes in rat corpus luteum[D]. Yangling: Northwest Aamp;F University, 2009. (in Chinese)
[38] ZHANG Z H, HAN Z, GUO Y, et al. Establishment of an efficient immortalization strategy using HMEJ-based b TERT insertion for bovine cells[J]. Int J Mol Sci, 2021, 22(22):12540.
[39] 高嘉敏. 延边黄牛黄体中凋亡相关基因的表达研究[D]. 延吉:延边大学, 2020.
GAO J M. The expression of poptosis related gene research in Yanbian cattle corpus luteum[D]. Yanji: Yanbian University, 2020. (in Chinese)
(编辑 白永平)

