SOCS2对山羊鼻甲骨细胞增殖、周期及凋亡的影响






摘 要: 细胞因子信号转导抑制因子2 (suppressor of cytokine signaling 2,SOCS2)在动物体内参与调节多种生理和病理过程,如细胞凋亡、细胞增殖、细胞周期、肿瘤和炎症反应等。本研究在首次克隆山羊SOCS2基因的基础上,研究过表达和干扰SOCS2表达对山羊鼻甲骨细胞增殖、周期及凋亡的影响。以1周岁的健康简州大耳羊(6只)的心、肝、脾、肺、肾、瘤胃、大肠、小肠和山羊鼻甲骨细胞共9个样本为模板,采用反转录PCR技术克隆山羊SOCS2基因CDS区序列,并进行序列分析。利用RT-qPCR技术检测SOCS2基因在不同组织中的表达。将克隆得到的SOCS2基因CDS区连接载体构建真核表达载体pcDNA3.1-SOCS2。根据山羊SOCS2基因序列设计合成并筛选有效siRNA。利用LipofectamineTM 3000试剂将pcDNA3.1-SOCS2和siRNA片段分别转染至鼻甲骨细胞,采用蛋白免疫印迹技术检测 SOCS2蛋白表达,MTT法检测SOCS2对细胞增殖的影响,流式细胞术检测SOCS2对细胞周期和凋亡的影响,并利用RT-qPCR技术检测细胞周期相关基因p21、CDK2和凋亡相关基因 Caspase3、Caspase7、PARP1、p53、Bax、BCL2L11 和Bcl-2的转录水平。结果显示,成功扩增山羊SOCS2 基因序列,总长为1 065 bp,CDS 区长为597 bp,编码198 个氨基酸残基。SOCS2基因在肝中表达水平最高;SOCS2可以抑制细胞增殖。成功构建真核表达载体pcDNA3.1-SOCS2,且该基因在鼻甲骨细胞内成功表达。SOCS2过表达可导致G2/M+S期细胞数量显著增加,且下调CDK2和p21基因的mRNA表达;促进细胞凋亡,且上调Caspase3、Caspase7、Bax、p53、BCL2L11、Bcl-2 基因的mRNA表达,PARP1表达水平无显著变化。而干扰SOCS2表达后,G0/G1 期细胞数量显著升高,且CDK2和p21基因的mRNA表达上调;细胞凋亡被抑制,且Caspase3、Bax、p53、PARP1基因的mRNA表达下调,Caspase7、BCL2L11、Bcl-2基因表达水平无显著变化。综上所述,SOCS2可将细胞周期阻滞在G2/M+S期,促进细胞凋亡,抑制细胞增殖。研究结果为全面揭示山羊SOCS2功能提供试验数据。
关键词: 山羊;SOCS2;细胞增殖;细胞周期;细胞凋亡
中图分类号:S852.21
文献标志码:A""" 文章编号:0366-6964(2024)05-2226-15
收稿日期:2023-08-28
基金项目:西南民族大学研究生创新型科研项目(YB2023338);四川省科技计划项目(2023YFN0043);四川省自然科学基金项目(2022NSFSC0082);四川省科技计划项目(23ZDYF3070);四川省畜禽育种攻关项目(2021YFYZ0003);浙江省科技计划项目(2022C04017)
作者简介:李秋云(2000-),女,四川自贡人,硕士,主要从事畜禽传染病研究,E-mail:428403258@qq.com
*通信作者:向 华,主要从事畜禽传染病研究,E-mail:xianghua2008411@163.com;朱江江,主要从事畜禽传染病研究,E-mail:zhujiang4656@hotmail.com
Effects of SOCS2 on Proliferation, Cycle and Apoptosis of Turbinate Bone Cells in Goats
LI" Qiuyun1, TIAN" Xinyuan1, LIAO" Wensheng1, ZHANG" Huanrong1, REN" Yupeng1, YANG" Falong
1, ZHU" Jiangjiang2*, XIANG" Hua1*
(1.Key Laboratory of Animal Medicine at Southwest Minzu University of Sichuan Province,
Chengdu
610041," China;
2.Qinghai-Tibetan Plateau Animal Genetic Resource
Reservation and Utilization
Key Laboratory of Sichuan Province, Chengdu 610041," China)
Abstract:" Suppressor of cytokine signaling 2 (SOCS2) is involved in regulating various physiological and pathological processes in animals, such as cell apoptosis, proliferation, cell cycle, tumor, and inflammatory response. In this study, based on the first cloned SOCS2 gene from goats, the effects of overexpression and interference SOCS2 expression on proliferation, cycle and apoptosis of goat turbinate bone cells were studied. A total of 9 samples of heart, liver, spleen, lung, kidney, rumen, large intestine, small intestine and goat turbinate bone cells of healthy Jianzhou goats (6 animals) were used as samples, and the sequence of the CDS region of the goat SOCS2 gene was cloned by reverse transcription PCR and analyzed the sequence. RT-qPCR was used to detect the expression of SOCS2 gene in different tissues. The cloned SOCS2 gene CDS region ligation vector was constructed as a eukaryotic expression vector pcDNA3.1-SOCS2. Design, synthesis and screen effective siRNAs based on goat SOCS2 gene sequences. After transfecting pcDNA3.1-SOCS2 and siRNAs to turbinate osteocytes with LipofectamineTM 3000 reagent, SOCS2 protein expression was detected with Western blot mothed, the MTT method detects the effect of SOCS2 on cell proliferation, flow cytometry to detect the effect of SOCS2 on cell cycle and apoptosis and RT-qPCR was used to detect the transcription levels of cell cycle-related genes p21, CDK2 and apoptosis-related genes Caspase3, Caspase7, PARP1, p53, Bax, BCL2L11 and Bcl-2. The results showed that the total length of goat SOCS2 gene was 1 065 bp, and the CDS zone length was 597 bp, encoding 198 amino acid residues. SOCS2 gene is expressed at the highest levels in the liver tissue; SOCS2 can inhibit cell proliferation. The eukaryotic expression vector pcDNA3.1-SOCS2 was successfully constructed, and the gene was successfully expressed in turbinate bone cells. SOCS2 overexpression can lead to a significant increase in the number of cells in the G2/M+S phase and down-regulation of mRNA expression in CDK2 and p21 genes. It promoted apoptosis and upregulated the mRNA expression of Caspase3, Caspase7, Bax, p53, BCL2L11, and Bcl-2 genes, but there was no significant change in PARP1 expression level. However, after interference the expression of SOCS2, the number of cells in G0/G1 stage increased significantly, and the mRNA expression of CDK2 and p21 genes was upregulated. The apoptosis was inhibited and the mRNA expression of Caspase3, Bax, p53 and PARP1 genes was downregulated, while the expression levels of Caspase7, BCL2L11 and Bcl-2 did not change significantly. In summary, SOCS2 can block cells in the G2/M+S phase, promote apoptosis, and inhibit cell proliferation. The results of this study accumulate experimental data for a comprehensive reveal of the function of goat SOCS2.
Key words: goat; SOCS2; cell proliferation; cell cycle; apoptosis
*Corresponding authors:" XIANG Hua, E-mail:xianghua2008411@163.com; ZHU Jiangjiang, E-mail:zhujiang4656@hotmail.com
细胞因子信号转导抑制因子(suppressor of cytokine signaling,SOCS)是一类由细胞产生并反馈性阻断细胞因子信号转导过程的免疫调控因子[1]。SOCS家族作为炎症因子转导的负反馈调节因子,可通过抑制炎症相关信号通路的核转录因子(NF-κB)和丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)的过度激活而发挥作用,调节促炎细胞因子的过量释放,进而抑制炎症反应[2-3]。
同时,SOCS蛋白对先天性免疫和适应性免疫起着重要的生理调节作用[4]。SOCS2作为SOCS家族中的成员,该基因在部分动物中,可参与调节多种细胞因子依赖的信号转导转录激活蛋白(janus kinase-signal transducer and activator of transcription,JAK-STAT)的信号通路[5];进而调控机体的生理和病理过程,包括细胞凋亡[6]、细胞增殖[7]、细胞周期[8]、肿瘤[9]和炎症反应[10]等。在代谢方面,研究发现在脂肪肝组织和正常肝组织中,SOCS2的表达模式存在差异[11]。在猪脂肪原代细胞中过表达SOCS2基因能够抑制生长激素(growth hormone,GH)诱导的脂解作用[12]。在肿瘤方面,大量的研究表明,SOCS2基因的表达水平变化与肿瘤的发生有显著相关性[13-14]。在肝癌患者中发现其癌组织中SOCS2表达水平显著下降,且SOCS2基因表达下降的肝癌患者的无病生存期显著缩短,前列腺癌患者组织中SOCS2表达水平显著上调[15]。而且,肝细胞癌(hepatocellular carcinoma,HCC)外泌体可以通过SOCS2和JAK3/STAT761信号通路激活成纤维细胞(fibroblasts,NFs),从而影响肿瘤微环境[16]。在免疫方面,有研究发现SOCS2基因可调节肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)等炎性细胞因子的水平,说明SOCS2有可能与炎症反应和炎性因子转录有关,从而减少炎性细胞的数目[17]。
同时,SOCS被认为是STATs的靶基因,可以直接作用于JAK/STAT信号通路抑制STATs活化,进而影响细胞的增殖、分化和凋亡等过程[18-19]。解云菲[20]研究发现,SOCS3可以通过调控STAT3 蛋白磷酸化激活 JAK2/STAT3 通路,进而调节该通路下游凋亡相关基因的表达,最终抑制 TNF-α 诱导的前体脂肪细胞凋亡。Duan等[21]研究发现,毛花苷C(lanatoside C)可通过调控JAK2/STAT6/SOCS2信号通路,降低线粒体膜电位来触发细胞凋亡,诱导人宫颈癌细胞周期停滞在S期和G2/M期。SOCS2是STAT5a、STAT5b下游靶基因,在催乳素作用下,SOCS2表达显著升高,继而调节牛乳腺细胞的增殖与泌乳[22]。SOCS2还可以抑制巨噬细胞内NF-κB信号通路激活,从而抑制细胞凋亡[23]。然而,对于SOCS2调控细胞周期及凋亡方面的具体机制尚不清楚,目前,尚无山羊SOCS2基因序列以及其对细胞周期和凋亡调控作用的研究报道。本研究选用简州大耳山羊作为材料,采用RT-PCR技术对山羊SOCS2的基因序列进行了克隆和序列分析;在构建 pcDNA3.1-SOCS2真核表达载体的基础上,将其转染山羊鼻甲骨细胞,研究 SOCS2对细胞周期、凋亡、增殖以及周期和凋亡相关基因的影响;同时干扰SOCS2的表达,探究其对细胞周期、凋亡、增殖及周期和凋亡相关基因表达的影响,为进一步全面揭示SOCS2功能奠定基础。
1 材料与方法
1.1 样本采集、总RNA提取及细胞
本试验在2022年于西南民族大学完成。6只1周岁健康简州大耳山羊购于四川简阳大哥大牧业有限公司。将山羊空腹屠宰后,采集每只山羊心、肝、脾、肺、肾、瘤胃、大肠和小肠组织8个组织样本,然后用无菌DEPC水冲洗干净,用锡箔纸包好后快速放入液氮保存待用。采用Trizol法进行组织和山羊鼻甲骨细胞总RNA的提取,质量检测合格后将其反转录为cDNA。山羊鼻甲骨细胞由西南民族大学动物医学实验室保存。pcDNA3.1(+)真核表达载体由西南民族大学青藏高原研究院惠赠。
1.2 主要仪器与试剂
多功能免染蛋白印记系统购自日本Cytiva公司;高速离心机5804购自Eppendorf公司;PCR仪、CO2恒温培养箱购自ThermoFisher Scientific公司;凝胶成像仪、半干转移电泳槽购自Tanon公司;荧光倒置显微镜购自日本奥林巴斯公司。
BamHⅠ 限制性内切酶、T4 连接酶、Premix TaqTM、TB Green Premix Ex TaqTMⅡ、XbaⅠ限制性内切酶购自TaKaRa公司;PrimeScriptTM reagent Kit with gDNA Eraser(Perfect Real Time)购自北京索莱宝公司;Trizol、LipoGeneTM 3000 转染试剂购自ThermoFisher Science 公司产品;胎牛血清(FBS)购自北京全式金公司;细胞周期检测试剂盒、Annexin V-FITC/PI Kit 凋亡检测试剂盒购自北京四正柏生物公司;ECL 化学发光底物购自美国Millipore公司;鼠 anti-Flag 单抗(sc-166355)、HRP 标记山羊抗鼠 IgG购自Abmart 公司;DMEM培养基购自Gibco公司。
1.3 试验方法
1.3.1 山羊 SOCS2基因克隆及序列分析
根据GenBank中山羊SOCS2基因预测序列(XM_027967202.1)设计克隆山羊SOCS2的特异性引物(表1)。以山羊肝组织cDNA 为SOCS2 基因PCR扩增模板,并通过 1.5%琼脂糖凝胶电泳对产物进行检测。检测无误后胶回收,产物与pMD19-T Simple载体连接后转化,阳性菌落 PCR 检测和测序确定无误后,将重组质粒命名为 pMD19-SOCS2。参考王宪军等[24]方法对山羊SOCS2基因进行序列分析。
1.3.2 真核表达载体 pcDNA3.1-SOCS2 构建及siRNA的合成
以SOCS2的CDS区序列为基础设计亚克隆引物,序列见表 1。上、下游引物划线部分分别为 BamHⅠ和XbaⅠ酶切位点,斜体部分为 Kozak 序列,划线加粗部分为 Flag 标签。使用BamHⅠ和XbaⅠ酶对载体 pcDNA3.1(+)和亚克隆获得的SOCS2的CDS区序列进行双酶切,随后用 T4 连接酶对回收纯化产物进行连接转化,经测序验证正确后的真核表达载体命名为 pcDNA3.1-SOCS2。使用BamH Ⅰ和XbaⅠ酶对pcDNA3.1-SOCS2质粒进行双酶切鉴定。将“ 1.3.1 ”克隆获得的 SOCS2基因的 CDS 区序列送上海吉玛基因股份有限公司合成 2 条 siRNA 干扰片段和一条阴性对照序列(表2)。
1.3.3 山羊SOCS2基因的组织表达差异检测
以“1.1”中反转录的cDNA为模板,表1中SOCS2基因克隆引物采用RT-qPCR检测SOCS2基因在不同组织中的表达差异。以泛素表达转录因子(ubiquitously-expressed transcript,UXT)基因作为内参基因,序列见表1。每个待测样本设置3次生物学重复。
1.3.4 山羊鼻甲骨细胞的复苏培养和转染
本试验所用鼻甲骨细胞为实验室前期分离和纯化获得[25]。复苏实验室冻存的鼻甲骨细胞,即细胞接种于含体积分数为15% FBS和1% 双抗的DMEM培养基中进行培养。待第6代细胞生长到70%~80%时,根据LipofectamineTM3000转染试剂说明书进行转染,操作程序参考文献[26]。山羊SOCS2过表达组设置pcDNA3.1-SOCS2组和pcDNA3.1(+)阴性对照组。山羊SOCS2干扰组设置SOCS2-siRNA1、SOCS2-siRNA2和阴性对照组(Negative control,NC)。转染 48 h 后,提取细胞的总 RNA 并反转录为 cDNA,RT-qPCR 技术检测 SOCS2基因的 mRNA 表达水平,筛选出有效的 siRNA 干扰片段。每组试验设置生物学重复3次。
1.3.5 检测SOCS2蛋白在山羊鼻甲骨细胞中的表达
按照“1.3.4”方式进行山羊SOCS2过表达组的转染,转染48 h后,收集蛋白样品。经 SDS-PAGE 电泳后,转入聚偏二氟乙烯(PVDF)膜上并进行封闭过夜。随后分别添加鼠源 Flag 单克隆抗体和兔源 β-Actin,4℃孵育过夜。然后再分别添加HRP 标记的山羊抗鼠 IgG 和山羊抗兔 IgG,室温摇床孵育 2 h,最后使用 ECL 试剂显色,成像。
1.3.6 SOCS2对山羊鼻甲骨细胞增殖的影响
参照“1.3.4”方式进行转染,待96 孔培养板内细胞生长至70%~80%时,将真核表达载体 pcDNA3.1-SOCS2和 pcDNA3.1(+)分别转染细胞,分别培养24、48、72和96 h。按照 MTT试剂说明书测定不同时间段562 nm波长处各孔光吸收OD值并绘制细胞生长曲线。同样,将干扰效率 70%以上的干扰片段和阴性对照组分别转染细胞,培养24、48、72和96 h,按照类似的步骤检测干扰SOCS2表达后对细胞增殖的影响。每组设置5个重复,试验重复3次。
1.3.7 SOCS2对山羊鼻甲骨细胞周期及周期相关基因表达的影响
参照“1.3.4”方式进行转染,待12孔培养板内细胞生长至70%~80% 时,将真核表达载体 pcDNA3.1-SOCS2和 pcDNA3.1(+)分别转染细胞,转染48 h 后,按细胞周期检测试剂盒操作步骤收样,流式细胞仪检测SOCS2过表达对细胞周期的影响。同样,将干扰效率 70%以上的干扰片段和阴性对照组分别转染细胞,转染48 h 后,按照类似的步骤检测干扰SOCS2表达后对细胞周期的影响。同时以UXT作为内参基因,参照王宪军等[27]设计的检测细胞周期相关基因表达的引物(表1),采用RT-qPCR 测定SOCS2对细胞周期相关基因mRNA 表达水平的影响。每组设3 个重复孔,试验重复3 次。
1.3.8 SOCS2 对山羊鼻甲骨细胞凋亡及凋亡相关基因表达的影响
参考“1.3.4”方式进行转染。转染48 h 后,根据细胞凋亡检测试剂盒说明书收样,使用流式细胞仪分别检测SOCS2过表达和干扰对细胞凋亡的影响。同时,参照但一昕等[28]设计的检测细胞凋亡相关基因的引物 (表1)。以UXT作为内参基因,采用RT-qPCR 测定SOCS2过表达和干扰对细胞凋亡有关基因 mRNA 表达水平的影响。每组设3 个重复孔,试验重复3 次。
1.3.9 数据统计与分析
以UXT为内参基因,采用2-ΔΔCt方法对实时荧光定量数据进行分析。使用 SPSS20.0 软件对试验数据进行单因素方差分析,P<0.01 为差异极显著,P<0.05为差异显著,P>0.05 为差异不显著。
2 结 果
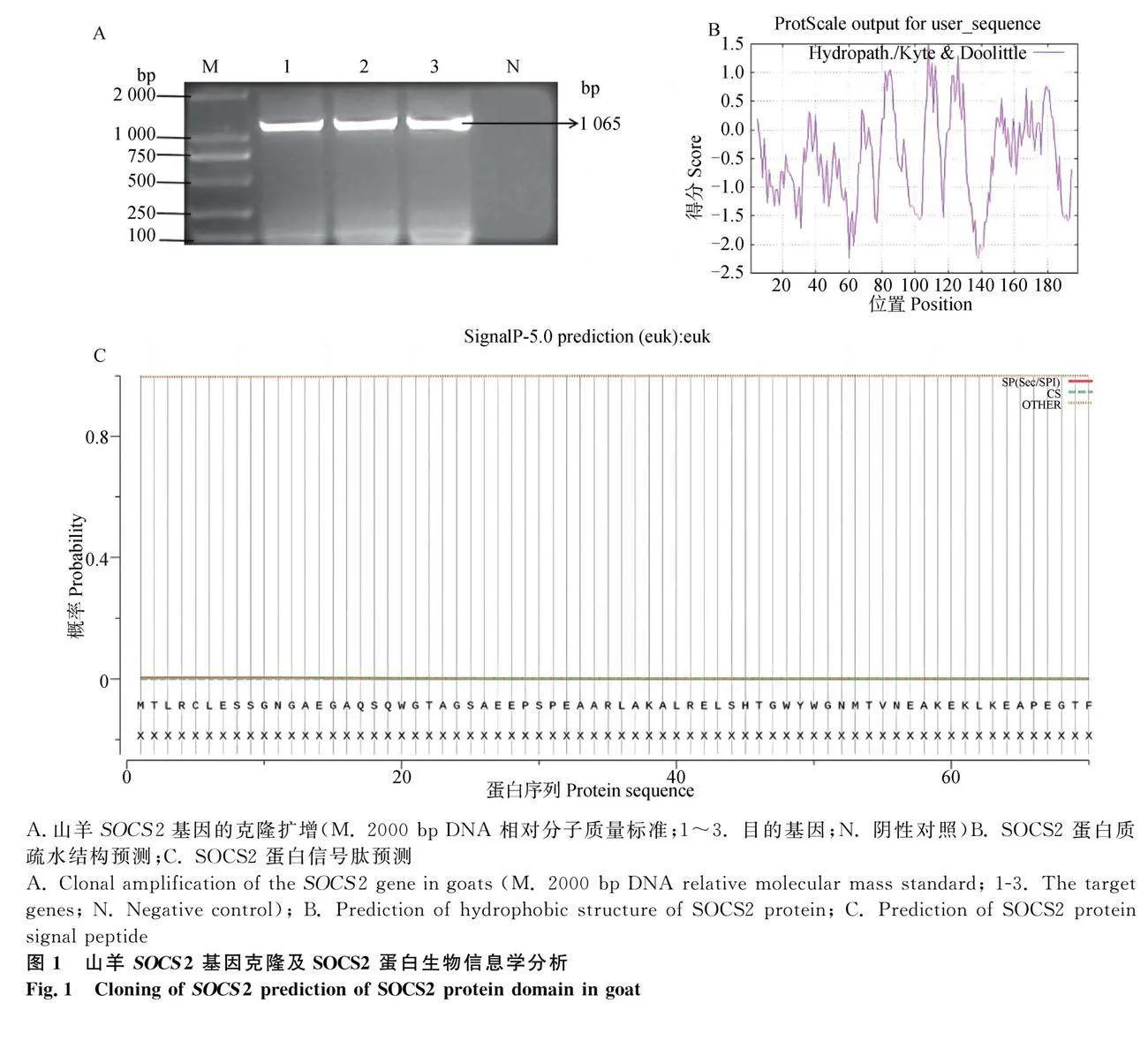
2.1 山羊SOCS2基因 CDS 区的克隆及序列分析
胶回收产物克隆转化后,经测序得到SOCS2基因序列长度为1 065 bp,其中,CDS区长597 bp,共编码198个氨基酸(图1A)。SOCS2 蛋白分子式为C990H1562N270O297S8,分子质量为22.258 475 ku,为亲水蛋白(图1B),主要分布在核内,不存在信号肽(图1C),无跨膜区(图2A)。SOCS2共有24个磷酸化位点,包括10个苏氨酸(Thr)、10个丝氨酸(Ser)、4个酪氨酸(Tyr)磷酸化位点(图2B)。提交NCBI数据库得到山羊SOCS2基因的GenBank登录号为MZ_055377。SOCS2二级结构预测发现α螺旋、无规则卷曲和延伸链分别占27.78%、52.02%和18.69%(图2C),SOCS2的三级结构如图2D。从STRING数据库检索到与SOCS2蛋白可能存在互作的蛋白包括JAK1、JAK2、STAT5A、STAT5B、SOCS1、LCK、GHR、CUL5、TCEB1、TCEB2(图2E)。系统进化树显示,山羊SOCS2基因与绵羊亲缘关系最近,然后是牦牛、牛、猪、人、马、小鼠,亲缘关系最远的是大鼠(图2F)。
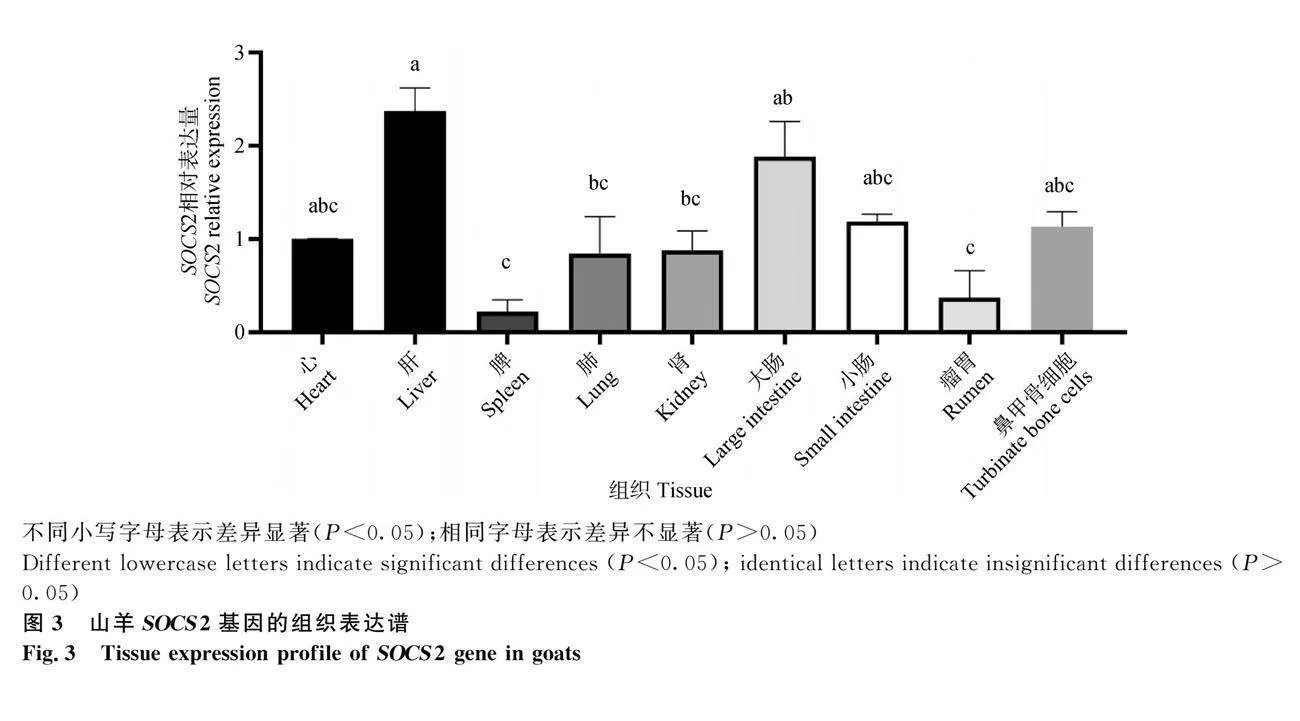
2.2 山羊SOCS2基因的组织表达差异分析
由图3可知,在山羊的心、脾、肝、肾、肺、瘤胃、大肠和小肠8个组织样本以及鼻甲骨细胞中都能检测到SOCS2基因的mRNA表达,然而肝中的SOCS2基因mRNA表达水平显著高于其他组织,其次是大肠,最低的是脾和瘤胃。
2.3 真核表达载体 pcDNA3.1-SOCS2的构建及鉴定
对纯化后的质粒 pcDNA3.1-SOCS2 进行 BamHⅠ和 XbaⅠ双酶切,得到 5 400 和 600 bp 左右长度片段(图4A)。测序结果与预期相同,表明真核表达载体构建成功。
2.4 SOCS2的过表达和干扰效率检测
以β-Actin为内参基因,Western blot检测结果显示,转染了pcDNA3.1-SOCS2重组质粒的细胞中检测到了标签蛋白Flag的表达(22.258 475 ku),而转染空载体pcDNA3.1(+)的细胞内无 Flag 蛋白的表达,表明SOCS2在鼻甲骨细胞内成功表达,可用于该蛋白的功能研究(图4B)。RT-qPCR 检测结果显示,干扰SOCS2(SOCS2-siRNA 1 和SOCS2-siRNA 2)后其相对表达量均显著低于对照组,其中SOCS2-siRNA2干扰效果最好,可降低SOCS2基因 mRNA 表达水平达 70%,达到了极显著水平(Plt;0.01) (图4C),可作为后续试验材料。
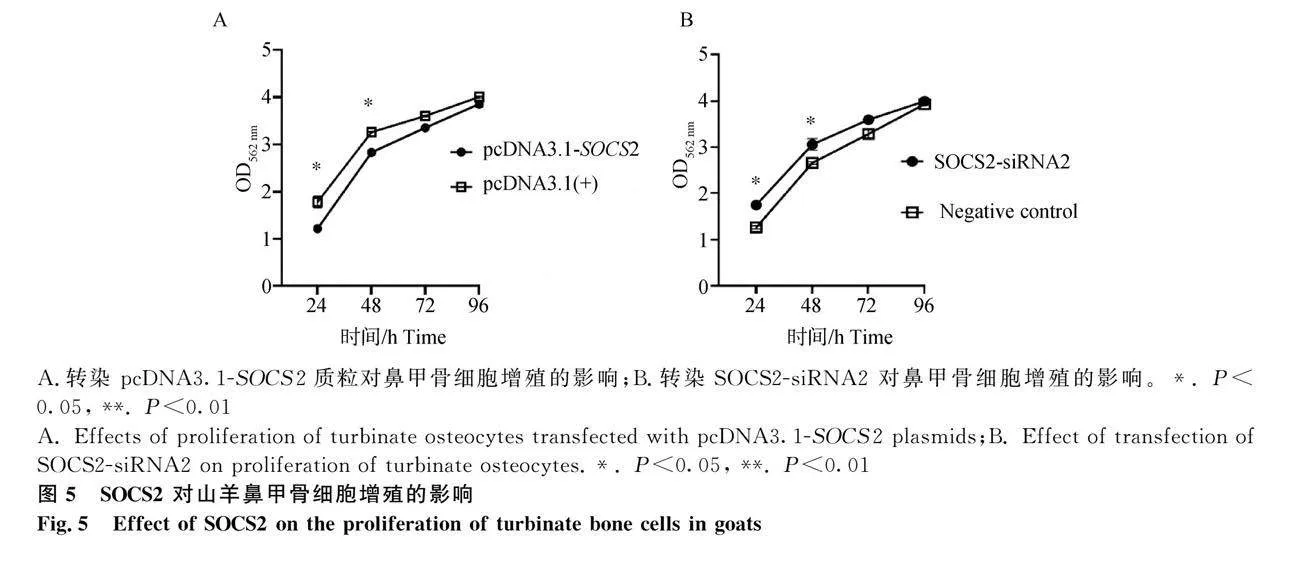
2.5 SOCS2 对山羊鼻甲骨细胞增殖的影响
试验结果见图5。与对照细胞组相比,转染 pcDNA3.1-SOCS2 组山羊鼻甲骨细胞增殖受到了一定程度的抑制(Plt;0.05),但是随着时间的延长,其抑制作用减弱。相反,转染 SOCS2-siRNA2促进了山羊鼻甲骨细胞增殖(Plt;0.05),且随着时间的延长,其促进作用减弱。
2.6 SOCS2 对山羊鼻甲骨细胞周期及周期相关基因表达的影响
与空载体pcDNA3.1(+)(41.73%±0.40%)相比,转染pcDNA3.1-SOCS2组G0/G1期细胞数(28.54%±0.22%)极显著降低;而与空载体(48.27%±0.31%)相比较,pcDNA3.1-SOCS2组的G2/M+S期占比约为(61.46%±0.50%),细胞数上升极显著(图6 A)。与阴性对照组(93.61%±0.25%)相比较,转染SOCS2-siRNA2组的 G0/G1 期细胞数(105.36%±0.14%)显著增加;而与阴性对照组(10.96%±0.58%)相比较,SOCS2-siRNA2 组G2/M+S 期细胞占比约为(4.63%±0.15%),细胞数减少极显著(图6 B)。可见,SOCS2可以将细胞阻滞于G2/M+S期。周期相关基因的检测结果显示,与pcDNA3.1(+)空载体组相比,pcDNA3.1-SOCS2 转染组CDK2和p21基因的mRNA表达水平下调(Plt;0.01)(图6 C)。而与阴性对照组相比,干扰SOCS2表达可上调CDK2和p21基因的mRNA表达 (Plt;0.01)(图6 D)。
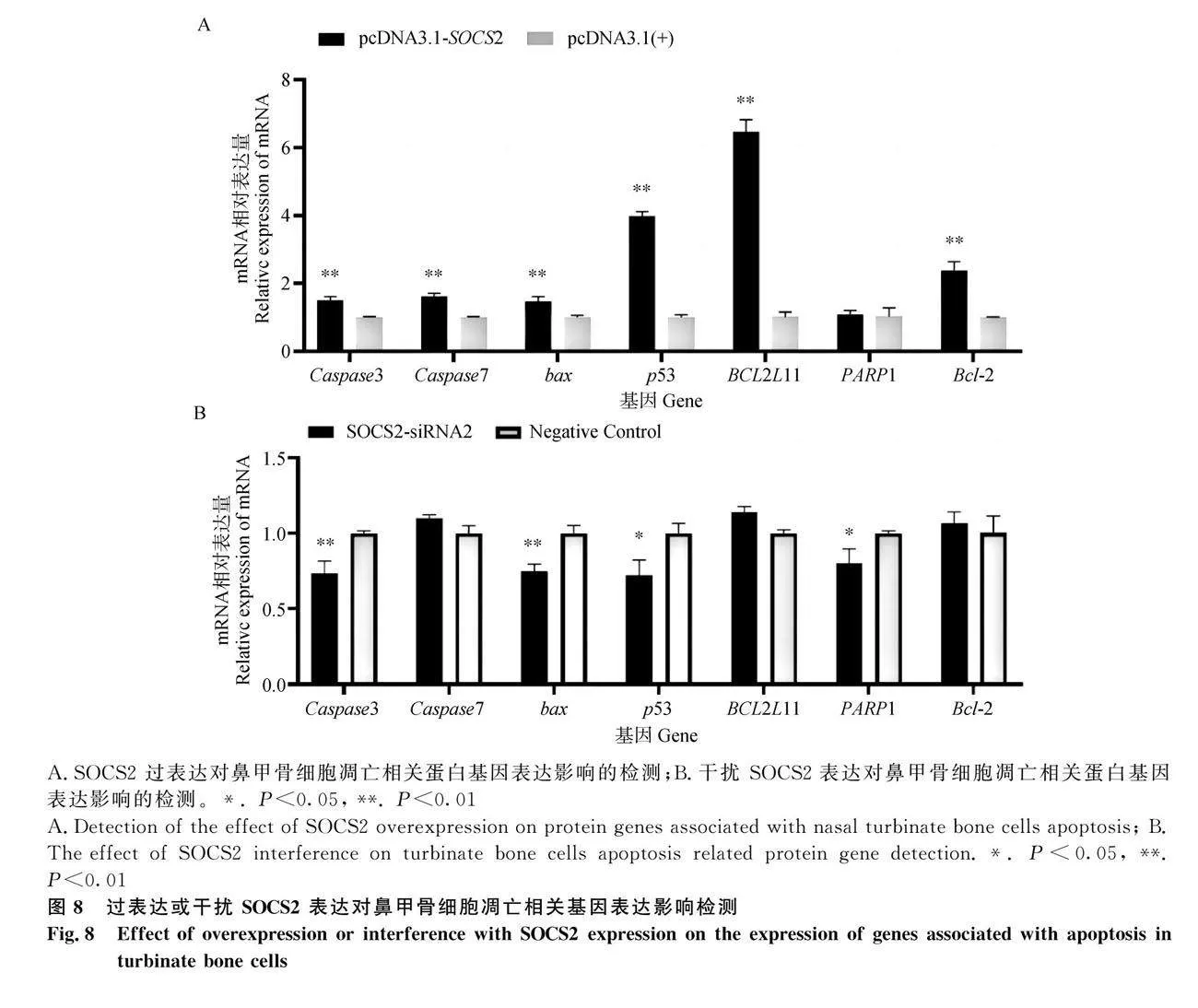
2.7 SOCS2 对山羊鼻甲骨细胞凋亡及凋亡相关基因表达的影响
结果显示,转染空载体pcDNA3.1(+)组的细胞早期凋亡率为9.89%±0.09%、晚期凋亡率为3.90%±0.20%;pcDNA3.1-SOCS2转染组细胞的早期凋亡率为33.77%±0.12%、晚期凋亡率24.34%±0.11%。转染Negative Control 片段组细胞的早期凋亡率为4.34%±0.11%、晚期凋亡率1.62%±0.07%;SOCS2-siRNA2转染组细胞的早期凋亡率为2.24%±0.04%,晚期凋亡率为0.68%±0.06%。可见,SOCS2促进了山羊鼻甲骨细胞的凋亡作用(图7)。细胞凋亡相关基因检测结果显示,与空载体pcDNA3.1(+)组相比,SOCS2过表达可极显著上调细胞内促凋亡基因Caspase3、Caspase7、Bax、 p53、BCL2L11 和抗凋亡基因 Bcl-2 mRNA的表达(Plt;0.01),但对PARP1 无显著作用。敲低 SOCS2 基因表达可极显著下调Caspase3、Bax mRNA水平(Plt;0.01),显著下调p53 和 PARP1水平(Plt;0.05),对Caspase7、BCL2L11、Bcl-2 mRNA表达无显著影响(图8)。
3 讨 论
目前,关于SOCS2功能的研究主要集中于人[29]、牛[30]、鼠[31]等,但尚未有关SOCS2基因功能的研究报道。同时,山羊鼻甲骨原代细胞常被用于山羊宿主细胞蛋白功能研究以及羊口疮病毒的增殖和致病机制研究的理想细胞类型之一[25,32-33]。本研究的对象为简州大耳山羊,通过克隆得到山羊SOCS2基因序列,总长为1 065 bp,CDS 区长为597 bp,编码198个氨基酸。生物信息学分析显示,SOCS2蛋白无跨膜结构域且不存在信号肽结构,二级结构中以无规则卷曲最多,其次是α螺旋,推测SOCS2蛋白为非分泌型Mixed样蛋白且该蛋白可能不在生物膜上行使功能。JAK2、STAT5A、STAT5B、SOCS1等蛋白常被报道参与细胞增殖、凋亡及机体炎症反应等。如,马涛等[34]研究发现,阿曼托双黄酮(amentoflavone,AF)可通过抑制SW579细胞中JAK2-STAT3通路活化及其下游基因的表达进而抑制SW579细胞的增殖同时促进细胞凋亡。施姮和舒芳芳[35]研究发现,干扰SOCS1基因的表达后,连翘苷的作用被抑制,促进了肺泡上皮细胞的凋亡、周期和氧化应激。Xiao等[36]研究发现,过表达RNF7后可以通过泛素化SOCS1激活JAK/STAT3信号通路,从而抑制肾癌细胞的凋亡。结合本研究互作蛋白的预测结果,推断SOCS2蛋白与这几种互作蛋白可能存在联系,从而一起调控细胞的凋亡和增殖。
细胞周期的运转受到许多不同种类的蛋白质、复合物以及细胞周期检测点等复杂物质的参与,这些物质之间相互影响、相互作用,共同协调和控制着细胞周期的运转,以确保细胞能够正常地分化、生长和凋亡[37]。有研究发现,当细胞的DNA受到损害时,细胞会利用其周期蛋白协同调控细胞周期进程,以便将细胞周期阻滞在某个特定的阶段,从而为DNA修复损伤提供充足的时间[38]。同时,当细胞DNA受到轻微损伤时,细胞更容易停滞在G0/G1期,相反则容易停滞在G2/M期,从而有助于细胞的生存[39]。本研究结果显示,过表达SOCS2后可将细胞周期阻滞于G2/M+S期,同时下调p21 mRNA表达抑制细胞的增殖,而干扰SOCS2表达后的结果相反。由此推测这种现象的发生可能是,当SOCS2表达发生变化时影响细胞的增殖以及CDK和p21基因的表达,从而调控细胞周期进程,为DNA的损伤修复赢取时间。这相比彭胜建等[40]的研究,更进一步的研究了增殖与周期之间的关系。除此之外,细胞周期进程还受细胞周期蛋白依赖性激酶(cyclin dependent kinase,CDK)、p21、内源性CDK抑制剂(cycin-dependent kinase inhibitors,CK)的影响[41-43]。细胞周期蛋白K(cyclin K,CCNK)作为细胞周期蛋白家族成员之一,可以调节前复合体的组装,且表达量与细胞增殖呈正相关[44]。在本研究中,SOCS2过表达后可抑制细胞的增殖,且下调CDK的mRNA表达,此结果与上述报道一致。作者从干扰SOCS2表达后对细胞的影响再次证实上述结果。
在细胞凋亡信号传递过程中,有多种不同的信号传递系统参与其中,这些系统会触发细胞凋亡程序,其中包括Bcl-2、Casepases、P53、BCL2L11和PARP1等多种蛋白的调节[45-46]。这些蛋白中Bcl-2家族(Bcl-2,BCL2L11)又在细胞凋亡过程中发挥着关键性的作用,它可以通过降低线粒体释放的细胞色素C来调控细胞凋亡的过程[47]。本研究结果显示,过表达SOCS2后可促进山羊鼻甲骨细胞的凋亡并上调细胞内促凋亡基因Caspase3、Caspase7、Bax、p53、BCL2L11 mRNA的表达。同时,参考Hirunagi等[48]的方法,设计、筛选到有效的干扰片段SOCS2-siRNA2,并将其转染细胞,发现干扰SOCS2表达后可抑制细胞凋亡并且下调Caspase3、Bax、p53和PARP1 mRNA水平。进而从相反方向证实了SOCS2的功能,这与Li等[23]、Shi等[49]报道的结果相符合。已有研究显示,Bcl-2/Bax的比值被认为是调节细胞凋亡的开关,对细胞的存活有很大影响,其比值下降预示细胞凋亡增加,其比值上升预示细胞凋亡减少[50]。干扰SOCS2表达后,Bcl-2虽未有明显变化,但Bcl-2/Bax比值显著上升,表明细胞凋亡被抑制了。同时,在试验中发现,过表达SOCS2基因后,
Bcl-2/Bax比值同样也出现了上升现象,作者推测在SOCS2基因调控的细胞凋亡信号通路中,可能还存在其他因子共同参与调控Bcl-2、Bax基因的表达。本研究发现,SOCS2过表达可上调细胞内促凋亡基因Caspase7、BCL2L11 mRNA表达,PARP1无显著变化;而干扰SOCS2表达可下调PARP1水平,Caspase7、BCL2L11无显著变化。据此可以推断PARP1、Caspase7和Bcl-2家族在表达上可能存在一定的相互作用,但具体作用尚不清楚,有待进一步研究。
4 结 论
山羊SOCS2基因总长1 065 bp其CDS区长597 bp,从ATG开始,到TAA结束,共编码198个氨基酸残基,与绵羊的SOCS2基因同源性最近,与大鼠小鼠同源性最远,SOCS2在山羊肝中表达最高,脾中表达最低。SOCS2可显著促进山羊鼻甲骨细胞凋亡,抑制增殖,增加G2/M期和S期细胞数量。这些结果为进一步探究山羊SOCS2功能奠定了基础。
参考文献(References):
[1] 赵心愉, 刘 娟, 邹曙明. 利用CRISPR/Cas9基因编辑技术敲除团头鲂SOCS1重复基因[J]. 水产学报, 2020, 44(12):1937-1947.
ZHAO X Y, LIU J, ZOU S M. Knock-out analysis of duplicated socs1 using CRISPR/Cas9 in Megalobrama amblycephala[J]. Journal of Fisheries of China, 2020, 44(12):1937-1947. (in Chinese)
[2] ZHANG B G, HU L, ZANG M D, et al. Helicobacter pylori CagA induces tumor suppressor gene hypermethylation by upregulating DNMT1 via AKT-NFκB pathway in gastric cancer development[J]. Oncotarget, 2016, 7(9):9788-9800.
[3] WAN J, CHE Y, KANG N N, et al. SOCS3 blocks HIF-1α expression to inhibit proliferation and angiogenesis of human small cell lung cancer by downregulating activation of Akt, but not STAT3[J]. Mol Med Rep, 2015, 12(1):83-92.
[4] QIN H W, HOLDBROOKS A T, LIU Y D, et al. SOCS3 deficiency promotes M1 macrophage polarization and inflammation[J]. J Immunol, 2012, 189(7):3439-3448.
[5] 周月宏, 田 坚, 沈静雪, 等. SOCS2基因转染对人肾小球系膜细胞TGF-β、Ⅳ型胶原蛋白、纤维连接蛋白表达的影响[J]. 山东医药, 2016, 56(3):17-19.
ZHOU Y H, TIAN J, SHEN J X, et al. Effect of SOCS2 gene transfection on expression of TGF-β, collagen Ⅳ and FN in human glomerular mesangial cells[J]. Shandong Medical Journal, 2016, 56(3):17-19. (in Chinese)
[6] WANG S N, CAI Y L, BU R S, et al. PPARγ regulates macrophage polarization by inhibiting the JAK/STAT pathway and attenuates myocardial ischemia/reperfusion injury in vivo[J]. Cell Biochem Biophys, 2023, 81(2):349-358.
[7] 刘 旭, 王海龙, 陈洪涛, 等. MiR-467b调控JAK/STAT信号通路在脂多糖诱导ATDC5细胞增殖及炎症反应中的作用[J]. 临床与病理杂志, 2021, 41(3):503-509.
LIU X, WANG H L, CHEN H T, et al. Role of miR-467b in regulating JAK/STAT signaling pathway in LPS induced proliferation and inflammatory response of ATDC5 cells[J]. Journal of Clinical and Pathological Research, 2021, 41(3):503-509. (in Chinese)
[8] 廉政君, 常 炜. 汉黄芩素调节JAK/STAT信号通路并诱导肺癌A549细胞凋亡及周期阻滞的作用及机制研究[J]. 临床肺科杂志, 2021, 26(2):270-274, 279.
LIAN Z J, CHANG W. Effect and mechanism of wogonin on regulating JAK/STAT signal pathway and inducing apoptosis and cell cycle arrest in lung cancer A549 cells[J]. Journal of Clinical Pulmonary Medicine, 2021, 26(2):270-274, 279. (in Chinese)
[9] TANG Y J, WU W, CHEN Q Q, et al. miR-29b-3p suppresses the malignant biological behaviors of AML cells via inhibiting NF-κB and JAK/STAT signaling pathways by targeting HuR[J]. BMC Cancer, 2022, 22(1):909.
[10] 袁宇晴, 娄 余, 龙 丹, 等. 溃结宁膏调控microRNA-155介导JAK/STAT通路对HT-29细胞炎症模型的影响及作用机制研究[J]. 中国中西医结合消化杂志, 2023, 31(4):285-292.
YUAN Y Q, LOU Y, LONG D, et al. Mechanism of Kuijiening Plaster on inflammation model of HT-29 cells by regulating microRNA-155 mediated JAK/STAT pathway[J]. Chinese Journal of Integrated Traditional and Western Medicine on Digestion, 2023, 31(4):285-292. (in Chinese)
[11] ZADJALI F, SANTANA-FARRE R, VESTERLUND M, et al. SOCS2 deletion protects against hepatic steatosis but worsens insulin resistance in high-fat-diet-fed mice[J]. FASEB J, 2012, 26(8):3282-3291.
[12] YANG H L, YAN J, FENG M, et al. Construction of suppressor of cytokine signaling 2 (SOCS2) adenoviral overexpression vector and its impact on growth-hormone-induced lipolysis in swine primary adipocytes[J]. Genet Mol Res, GMR, 2013, 12(2):1283-1293.
[13] 成 诚, 王佩雯, 杨 益, 等. 肿瘤相关巨噬细胞在吸烟促进肺癌发展中作用及表观遗传机制[C]//中国毒理学会第十次全国毒理学大会论文集. 珠海:中国毒理学会, 2023:549-550.
CHENG C, WANG P W, YANG Y, et al. Role and epigenetic mechanism of tumor-associated macrophages in promoting the development of lung cancer through smoking[C]//Proceedings of the 10th National Toxicology Conference of the Chinese Society of Toxicology. Zhuhai:Chinese Society of Toxicology, 2023:549-550. (in Chinese)
[14] TU Y H, MEI F. miR-3648 promotes lung adenocarcinoma-genesis by inhibiting SOCS2 (suppressor of cytokine signaling 2)[J]. Bioengineered, 2022, 13(2):3044-3056.
[15] 戴奇山, 朱建国, 江福能, 等. SOCS2在良性前列腺增生症与前列腺癌中的表达及其意义[J]. 中国现代医学杂志, 2013, 23(34):11-15.
DAI Q S, ZHU J G, JIANG F N, et al. Expression and significances of SOCS2 in prostate cancer tissues and benign prostate hyperplasia tissues[J]. China Journal of Modern Medicine, 2013, 23(34):11-15. (in Chinese)
[16] ZHOU X H, XU H, XU C, et al. Hepatocellular carcinoma-derived exosomal miRNA-761 regulates the tumor microenvironment by targeting the SOCS2/JAK2/STAT3 pathway[J]. World J Emerg Med, 2022, 13(5):379-385.
[17] 李晓艳, 莫立稳, 程 莹, 等. 白果内酯调控细胞因子信号转导抑制因子2抑制高糖诱导的肾小球系膜细胞中炎症与纤维化成分的表达[J]. 河北医学, 2022, 28(12):2007-2012.
LI X Y, MO L W, CHENG Y, et al. Bilobalide regulates SOCS2 to inhibit the expression of inflammatory fibrotic components in high glucose-induced glomerular mesangial cells[J]. Hebei Medicine, 2022, 28(12):2007-2012. (in Chinese)
[18] LINOSSI E M, CALLEJA D J, NICHOLSON S W. Understanding SOCS protein specificity[J]. Growth Factors, 2018, 36(3-4):104-117.
[19] DURHAM G A, WILLIAMS J J L, NASIM M T, et al. Targeting SOCS proteins to control JAK-STAT signalling in disease[J]. Trends Pharmacol Sci, 2019, 40(5):298-308.
[20] 解芸菲. siRNA干扰SOCS3表达对TNF-α诱导前体脂肪细胞凋亡的影响[D]. 杨凌:西北农林科技大学, 2011.
XIE Y F. Effects of Silencing SOCS3 expression by SIRNA on TNF-α induced preadipocytes apoptosis[D]. Yangling:Northwest Aamp;F University, 2011. (in Chinese)
[21] DUAN Y C, CHEN L, SHAO J, et al. Lanatoside C inhibits human cervical cancer cell proliferation and induces cell apoptosis by a reduction of the JAK2/STAT6/SOCS2 signaling pathway[J]. Oncol Lett, 2021, 22(4):740.
[22] 李 胜. STAT5对水牛乳腺上皮细胞增殖和乳蛋白基因表达的调控作用及乳腺组织的定量蛋白质组学研究[D]. 南宁:广西大学, 2019.
LI S. Studies related to actions of stat5 in proliferation of mammary epithielal cells and expression of genes related to milk proteins and quantitative proteomics of buffalo mammary gland[D]. Nanning:Guangxi University, 2019. (in Chinese)
[23] LI S, HAN S, JIN K P, et al. SOCS2 suppresses inflammation and apoptosis during NASH progression through limiting NF-κB activation in macrophages[J]. Int J Biol Sci, 2021, 17(15):4165-4175.
[24] 王宪军, 向 华, 张焕容, 等. 山羊HABP4基因的克隆、序列分析及功能预测[J]. 畜牧兽医学报, 2021, 52(12):3426-3438.
WANG X J, XIANG H, ZHANG H R, et al. Cloning, sequence analysis and function prediction of HABP4 gene in goat[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(12):3426-3438. (in Chinese)
[25] 徐颂为, 向 华, 张焕容, 等. 干扰SERBP1表达对山羊鼻甲骨原代细胞增殖、周期及凋亡的作用[J]. 畜牧兽医学报, 2022, 53(8):2708-2720.
XU S W, XIANG H, ZHANG H R, et al. Effects of interfering SERBP1 on the cell proliferation, cell cycle and apoptosis in goat turbinate bone primary cells[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(8):2708-2720. (in Chinese)
[26] 王江林, 王 永, 池永东, 等. KLF11抑制山羊肌内前体脂肪细胞分化[J]. 畜牧兽医学报, 2020, 51(5):976-986.
WANG J L, WANG Y, CHI Y D, et al. KLF11 inhibits the differentiation of goat intramuscular preadipocyte[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(5):976-986. (in Chinese)
[27] 王宪军, 向 华, 张旭梅, 等. 羊口疮病毒ORFV118蛋白对山羊睾丸支持细胞周期、凋亡及免疫细胞因子的影响[J]. 华北农学报, 2022, 37(1):222-231.
WANG X J, XIANG H, ZHANG X M, et al. Effects of ORFV118 on cell cycle, apoptosis and the immune-related cytokines in goat testicular sertoli cells[J]. Acta Agriculturae Boreali-Sinica, 2022, 37(1):222-231. (in Chinese)
[28] 但一昕, 杨 璐, 向 华, 等. BIRC5对山羊睾丸细胞周期、凋亡的影响[J]. 畜牧兽医学报, 2023, 54(4):1511-1524.
DAN Y X, YANG L, XIANG H, et al. Effects of BIRC5 on the cycle and apoptosis of goat testis cells[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(4):1511-1524. (in Chinese)
[29] 刘海涛, 罗 庆, 范 立, 等. 细胞因子信号转导负调控蛋白2在变应性鼻炎中的表达及临床意义[J]. 中国医药导报, 2019, 16(33):19-22.
LIU H T, LUO Q, FAN L, et al. Expression and clinical significance of negative regulatory protein 2 of cytokine signal transduction in allergic rhinitis[J]. China Medical Herald, 2019, 16(33):19-22. (in Chinese)
[30] 董宝霞, 杨玉莹, 荆海霞, 等. 瘦素对牦牛MEC中SOCS2 mRNA及蛋白水平的表达影响[J]. 甘肃农业大学学报, 2022, 57(4):10-16, 26.
DONG B X, YANG Y Y, JING H X, et al. Effect of leptin on SOCS2 mRNA and protein expression in MEC of yak[J]. Journal of Gansu Agricultural University, 2022, 57(4):10-16, 26. (in Chinese)
[31] 贾 超, 李树岗, 范秋玉, 等. LncRNA Gm15621通过调控miR-133a/SOCS2轴抑制类风湿关节炎成纤维样滑膜细胞炎症[J]. 免疫学杂志, 2021, 37(3):263-269.
JIA C, LI S G, FAN Q Y, et al. LncRNA Gm15621 inhibits fibroblast-like synoviocytes inflammation by regulating miR-133a/SOCS2 axis in rheumatoid arthritis[J]. Immunological Journal, 2021, 37(3):263-269. (in Chinese)
[32] DIEL D G, LUO S, DELHON G, et al. Orf virus ORFV121 encodes a novel inhibitor of NF-κB that contributes to virus virulence[J]. J Virol, 2011, 85(5):2037-2049.
[33] WANG X J, XIANG H, ZHANG H R, et al. HABP4 overexpression promotes apoptosis in goat turbinate bone cells[J]. Anim Biotechnol, 2022, doi:10.1080/10495398.2022.2062601.
[34] 马 涛, 王红梅, 赵 婷, 等. 阿曼托双黄酮通过JAK2-STAT3通路影响甲状腺癌SW579细胞的增殖和凋亡[J]. 中国肿瘤生物治疗杂志, 2023, 30(3):211-216.
MA T, WANG H M, ZHAO T, et al. Amentoflavone induces apoptosis and suppresses proliferation of thyroid carcinoma SW579 cells by inhibiting the activation of JAK2-STAT3 pathway[J]. Chinese Journal of Cancer Biotherapy, 2023, 30(3):211-216. (in Chinese)
[35] 施 姮, 舒芳芳. 连翘苷调控细胞因子信号转导抑制因子1对肺炎链球菌诱导的肺泡上皮细胞凋亡和氧化应激的影响[J]. 中国临床药理学杂志, 2023, 39(8):1142-1146.
SHI H, SHU F F. Effects of phillyrin on alveolar epithelial cell apoptosis and oxidative stress induced by Streptococcus pneumoniae by regulating suppressor of cytokine signaling 1[J]. The Chinese Journal of Clinical Pharmacology, 2023, 39(8):1142-1146. (in Chinese)
[36] XIAO C W, ZHANG W, HUA M M, et al. RNF7 inhibits apoptosis and sunitinib sensitivity and promotes glycolysis in renal cell carcinoma via the SOCS1/JAK/STAT3 feedback loop[J]. Cell Mol Biol Lett, 2022, 27(1):36.
[37] 谭慧心, 董彦宏, 关文辉, 等. 细胞周期调控与肿瘤发生和治疗的关系研究[J]. 哈尔滨商业大学学报(自然科学版), 2015, 31(6):667-670.
TAN H X, DONG Y H, GUAN W H, et al. Relation of cell cycle regulation with occurrence and treatment of tumor[J]. Journal of Harbin University of Commerce (Natural Sciences Edition), 2015, 31(6):667-670. (in Chinese)
[38] KIM M Y, PARK S J, SHIM J W, et al. Naphthazarin enhances ionizing radiation-induced cell cycle arrest and apoptosis in human breast cancer cells[J]. Int J Oncol, 2015, 46(4):1659-1666.
[39] CHEN S H, LUO T W, YU Q, et al. Isoorientin plays an important role in alleviating cadmium-induced DNA damage and G0/G1 cell cycle arrest[J]. Ecotoxicol Environ Saf, 2020, 187:109851.
[40] 彭胜建, 丁美胜, 赵世明, 等. 过表达细胞因子信号转导抑制因子2调控JAK2/STAT3通路抑制直肠癌细胞活性和移植瘤生长[J]. 重庆医科大学学报, 2023, 48(1):37-42.
PENG S J, DING M S, ZHAO S M, et al. Overexpression of SOCS2 on inhibition of rectal cancer cell growth activity and xenograft tumor growth by JAK2/STAT3 pathway[J]. Journal of Chongqing Medical University, 2023, 48(1):37-42. (in Chinese)
[41] 谢娜娜, 闫书平, 张崇昊, 等. 植物雌激素大豆黄酮对牛乳腺上皮细胞增殖及细胞周期的影响[J]. 动物营养学报, 2022, 34(4):2645-2653.
XIE N N, YAN S P, ZHANG C H, et al. Effects of phytoestrogen daidzein on proliferation and cell cycle of bovine mammary epithelial cells[J]. Chinese Journal of Animal Nutrition, 2022, 34(4):2645-2653. (in Chinese)
[42] 潘剑锋, 尚方正, 马 荣, 等. 周期蛋白和周期蛋白依赖性激酶及相关激酶抑制剂在细胞周期进程中的调控机制研究进展[J]. 生物工程学报, 2023, 39(4):1525-1547.
PAN J F, SHANG F Z, MA R, et al. Advances of the regulatory mechanism of cyclin, cyclin- dependent kinases and related kinase inhibitors in cell cycle progression[J]. Chinese Journal of Biotechnology, 2023, 39(4):1525-1547. (in Chinese)
[43] 范金柱, 郭云山, 任小宇, 等. AUF1负向调控p21对骨肉瘤细胞增殖和凋亡的影响[J]. 西部医学, 2023, 35(4):480-484, 489.
FAN J Z, GUO Y S, REN X Y, et al. The effect of AUF1 negatively regulating p21 on the proliferation and apoptosis of osteosarcoma cells[J]. Medical Journal of West China, 2023, 35(4):480-484, 489. (in Chinese)
[44] LEI T J, ZHANG P X, ZHANG X D, et al. Cyclin K regulates prereplicative complex assembly to promote mammalian cell proliferation[J]. Nat Commun, 2018, 9(1):1876.
[45] LI M, GAO P, ZHANG J P. Crosstalk between autophagy and apoptosis: potential and emerging therapeutic targets for cardiac diseases[J]. Int J Mol Sci, 2016, 17(3):332.
[46] OUYANG C H, YOU J Y, XIE Z L. The interplay between autophagy and apoptosis in the diabetic heart[J]. J Mol Cell Cardiol, 2014, 71:71-80.
[47] MARQUEZ R T, XU L. Bcl-2: Beclin 1 complex: multiple, mechanisms regulating autophagy/apoptosis toggle switch[J]. Am J Cancer Res, 2012, 2(2):214-221.
[48] HIRUNAGI T, SAHASHI K, TACHIKAWA K, et al. Selective suppression of polyglutamine-expanded protein by lipid nanoparticle-delivered siRNA targeting CAG expansions in the mouse CNS[J]. Mol Ther-Nucl Acids, 2021, 24:1-10.
[49] SHI L, HU H B, SUN P X, et al. RPL38 knockdown inhibits the inflammation and apoptosis in chondrocytes through regulating METTL3-mediated SOCS2 m6A modification in osteoarthritis[J]. Inflamm Res, 2022, 71(7-8):977-989.
[50] LALIER L, CARTRON P F, JUIN P, et al. Bax activation and mitochondrial insertion during apoptosis[J]. Apoptosis, 2007, 12(5):887-896.
(编辑 白永平)

