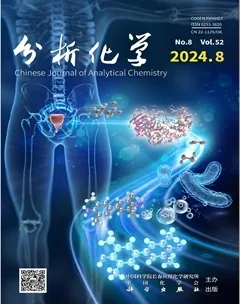
基于多聚腺嘌呤的二嵌段寡核苷酸探针用于卡那霉素可视化检测
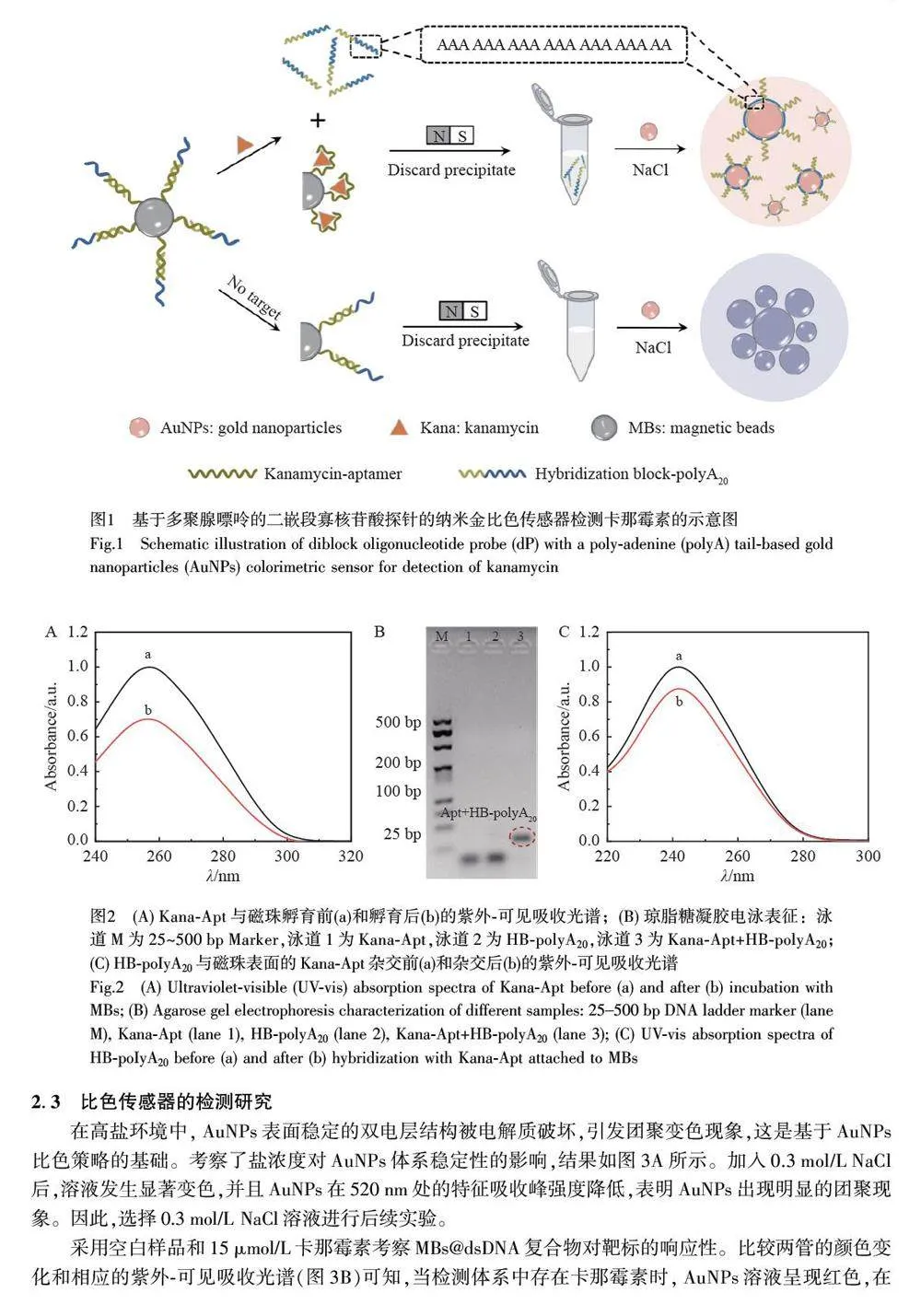
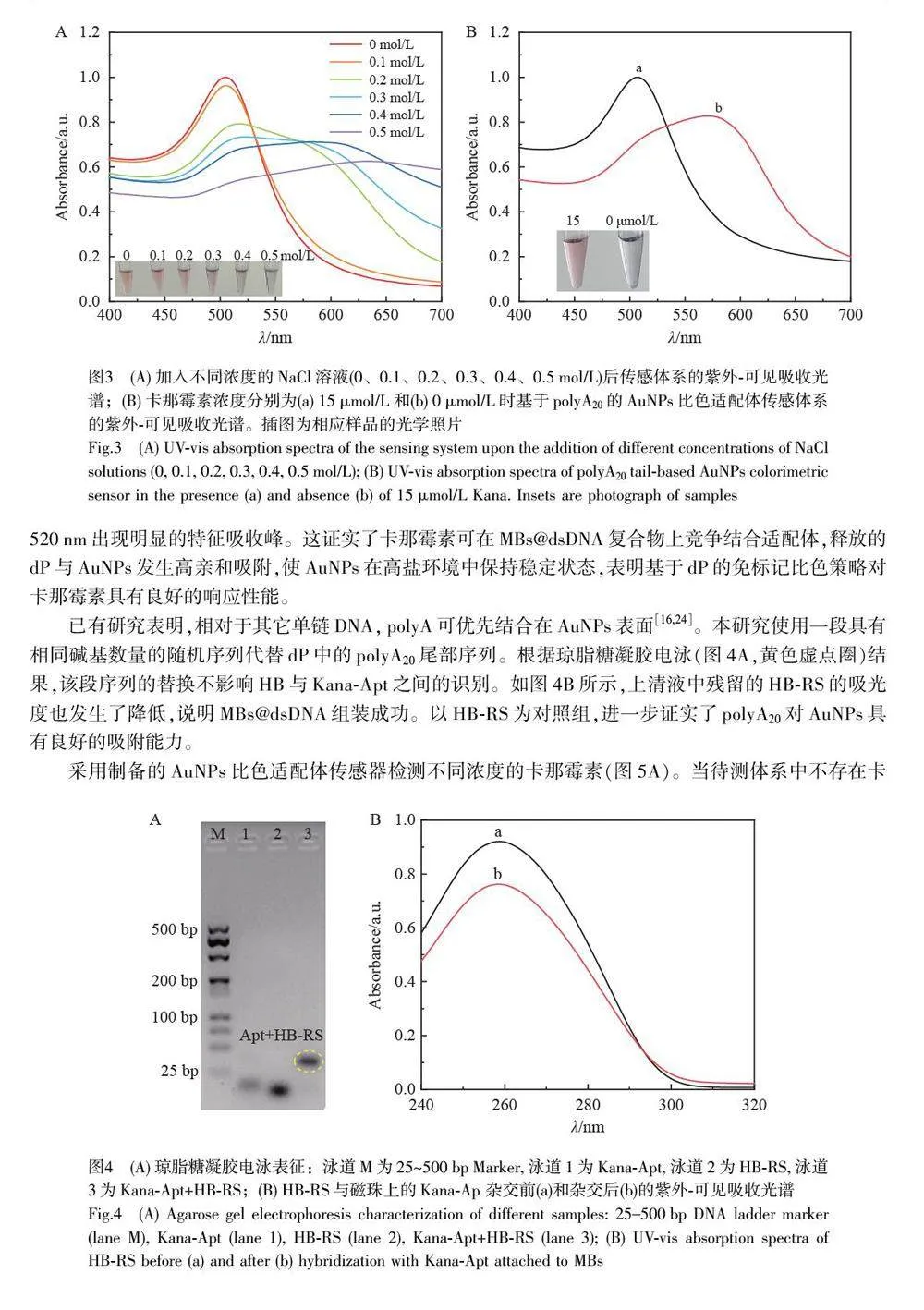


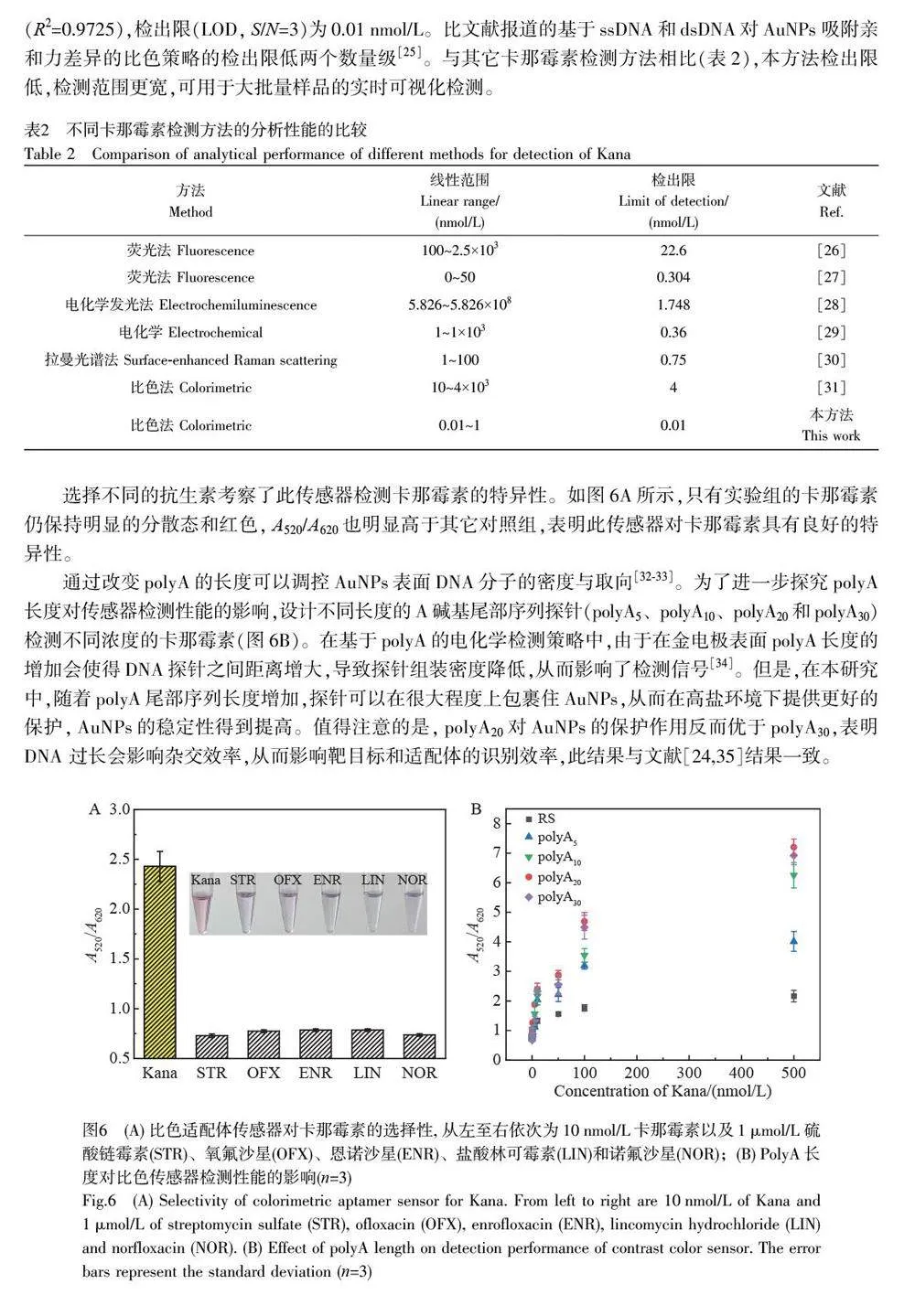


摘要 单链DNA(Single-stranded DNA, ssDNA)在未修饰的裸金纳米颗粒(AuNPs)上的吸附已成为基于核酸分子的比色分析的常用机制。本研究设计了一段包含多聚腺嘌呤(polyA20)尾部序列的二嵌段寡核苷酸探针(dP),构建了一种免标记的AuNPs 比色生物传感器用于检测卡那霉素(Kanamycin, Kana)。在卡那霉素存在的情况下,磁珠@双链DNA(MBs@dsDNA)复合物上的卡那霉素适配体序列(Kana-Apt)与其特异性结合,导致dP 从磁珠表面释放。由于polyA20 与AuNPs 之间有强吸附亲和力, dP 被吸附在AuNPs 表面,从而在高盐环境中保护AuNPs 不发生团聚。与具有相同碱基数量的随机序列(Random sequence, RS)相比,利用含有polyA20 尾部序列的AuNPs 比色策略对卡那霉素的检测灵敏度提高了2 个数量级。此比色传感器对卡那霉素的线性检测范围为0.01~1 nmol/L,检出限(LOD, S/N=3)为0.01 nmol/L。本方法无需大型仪器及其它信号放大策略,具有较高的灵敏度和特异性,适用于现场大批量样品的快速、可视化和实时检测,为其它抗生素以及影响食品安全的化学污染物的可视化检测提供了新思路。
关键词 卡那霉素;金纳米颗粒;核酸适配体;生物传感器;食品安全
卡那霉素(Kanamycin, Kana)是一种用于预防和治疗微生物感染的广谱氨基糖苷类抗生素,被用作农业和畜牧业中的饲料添加剂和兽药[1]。然而,滥用卡那霉素的现象屡见不鲜,导致其在动物源性食品中残留,进而经由食物链进入人体,通过积累效应危害公众健康[2]。我国国家标准《食品安全国家标准食品中农药最大残留限量》(GB 31650—2019)[3]规定了不同食品中卡那霉素的最大残留限量(Maximumresidue limits, MRLs),如牛奶中的MRL 为150 μg/kg,肌肉的MRL 为100 μg/kg。卡那霉素的检测方法主要包括色谱法[4]、酶联免疫吸附分析法[5]和毛细管电泳法[6]等。但是,大多数方法需要专业的操作人员和高精度仪器的支持,在现场实时检测和大批量筛查中的应用仍存在局限性。因此,建立简单、灵敏和低成本的卡那霉素检测方法对于保障食品安全和公众健康具有重要的现实意义。
目前,基于新型纳米材料构建的低成本、易小型化的生物传感器受到了广泛关注[7-8]。其中,比色生物传感器因其具有操作简单、成本低和可视化识别等特性而备受关注,在大批量样品的筛查方面显示出良好的应用潜能。金纳米颗粒(Gold nanoparticles, AuNPs)的合成简单且易于生物功能化,常作为比色生物传感器的关键元件[9-10]。此外, AuNPs 表现出与粒子间距相关的表面等离子体特性[11-12],为比色法的现场应用提供了优良的纳米检测平台。值得注意的是,单链DNA(Single-stranded DNA, ssDNA)和双链DNA(Double-stranded DNA, dsDNA)在未经修饰的AuNPs 上具有不同的吸附特性。由于ssDNA 具有柔性,更易吸附在AuNPs 上,而dsDNA 的刚性双螺旋结构使其在AuNPs 表面的吸附较差[13]。基于此原理的AuNPs 比色传感策略已被广泛应用于许多领域,特别是食品安全现场筛查和个人医疗保健中的即时检测(Point-of-care testing, POCT)[14-15]。尽管该类免标记比色法简便快速,但其主要依赖于ssDNA 对AuNPs 的吸附亲和力,导致检测灵敏度受限。不同的DNA 碱基与AuNPs 表面相互作用的方式不同[16]。已有研究证实,相比于随机序列的DNA,多聚腺嘌呤(Poly-adenine, polyA)对AuNPs 表现出更高的吸附亲和力[17-18],这种独特性质使得polyA 在生物分子编程、生物传感器和新型药物递送等研究领域得到了广泛应用[19-21]。然而,基于polyA 和AuNPs 之间高吸附亲和力的比色分析研究仍然较少[22]。
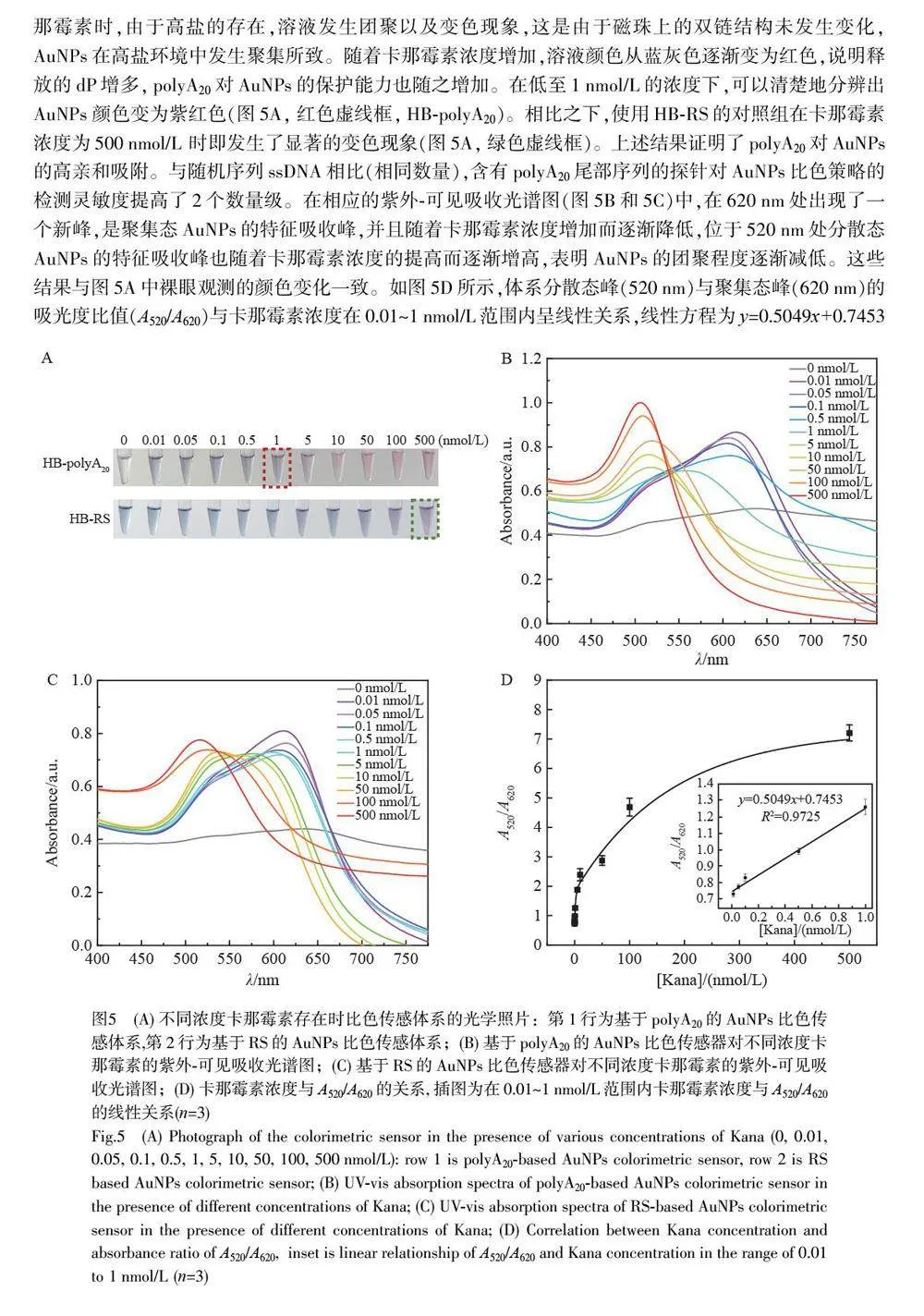
在传统AuNPs比色策略的基础上,本研究构建了一种基于二嵌段寡核苷酸探针(Diblock oligonucleotideprobe, dP)的免标记比色适配体传感器用于卡那霉素的检测。与含相同碱基数量的随机序列(Randomsequence, RS)相比,在不依赖任何信号放大技术的情况下,利用含有polyA20 尾部序列的AuNPs 比色策略对卡那霉素的检测灵敏度提高了2 个数量级,线性检测范围为0.01~1 nmol/L,检出限为0.01 nmol/L,并可实现裸眼检测,具有良好的特异性。本方法克服了比色传感器检测灵敏度低的问题,实现了卡那霉素的可视化灵敏检测。