数字化PCR芯片技术用于食源性细菌多重定量检测


摘要 食源性细菌可造成食物腐败变质并产生多种有害毒素,严重危害食品安全和人体健康。因此,开发食源性细菌有效的检测方法具有十分重要的意义。本研究提出了基于多重数字化聚合酶链式反应(PCR)芯片的分析方法,可对3 种常见食源性细菌(金黄色葡萄球菌(Staphylococcus aureus)、沙门氏菌(Salmonellatyphimurium)和单增李斯特菌(Listeria monocytogenes))进行快速且高效的检测。此芯片采用离心力驱动的数字化进样方式, 15 min 内即可完成数字化检测过程,操作简便。PCR 实验结果表明,经历25 个热循环后即可检出阳性信号。此芯片在低浓度细菌核酸定量检测方面具有显著优势,可有效避免假阴性结果。利用此芯片可对浓度为105~108 CFU/mL 的细菌样本进行多重检测。相比荧光定量PCR 技术,此芯片在分析低含量靶标时具有更高的准确度和灵敏度。
关键词 数字化芯片;多重聚合酶链式反应;金黄色葡萄球菌;沙门氏菌;单增李斯特菌
食品污染问题是当今世界上最广泛的卫生问题之一[1]。病原微生物是导致食品腐败变质的主要原因之一,可在保存不当的食品中过度繁殖而产生大量有害物质,严重危害人体健康,甚至导致死亡[2]。随着社会经济发展和消费者认知水平的提高,食品安全问题受到了广泛关注,这对食源性细菌(致病菌)的检测技术提出了更高的要求。金黄色葡萄球菌(Staphylococcus aureus)、沙门氏菌(Salmonella spp.)和单增李斯特菌(Listeria monocytogenes)是3 种常见的食源性细菌,在受到污染的肉类、蛋类、禽类、海产品、乳制品和蔬菜等食品中均能被检出,其随食物进入人体后可大量繁殖并释放多种毒性物质,从而威胁人体健康,如产生急性胃肠炎、肺炎、伪膜性肠炎、发热和恶心等症状[3-5]。更为严重的是,食物中有时可能存在两种或多种细菌。因此,构建高效的食源性细菌检测方法对于食品安全存储、预防食物中毒及不良反应的快速诊断都具有重要意义。
传统的平板培养法[6-8]是目前检测食源性细菌最常用的检测方法,该方法通常需要1~5 d 甚至更久,时效性较低,并且依赖于专业的操作人员和特定的工作环境,步骤繁琐,对多种细菌的同时检测难度较大。随着分子生物学检测技术日益成熟,目前已有多种方法用于食源性细菌的快速检测,如聚合酶链式反应(Polymerase chain reaction, PCR)、实时荧光定量PCR 技术[9]、核酸探针技术[10-11]和环介导等温扩增技术[12-14]等。其中,实时荧光定量PCR 技术因其快速、操作简单以及实验基础设施覆盖范围广等优点,在实际检测中被广泛使用。然而,该技术在低含量目标物检测[15]方面尚存在不足,存在假阴性信号。因此,开发一种检出速率快、成本低、灵敏度高以及可多通道检测的定量分析技术用于食源性细菌的分析检测对保障食品安全至关重要。
数字化PCR(Digital PCR, dPCR)技术[16]是一种被广泛认可的核酸定量检测技术。与实时荧光定量PCR 技术相比,数字化PCR 技术在核酸绝对定量方面具有显著优势,如具有更高的灵敏度和准确性[17-18]。该技术能够实现在多个微单元内同时进行PCR 扩增反应,并在反应结束后对扩增结果为阳性和阴性的单元数目进行统计分析[19],即可实现对原始样本中核酸浓度的绝对定量分析。该技术不依赖于循环阈值(Cycle threshold, Ct),也不需要参照已知浓度的标准品,是一种更直接有效的定量扩增检测技术。因此,数字化PCR 技术在癌症早期检测[20-21]、单细胞基因表达[22]和病原微生物检测[23-25]等生物医学领域具有广阔的应用前景。
微流体技术和微加工工艺的成熟促进了数字化PCR 技术朝着自动化和微型化的方向发展。根据工艺的不同,数字化PCR 技术可分为基于油包水的微滴数字化PCR(Droplet digital PCR)技术[26-30]和基于微流控芯片的芯片数字化PCR(Chip digital PCR)技术[31-34]。微滴数字化PCR 平台可以实现更高通量的数字化分析,因而具有更宽的动态检测范围。但是,微滴数字化PCR 平台依赖复杂昂贵的设备和较长的工作流程,导致测试成本增加,检测时间延长。此外,在液滴转移过程中可能发生交叉污染,也会影响检测结果。与微滴数字化PCR 平台相比,芯片数字化PCR 平台采用全封闭芯片结构,利用物理屏障将微单元隔开,不仅避免了操作过程中由于碰撞导致的液滴聚集,还可避免交叉污染和降低热循环过程中液滴融合的风险,进而确保绝对定量分析结果的准确性。
基于食源性细菌的多重检测需求和芯片数字化PCR 的技术优势,本研究构建了一种成本低、操作简单的多重微流控数字化PCR 芯片。此数字化PCR 芯片包括进样区、数字化阵列单元和废液存储区3 个功能区,其中,数字化阵列单元包含4 个平行模块,每个平行模块分布有2400 个微腔室,用于平行PCR 反应。芯片无需精密的注射泵和复杂的微阀控制进样,直接采用离心力驱动进样,一次加样和离心操作即可完成数字化进样,操作简单。与传统的荧光定量PCR 分析技术相比,此数字化PCR 芯片在针对低浓度细菌定量检测,特别是对金黄色葡萄球菌、沙门氏菌和单增李斯特菌3 种细菌同时检测方面具有明显优势。此芯片技术具有良好的实用性,有望成为食源性细菌多重定量检测的有效技术手段。
1 实验部分
1.1 仪器与试剂
URE-2000/35 光刻机(中国科学院光电研究所);PDC-002 等离子清洗机(美国Harrick Plasma 公司);SSNP-9600A 全自动核酸提取仪(江苏硕世生物公司);Nikon Ti2-E 荧光显微镜成像系统(日本尼康公司);96S 实时荧光定量PCR 仪(上海宏石公司);高速离心机(上海安亭公司);TC-EA 平板PCR 仪(杭州博日公司)。
聚二甲基硅氧烷(Polydimethylsiloxane, PDMS)和Sylgard 184固化剂(美国DowCorning 公司);SU8-2050 系列负光刻胶(美国Micro Chem 公司);三甲基氯硅烷(三氟-1,1,2,2-四氢辛基)和吐温-20(美国Sigma Aldrich 公司);SU8 显影剂(美国Kayaku Advanced Materials 公司);300 cst 和10 cst 硅油(麦克林公司);核酸提取试剂(江苏硕世公司);金黄色葡萄球菌核酸检测试剂和沙门氏菌、金黄色葡萄球菌、单增李斯特菌三重核酸检测试剂均购自深圳生科原公司;血琼脂平板(中国北京陆桥公司)和实验所用菌株:金黄色葡萄球菌(Staphylococcus aureus, S. aureus, ATCC25923)、鼠伤寒沙门氏菌(Salmonellatyphimurium, S. typhimurium, ATCC14028)和单增李斯特菌(Listeria monocytogenes, L. monocytogenes,ATCC19115)由苏州工业园区疾病防治中心检验科微生物室提供。
1.2 实验方法
1.2.1 数字化芯片的制备
根据PDMS 的微腔结构设计图纸,采用SU-8 标准湿刻法[35]制作芯片模板。首先在硅片基板上旋涂光刻胶,再移至烘胶台,分别于65 ℃加热2 min, 95 ℃加热5 min。硅片冷却后,移至URE-2000/35 光刻机校准台,覆盖光掩膜后曝光。曝光后的硅片再移至烘胶台,分别于65 ℃加热3 min、95 ℃加热6 min。硅片冷却后,用SU8 显影剂处理并用氮气吹干,最终得到干净的硅片模具。
将得到的硅片和50 μL 烷基化试剂置于干燥皿中,室温下抽真空,静置6 h。将PDMS 预聚物和固化剂以体积比10∶1 混匀,并利用真空泵脱气去除混合液中的气泡,获得PDMS 混合物。采用旋涂机在硅片模具上旋涂一层PDMS 混合物,并于70 ℃烘箱中固化。在固化后的PDMS 表面覆盖大小合适的玻片,并用PDMS 混合物进一步封装固化。取下固化后的PDMS,将非图案部分切掉,并用打孔器在进出样口部分打孔。将PDMS 和载玻片用等离子清洗机处理,再将二者键合封装。封装后的芯片在110 ℃烘箱内保温3 h, 得到实验用芯片。
1.2.2 细菌培养和核酸提取
分别挑取3 种细菌的标准菌株冻干磁珠1 颗于10 mL 营汤肉汤过夜培养。将复苏后的菌液分别接种于3 个血琼脂平板:金黄色葡萄球菌和鼠伤寒沙门氏菌在36 ℃培养箱中培养24 h;单增李斯特菌在36 ℃培养箱中培养48 h。分别挑取单个新鲜菌落用无菌生理盐水稀释,并充分混匀,采用麦氏比浊仪调整浊度至0.5 McF(约相当于细菌浓度1.5×108 CFU/mL)。将108 CFU/mL 菌液稀释10 倍,获得一组4 个梯度密度的细菌悬液,每种菌每个稀释浓度取200 μL, 上机30 min 完成核酸提取。
1.2.3 荧光定量PCR实验
金黄色葡萄球菌的荧光定量PCR 反应体系包括:0.5 μL 聚合酶、15.5 μL PCR 反应液、1 μL 核酸和1 μL 10% 吐温-20。PCR 反应参数为:UNG 处理50 ℃, 2 min;预变性95 ℃, 3 min;PCR 扩增每个循环为95 ℃、5 s 和55℃、60 s;40 个循环。沙门氏菌和单增李斯特菌的PCR 反应体系和参数以及3 种组分的多重PCR 按同样方法完成。采用无菌生理盐水作为阴性对照样本。
1.2.4 芯片上的数字化样品加载
采用移液器将1.2.3 节得到的PCR 反应溶液(18 μL)和硅油(10 cst, 40 μL)依次加入芯片的进样口,将芯片放入改装后的离心机托盘中固定,以2000 r/min 运行15 min, 完成数字化样品加载。数字化加样完成后,在芯片的进样口和出样口充注硅油(300 cst)封闭微腔,以防止PCR 过程中低粘度硅油挥发。
1.2.5 数字化芯片检测
首先测试金黄色葡萄球菌在1×100、1×10‒1、1×10‒2 和1×10‒3 不同稀释度下的PCR 扩增结果。将含有不同浓度靶标核酸的PCR 反应溶液注入数字化芯片,完成数字化加载后移至芯片反应器(配备平板加热装置),按照1.2.3 节的PCR 反应条件运行扩增程序。采用无菌生理盐水作为阴性对照。每个实验重复3 次。采用荧光显微镜(尼康-Ti2)获取荧光图像。采用Image J 软件处理采集的荧光照片数据,调整合适的阈值以区分阳性孔和阴性孔并计数,根据泊松分布统计目标核酸的浓度。FAM 荧光染料用于指示金黄色葡萄球菌单重PCR 结果;FAM、VIC 和CY5 荧光染料分别指示沙门氏菌、单增李斯特菌和金黄色葡萄球菌的三重PCR 结果。
2 结果与讨论
2.1 微芯片结构表征
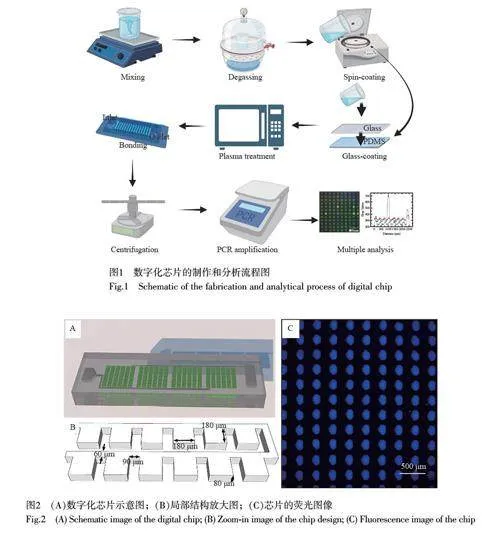
数字化芯片制作和分析流程图如图1 所示。本研究采用玻片-PDMS-玻片“三明治”结构,夹在两个玻片之间的PDMS 薄膜厚度(旋涂厚度)约为0.3 mm, 可以最大限度减少PCR 热循环过程中的水分丢失。此芯片设计为单层模板结构,可显著降低模具的制作难度。每个数字化芯片(图2A)分为4 个平行模块,每个模块含有2400 个微腔阵列,因此,单个样品数字化后将被分割为9600 个独立微腔室,进样口、阵列微室和储液腔通过微通道连接。如图2B 所示,芯片微腔的长和宽均为180 μm, 高度为80 μm。微孔之间的间距为90 μm,通过60 μm宽的通道相连接。芯片制备可预先完成,包括制作模板、等离子处理和键合等步骤。数字化PCR 检测过程,包括提取核酸、离心加样、PCR 扩增和分析,共需3 h。
芯片的工作原理是通过离心产生的驱动力推动进样口内的液体进入芯片。实验采用密度小于水的不混溶相,在进样口中, PCR 反应液(水相)位于底层并优先进入芯片阵列区结构。待水相全部进入数字化阵列区后,油相也随之进入阵列区,最终充满通道,并将微腔室内的水相隔离,以确保后续的数字化扩增反应。
为验证芯片的数字化分析性能,本研究首先采用FAM 染料水溶液和硅油模拟数字化结果。在进样口加入模拟的水样品和硅油后,装载芯片,通过离心驱动液体进入芯片微腔。由于硅油比重(0.96 g/mL,25 ℃)小于水相,因此,在进样口中油相位于上层,水相位于下层,水相优先进入芯片微腔室,然后硅油进入芯片,并将微腔室的水相隔离。图2C 为数字化过程结束后局部芯片阵列结构的荧光图像,结果表明,水相只在微腔室内存在,微腔中的模拟水样品可以被硅油完全隔离开。因此,此设计可进一步用于后续的食源性细菌核酸数字化分析的实验。
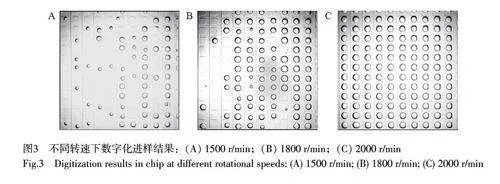
芯片采用离心力驱动液体数字化过程。图3 展示了不同离心转速下芯片微腔室内的加载分配情况。在选定的转速范围内,在较高的转速下,液体受到的离心力越大,进入微腔室的水相体积越多,越有利于完整的数字化过程。由于等离子处理后的玻璃和PDMS 表面均为亲水性,本实验中的水相会直接接触芯片内壁。为避免水相在微通道壁残留,本研究采用将芯片置于鼓风干燥箱中进行热处理的方式将亲水内表面转变为疏水表面。图4 为数字化芯片键合后在110 ℃烘箱中处理不同时间的油水界面图,根据两相在PDMS 表面的接触角可以判断出,在热烘3 h 后芯片表面转变为疏水表面。
2.2 荧光定量PCR 检测金黄色葡萄球菌、单增李斯特菌和鼠伤寒沙门氏菌
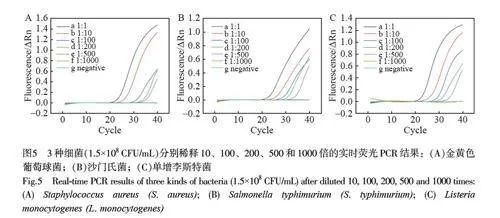
常规实时荧光定量PCR 分析技术中,通常在Ct 值为15~35 时才有定量分析参考价值。在痕量核酸检测体系中,在35 个扩增循环后才会出现明显的识别信号,这导致其与假阴性信号难以区分。数字化分析技术对于低浓度核酸的定性和定量检测具有独特优势。为验证本研究设计的数字化芯片的检测性能,首先利用荧光定量PCR 技术分别对3 种不同浓度的目标细菌核酸进行扩增实验。如图5 所示, 3 种细菌低倍稀释后,其提取核酸的扩增曲线(a~d)可以较好地进行定性和定量分析;然而,高倍稀释后(e~f),扩增曲线的Ct 值均为35 或者更大,临床结果参考价值较低。例如,金黄色葡萄球菌、沙门氏菌和单增李斯特菌样本稀释500 倍时,得到的Ct 值分别为37.52、36.56 和36.65;当3 种细菌稀释1000 倍时,均已无法得到Ct 值,根据试剂盒说明书指导,结果判定为阴性。上述结果表明,此技术在检测低丰度靶标时可能存在假阴性,难以实现定量分析。
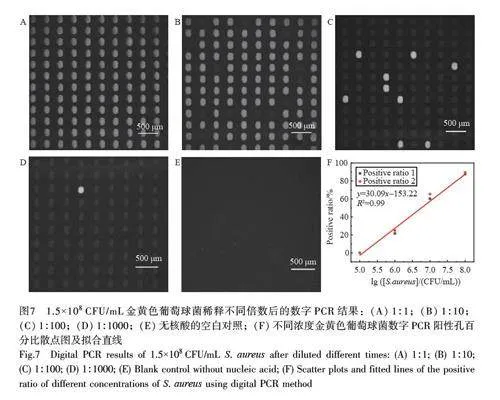
将已知浓度的金黄色葡萄球菌样品稀释1000 倍后,采用此数字化芯片进行分析,并进行不同时长的PCR 扩增反应,观测芯片内的荧光信号变化(图6)。在经历25 个扩增循环后,其中一些微腔显示出可识别的荧光信号。当扩增反应延长至40 个循环后,阳性微腔内的荧光信号略有增强,但其数目占总腔室数目(阳性孔/(阳性孔数目+阴性孔数目))的比值未发生变化,表明此数字化芯片内的扩增反应在经历25 个循环后即可以准确显示阳性结果。进一步利用此数字化芯片对不同稀释倍数的样本进行分析,如图7 所示,不同阳性微孔的数目对应不同的靶标浓度。由图7A 可见,当待测核酸浓度过高时,此芯片仅适用于定性检测,不适用于定量分析(单个微腔室内可能出现多于一个的拷贝数);当待测核酸浓度较低时,芯片展现出较高的分析效率和分析准确度。例如,当金黄色葡萄球菌稀释1000 倍时,依然可以准确地识别并给出阳性结果。空白对照结果(图7E)表明,此芯片分析平台可以有效避免污染和假阳性结果。如图7F 所示,利用此芯片可对浓度为105~108 CFU/mL 的细菌样本进行多重检测,并且具有较好的线性关系,表明此芯片适用于对低浓度靶标的定量检测。
2.3 数字化芯片多重定量分析
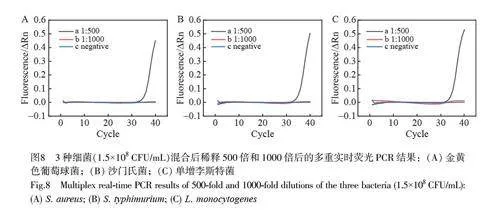
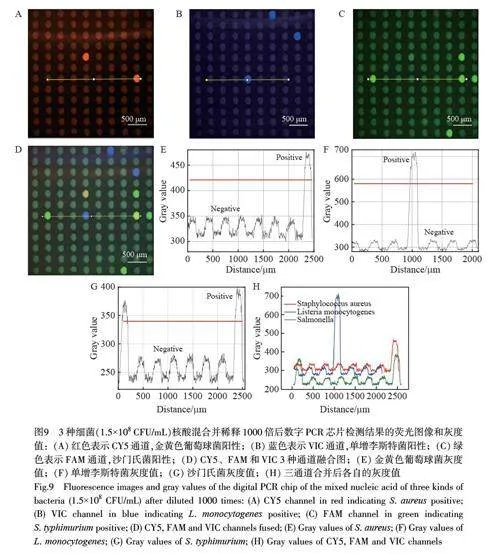
在日常检测中经常会有几种细菌共存于一个样品的情况。因此,多重食源性细菌的检测更具有实际意义。为验证本研究设计的芯片的多重检测能力,考察了此芯片对稀释不同倍数的金黄色葡萄球菌、沙门氏菌和单增李斯特菌混合样品的检测性能,并与荧光定量PCR 结果进行比较。3 种致病菌的荧光定量PCR 扩增曲线如图8 所示,将样本稀释500 倍时, 3 种致病菌扩增曲线的Ct 值分别为36.83、36.01和36.04;将样本稀释1000 倍后,均无法测得Ct 值。因此,荧光定量PCR 技术不适用于该浓度范围内的核酸检测。图9为数字化芯片对3 种致病菌混合样本稀释1000 倍后的分析结果。3 个荧光通道(分别对应红、蓝、绿3 种颜色)分别对应3 种细菌(图9A~9C)。通过对选区微腔室的灰度值进行计算,如图9E~9G 所示, 3 种细菌的阳性和阴性灰度值的比值分别约为4、9 和3 倍。当对应的灰度值阈值分别设置为420、580 和340 时,可以对此芯片上所有微腔室的荧光结果进行有效统计。结果表明, 3 种细菌在多重PCR 实验条件下依然可通过微腔室之间的荧光强度差异而被准确识别。即使单个微腔室中存在两种以上不同种核酸时,阳性荧光信号依然可以被准确区分(图9D)。因此,本研究设计的数字化芯片在低丰度食源性细菌的多重定性检测方面具有应用潜力。
3 结论
设计了一种基于微流控芯片的数字化PCR 分析装置,成功实现了3 种食源性细菌的高灵敏检测。利用离心进样方法, 15 min 即可完成样品加载,操作简便。与传统的荧光定量PCR 技术相比,此芯片在定量检测低浓度核酸靶标时具有显著优势,同时在多重细菌检测方面也具有优异的性能。然而,此技术也存在一些需要改进之处,如核酸检测依然需要先提取核酸再进行分析,后续研究将进一步对芯片结构和性能进行优化,以实现无提取、直接扩增的分析策略;本研究采用PDMS 制作芯片不利于商业化产品的开发和应用推广,后续研究将继续探索塑料等芯片的制备技术,以推进此数字化PCR 技术在食品安全领域的实际应用。
References
[1] FUNG F, WANG H S, MENON S. Biomed. J. , 2018, 41(2): 88-95.
[2] GALLO M, FERRARA L, CALOGERO A, MONTESANO D, NAVIGLIO D. Food Res. Int. , 2020, 137: 109414.
[3] DA SILVA A C, RODRIGUES M X, SILVA N C C. Braz. J. Microbiol. , 2020, 51(1): 347-356.
[4] COLLINS J P, SHAH H J, WELLER D L, RAY L C, SMITH K, MCGUIRE S, TREVEJO R T, JERVIS R H, VUGIA D J,RISSMAN T, GARMAN K N, LATHROP S, LACLAIR B, BOYLE M M, HARRIS S, KUFEL J Z, TAUXE R V, BRUCE BB, ROSE E B, GRIFFIN P M, PAYNE D C. MMWR-Morb. Mortal. Wkly. Rep., 2022, 71(40): 1260-1264.
[5] MOURA A, LEFRANCQ N, WIRTH T, LECLERCQ A, BORGES V, GILPIN B, DALLMAN T J, FREY J, FRANZ E,NIELSEN E M, THOMAS J, PIGHTLING A, HOWDEN B P, TARR C L, GERNER-SMIDT P, CAUCHEMEZ S, SALJE H,BRISSE S, LECUIT M. Sci. Adv. , 2021, 7(49): eabj9805.
[6] GB/T 4789.10—2016. Detection of Food Microorganisms of Staphylococcus aureus. National Standards of the People′s Republic of China.
食品微生物学检验金黄色葡萄球菌检验. 中华人民共和国国家标准. GB/T 4789.10—2016.
[7] GB/T 4789.4—2016. Detection of Food Microorganism of Salmonella. National Standards of the People′s Republic ofChina.
食品微生物学检验沙门氏菌检验. 中华人民共和国国家标准. GB/T 4789.4—2016.
[8] GB/T 4789.30—2016. Detection of Food Microorganism of Listeria monocytogenes. National Standards of the People′s Republic of China.
食品微生物学检验单核细胞增生李斯特氏菌检验. 中华人民共和国国家标准. GB/T 4789.30—2016.
[9] CHIN N A, SALIHAH N T, SHIVANAND P, AHMED M U. J. Food Sci. Technol. , 2022, 59(12): 4570-4582.
[10] LIU Y, CAO Y, WANG T, DONG Q, LI J, NIU C. Front. Microbiol. , 2019, 10: 222.
[11] BAI X, WANG K, CHEN L, ZHOU J, WANG J. J. Mater. Chem. B, 2022, 10(33): 6248-6262.
[12] XIE C, CHEN S, ZHANG L, HE X, MA Y, WU H, ZOU B, ZHOU G. Anal. Bioanal. Chem. , 2021, 413(11): 2923-2931.
[13] WANG J, STAHELI J P, WU A, KREUTZ J E, HU Q, WANG J, SCHNEIDER T, FUJIMOTO B S, QIN Y, YEN G S,WENG B, SHIBLEY K, HAYNES H, WINER R L, FENG Q, CHIU D T. Anal. Chem. , 2021, 93(6): 3266-3272.
[14] KREUTZ J E, WANG J, SHEEN A M, THOMPSON A M, STAHELI J P, DYEN M R, FENG Q, CHIU D T. Lab Chip,2019, 19(6): 1035-1040.
[15] LI D, WANG D, DONG J, WANG N, HUANG H, XU H, XIA C. Korean J. Radiol. , 2020, 21(4): 505-508.
[16] TAN L L, LOGANATHAN N, AGARWALLA S, YANG C, YUAN W, ZENG J, WU R, WANG W, DURAISWAMY S. Crit.Rev. Biotechnol. , 2022, 43(3): 433-464.
[17] SALIPANTE S J, JEROME K R. Clin. Chem. , 2020, 66(1): 117-123.
[18] XIA L, ZHUANG J, ZOU Z, YIN J, MU Y. Talanta, 2022, 237: 122977.
[19] YEN G S, FUJIMOTO B S, SCHNEIDER T, KREUTZ J E, CHIU D T. J. Am. Chem. Soc. , 2019, 141(4): 1515-1525.
[20] WANG Y, GAO W, WU M, ZHANG X, LIU W, ZHOU Y, JIA C, CONG H, CHEN X, ZHAO J. Talanta, 2021, 225: 122057.
[21] BAI Y, QU Y, WU Z, REN Y, CHENG Z, LU Y, HU J, LOU J, ZHAO J, CHEN C, MAO H. Biosens. Bioelectron. , 2019,142: 111523.
[22] THOMPSON A M, GANSEN A, PAGUIRIGAN A L, KREUTZ J E, RADICH J P, CHIU D T. Anal. Chem. , 2014, 86(24):12308-12314.
[23] WANG J, KREUTZ J E, THOMPSON A M, QIN Y, SHEEN A M, WANG J, WU L, XU S, CHANG M, RAUGI D N, SMITH R A, GOTTLIEB G S, CHIU D T. Lab Chip, 2018, 18(22): 3501-3506.
[24] MONTEIRO S, SANTOS R. PLoS One, 2017, 12(7): e0179985.
[25] HE Hao-Yan, HUANG En-Qi, LI Zhu-Jun, SHU Bo-Wen, XU Bang-Lao, LIU Da-Yu. Chin. J. Anal. Chem. , 2020, 48(7):855-862.
何浩延, 黄恩奇, 黎柱均, 舒博文, 徐邦牢, 刘大渔. 分析化学, 2020, 48(7): 855-862.
[26] HAN Y, WANG J, ZHANG S, YANG S, WANG X, HAN Y, SHEN Z, XU X. Food Microbiol. , 2022, 103: 103933.
[27] CHEN Z, LIAO P, ZHANG F, JIANG M, ZHU Y, HUANG Y. Lab Chip, 2017, 17(2): 235-240.
[28] XU P, ZHENG X, TAO Y, DU W. Anal. Chem. , 2016, 88(6): 3171-3177.
[29] SEKI Y, FUJIWARA Y, KOHNO T, TAKAI E, SUNAMI K, GOTO Y, HORINOUCHI H, KANDA S, NOKIHARA H,WATANABE S, ICHIKAWA H, YAMAMOTO N, KUWANO K, OHE Y. Oncologist, 2016, 21(2): 156-164.
[30] FAN Yi-Qiang, WANG Mei, GAO Feng, ZHUANG Jian, TANG Gang, ZHANG Ya-Jun. Chin. J. Anal. Chem. , 2016, 44(8):1300-1307.
范一强, 王玫, 高峰, 庄俭, 唐刚, 张亚军. 分析化学, 2016, 44(8): 1300-1307.
[31] ZHOU S, GOU T, HU J, WU W, DING X, ANG W, HU Z, MU Y. Biosens. Bioelectron. , 2019, 128: 151-158.
[32] DAWN E C, THOMAS S, MICHELLE W, DANIEL T C. Anal. Chem. , 2010, 82(13): 5707-5717.
[33] ZHOU L, ZHUANG G, LI G. Sens. Actuators, B, 2018, 261: 364-371.
[34] YIN J, ZOU Z, YIN F, LIANG H, HU Z, FANG W, LV S, ZHANG T, WANG B, MU Y. ACS Nano, 2020, 14(8): 10385-10393.
[35] LI C, WANG X, XU J, MA B. Analyst, 2020, 145(21): 6813-6820.

