基于活细胞的微生物砷离子传感器的性能拓展与优化



摘要 在全细胞微生物传感器的开发中,细胞的代谢活性状态和信号输出形式等因素会直接影响传感器的稳定性和可重复性等性能,给传感器的应用开发中标准化方法的建立带来了挑战。本研究选择基于Replication protein L(RepL)信号放大器的砷离子传感器为研究对象,探究了不同条件对砷离子传感器的检测性能的影响。研究结果表明,细胞的培养环境、生长状态(如不同的生长期)、报告子的类型以及诱导时长等均会对砷离子传感器的检测性能产生显著影响。传感器在不同培养基中的稳定性差别较大,其中在LB培养基中展现出更高的稳定性。同时,不同生长期的细胞也展现出不同的检测性能优势:在平台生长期的细胞中,传感器的检测灵敏度和线性度更佳;在对数期的细胞中,检出限更低。此外,传感器的响应存在最优的诱导时长,过长或过短的诱导时间都会影响传感器的响应,本研究中砷离子传感器的最佳诱导时间约为2~3 h。通过对3 种荧光蛋白报告子的对比研究发现,荧光蛋白的选取对传感器检出限的影响不大(均在5~10 μg/L 范围内),但会显著改变传感器的响应时间(从40 min 到2 h);同时,荧光蛋白的发光亮度越高,传感器响应越快。本研究结果表明,可以根据不同的需求选取不同状态的细胞,以最大限度优化细胞传感器的检测性能,拓展传感器的应用空间。本研究结果为微生物传感器在实际检测中的应用提供了可靠的依据。
关键词 砷离子微生物传感器;培养基;细菌生长阶段;荧光蛋白报告基因;响应时间
近年来,得益于合成生物学的迅猛发展[1],越来越多的微生物细胞活体传感器被开发出来[2]。这些微生物传感器通过在细胞膜上或细胞质中引入受体蛋白,使其能够与特定的化学物质或重金属离子结合[3]。然后,通过信号传导级联效应[4-5],最终改变报告基因的转录活性,实现长期检测。与传统的化学和生化检测方法不同,合成生物学的微生物传感器检测方法直接涉及活细胞内的基因表达活动。鉴于活细胞生物传感器的信号输出依赖于细胞一系列的生理过程,尽管微生物传感器能够实现比传统检测方法更低的检出限或更高的灵敏度,但由于基因表达过程的复杂性,如转录和翻译过程,影响其检测结果的变量远多于传统的检测方法。
目前,大多数微生物活细胞传感器的研究侧重于特定分子环路的设计以及对环路元件等细节的优化,通常忽视了微生物本身的生理状态对用于检测的分子环路的信号输出可能产生的影响。同时,基因表达在不同阶段的调控会在一定程度上影响微生物传感器的稳定性,也为微生物传感器实际检测中标准化方法的建立提出了严峻的挑战。考虑到上述因素的复杂性和多样性,并处于实时动态变化之中,无法通过控制变量的方式逐一研究其对设计的分子环路的影响,因此,可以将微生物的宏观表型,如生长速度和生理状态等,作为这些因素的总和,并将其作为单一变量,测试其对微生物传感器的影响。同时,通过改变输出信号端的报告基因,可以研究输入信号端和输出信号端之间的关系,以降低这些宏观因素对微生物传感器的影响,从而为进一步优化微生物传感器的检测性能提供切实可行且简便的方法。
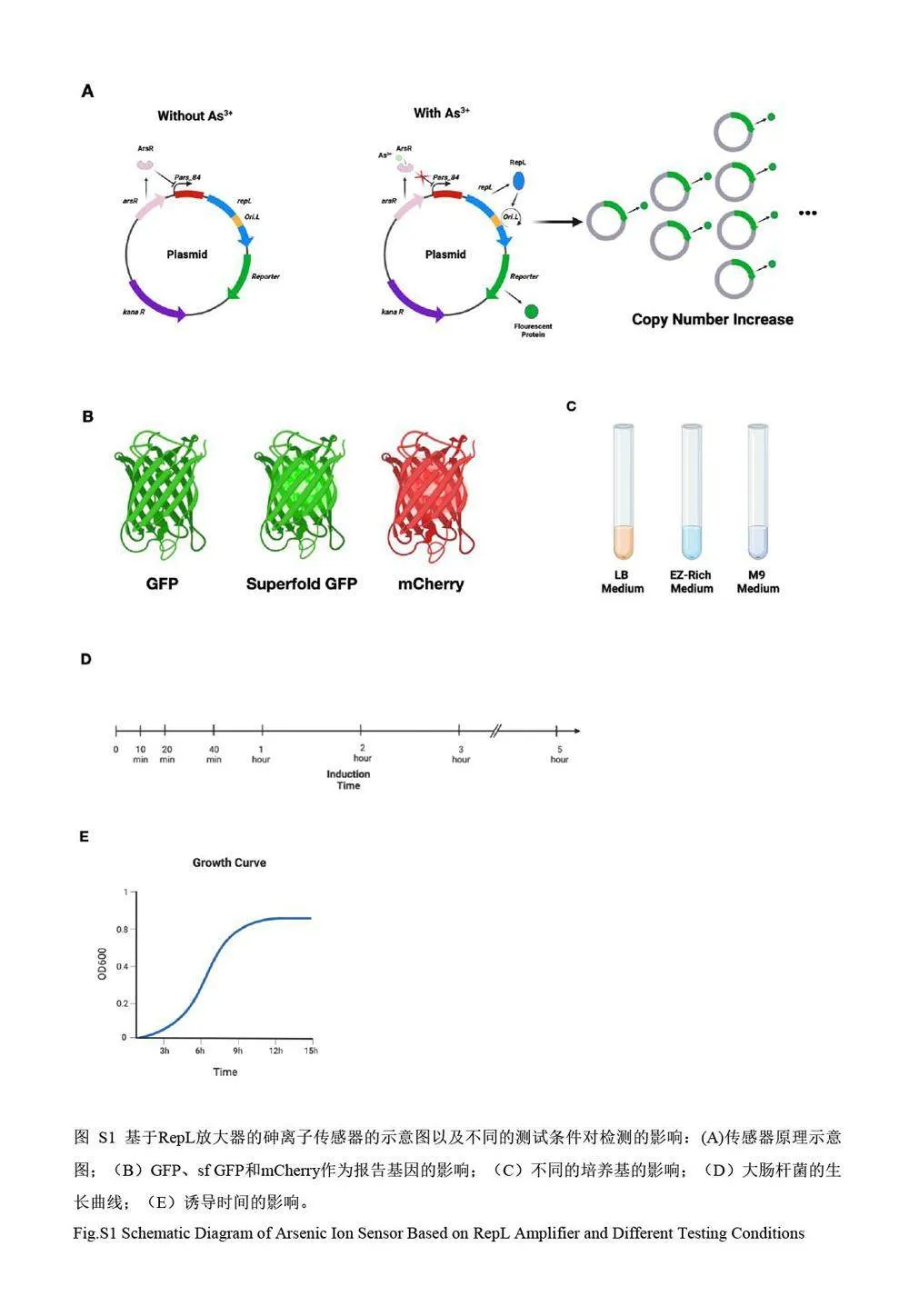
本研究利用基于Replication protein L(RepL)信号放大器[6-8]的砷离子传感器作为研究对象,对影响微生物传感器性能的参数进行了详细研究。Rep L 是噬菌体P1 DNA L 复制子(Replicon L)内部的一个长度为281 个氨基酸的开放阅读框编码蛋白质。在裂解周期(Lytic cycle)内,该蛋白可与L 复制子相互作用,完成噬菌体DNA 的复制,从而实现噬菌体增殖[9]。由于Rep L 基因位于As3+诱导表达的启动子之后,因而可以通过改变As3+浓度实现对Rep L 蛋白的表达控制;Rep L 蛋白可与位于其DNA 序列内的复制起始位点OriL 结合,调控工作质粒的拷贝数,通过基因数目的扩增实现As3+响应信号的放大(示意图见电子版文后支持信息图S1)。通过对3 组以不同荧光蛋白作为输出信号的细胞传感器进行对比测试,考察了不同的信号输出形式和操作条件对传感器性能的影响。
1 实验部分
1.1 仪器、材料与试剂
Arhat 96 梯度PCR 仪(莫纳生物科技有限公司);SPARKTM 多功能微孔板检测仪(瑞士TECAN 公司);Sigma 3K15 台式高速离心机(德国Sigma 公司);NanoDropTMOne/OneC 微量紫外可见光分光光度计(美国赛默飞世尔科技公司);PTX-JA210S 分析天平(华志电子科技有限公司);IS-RSDS 恒温振荡器(美国CRYSTAL 公司);D1008E 掌上离心机(大龙兴创实验仪器股份公司);Micro Pulser 电穿孔仪(美国BIO RAD 公司)。
质粒pMT012[10]和pMT018[10]由本实验室在前期工作中构建, pASQ_mCherry 质粒是以pMT012 为载体改造而来(具体构建过程见电子版文后支持信息)。分别将以上3 个质粒通过热激的方法转化至DH5α的化学感受态细胞中,得到3 种细胞传感器菌株DH5α(pMT012)、DH5α(pMT018)和DH5α(pASQ_mCherry),将3 种菌株细胞于–80 ℃冻存,待用。
SalI(1080S)和SphI(1246S)Restriction Enzyme(宝日医生物技术(北京)有限公司);DpnI RestractionEndonuclease(美国New England Biolabs 公司);T4 DNA ligase(EL0011)、GeneJET Plasmid MiniPrep Kit(K0502)、GeneJET PCR Purification Kit(K0702)和GeneJET Gel Extration Ki(K0691)(美国赛默飞世尔科技公司);2 × Phanta Flash Master Mix PCR kit(P510,南京诺唯赞生物科技股份有限公司);As3+标准溶液(分析纯,北京谱析标准技术有限公司);氨苄青霉素储存液(100 mg/mL, A1170)、硫酸卡那霉素(K1030)、胰蛋白胨OXOID(LP0042K)、琼脂粉(A8190)、酵母提取物(Y8020)和DH5α感受态细胞(C1100)(北京索莱宝科技有限公司);1×PBS 缓冲液(G4202-100ML,武汉塞维尔生物科技有限公司);PCR 引物pASQ vet F(5′-GCGTCGACATATTTTCCTCCTGGAAAGCTTCATTAC-3′)、pASQ vct R(5′-ACGCGCATGCTAACGACTCAGGCTGCTACTG-3′)、pASQ mCherry F(5′-GCGTCGACATGGTGAGCAAGGGCGAGGAGGATAAC-3′)和pASQ mCherry R(5′-ACGCGCATGCTTACTTATACAGCTCGTCCATGCCGCCGGT-3′)(吉林省库美生物科技有限公司)。如无特殊说明,实验用水均为去离子水。
1.2 实验方法
1.2.1 基于不同报告子和培养基条件的测试
将–80 ℃冻存的DH5α(pMT012)、DH5α(pMT018)和DH5α(pASQ_mCherry)菌株取出,分别在含有卡那霉素的琼脂平板上划线,于37 ℃恒温箱中培养过夜以获取单克隆。第2 天,分别从培养平板上挑取3 种菌株的单克隆,接种到含有硫酸卡那霉素的5 ml LB 液体培养基中, 37 ℃恒温摇床(250 r/min)培养过夜。测定3 种菌液在600 nm 的光密度(OD600)值,然后分别稀释、转接到2 mL 新鲜的LB 培养基、EZ-Rich 培养基和M9 培养基中,至OD600≈0.01, 37 °C 恒温摇床(250 r/min)培养2~3 h,直到菌液的OD600≈0.4,即大肠杆菌处于指数/对数生长期。取适量As3+标准储存液分别添加到上述菌液中,使As3+终浓度分别为0、0.1、0.5、1.0、5.0、10、30、50、80 和100 μg/L,继续培养5 h,使菌株在As3+刺激下产生响应。
1.2.2 基于细菌不同生长状态的测试
在琼脂平板上挑选pMT012、pMT018 和pASQ_mCherry 的单克隆菌落,加入到含有硫酸卡那霉素的LB、EZ-Rich和M9液体培养基中, 37 ℃恒温摇床(250 r/min)培养过夜。对于迟滞期(Lag phase)与平台期(Stationary phase)进行的诱导实验,分别将上述过夜培养的菌液在新鲜培养基中稀释至OD600≈0.01 和1,并按照预先设定的As3+浓度梯度加入As3+标准储存液, 37 ℃恒温摇床(250 r/min)培养5 h, 取出样本测试其荧光强度。对数期诱导实验的实验过程和条件与1.2.1 节相同。
1.2.3 基于不同诱导时长的测试
首先在pMT012、pMT018 和pASQ_mCherry 琼脂平板上挑取单个菌落,接种到含硫酸卡那霉素的LB 液体培养基中, 37 ℃恒温摇床(250 r/min)培养过夜。分别在新鲜的LB、EZ-Rich 和M9 液体培养基中稀释至OD600≈0.01,继续培养2~3 h, 或者至菌液的OD600≈0.4。然后,加入适量的As3+标准液至其终浓度为10 μg/L, 继续诱导培养。在诱导的第10 min、20 min、40 min、1 h、2 h、3 h 和5 h 的时间点分别取出相应的菌液,进行后续的测试。
1.2.4 荧光测试
每种测试条件下的细菌菌液各取出500 μL, 以13000 r/min 离心1 min, 弃上清液,收集菌体;加入500 μL PBS 缓冲液进行洗涤, 13000 r/min 离心1 min,弃上清液;采用适量的PBS 缓冲液重悬细菌细胞,使细菌终浓度为OD600≈0.2~0.8。
取200 μL 重悬菌液加入到96 孔板中,使用酶标仪测定不同条件下细菌的OD600 和荧光强度值,以PBS 缓冲液作为对照。对于GFP 和sfGFP,激发波长为475 nm,检测515 nm 处的荧光强度值作为输出信号。对于mCherry,激发波长为560 nm, 检测610 nm 处的荧光强度值作为输出信号。各实验均进行3 组平行实验。
2 结果与讨论
2.1 不同培养基条件下As3+的响应
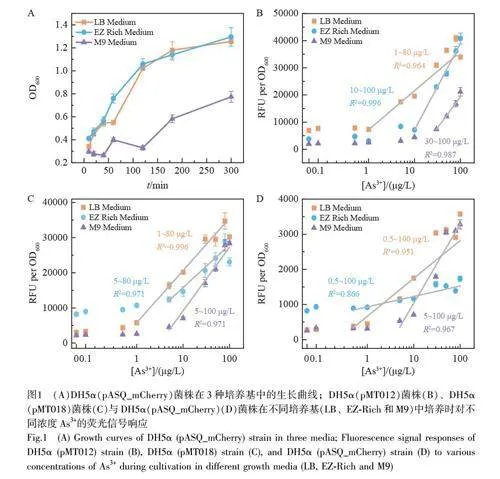
对比了3 种菌株(DH5α(pMT012)、DH5α(pMT018)和DH5α(pASQ_mCherry))在3 种培养基(LB、M9 和EZ rich)中对不同浓度As3+的响应。图1A 为DH5α(pASQ_mCherry)菌株在3 种培养基中的生长曲线,细胞在M9 中的生长速度远低于另外两种培养基,因为M9 是贫乏培养基,细胞在其中生长速度较慢;在丰富培养基LB 和EZ-Rich 中细胞均展现出较快的生长和繁殖速度。其它两个菌株也表现出了相同的趋势。
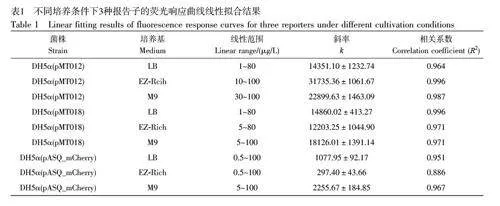
图1B~1D 显示了3 种菌株分别在不同的培养基中对不同浓度As3+的响应情况。结果表明, 3 种菌株在不同的生长环境中均在一定浓度区间内具有线性响应,但是不同培养基中的线性范围差异较大。不同培养条件下3 种报告子的线性拟合结果见表1, DH5α(pMT012)菌株在LB 和EZ-Rich 中的线性范围较宽,分别为1~80 μg/L 和10~100 μg/L,但是在M9 中的线性范围明显变窄,只有30~100 μg/L;DH5α(pASQ_mCherry)展现出类似的趋势;而DH5α(pMT018)菌株的结果有所不同,在EZ-Rich 培养基中显示出较窄的线性范围。上述结果说明,传感器检测的线性范围与培养基和报告基因的性质均密切相关。综上,不同菌株在LB 培养基中的线性范围变化较小,在其它两种培养基中,线性范围在不同报告基因的传感器中变化较大。
3 种菌株在M9 培养基中对As3+的检出限高于LB 和EZ-Rich,推断可能是由于M9 属于贫乏培养基,整体的蛋白合成和DNA 复制等过程处于较低水平,在较低浓度(如1 μg/L)As3+的诱导下,难以产生足够的质粒拷贝数,最终导致荧光强度较低。DH5α(pMT012)和DH5α(pMT018)菌株在LB 中表现出更稳定的线性区间(1~80 μg/L)和斜率(约14500)。与LB 相比, DH5α(pMT012)菌株在EZ-Rich 中展现出相对更高的灵敏度, DH5α(pASQ_mCherry)菌株的检测范围更宽,但检测灵敏度很低,而DH5α(pMT018)的检测灵敏度和线性范围位于两者之间。这些结果表明,尽管EZ-Rich 培养基成分更简单,理论上背景荧光信号应更低,但在3 种菌株中呈现出较差的稳定性。这可能因为与基于天然提取物的LB 培养基相比,由多种无机盐组成的EZ-Rich 培养基成分相对简单,由于细菌内部生理状态之间存在随机差异,成分相对简单的EZ-Rich 培养基可能会放大这种差异。与此相反, LB 培养基由于营养成分更复杂和丰富,掩盖了细菌群体内部生理状态之间的随机差异,因此呈现出更稳定的测试性能。
2.2 细菌在不同生长状态下对As3+的响应
细菌在培养过程中的生长通常分为迟滞期(Lag phase)、对数期(Exponential phase)、平台期(Stationaryphase)和衰亡期(Decline phase)4个阶段[11],其中,前3个阶段为活细胞最重要的时期。以往的研究中,微生物传感器大多集中在细菌的对数期进行检测[12],目前还没有对其它2 个时期的检测性能进行研究的报道。
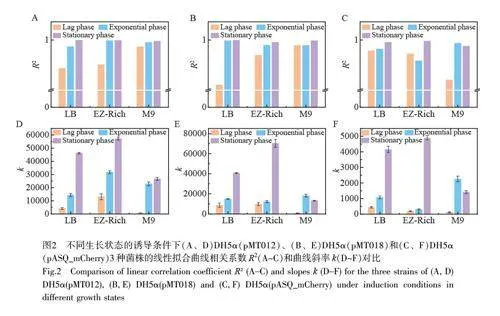
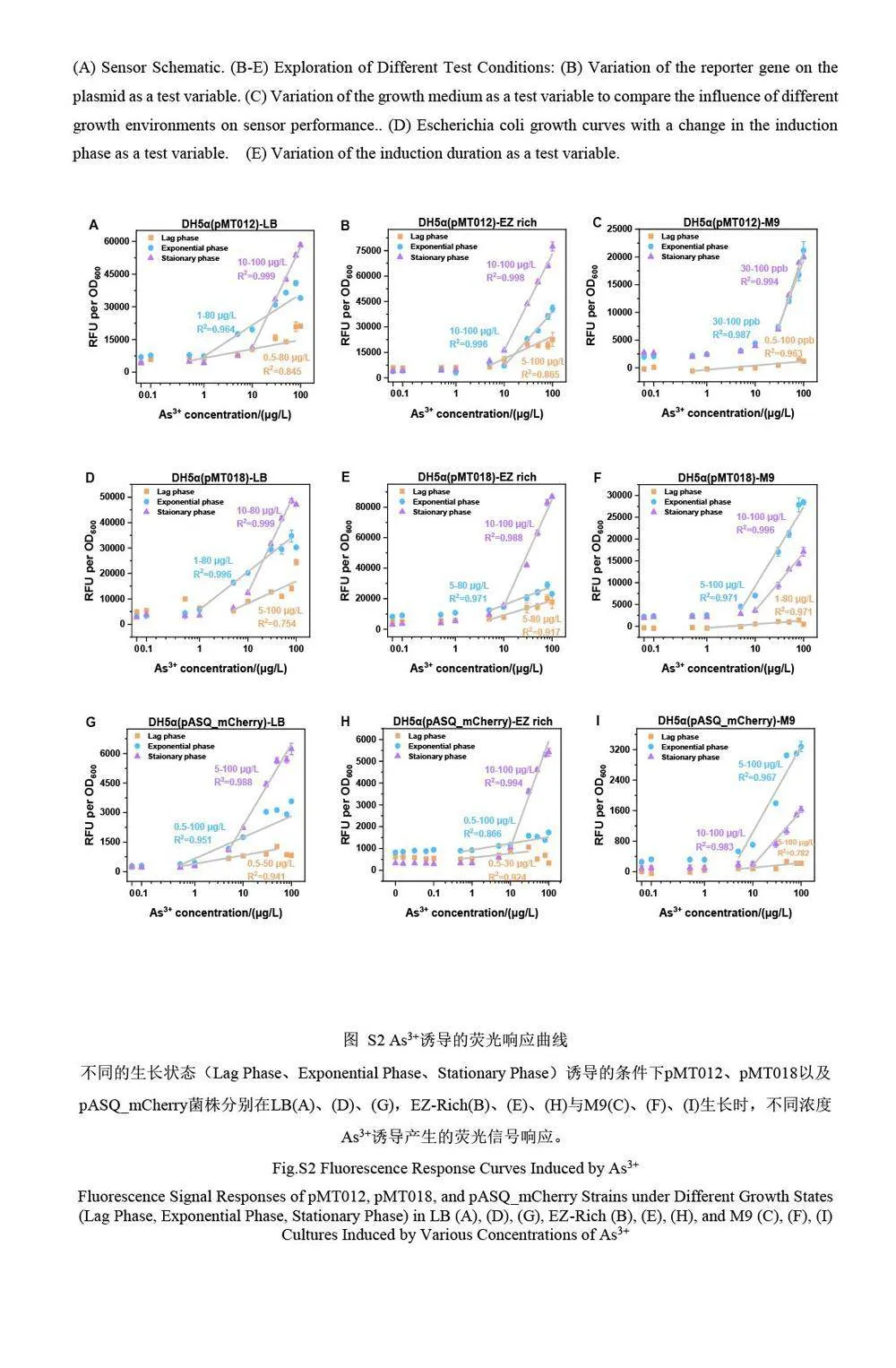
本研究分别对3 种菌株的不同的生长阶段的菌体细胞对As3+的响应进行了对比研究(图2 和电子版文后支持信息S2)。结果表明,传感器在细菌不同生长阶段对As3+的响应明显不同,并且这种差异在3 种菌株中表现出一些共性(电子版文后支持信息S2)。首先,在迟滞期诱导的细菌均表现出很低的荧光信号响应,并且与菌株和培养基条件无关。迟滞期的细菌代谢活跃,大量合成细菌分裂所需的酶类、ATP以及其它细胞成分,为细菌分裂做准备,这一时期细菌的主要任务是积累物质和能量,对环境的刺激不太敏感[11],因此,迟滞期的细菌不适合用于检测。在LB 和EZ-Rich 培养基中, 3 种菌株的平台期诱导组相对于指数生长期组表现出更好的线性特性和更高的荧光信号。对比拟合曲线的斜率发现,在较高浓度范围(10~100 μg/L)内, LB 和EZ-Rich 中平台期的细菌响应灵敏度明显高于对数期。然而,在M9 培养基中却展现出了完全不同的结果, M9 培养基中平台期的响应与对数期基本一致(如DH5α(pMT012))或更差(如DH5α(pMT018)和DH5α(pASQ_mCherry))。这可能是因为M9 培养基中细菌的生长环境营养缺乏,处于半饥饿状态,细菌的生理状态与平台期处于饥饿状态的细菌相似。因此,对数期与平台期细菌生理状态和代谢活性相差较小,传感器对As3+的响应也更接近。
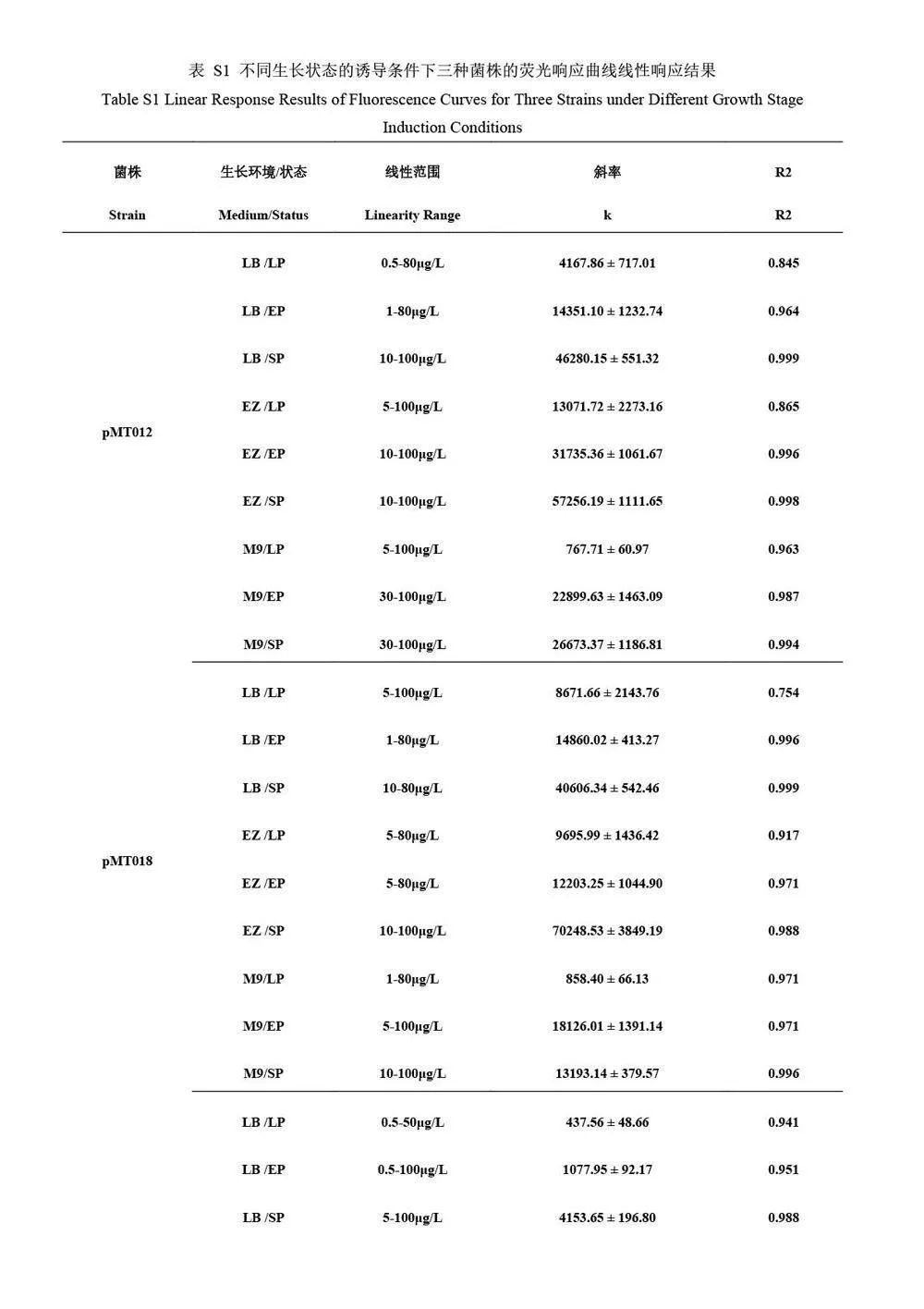
对比3 种菌株分别在不同生长阶段诱导的线性曲线方程的相关系数(R2,图2A~2C,以及电子版文后支持信息表S1)可知,平台期细菌传感器在其线性范围内普遍表现出更优异的线性响应,稳定性较好;迟滞期和对数期的细菌的线性响应程度随培养基和报告子的改变均会发生变化,并且在某些条件下线性响应很差,这种现象在迟滞期尤为明显,进一步证实了迟滞期的细菌不适合作为微生物传感器用于实际检测。采用拟合线性曲线的斜率(k)表征细菌传感器在其线性范围内的灵敏度(图2D~2F,电子版文后支持信息表S1),在两种丰富培养基中, 3 种菌株的平台期细菌的检测灵敏度也均远高于其它两个生长阶段的细菌,进一步显示了利用平台期细菌改善传感器性能的巨大潜力。
虽然平台期的细菌具有更好的线性响应和更高的灵敏度,但是其线性范围明显比对数期和迟滞期的细菌更窄。推测这可能因为在迟滞期或者对数生长期,细菌的大部分蛋白质表达系统用于与生长相关的基因表达,如各种rRNA 和核糖体大小亚基蛋白等[13];而在平台期的细菌,由于生长速度下降,细菌内的转录和翻译系统可以表达更多与生长无关的基因和蛋白质,这可能导致平台期的检出限较高。此外,由于平台期营养物质逐渐缺乏,细菌更容易进入应激状态[14],从而导致包括金属离子外排蛋白质[15]的表达上调,进一步影响其在低浓度条件下的检测性能。
2.3 不同诱导时长条件下As3+的响应
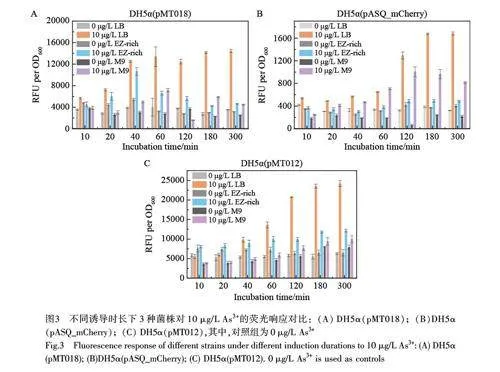
本研究测试了3 种菌株在不同诱导时长内对10 μg/L As3+的响应,结果如图3 所示, 3 种菌株在LB培养基中均表现出了更灵敏的响应和更高的荧光强度,在5 h 内均表现出稳定的高表达,这可能是由于LB 培养基营养丰富,能够长时间支持荧光蛋白的高表达。与此相反, EZ-Rich 和M9 培养基中荧光信号相对较弱,并且随着诱导时间延长,信号增强程度较小,甚至在DH5α(pASQ_mCherry)菌株中诱导2 h 后出现了荧光信号下降的趋势。此外, DH5α(pASQ_mCherry)在EZ-Rich 中的响应低于在LB 和M9 中的响应。3 种菌株在所有培养基中诱导2~3 h 条件下,砷离子传感器均表现出较高的信号响应,表明此传感器最佳诱导时长约为2~3 h。上述结果表明,传感器的响应时间均在数小时内,诱导时间并非越长越好,实际检测中应根据具体的传感器和培养环境选择最佳的诱导时长。
2.4 不同报告基因响应的对比
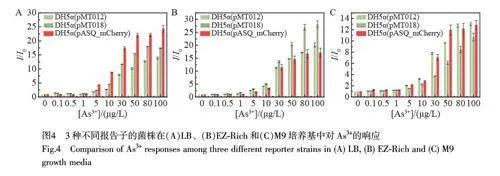
不同荧光蛋白的发光性质(包括量子效率、发光亮度和成熟时间等)存在较大的差异,选取不同的荧光蛋白作为输出信号是否会影响传感器的性能,目前还没有明确的研究结论。本研究对基于3 种报告子(GFP、sfGFP 和mCherry)的细胞传感器进行了对比。鉴于3 种荧光蛋白报告子的发光性质相差较大,对3 种菌株的相对荧光强度(即不同As3+浓度下各菌株的荧光强度I 与[As3+]=0 时的荧光强度I0 的比值)进行对比(图4)。结果表明,不同的荧光蛋白的亮度差别较大, mCherry 的发光亮度远低于GFP 和sfGFP,但是, DH5α(pASQ_mCherry)响应的最低浓度与其它两个菌株差异较小,均在5 μg/L 时具有较明显的响应。此外,尽管3 种菌株在不同的培养基中的响应程度存在差异,但这种差异不具有规律性,在LB 中DH5α(pASQ_mCherry)的响应程度更大, EZ-Rich 中DH5α(pMT018)的响应更明显,而M9 中DH5α(pMT012)和DH5α(pASQ_mCherry)均表现出较强的信号响应。这种差异可能是检测误差或细菌生理活性等因素导致的随机变化。以上结果表明,发光强且发光效率高的荧光蛋白不一定具有更优的信号响应。
通过与上述图3 结果对比发现, 3 种不同报告子菌株的响应时间不同,在菌株DH5α(pMT018)和DH5α(pMT012)中, As3+诱导20~40 min 时, LB 和EZ-Rich 中培养的pMT018 菌株已经开始出现响应,而在LB 中生长的DH5α(pASQ_mCherry)需要60~120 min 时才出现明显的响应,这可能与GFP 和mCherry的发光亮度和量子产率存在很大差异有关。与GFP 相比, mCherry 的发光效率和亮度较差[16],这说明选择荧光蛋白作为报告子时,荧光蛋白的发光性能至关重要,在传感器可选择的范围内应尽量选择量子产率和荧光亮度较高的蛋白。荧光蛋白在发光之前需要经历转录、翻译和折叠等步骤,其中,折叠过程占据了大部分时间,该过程通常称为蛋白质的成熟时间,只有正确折叠的成熟荧光蛋白分子才会产生发色团。DH5α(pMT012)和DH5α(pMT018)菌株的报告子荧光蛋白分别为sfGFP 和GFP,两者最大的区别在于成熟时间。荧光蛋白的成熟时间可能会影响传感器的响应速度,但本研究结果表明,虽然sfGFP 的成熟时间(几分钟)比GFP(~40 min)短很多[17],但快的成熟速度并未明显缩短传感器的响应时间。因此,传感器的响应时间不仅与报告蛋白的折叠速度有关,还可能受报告子蛋白和传感器调控环路中转录因子的成熟速度共同影响,为提高传感器的响应速度,需要同时缩短二者的成熟时间。
3 结论
对比了3 种菌株(DH5α(pMT012)、DH5α(pMT018)和DH5α(pASQ_mCherry))在不同的宏观因素(如生长环境、细菌生长状态和As3+诱导时长)条件下,基于Rep L 放大环路的微生物传感器的检测性能。实验结果表明,这些宏观因素对于微生物活细胞传感器的检测性能具有显著影响。采用LB 培养基可获得更稳定的测试效果,平台期的细菌在较高浓度(5~100 μg/L)As3+的诱导下具有更好的线性响应和灵敏度。在实际样品的检测过程中,可根据检测需要合理选择测试条件。同时,考察了不同的荧光蛋白作为输出信号对传感器性能的影响。荧光蛋白的发光性质对传感器的性能(尤其是响应速度)至关重要,采用量子效率和发光亮度高的荧光蛋白会缩短传感器的响应时间,这为开发快速响应的微生物传感器提供了理论依据和可行性策略。由于生物系统自身的复杂性,影响基因表达的因素多种多样,难以确定某个具体因素。但是,作为宏观表型的细菌生长状态可作为降低这些因素影响的重要参考,为优化微生物传感器的检测性能提供切实可行和简单便捷的方法,在微生物传感器的应用和标准检测方法的建立方面具有重要意义。
References
[1] MENG F, ELLIS T. Nat. Commun. , 2020, 11(1): 5174.
[2] KIM H J, JEONG H, LEE S. Anal. Bioanal. Chem. , 2018, 410: 1191-1203.
[3] BONTIDEAN I, BERGGREN C, JOHANSSON G, CSÖREGI E, MATTIASSON B, LLOYD J R, JAKEMAN K J, BROWNN L. Anal. Chem. , 1998, 70(19): 4162-4169.
[4] TYSON J J, CHEN K C, NOVAK B. Curr. Opin. Cell Biol. , 2003, 15(2): 221-231.
[5] ALON U. Nat. Rev. Genet. , 2007, 8(6): 450-461.
[6] GARDIOL D, GRAMAJO H C, HIRSCHBEIN L, MENDOZA D. Gene, 1993, 123(1): 39-44.
[7] ONGENAE V, AZEREDO J, KROPINSKI A M, ROZEN D, BRIEGEL A, CLAESSEN D. Sci. Rep. , 2022, 12(1): 17785.
[8] MOCHIZUKI S, HIRATSU K, SUWA M, ISHII T, SUGINO F, YAMADA K, KINASHI H. Mol. Microbiol. , 2003, 48(6):1501-1510.
[9] HANSEN E B. J. Mol. Biol. , 1989, 207(1): 135-149.
[10] LI J, CUI M, ZHAO J, WANG J, FANG X. Biosens. Bioelectron. , 2023, 221: 114937.
[11] PELEG M, CORRADINI M G. Crit. Rev. Food Sci. Nutr. , 2011, 51(10): 917-945.
[12] BEREZA-MALCOLM L T, MANN G L, FRANKS A E. ACS Synth. Biol. , 2015, 4(5): 535-546.
[13] DRYSELIUS R, IZUTSU K, HONDA T, IIDA T. BMC Genom. , 2008, 9(1): 559.
[14] VOGT S L, SERAPIO-PALACIOS A, WOODWARD S E, SANTOS A S, DE VRIES S P, DAIGNEAULT M C,BRANDMEIER L V, GRANT A J, MASKELL D J, ALLEN-VERCOE E. Gut Microbes, 2023, 15(1): 2190303.
[15] DAS S, DASH H R, CHAKRABORTY J. Appl. Microbiol. Biotechnol. , 2016, 100(7): 2967-2984.
[16] PADILLA-PARRA S, AUDUGÉ N, LALUCQUE H, MEVEL J C, COPPEY-MOISAN M, TRAMIER M. Biophys. J. , 2009,97(8): 2368-2376.
[17] SHASHKOVA S, WOLLMAN A J, HOHMANN S, LEAKE M C. Bio-protoc. , 2018, 8(2): e2710.

