认真实验,主动探究

实验是初中化学知识体系中重要的组成部分,重点引导学生通过动手操作,亲身观察化学反应,体验化学原理的形成过程,从而加深学生对知识的理解,增强学生的实验技能,培养学生的探究能力。以“配制一定溶质质量分数的氯化钠溶液”实验活动教学为例,从情境导入、目标导学、探究活动、习题强化四部分对其实践过程展开研究。
一、情境导入,认识实验意义
“配制一定溶质质量分数的溶液”实验活动要求学生通过实验准备、实验操作、问题讨论等,加深对溶质质量分数的理解,掌握配制溶液的过程及操作步骤,初步学习或学会相关的化学实验基本操作,提升学生的实践能力。基于此,教师为学生创设生活化情境,启发学生思考,认识本实验的意义。
教师先展示医用生理盐水的说明书:
教师为学生创设情境:生理盐水是医疗中常用的一种溶液,当我们感冒去输液的时候,医生多以生理盐水和其他药品进行融合,再输入我们的体内。那么,从我们看到的氯化钠注射液的说明书上,此信息中的0.9%表明的含义是什么呢?溶质质量分数的大小代表了什么呢?
随后,教师指导学生分小组展开探究,解决情境中的问题。
学生探究回答:0.9%表示的是生理盐水的浓度。
学生探究回答:溶质质量分数越大,说明生理盐水的浓度越大。
教师引导:理解质量分数增大,溶液的浓度越大,也可以说溶液的密度也会随之增大。今天,我们就一起来配置一定溶质质量分数的氯化钠溶液,一起看看如何通过动手操作控制溶液的浓度;如何对溶液的浓度进行改变。
通过这样的教学过程,教师用生活化的情境激发学生的实验兴趣,同时让学生认识到本次实验的意义,培养学生的探究意识,促进实验教学的有效实施。
二、目标导学,明确实验目标
在实验课之前,对于相关操作已有课堂或生活中的体验,学生已经学习了溶液浓度的表示方法,也就是溶质的质量分数,掌握了相关的简单计算,生活中,也会遇到使用溶液浓度的情况,这些都为学习本节课奠定了一定的基础。基于此,教师为学生出示本次实验课的目标,让学生做到心中有数。
“配制一定溶质质量分数的氯化钠溶液”实验目标:
(1)初步认识配制一定溶质质量分数的溶液的实验操作。
(2)通过本实验活动(包括实验的预习准备、实验操作、问题讨论等),加深理解溶质的质量分数的概念。
(3)按配制溶液的步骤配制一定溶质质量分数的溶液(6%和3%),大致了解一定质量分数的溶液配制过程及其操作步骤。
(4)提高动手操作能力和科学探究能力,能够对实验中出现的误差进行分析。
(5)形成具体问题具体分析的意识,初步学习或学会相关的化学实验基本操作,培养科学素养,提高实践能力。
教师过渡:同学们想不想亲自配制一定溶质质量分数的氯化钠溶液呢?
明确目标,提高学生参与实验学习的积极性,同时也为实验开展奠定基础。
三、探究互动,完成实验过程
本实验课全程要求学生合作完成,分为“探究分析—配制溶液—误差分析—实验答疑”四个环节。
(一)探究分析
在探究分析环节,教师重点引导学生对实验目标进行分析,同时认识实验器材、实验步骤,做好实验前的准备工作。
首先,教师提出驱动性问题:如何配制50 g质量分数为6%的氯化钠溶液?我们应该用到哪些实验器材、实验药品?实验步骤分为哪几步?你是先考虑实验步骤还是所需仪器?
教师指导学生分组探究讨论,并指名学生回答。
学生探究回答:思考过程应该先考虑步骤,再根据步骤考虑仪器,可以避免仪器的遗漏。
教师指导:很好,如果我们先考虑仪器的话,会出现仪器准备过多或者过少的问题,影响实验的进度。因此,我们应该先梳理出实验的步骤,再根据每一步思考需要哪些仪器,每种仪器需要准备几个,以此让我们的实验更加精准,提高实验效率。
学生探究回答:配制溶液的一般步骤为:计算,称量,量取,溶解。
教师指导:根据大家提出的实验步骤,实验仪器应该从第二步开始应用,总共包括的实验仪器和药品为烧杯、托盘天平、玻璃棒、量筒、药匙、胶头滴管、水、食盐。
随后,教师提出驱动性问题:如果我们想配置溶质质量分数为6%的氯化钠溶液,我们需要称量多少实验药品呢?
学生解答:已知溶液的质量是50 g,溶液的质量分数是6%,所需溶质的质量为:50 g×6%=3 g;所需溶剂的质量为:50 g-3 g=47 g,因此,我们需要称量47 g水、称量3 g食盐。
紧接着,教师指导学生认识面前的实验仪器,包括烧杯、托盘天平、玻璃棒、量筒、药匙、胶头滴管,并要求学生分小组汇报各个实验仪器的功能。
学生探究回答:烧杯主要用于溶解食盐、配制溶液;托盘天平用于称取食盐和水;玻璃棒用于溶液搅拌,使溶质完全溶解;量筒用来量取水;药匙用来量取食盐;胶头滴管用于对水的量进行细微调整,保证水的质量符合实验要求。
通过这样的教学过程,教师引导学生在实验前做好充足的准备工作,同时培养学生严谨的科学探究态度以及动手操作能力,促进实验教学的有效实施。
(二)配制质量分数为6%的氯化钠溶液
学生动手操作完成实验的过程是整个实验课的核心。教师不仅要做好巡视,同时也要为学生提供必要的指导和帮助,培养学生的动手操作能力和探究能力,同时推进学生的实验进度。
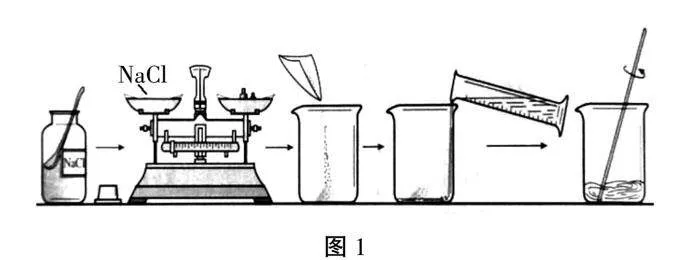
首先,教师为学生展示整个实验步骤对应的图片(如图1),其中包括称取药品氯化钠—量取水—融合—搅拌。
随后,教师指导学生分组实验,根据实验提示完成称量和量取操作,同时,教师组织各个小组之间互相检查是否量取正确,对于量取不正确的小组,教师留出一定的时间要求学生重新量取,然后再进行溶解实验。
在学生实验过程中,教师巡视,并向学生讲解各个实验仪器的使用方式以及规范的操作。
烧杯的使用:保证烧杯内部干燥、没有水珠,若实验前清洗过烧杯,应该用干纸巾擦干或者倒置烧杯,使其自然风干,避免影响最终的溶液数据。
水的量取:量取水的时候,应该注意加到量筒刻度线以下,再用胶头滴管向量筒中滴水,以保证最终的水量与实验数据相符合。
在学生实验中,教师可以鼓励学生合理分工,并且做好互相监督和指导,当同伴有失误的时候,一定暂停实验,并对失误进行及时处理。
在学生完成溶液配置实验后,为了加深学生对本轮实验的理解,教师以课堂练习题的方式指导学生回顾本次实验的步骤以及易错点、操作失误等,从而提高学生的动手操作能力。
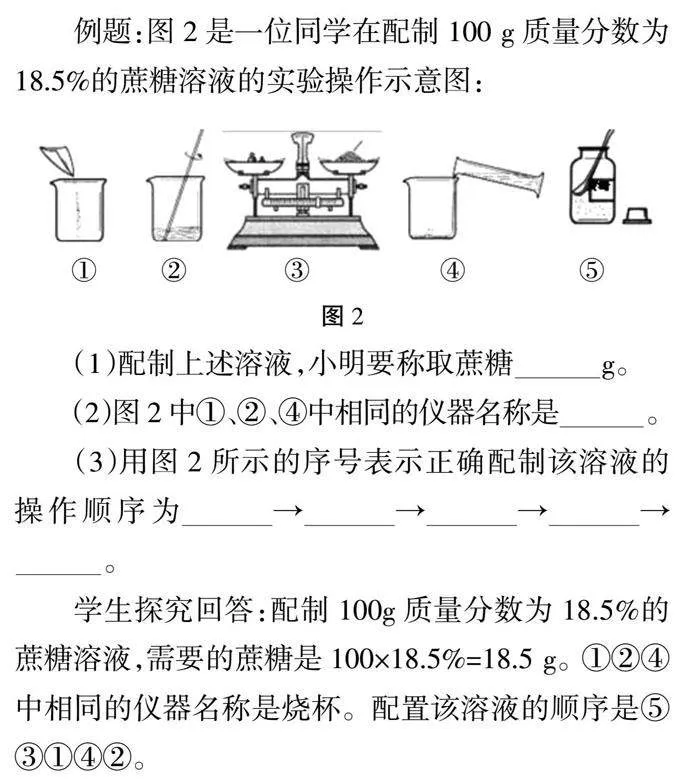
例题:图2是一位同学在配制100 g质量分数为18.5%的蔗糖溶液的实验操作示意图:
(1)配制上述溶液,小明要称取蔗糖______g。
(2)图2中①、②、④中相同的仪器名称是 。
(3)用图2所示的序号表示正确配制该溶液的操作顺序为____→____→____→____→____。
学生探究回答:配制100g质量分数为18.5%的蔗糖溶液,需要的蔗糖是100×18.5%=18.5 g。①②④中相同的仪器名称是烧杯。配置该溶液的顺序是⑤③①④②。
教师过渡:通过刚才的实验过程以及练习,我们知道配制一定质量分数的溶液,需要对所学溶质、溶剂的质量做好计算和量取,然后再应用各种仪器配制溶液。
随后,教师提出驱动性问题:溶液的配制只能用固体溶于水的方法吗?有时候我们拿到的是溶质质量分数非常高的浓溶液,让我们来配置稀溶液,如用6%的氯化钠溶液(密度约为1.04 g/cm3)配置3%的氯化钠溶液,我们应该怎么操作呢?
学生探究回答:往浓溶液里加水。
教师指导:加水的方式确实能够满足我们的要求,但是我们应该做哪些准备工作呢?需要哪些用品?实验分为哪几个步骤?
学生探究回答:根据稀溶液的质量和溶质质量分数,先计算出所需要的浓溶液的质量以及所需要加水的量;再量取一定量的浓溶液,并向其中加入一定量的水;充分搅拌后,即可得出我们想要的稀溶液。
通过这样的教学过程,教师引导学生完整地体验配置一定溶质质量分数的溶液的实验操作,不仅可以培养学生的合作能力、实验能力、探究能力,同时能够很好地激发学生的实验兴趣,培养学生的实验思维,促进实验课的有效实施。
(三)配制质量分数为3%的氯化钠溶液
第二阶段的实验重点引导学生学习用浓溶液配制稀溶液的实验方法,考查学生的实验操作能力以及实验探究思维。这一环节中,多以学生自主探究为主,教师指导为辅,鼓励学生自主尝试,大胆试错,从而提升学生的实验素养。
首先,教师提出驱动性的问题:用6%的食盐水如何配制50 g 3%的氯化钠溶液呢?根据之前的思考,一起来计算所学浓溶液的质量、水的质量。
学生探究回答:要配制50 g 3%的溶液,我们必须知道要取多少实验材料,这样才能够得出准确的溶液。
学生探究回答:在实验中,我们需要向浓溶液中加入水,所以水起到了稀释的作用,而且水也占最终溶液的质量。但在整个稀释过程中,溶质的质量是不变的,所以我们可以设需要浓溶液xg,溶质质量就是6%x,而我们最终要配置的50 g 3%的食盐水中,含有的溶质质量为:50 g×3%=1.5 g。因此,可以列出方程式6%x=1.5 g,x=25 g。因此,我们所需要的6%的食盐水的质量为25 g。需要水的质量是50 g-25 g=25 g。
基于上述计算结果,教师指导学生实验,配置50 g 3%的氯化钠溶液。
在学生实验过程中,教师巡视,并鼓励学生小组内部互相指导和监督,同时针对学生出现的实验操作错误进行指导。
实验步骤:
第一步:准备一只干净的烧杯,用量筒量取25 g的水倒入烧杯中。
第二步:用量筒量取溶质质量分数为6%的食盐水的体积,缓缓倒入烧杯中。
第三步:用玻璃棒搅拌,直至溶液呈透明。
这样的教学过程,不仅加深了学生对溶质质量分数的理解,让学生学会根据现有数据计算实验数据,同时锻炼了学生对烧杯、量筒等实验仪器的使用,提高学生的实验能力,促进实验教学的有效实施。
(四)误差分析
在化学实验中,出现误差是非常正常的,多数情况下都是因为实验者操作不当或者计算错误,导致所用药品的质量大小出现问题,影响最终的实验数据。因此,在实验教学中,教师还要引导学生学会对实验中的误差进行分析,从而培养学生形成严谨的实验态度。
教师提出驱动性的问题:在配置一定溶质质量分数溶液的实验中,哪些因素会导致实验结果偏大?哪些会偏小?哪些无影响?(指导:误差分析要根据质量分数的定义式来分析。)
随后,教师指导学生展开自主探究,对溶质质量分数偏大、溶质质量分数偏小、溶质质量分数无影响的情况展开分析。
学生探究回答:所配溶液中溶质的质量分数偏大,可能存在的原因:
(1)溶质的质量偏大:称取固体溶质质量偏大或量取浓溶液时仰视读数。
(2)溶剂的质量偏小:用量筒量取水时,读数时俯视液面;水量好后,向烧杯中倾倒时有液体洒落。
学生探究回答:所配溶液中溶质的质量分数偏小,可能存在的原因:
(1)溶质的质量偏小。
(2)称量固体溶质的质量偏小。
(3)所用固体溶质不纯、不干燥或已潮解。
学生探究回答:所配溶液中溶质的质量分数无影响的错误操作可能是装瓶时将溶液洒落不影响溶液中溶质的质量分数,只是溶液质量减小。
在学生探究结束后,教师对学生提到的原因进行梳理和汇总,并从中选择学生常犯的实验错误进行讲解。
教师指导:当我们称取固体溶质的时候,如果称多了,就会导致溶质增多,溶解后溶液的溶质质量分数偏大;当我们量取浓溶液的时候仰视量筒的读数,就会导致量取的浓溶液偏多,这样加入水稀释后溶液的溶质质量分数偏大。当水量好后,向烧杯中倾倒时有液体洒落,也会导致溶剂少,溶解后溶液的溶质质量分数偏小。
通过这样的教学过程,教师引导学生学会对实验结果、实验数据等进行误差分析,从而促进学生养成正确的实验习惯,以此提高学生的实验能力,促进实验教学的有效实施。
四、习题强化,延伸实验知识
在实验课教学中,除了学生必须完成的实验任务,教师还可以借助一系列的习题强化学生对实验步骤、实验操作以及实验运算的理解和掌握,延伸实验知识,从而促进学生探究思维的形成。
判断题:
1.试剂瓶中的溶液在使用时不慎洒出一部分,剩余溶液的溶质质量分数减小。( )
解析:错误,溶液具有均一性、稳定性,试剂瓶中的溶液在使用时不慎洒出一部分,剩余溶液的溶质质量分数不变。
2.配制一定质量分数的氯化钠溶液,量筒中本身有水会导致所配溶液的溶质质量分数偏小。( )
解析:错误,配制一定质量分数的氯化钠溶液,量筒中本身有水,不影响量取水的体积和质量,不影响所配溶液的溶质质量分数大小,故错误。
上述习题重点锻炼学生实验误差分析能力,同时培养学生科学实验、严谨实验的意识和能力。
五、总结
初中化学实验教学具有非常突出的实践意义。在实验课的教学中,教师要借助情境引导,激发学生的实验兴趣,同时指导学生展开实验前的分析和探究,为实验操作做好准备。在学生实验过程中,教师要加强巡视指导,解决学生实验中遇到的各种问题,以此提升学生的实验能力。另外,教师也要引导学生学会误差分析,并借助习题训练培养学生的实验解题能力,从而提升实验课教学的效果。
(作者单位:上杭县第四中学)
编辑:温雪莲

