10种化学杀菌剂对茶树炭疽病菌(Colletotrichum camelliae)的室内毒力测定

摘要:采用菌落直径法测定茶树炭疽病菌山茶刺盘孢(Colletotrichum camelliae)对10种化学杀菌剂的敏感性,以期为该病原引起的茶炭疽病的田间防控提供参考依据。结合试验数据分析表明,75%百菌清和50%甲基硫菌灵在5 μg/mL时抑菌率就达到了100%;10%苯醚甲环唑和250 g/L丙环唑在50 μg/mL时抑菌率分别达到了92.88%,100%;250 g/L吡唑醚菌酯、40%腈菌唑、80%代森锰锌、250 g/L嘧菌酯、25 g/L咯菌腈和80%代森锌的抑菌效果依次减弱。并对10种化学杀菌剂的抑菌率进行分析,分别计算出毒力回归方程、相关系数及半数有效浓度(EC50)。研究发现50%甲基硫菌灵、75%百菌清、250 g/L丙环唑和10%苯醚甲环唑对茶树炭疽菌有较强的毒力。
关键词:茶炭疽病;毒力测定;化学杀菌剂
中图分类号:S571.1;TQ455 文献标识码:A 文章编号:1000-3150(2024)08-35-5
茶炭疽病是茶树常见的叶部病害之一,该病害的发生可引起茶树叶部坏死、影响茶树的光合作用、严重者导致茶树死亡[1]。在秋季茶炭疽病发生严重的茶园,翌年春茶将减产10%~20%[2]。我国研究者对茶炭疽病的病原分类进行了系统性研究,Liu等[3]从福建和浙江等7个省份的茶炭疽病发病叶片分离鉴定到了6个炭疽病病原菌种,并认定C. camelliae为茶炭疽病病原菌的优势种。Wang等[4]对中国15个省份的茶炭疽病病叶进行分离,所得到的病原菌包括已知种C. camelliae、C. cliviae、C. fioriniae、C. fructicola、C. karstii、C. siamense、C. aenigma、C. endophytica和C. truncatum,1个新发现种C. wuxiense,以及1个未鉴定种,通过分离鉴定,同样认为C. camelliae为茶炭疽病病原菌的优势种。
在众多的茶炭疽病病原菌种中,山茶刺盘孢(Colletotrichum camelliae)能为害我国大多数茶树品种,是引起我国茶树炭疽病发生的主要病原菌种[5]。其分生孢子为圆柱形或梭形,两端钝圆,中间有1~2个小油滴,部分中间稍有溢缩。附着胞深褐色,近圆形或不规则形[6]。其主要依靠菌丝体或者分生孢子粘附在茶树叶片的茸毛上,待环境适宜后,萌发产生芽管侵入叶片组织,侵入可在体内潜育1~2周,发病初期出现深绿色水渍状小病斑,病斑慢慢扩大成褐色,发病后期病斑部位形成凹陷隆起,并分布密集的小黑点,即为分生孢子盘,这是造成炭疽病反复发生的侵染源[7]。
由于对茶炭疽病的研究还不够深入,针对茶树炭疽病的防治手段仍比较有限。王国君等[8]通过田间防控试验发现25%吡唑醚菌酯乳油和10%苯醚甲环唑水分散粒剂对茶炭疽病防控有较好效果。陈俊华等[9]通过菌丝抑制法测定信阳茶炭疽病对化学杀菌剂的敏感性,发现其对10%苯醚甲环唑水分散粒剂、25%嘧菌酯乳油、25%丙环唑乳油的敏感性较高。姚秋荣等[10]通过开展杀菌剂阿砣防治茶炭疽病的田间试验,发现其对茶炭疽病的防治效果较好。使用化学药剂防治茶炭疽病仍是当前和以后很长一段时间的主要手段,本试验采用室内菌丝生长速率法,测定C. camelliae对10种常见化学杀菌剂的敏感性,为由病原菌C. camelliae引起的茶炭疽病的化学防控提供理论依据。
1 材料与方法
1.1 供试菌株及培养基
茶树炭疽病病原菌从中国农业科学院茶叶研究所试验茶园中发病的茶树叶片中采用组织分离法得到,经过生物学和形态学鉴定为山茶刺孢盘(C. camelliae)。所用培养基为常规的PDA培养基(马铃薯200 g、葡萄糖20 g、琼脂15 g、蒸馏水1 000 mL)。
1.2 供试化学杀菌剂
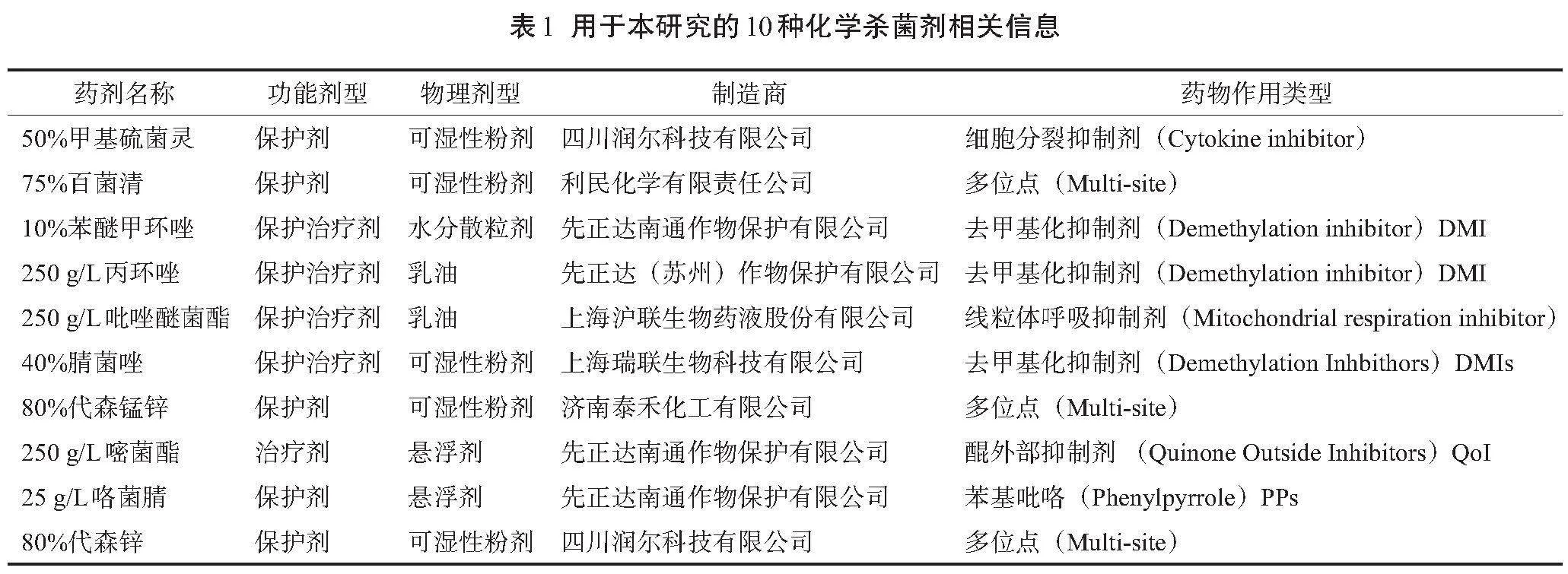
试验所用化学杀菌剂如表1所示。其中4种保护剂,4种保护治疗剂,2种治疗剂。
1.3 试验方法
先将10种供试化学杀菌剂按照其说明给出的有效成分配置成200 μg/mL的母液,然后依次稀释至不同梯度。待高温灭菌后的培养基冷却至50 ℃时,用移液器吸取2 mL不同种类的药液,加入18 mL的培养基中,摇晃均匀,配制成0.5、5.0、10.0、50.0、100.0 μg/mL 5种不同药剂质量浓度的PDA培养基。并以2 mL无菌水加入到18 mL培养中为对照(CK),待平板中的培养基凝固后,用5 mm的打孔器打取活化好的菌饼,用镊子将菌饼放置于培养基中间。每个处理设置3个重复。放置于25 ℃恒温培养箱中,培养2 d后每天使用十字交叉法测量菌丝直径,做好记录。待CK组菌丝长到培养皿2/3时,移至超净工作台中拍照,并计算抑菌率。
2 结果与分析
2.1 10种化学杀菌剂抑菌效果测定
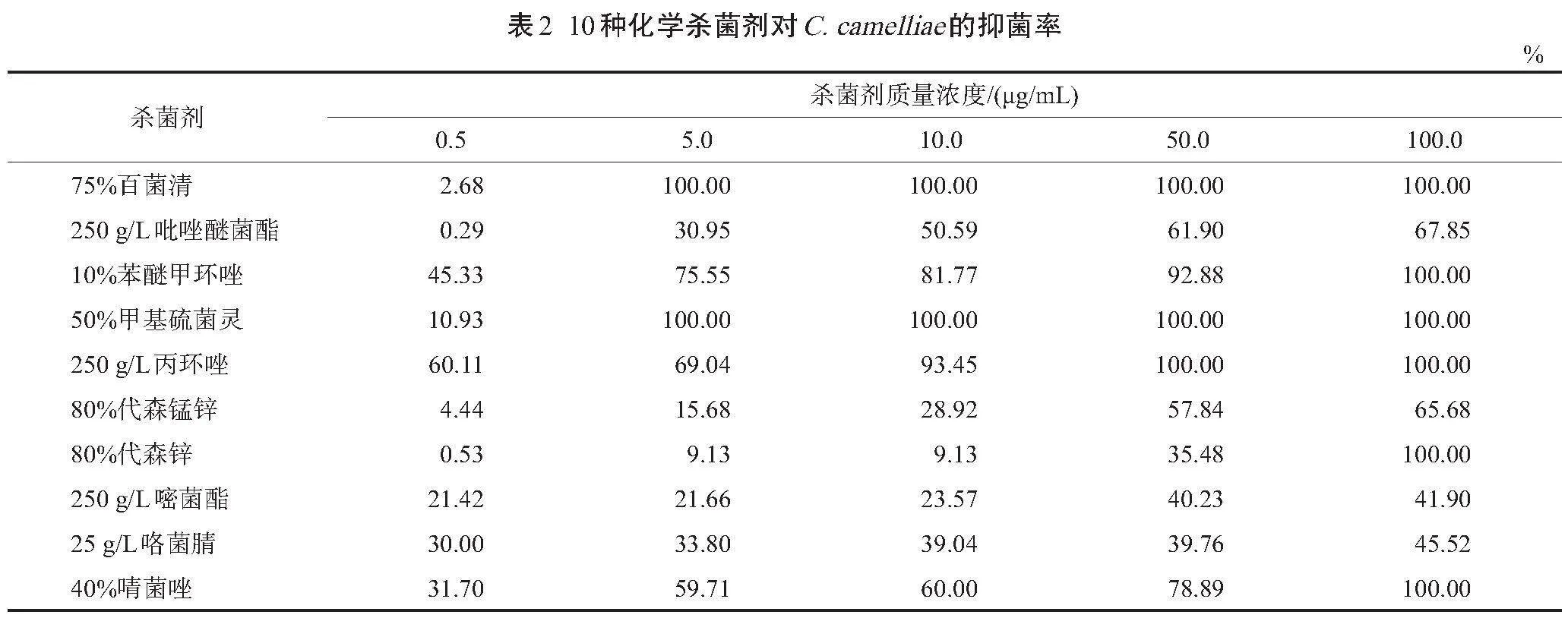
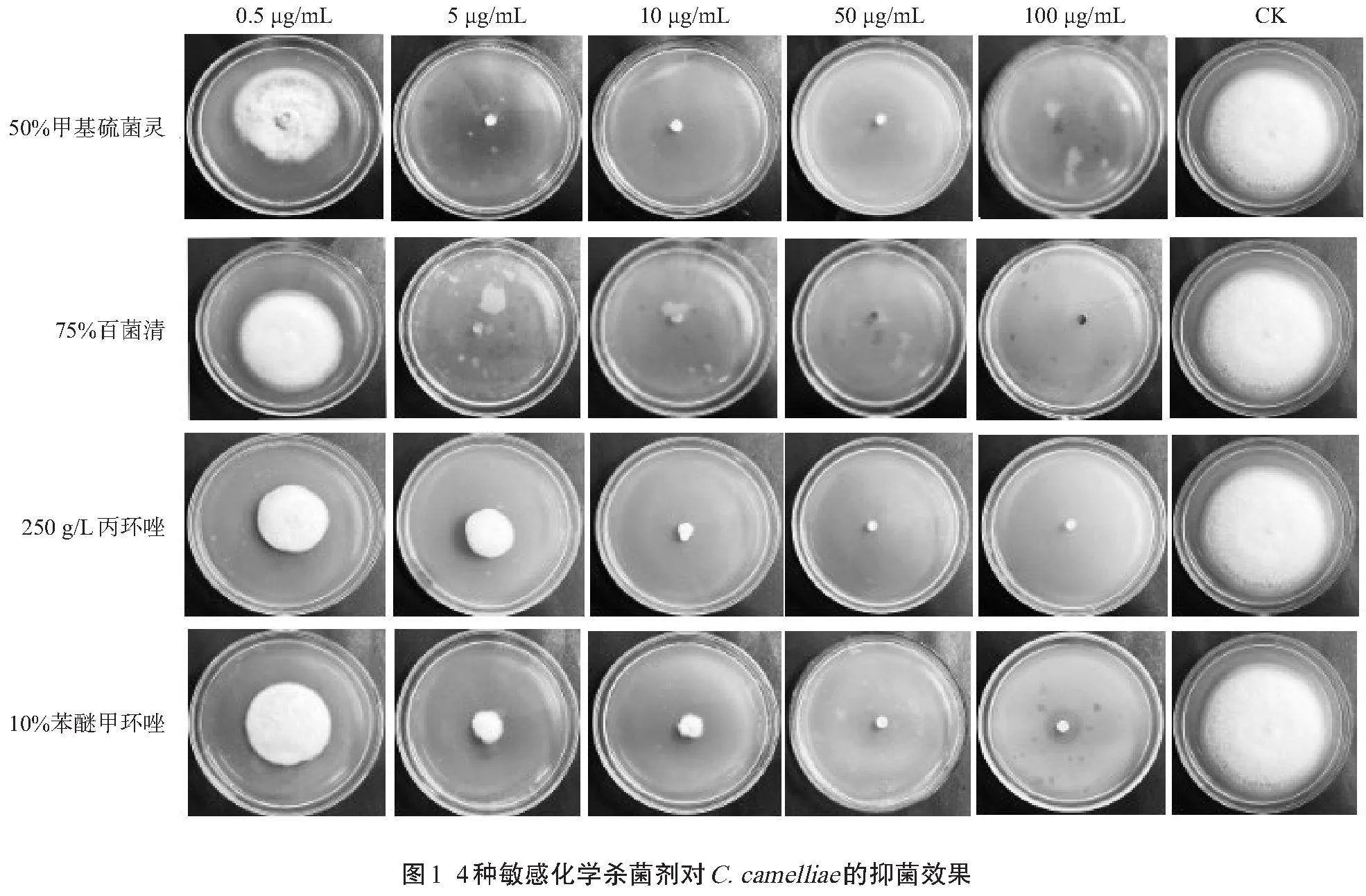
从试验结果(表2)可以看出,C. camelliae对这10种化学杀菌剂均具有一定的敏感性。这10种化学杀菌剂的抑菌效果从高到低依次为50%甲基硫菌灵、75%百菌清、250 g/L丙环唑、10%苯醚甲环唑、40%腈菌唑、80%代森锌、250 g/L吡唑醚菌酯、80%代森锰锌、25 g/L咯菌腈、250 g/L嘧菌酯。在这10种化学杀菌剂中,50%甲基硫菌灵0.5 μg/mL抑菌率为10.93%,在5、10、50、100 μg/mL时均完全抑制了菌丝的生长;75%百菌清的抑菌效果虽然在0.5 μg/mL时抑菌率仅为2.68%,比同质量浓度的50%甲基硫菌灵抑菌率稍低,但在5、10、50、100 μg/mL时也完全抑制了病原菌丝的生长。250 g/L丙环唑在10.0 μg/mL时,抑菌率超过90%,为93.45%;在50、100 μg/mL时,抑菌率均为100%。10%苯醚甲环唑在质量浓度为10.0、50.0 μg/mL时的抑菌率超过80%,分别为81.77%、92.88%;在100 μg/mL时抑菌率为100%。以上4种杀菌剂对C. camelliae的抑菌效果较好(图1)。另外,40%腈菌唑和80%代森锌虽然在100 μg/mL时抑菌率达到100%,但低于100 μg/mL质量浓度的处理其抑菌率均不理想。其余4种化学杀菌剂所有质量浓度处理下都有一定的菌丝长出。
2.2 10种化学杀菌剂毒力回归方程及半数有效浓度(EC50)的测定
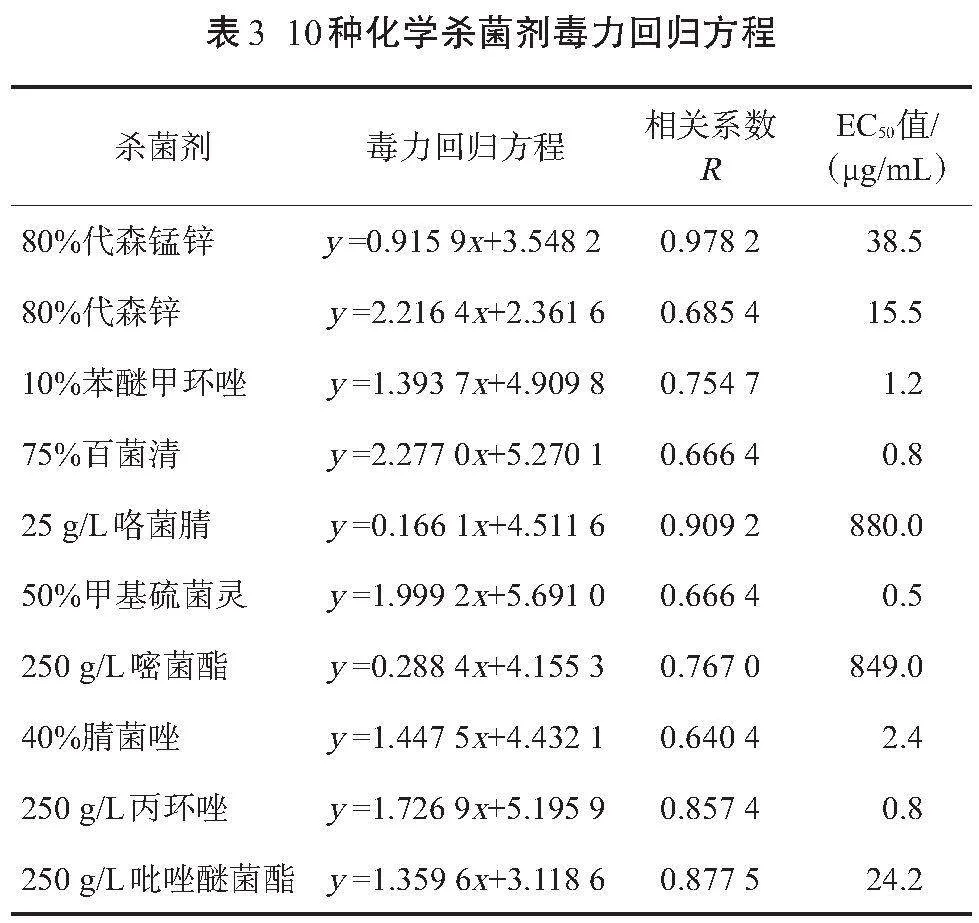
使用Excel和SPSS软件对化学杀菌剂浓度的log值(x值)和抑菌率对应的几率值(y值)进行分析,得出10种化学杀菌剂的毒力回归方程,以及相关系数R、EC50值。由表3可见,10种杀菌剂的EC50值相差较明显,50%甲基硫菌灵的EC50值最小,25 g/L咯菌腈的EC50值最大。10种杀菌剂按照EC50值从小到大的顺序依次为50%甲基硫菌灵、75%百菌清、250 g/L丙环唑、10%苯醚甲环唑、40%腈菌唑、80%代森锌、250 g/L吡唑醚菌脂、80%代森锰锌、250 g/L嘧菌酯、25 g/L咯菌腈。
3 小结与讨论
10种供试化学杀菌剂中,病原菌C. camelliae对50%甲基硫菌灵、75%百菌清、250 g/L丙环唑、10%苯醚甲环唑的敏感性较好,这4种化学杀菌剂可作为由C. camelliae引起的茶树炭疽病的田间防治参考药剂,而25 g/L咯菌腈、40%腈菌唑、80%代森锰锌、80%代森锌、250 g/L嘧菌酯、250 g/L吡唑醚菌酯的抑菌效果不甚理想。在4种抑菌效果较明显的杀菌剂中,75%百菌清属于多位点杀菌剂,50%甲基硫菌灵属于MBC类杀菌剂,250 g/L丙环唑和10%苯醚甲环唑属于DMI类杀菌剂,同属于DMI类杀菌剂的40%腈菌唑的抑菌效果虽然低于相同机制的杀菌剂,但明显优于其他类型的杀菌剂。李学俊等[11]对大粒咖啡病(C. kahawae)进行了室内毒力测定,发现70%甲基硫菌灵和30%肟菌·戊唑醇可以完全抑制大粒咖啡炭疽病的生长。黄艳花等[12]对紫果西番莲顶枯病病原菌暹罗炭疽菌(Colletotrichum siamense)进行了室内毒力测定,发现70%甲基硫菌灵对紫果西番莲顶枯病有较强的毒力。张琳等[13]通过菌丝速率生长法对南瓜炭疽病(Colletotrichum brevisporum)室内毒力测定,结果表明97%多菌灵、97%抑霉唑、96%甲基硫菌灵的毒力较高。结合本研究的试验结果,推断甲基硫菌灵可能对炭疽菌属内多个种有较好的抑制效果。董金龙[14]对98%甲基硫菌灵、96.5%咪鲜胺、99.8%咯菌腈、95%苯醚甲环唑、98.1%多菌灵、96%吡唑醚菌酯进行抑菌试验,发现99.8%咯菌腈对红心莲毁灭炭疽菌(Colletotrichum destructivum)的抑制率最强,而本研究中25 g/L咯菌腈对茶树炭疽病抑制效果一般,原因可能是咯菌腈对炭疽菌属内不同种的抑制效果有差异[15]。本研究结果与饶家瑞等[16]的试验结果基本一致,70%甲基硫菌灵和10%苯醚甲环唑在质量浓度为100 μg/mL时的抑菌效果均超过了90%。
本研究是在室内进行的毒力测定,试验条件相对可控,然而田间的防治受寄主的生理特性、种植环境、喷药时间、天气、喷药器材及其他不可预见因素的影响。鉴于此,4种具有较强毒力化学杀菌剂的田间防治效果还需要进一步验证。
参考文献
[1] 雷娇娇, 田力, 袁伟, 等. 贵阳花溪久安茶树炭疽病病原菌(Colletotrichun gloeosporioides)的分离鉴定及生物学特性[J]. 江苏农业科学, 2020, 48(11): 100-105.
[2] 谭荣荣, 周国珍, 毛迎新, 等. 250 g/L吡唑醚菌酯悬浮剂防治茶树炭疽病试验[J]. 湖北植保, 2015(2): 9-10.
[3] LIU F, WEIR B S, DAMM U, et al. Unravelling Colletotrichum species associated with Camellia: Employing ApMat and GS loci to resolve species in the C gloeosporioides complex[J]. Persoonia, 2015, 35(1): 63-86.
[4] WANG Y C, HAO X Y, WANG L, et al. Diverse Colletotrichum species cause anthracnose of tea plants (Camellia sinensis (L.) O. Kuntze) in China[J/OL]. Scientific Reports, 2016, 6(1): 35287. https://doi.org/10.1038/srep35287.
[5] 王玉春, 郝心愿, 黄玉婷, 等. 中国主要茶区茶树炭疽菌系统发育学[J]. 中国农业科学, 2015, 48(24): 4924-4935.
[6] 贡长怡. 茶树炭疽病菌的致病力分析及其对四种常规药剂的敏感性[D]. 合肥: 安徽农业大学, 2020.
[7] 刘威, 袁丁, 尹鹏, 等. 茶树炭疽病的研究进展[J]. 热带农业科学, 2016, 36(11): 20-26.
[8] 王国君, 熊建伟, 陈利军. 几种杀菌剂对信阳茶树炭疽病的防治效果评价[J]. 农药, 2016, 55(8): 604-606.
[9] 陈俊华, 郭世保, 李刚, 等. 信阳茶树炭疽病菌对5种杀菌剂的敏感性[J]. 福建林业科技, 2015, 42(4): 42-47.
[10] 姚秋荣, 肖宏俊. 杀菌剂阿砣防治茶树炭疽病的试验报告[J]. 新农业, 2021(18): 81.
[11] 李学俊, 任圆, 陈红梅, 等. 大粒咖啡炭疽病病原菌形态和分子鉴定及杀菌剂筛选[J]. 热带作物学报, 2024, 45(6): 1273-1281.
[12] 黄艳花, 崔忠吉, 蒙成, 等. 紫果西番莲顶枯病病原菌生物学特性分析及室内杀菌剂毒力测定[J]. 广西农学报, 2023, 38(4): 32-42.
[13] 张琳, 彭琳, 邵郅伟, 等. 南瓜炭疽病菌Colletotrichum brevisporum生物学特性及药剂防治[J]. 植物保护, 2021, 47(4): 59-65.
[14] 董金龙. 红心莲毁灭炭疽病菌生物学特性及高效安全药剂筛选[J]. 福建农业学报, 2022, 37(8): 1067-1071.
[15] 李静宇, 蒲小明, 蒲浩杰, 等. 8种杀菌剂对梅片树炭疽病菌的室内毒力测定[J]. 农业研究与应用, 2021, 34(4): 62-67.
[16] 饶家瑞, 孟泽洪, 李帅, 等. 14种农药对茶炭疽病病原Colletotrichum camelliae的抑制活性[J]. 贵茶, 2022(3): 37-43.

