茶叶中农药残留常规检测方法研究进展

摘要:茶叶作为全球广泛消费的饮料,在全球食品安全意识不断提升的背景下,其农药残留问题引起了人们的高度关注,各国政府和相关机构都在不断加强对农药残留的监管和检测,而对茶叶中农药残留进行检测是确保茶叶安全性的有效手段。文章概述了茶园中常用农药的应用情况,介绍了固相萃取技术和QuEChERS这2种在茶叶农残检测中常用的前处理技术,综述了气相色谱法、高效液相色谱法、气相色谱-质谱联用法、气相色谱-串联质谱联用法和液相色谱-串联质谱联用法等常规方法在茶叶农药残留检测中的应用。阐述了这些方法的工作原理、技术特点以及应用现状,并对其发展前景进行展望,旨在为今后茶叶中农药残留分析研究提供参考。
关键词:茶叶;农药残留;前处理;色谱法;色谱质谱联用法
中图分类号:TS272.7;S481.8 文献标识码:A 文章编号:1000-3150(2024)08-01-13
中国是世界第一大产茶国,据统计,2023年全国18个主要产茶省的茶园总面积为343.31万hm2,干毛茶总产量为333.95万t,总产值再创历史新高,达到3 296.68亿元[1]。茶叶作为中国重要的经济作物和出口农产品,其产品质量安全对促进茶叶经济的发展和保障消费者的生命健康至关重要。而茶产品质量安全问题主要涉及农药残留、重金属、微生物、异物及粉尘等有害物污染[2]。赵丽等[3]对2016—2020年欧盟通报数据分析发现,农药残留超标问题占茶叶质量安全问题总量的80%。这说明农药残留是茶产品中最常见且最需要关注的质量安全问题。根据欧盟官网的数据统计,2021—2023年3年间,出口至欧盟的中国茶叶产品农药残留超标批次中,呋虫胺、唑虫酰胺、三氟氯氰菊酯和毒死蜱的残留超标情况尤为突出。其中,呋虫胺被通报的频率最高,唑虫酰胺、三氟氯氰菊酯次之,毒死蜱紧随其后。可见在茶叶生产中,可能缺乏对这些农药的严格管控以及足够的监管和检测能力,从而影响了中国茶叶的出口。因此,加强农药规范使用的管理、提升农药残留的检测技术水平,以及严格遵循国际市场的安全标准对于我国茶叶出口至关重要。
对茶叶中农药残留的检测是保障茶叶质量安全的关键环节。茶叶中农药残留常规检测方法主要包括气相色谱法(GC)、高效液相色谱法(HPLC)以及它们的联用技术,如气相色谱-质谱联用法(GC-MS)、气相色谱-串联质谱联用法(GC-MS/MS)和液相色谱-串联质谱联用法(LC-MS/MS)等。这些方法以其高灵敏度、高选择性和高准确性在茶叶农药残留检测领域发挥了重要作用。本文围绕茶园常用农药种类以及茶叶中农药残留常规检测技术进行综述,并对茶叶中农药残留检测技术的未来发展趋势进行探讨,以期为今后茶叶农药残留检测技术研究提供参考。
1 茶园农药应用情况
茶园常用农药根据其化学结构可大致分为有机氯类农药、有机磷类农药、氨基甲酸酯类农药、拟除虫菊酯类农药和有机杂环类农药[4]。我国从上世纪中期开始,在茶园中使用化学农药,当时以六六六(HCH)和滴滴涕(DDT)等有机氯类农药为主。有机氯类农药挥发性低、药效强,是最早合成的高效广谱杀虫剂,但其毒性高、不易降解,易通过食物链在动物及人体脂肪中高度蓄积,严重危害人体健康[5]。1972年农业部颁布命令禁止HCH和DDT在茶园中使用,现已全面禁止有机氯类农药在茶叶种植中应用。自20世纪60年代起,我国开始在茶园中使用敌敌畏等有机磷类农药。
有机磷类农药由于其在功能上可以取代有机氯类农药,并且更易降解、环境污染更小,在生物体内一般不蓄积,因此得到快速发展,曾是我国大量生产和广泛使用的农药之一[6]。茶叶中常用的有机磷类农药主要有乐果、毒死婢、甲胺磷、水胺硫磷、草甘膦等。有机磷类农药挥发性强,药效强、杀虫谱广、残效期较短、价格低廉[7]。但有机磷类农药中有不少品种对生物体的急性毒性很强,若有机磷类农药摄入过量,人体可能出现昏迷和呼吸衰竭的症状,甚至死亡[8]。
氨基甲酸酯类农药是20世纪中期迅速发展起来的高效广谱杀虫剂,其极性强、热稳定性差,具有杀虫效果显著、低毒、分解快、代谢迅速、残留期短及选择性强等特点[9]。茶叶中常用的氨基甲酸酯类农药主要有氧乐果、灭多威、涕灭威、呋喃丹等。该类农药与有机磷类农药相比,毒性相对较低[10]。此外,多数氨基甲酸酯类农药使用后能够很快转化为相应的代谢产物,且这些代谢产物往往具有与母体相同甚至更强的生物活性。因此,测定氨基甲酸酯类农药残留量时,必须考虑其代谢产物的测定[11]。因其生物毒性低于有机磷类农药,且分解快,在环境中的持久性弱于有机氯农药,该类农药已经成为有机氯类等持久性农药良好的替代品[12]。
拟除虫菊酯类农药是一类仿照天然除虫菊酯成分结构合成的仿生杀虫剂[13]。从20世纪80年代中期起,拟除虫菊酯类农药被广泛应用于茶树虫害的防治。茶叶中常用的拟除虫菊酯类农药有联苯菊酯、氯氰菊酯、溴氰菊酯等[14]。相较于有机磷、氨基甲酸酯类农药,该类农药具有使用浓度低、活性位点高、触杀作用强、灭虫速度快、低毒、杀虫谱广等特点。虽然该类农药对哺乳动物的毒性较低,但由于其亲脂性和长期广泛使用,很容易通过食物链在生物体中积累[15]。此外,拟除虫菊酯类农药进入水体后,会对鱼、虾、蟹类等水生生物造成毒害,不仅影响水生生物的繁殖和生长,还会损害水质,恶化水生生物的生存环境。当人类食用了含有该类农药残留的水产品后,其农药残留会转移到人体中,可能导致人体多功能受损,严重时甚至可能危及生命[16]。
有机杂环类农药是继拟除虫菊酯类农药之后杀虫剂合成史上的重大突破。其对茶小绿叶蝉具有良好的防治效果,在茶园害虫管理中被广泛采用[17]。茶叶中常用的有机杂环类农药主要有吡虫啉、啶虫脒和噻虫嗪等。该类农药杀虫效果强,对哺乳动物、水生动物和鸟类的毒性较低,与环境相容性高,并且与其他常用农药没有交互作用[18]。但这些杀虫剂通常残留期长,不易降解,对人畜有毒。其中毒的常见症状包括头痛、呕吐、疲劳、心率加快、血压升高、意识丧失,随后可能出现呼吸困难、肝肾功能障碍、昏迷,严重情况下甚至可能导致死亡。
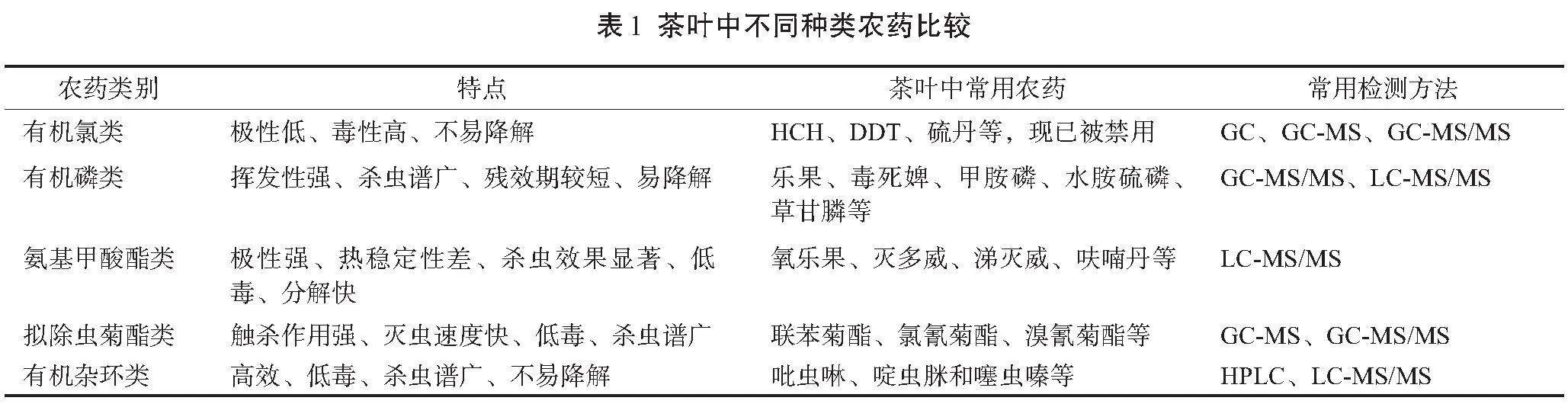
结合茶园常用的农药及相关的报道,可知目前在茶叶生产中常用的农药包括有机杂环类和拟除虫菊酯类农药,有机磷类、拟除虫菊酯类和有机杂环类农药在茶叶中残留的现象比较常见,经常被检出超标的农药主要有呋虫胺、唑虫酰胺、啶虫脒、三氟氯氰菊酯、毒死蜱等。因不同类型农药的结构和性质存在差异,其采用的常规检测方法也不尽相同,茶叶中常用农药的特点及常规检测方法如表1所示。
2 茶叶中农药残留常规检测方法
茶叶中农药残留分析是一项综合性技术,需要高灵敏度、高精密度的分析操作手段。由于茶叶含有丰富的化学成分,极易干扰痕量目标农药的测定,因此茶叶农药残留的检测包括前处理和进样检测两大部分。
2.1 茶叶中农药残留的前处理方法
茶叶样品的前处理包括提取和净化2个部分,旨在从复杂的茶叶基质中分离出目标分析物,同时去除可能干扰检测的非目标物质。该步骤在整个检测流程中起着关键的作用,并在很大程度上决定检测结果的准确度和精密度。而由于各类农药结构和性质的差异,其前处理方法各不相同,常见的农药残留前处理方法有固相萃取(SPE)、固相微萃取(SPME)、液液萃取(LLE)、QuEChERS(Quick, Easy, Cheap, Effective, Rugged, and Safe)方法等,而茶叶农药残留常规检测中多数采用SPE和QuEChERS方法对茶叶样品进行前处理。
2.1.1 固相萃取技术
SPE是茶叶农药残留检测中一种重要的前处理技术,其通常采用有机溶剂对茶叶样品进行萃取处理,所得的萃取溶液经过固相萃取柱(SPE填料5d854270f53f7117ce449b5273972c584a1ee4d06486b66a102701ea08dcde2f)能有效捕获目标农药,同时将其他干扰物质留在溶液中,继而使用特定的洗脱液将目标农药从固相萃取柱上洗脱下来,从而实现茶叶样品的分离和净化[19]。因具有净化速率快、净化效果好、回收率高、重现性好、基质干扰小、可实现仪器自动化等优点,SPE广泛应用于茶叶农药残留检测的前处理中。茶叶样品前处理常用的固相萃取柱有N-丙基乙二胺(PSA)、石墨化碳黑(GCB)、十八烷基硅烷键合硅胶(C18)、弗罗里硅土(Florisil)、Cleanert TPT茶叶专用柱及其他复合材料等。随着纳米材料技术的快速发展,新型材料如多壁碳纳米管(MWCNTs)、石墨烯(GO)等也已被广泛应用于茶叶农药残留检测的前处理过程中。王艳丽等[20]以茶叶中45种有机磷农药为研究对象,采用乙腈对茶叶样品进行提取,经TPT固相萃取柱净化,以体积比为3∶1的乙腈-甲苯混合溶液进行洗脱,有效实现了茶叶样品的分离与净化。陈昌梅等[21]采用乙腈作为提取溶剂、石墨化炭黑-氨基复合柱(GCB/NH2)作为固相萃取小柱对茶叶进行前处理,满足了茶叶复杂基质中多种农药残留的痕量检测需求。林明霞[22]比较了GCB/NH2柱、石墨化炭黑/乙二胺-N-丙基硅烷基化硅胶复合柱(GCB/PSA)和Cleanert TPT固相萃取柱这3种复合固相萃取柱对茶叶样品中6种农药组分的净化效果。研究结果表明,GCB/NH2柱和GCB/PSA柱具有相近的净化效果,Cleanert TPT柱更适用于含二苯醚类农药样品的净化。此外,固相萃取技术的提取净化效果受到多种因素的影响,如提取溶剂和提取方法的选择、所使用的净化材料和洗脱溶剂等。张帆等[23]采用SPE结合超高效液相色谱-串联质谱(UHPLC-MS/MS)方法,实现了茶油中12种氨基甲酸酯类农药残留的检测。在研究中,对振荡提取和超声提取两种提取技术在茶油样品中12种农药的回收率进行了对比分析,结果显示超声提取法的提取回收率较高。通过比较GO、MWCNTs和C18固相萃取小柱对茶油中12种农药的吸附净化效果,发现GO小柱的回收效果差,MWCNTs和C18固相萃取小柱均表现出较好的农药回收率,但与MWCNTs相比,C18小柱在去除样品基质干扰方面略差,故选择MWCNTs作为净化材料。研究中还比较了不同用量(2、4、6、8、10 mL)的洗脱溶剂乙腈对目标物的洗脱效果,最终确定洗脱溶剂乙腈的用量为8 mL。
随着新型固相萃取材料的持续开发,固相萃取技术进一步增强了茶叶的提取净化效果。Gao等[24]开发了一种基于氮杂大环结构的新型固相萃取吸附剂,并将其与HPLC技术结合,用于检测茶饮料中的微量有机磷类农药。研究结果表明,这种氮杂环类吸附剂具有良好的提取性能,在处理茶饮料复杂基质时,对于有机磷农药的提取表现出巨大的应用潜力。胡高华等[25]开发了一种壳聚糖/氧化石墨烯/硅藻土固相萃取柱作为净化剂,通过研究其对茶叶基质的吸附作用,发现该新型固相萃取净化柱可以高效吸附去除茶叶基质,大大降低基质效应,绿茶、红茶和乌龙茶中农药的基质效应分别下降了4.7%~66.5%、3.2%~35.5%和4.4%~42.8%。
2.1.2 QuEChERS方法
QuEChERS是一种新兴的农药残留检测的前处理方法,由美国农业部(USDA)的科学家Anastassiades等人在2003年提出,因其快速、简便、低成本、高效、耐用且安全的特点而得名[26]。QuEChERS通过将吸附剂均匀地分散于茶叶提取液中,随后通过快速涡旋混合,有效地捕获茶叶样品中的干扰物质,从而实现样品快速、高效且经济的分离提取。其常用的吸附剂种类与SPE填料类似。该方法因其操作的简便性和出色的净化效果,已在茶叶农药残留分析中被广泛采用,并且也得到了不断改进和优化。袁荷芳等[27]采用C18、PSA、GCB和无水硫酸镁混合型吸附剂,通过固相分散萃取(dSPE)的方法来净化茶叶样品,结合UHPLC-MS/MS对茶叶样品进行分析,从而建立了茶叶中250种农药残留及代谢物的检测方法。Chen等[28]用Florisil、C18和GCB的混合物作为吸附剂,对QuEChERS方法进行了改进,再结合UHPLC-MS/MS,成功分析了茶叶样品中37种拟除虫菊酯类农药的典型代谢物。
随着分析技术的不断发展,多种新型净化剂的引入增强了QuEChERS方法在茶叶农药残留检测中的应用。林金俗等[29]采用羧基化多壁碳纳米管作为吸附材料,利用这一优化后的QuEChERS方法,结合三重四极杆气质联用技术,建立了茶叶中16种农药残留的分析方法。周超等[30]以茶叶中17种有机磷类农药为研究对象,采用基于新型净化剂MWCNTs、传统的QuEChERS法、TPT茶叶农药残留检测专用柱和GCB/NH2固相萃取柱这4种前处理方法对茶叶样品进行提取净化,通过比较4种方法的净化效果和农药残留回收率发现,MWCNTs的回收率较好,是最佳的前处理方法。许芮菡等[31]以茶叶中10种拟除虫菊酯类农药为研究对象,比较了在基础净化剂200 mg PSA和200 mg C18的基础上,再加入单壁碳纳米管、MWCNTs、氨基化多壁碳纳米管和石墨烯4种碳纳米材料和其不同用量下的净化效果,研究结果表明最佳的前处理净化剂为60 mg MWCNTs、200 mg PSA和200 mg C18。周书威等[32]制备了一种均匀稳定的Fe3O4负载石墨化碳黑磁性纳米材料(GCB/Fe3O4)作为净化剂,研究了GCB/Fe3O4对茶叶中色素、多酚等干扰物质的吸附性能。结果表明,其不仅具有良好的吸附净化效果,还具备磁性,操作更简便快捷,节约了净化时间。
因此,不同的前处理技术具有不同的特点。随着前处理技术的创新,茶叶样品的净化效果得到增强,同时也有助于降低分析成本。在茶叶农药残留检测中,应基于茶叶样品的特性、目标农药的类别及其性质等因素,选择适宜的前处理技术,实现在茶叶复杂基质背景下,对目标农药的有效富集及净化。
2.2 茶叶农药残留的常规检测技术
茶叶样品经前处理后,根据目标待测物的特性选择合适的检测技术进行进样检测分析。茶叶农药残留的常规检测技术主要有GC、HPLC以及色谱和质谱联用的方法。其中,色谱-质谱联用技术因其高灵敏度和选择性,广泛应用于茶叶中农药残留的分析,包括GC-MS、LC-MS、GC-MS/MS)、LC-MS/MS,以及液相色谱-高分辨质谱(LC-HRMS),如液相色谱-飞行时间质谱(LC-TOF MS)和液相色谱-静电场轨道阱质谱(LC-Orbitrap MS)等。
2.2.1 气相色谱法
GC依据目标化合物的沸点、极性以及吸附能力的差异,采用气体作为流动相,实现混合物中各组分的分离和分析。待分析的样品首先在汽化室中汽化转化为气态,随后由惰性气体(载气)携带进入填有固定相的色谱柱。样品中的各组分根据其沸点、极性或吸附特性,在色谱柱内经历多次分配和吸附/解吸附过程,随后流出进入检测器,检测器将组分的物理化学特性转换为电信号,通过放大和记录这些信号,得到能直观展示样品中各组分的分离情况的气相色谱图。继而根据色谱图中物质的出峰顺序和保留时间实现定性分析,根据物质的峰面积或峰高实现定量分析[33]。Soltani等[34]采用GC检测不同样品中的农药,通过比较实际样品与标准溶液的色谱图,实现5个实际样品中农药残留的定性定量分析。GC技术因其操作简便、分析快速、分离高效、选择优异、检测灵敏以及适用微量样品检测,于茶叶农药残留检测中被广泛应用。GC适用于热稳定性好、极性较低、易挥发的农药残留的检测,如有机磷、有机氯以及拟除虫菊酯类农药[35]。
此外,还可根据待测农药的结构和元素组成的不同选择相应的检测器以提高检测的灵敏度。在茶叶农药残留检测中应用最多的是电子捕获检测器(ECD)、氮磷检测器(NPD)和火焰光度检测器(FPD)。ECD对含卤素的化合物敏感,因其对含强电负性元素或基团的农药具有高灵敏度而广泛应用于茶叶中有机氯类和拟除虫菊酯类农药的分离与测定[36]。Liu等[37]应用配有ECD的气相色谱仪,对茶叶中的有机氯和拟除虫菊酯类农药残留进行了定量分析。研究发现所有目标农药的最低检测限(LOD)介于0.04~1.00 μg/L之间,所有农药的相对回收率在80.0%~120.8%范围内,相对标准偏差(RSD)在0.8%~19.9%之间。说明所采用的气相色谱仪配合ECD的方法具有较好的准确性和重复性,能有效实现茶叶中有机氯类和拟除虫菊酯类农药的检测。但该检测器也存在一定的局限性,其线性响应范围较窄,且对温度和载气流速的变化较为敏感,因此在使用GC-ECD分析茶叶农药残留时需要严格控制试验条件。NPD对于含氮、磷元素的有机化合物具有较高的检测敏感性,被广泛应用于茶叶中有机磷和氨基甲酸酯类农药残留的检测,该检测器灵敏度高,选择性强。游飞明等[38]使用配有NPD的气相色谱仪同时测定茶叶中16种有机磷农药残留,用固相萃取方法对茶叶样品中的目标农药进行提取净化。研究结果表明,使用氮磷检测器的气相色谱仪可以实现对茶叶中有机磷农药残留的分析测定,其回收率在62.8%~109.1%之间,RSD小于14.7%,16种有机磷农药的检出限在0.01~0.16 mg/kg之间,各项技术指标均已达到测定的要求。但该检测器性能的稳定性和耐用性存在一定的局限性,重现性较差且使用寿命相对较短,使用成本较高[36]。FPD则对含硫和磷的物质敏感,对茶叶中含磷农药的选择性高、灵敏度强。黎亭等[39]使用GC配FPD对茶叶中的10种有机磷农药进行检测。对茶叶样品采用乙腈溶剂和超声波提取,经固相萃取柱净化,使用弱极性柱石英毛细管柱分离。结果在0.05~1.00 mg/kg范围内呈现出规则的线性分布。有机磷农药在0.02~1.00 mg/kg残留水平下,该方法的回收率为80%~102%,检测限低至0.002~0.013 mg/kg。Moinfar等[40]的研究结果也证实了这一点,该研究采用配有FPD的气相色谱仪来实现茶叶中有机磷农药残留的测定。研究结果显示该方法对茶叶中所有目标农药的最低检测限为0.030~1.000 μg/kg,所有目标农药的回收率在83.3%~117.4%范围内,RSD在3.0%~7.8%之间。该检测器使用成本低,但稳定性相对较差,且对载气的要求较高。因此,在茶叶农药残留的实际检测中,应针对农药类型选择与之适配度高的检测器,从而提高气相色谱分析的精密度和灵敏度。
但气相色谱分析也存在一定的局限性。首先,该方法不适用于分析对热不稳定、难于气化和极性较强的农药。其次,GC的抗干扰能力差,茶叶基质复杂,通过GC进行茶叶农药残留分析时,对前处理要求严格;此外,由于GC是依据保留时间进行定性,这可能导致结构相似化合物的误判,从而出现“假阳性”结果[41]。在没有质谱的条件下,采用双柱色谱分析技术可以有效提升分析的准确性。这种技术通过对比同一种物质在两根不同极性的毛细管柱上的保留时间差异,进行双重色谱柱验证,以减少假阳性的产生,降低误判的可能性。卢剑等[42]采用气相色谱双柱法对茶叶中多种有机氯和拟除虫菊酯类农药残留进行了测定。该研究采用了DB-1701和DB-35ms两种不同极性的毛细管色谱柱,结合微电子捕获检测器实现了对茶叶中农药残留的分析。在DB-1701色谱柱上,25种目标农药的检测限在0.000 6~0.500 0 mg/kg范围,其平均回收率为81.76%~118.16%,RSD在1.42%~9.56%之间。而DB-35ms色谱柱的检测限范围为0.000 4~0.500 0 mg/kg,对应的平均回收率介于72.02%~119.23%之间,RSD在0.21%~5.77%之间。因此,气相色谱双柱法,提高了对目标化合物定性与定量分析的准确性,并有效缩短了阳性样品验证的时间。在缺乏质谱联用技术的条件下,气相色谱双柱法能有效提高茶叶农药残留分析的可靠性。
2.2.2 高效液相色谱法
HPLC是采用液体作为流动相,基于待分离物质在极性和吸附性上的差异,以实现混合物中各组分的有效分离与鉴定。在传统的液相色谱基础上,融合气相色谱的理论基础,引入高压输送系统、高性能色谱柱以及高灵敏的检测器等诸多方面的关键技术,从而发展出一种既快速又高效的新型分离分析技术,即HPLC。HPLC因分离效率高、速度快、流动相选择范围广等优点,在茶叶农药残留检测中被广泛应用。与GC技术相比,HPLC不需要考虑样品的挥发性和热稳定性,适用于具有高沸点、较差热稳定性、不易挥发的农药残留的定量测定,如氨基甲酸酯类和N-甲基氨基甲酸酯类[19]。因此,在对茶叶样品进行适宜的前处理后,可采用HPLC检测茶叶中这类农药的残留量。在HPLC系统中,待分析的样品从进样口进入,被流动相由高压泵泵入色谱柱,样品中的各组分根据其与固定相的亲和力强弱不同而以不同的速率移动,从而实现样品中各组分的有效分离,流出的各个组分基于其自身特性随后通过检测器进行检测,并记录下它们的保留时间和响应信号形成色谱峰,继而实现对目标分析物的定性和定量分析[33]。在整个分析过程中,流动相的选择至关重要。在对茶叶农药残留采用HPLC进行分析时,流动相通常集中在甲醇-水和乙腈-水两种主要的溶剂体系中。其中,乙腈因其强大的洗脱能力、较低的黏度以及相对较低的系统压力使其在HPLC分析中能够提供快速的分析和较高的分离效率。但乙腈的成本较高,且具有一x76rK93uhIXL3XCML9zYR4qa8rZDK/XrAT+3RzfWoSg=定的毒性。而甲醇具有较低的毒性和成本优势,但其可能导致系统压力较高,且洗脱能力不如乙腈[43]。在实际的茶叶农药残留检测中,需要根据样品特性和具体的分析目标来确定流动相的组成和比例。
HPLC分析中通常使用紫外检测器(UV)、二极管阵列检测器(DAD)和荧光检测器(FL)。UV是基于茶叶样品中残留的农药对紫外光的吸收特性进行检测,其结构简单、灵敏度高、对环境温度和流速不敏感,可用于梯度洗脱。Kim等[44]采用高效液相色谱法-紫外检测器测定绿茶中的醚菊酯,该方法的LOD和定量限(LOQ)分别为0.006、0.020 mg/kg,分析线性在0.02~2.00 mg/kg范围内时,具有良好的线性关系,回收率在89.9%~94.6%范围内,RSD小于5%,说明这个配有紫外检测器的高效液相色谱仪,在检测绿茶中醚菊酯农药时表现出良好的性能。DAD是紫外检测器的一个重要进展,同样适用于茶叶中有紫外吸收特性农药残留的检测。DAD采用光电二极管阵列为其检测元件,能够在一次进行过程中,同时捕获样品的色谱图谱和光谱数据。通过分析色谱图谱中的保留时间规律以及光谱中的特征吸收峰,对样品进行综合定性分析,一定程度上增加结果的可靠性,但灵敏度较UV差。楼正云等[45]采用配有二级管阵列检测器的高效液相色谱仪测定茶叶中吡虫啉农药残留量。茶叶样品用乙腈提取,经C18固相萃取柱净化,用乙腈洗脱。茶叶中的最低检出水平为0.01 mg/kg,其检测的灵敏度、准确度和重复性均符合茶叶农药残留分析的技术要求。FL是一种灵敏度很高、选择性很好的检测器,适用于检测茶叶中具备荧光特性或经衍生化处理后可以产生荧光响应的农药,例如氨基甲酸酯类农药[36]。王晓亮等[46]采用配备FL和柱后衍生装置的高效液相色谱仪,对茶叶中10种氨基甲酸酯类农药残留进行了测定。该研究采用QuEchERs方法对茶叶样品进行前处理。方法的检出限为0.01~0.02 mg/kg,平均加标回收率为81.98%~95.59%,RSD为1.22%~4.98%,说明该方法准确度高、精密度好,适用于茶叶中氨基甲酸酯类农药残留的检测。因此,在对茶叶农药残留进行HPLC分析时,应根据目标分析物特性和具体的分析需求来选择合适的检测器。
2.2.3 色谱-质谱联用技术
茶叶农药残留检测中,无论是采用GC还是HPLC技术,均需要先将茶叶样品中的各个组分进行有效分离,再逐个进入检测器进行分析。但由于茶叶本身的化学组成非常复杂,在色谱分析时易发生干扰物与目标物在色谱柱中表现出相似保留时间的现象,这可能导致误判,即色谱分析极易出现“假阳性”结果。而质谱法借助离子化技术,将目标农药电离成离子态,随后利用质量分析器和检测器将这些离子按照质荷比大小分离,形成特征的质量谱图。通过比对标准物质的质谱图或质谱数据库的检索,结合特征离子的信号强度,从而对各农药残留组分进行精确地定性和定量分析,极大地避免色谱分析中出现的“假阳性”问题[47]。
质谱分析仪主要由进样系统、离子源、质量分析器和检测器组成。离子源是质谱分析仪的“心脏”,可使待测样品被电离成离子,常用的电离方式有电子轰击电离(EI)、化学电离(CI)、电喷雾电离(ESI)和大气压化学电离(APCI)等。质量分析器是质谱分析仪的另一个核心组件,其依据离子的质荷比(m/z)大小将离子源产生的离子进行分离,进而产生可被检测器捕获的离子信号。质谱分析仪的类型一般就是按照质量分析器来划分的,而质量分析器的性能参数,如分辨率、灵敏度和精确度是衡量质谱分析仪性能的关键。常见的质量分析器有四极杆质量分析器(Q)、离子阱质量分析器(IT)、飞行时间质量分析器(TOF)及傅里叶变换离子回旋共振质量分析器(FT ICR)等[36]。尽管质谱法具有特异性强和灵敏度高的特点,但是其对进样纯度要求高,故对样品的前处理要求严苛,而气相色谱仪和液相色谱仪就是质谱法理想的“进样器”。因此色谱-质谱联用技术,因兼具色谱的高效分离特性和质谱的高分辨率特性而被广泛应用于茶叶农药残留检测中,是当前茶叶农药残留分析的主流技术。如GC-MS、GC-MS/MS、LC-MS及LC-MS/MS等,茶叶中农药残留的色谱-质谱联用检测实例如表2所示。其中,若与气相色谱或液相色谱连接的是单质谱,可以采用选择离子监测方式(SIM),即选择目标化合物的某个或某些特征离子进行跳跃式扫描检测,在这种模式下,质谱仪的离子源会忽略所有其他离子,只允许目标离子通过质量分析器,从而显著提高检测灵敏度。若连接的是串联质谱,则可以采用多反应选择监测方式(MRM),即在目标化合物的一级质谱中选择1个母离子,通过特定的碰撞诱导解离产生子离子,再从形成的子离子中选择某个或某些特定的离子进行扫描检测,通过同时监测多个特定的离子对,即母离子和对应的子离子,从而提高分析的特异性[48]。
气相色谱-质谱联用仪是在气相色谱高效分离的基础上,结合质谱高分辨率鉴定农药组分的特点形成的一种分析技术。该技术是目前最成熟的一种联用技术,被广泛应用于茶叶中农药残留的分析,主要适用于茶叶中易挥发且具有良好热稳定性的农药残留的检测。气相色谱-质谱联用仪最为典型的离子源是电子轰击电离源,它主要适用于低沸点农药的电离。通过高能电子束直接撞击样品分子,导致分子失去电子形成带正电荷的分子离子。这些离子随后会通过质量分析器继续断裂,进一步分离产生一系列碎片离子,再被送入检测器检测[61]。相较于单气相色谱法,其常用的检测器如电子捕获检测器、氮磷检测器、火焰光度检测器等都具有一定的局限性,而质谱仪作为理想的“检测器”,能检测出几乎全部化合物,并且可以选择性地检测目标农药的特征离子,根据目标待测物的保留时间与特征碎片离子双重效果作为定性定量依据,有效地降低了基质和杂质峰的干扰,极大地避免了GC分析过程中出现定性误判的问题,检测灵敏度大大增强,在茶叶农药残留分析中广泛应用。陈泽宇等[62]采用了气相色谱-负化学离子源-质谱-选择离子监测(GC-NCI-MS-SIM)同时测定云南茶叶中7种农药残留量。通过NCI的电离方式,在全扫描模式下得到各待测农药的质谱图,依据各待测农药的质谱图来确定每个农药的特征离子(1个定量离子、2个参考离子)。其中,定量离子是用于定量分析的特定离子,选择相对丰度最高的特征离子作为定量离子;而参考离子则用于辅助定性分析。
尽管GC-MS能够提供农药的分子离子碎片信息,从而为待测物的结构鉴定提供重要依据,但GC-MS仍存在一定的不足,因茶叶成分复杂,多种化合物的离子信号可能会相互重叠,从而使其谱图解析难度较大,因此,为了解决这一问题,GC-MS/MS技术应运而生,其通过在质谱仪中增加1个或多个质量分析器,更精确地实现茶叶中农药残留的定性定量分析。在GC-MS/MS中,第一级质谱主要用于初步的分离和选择性筛选,经过碰撞裂解后,再由第二级质谱裂解产生特征离子的离子碎片,从而在一定程度上降低茶叶基质干扰,优化质谱检测信号,也可以防止GC-MS检测中未检测出实际存在的物质或因干扰物质一级碎片相同而出现“假阴性”的可能[47]。杨广等[63]比较了GC、GC-MS和GC-MS/MS 3种技术对茶叶中拟除虫菊酯类农药残留的检测结果。研究发现配有火焰离子化检测器(FID)的GC能够检测到氯氰菊酯、氰戊菊酯和溴氰菊酯的存在,而GC-MS未能检测出任何农药残留。此外,GC-MS/MS虽然检测出了溴氰菊酯,但其检测到的含量低于GC的检测结果。这表明,采用GC检测茶叶中农药残留时,仅根据保留时间会将杂质错误地定性为目标物,出现假阳性的可能性很大;采用GC-MS检测茶叶中的农药残留时,因其可根据保留时间和特征离子双重效果进行定性定量分析,有效地排除了假阳性结果的发生。但是该研究采用GC-MS检测时,因受到样品杂质的干扰,未能检测出实际存在的农药残留,从而导致假阴性结果的产生。而GC-MS/MS通过选择性地对目标物质的特征母离子进行二次电离,有效排除了其他物质的干扰,从而获得了正确的检测结果。该技术不仅避免了GC检测可能产生的假阳性问题,也防止了GC-MS检测中出现的假阴性情况,确保了检测结果的准确性和可靠性,实现了对茶叶中农药残留的精确定性和定量分析。
利用MS/MS可以同时得到较低的检测限和良好的结构鉴定信息,同时还可以采用MRM和SIM模式,提高分析效率,实现对复杂样品中目标化合物的准确鉴定和定量,在茶叶农药残留分析中应用非常广泛[61]。李福敏等[64]利用气相色谱-三重四极杆串联质谱技术(GC-QqQ-MS/MS),实现了茶叶中12种有机氯农药残留的分析。茶叶样品经前处理后,根据GC-QqQ-MS/MS母离子和子离子一一对应的多反应检测模式,采用全扫描方式得到12种有机氯农药标准物质的总离子流色谱图,以确定目标化合物的母离子及其保留时间。进一步通过子离子扫描技术对碰撞能量进行优化,以确保获得响应最高的子离子信号。在此基础上,采用MRM模式,选出特征性强、背景干扰小的两对特征离子对分别作为定性离子对和定量离子对。通过对目标化合物的母离子、子离子及碰撞能量等质谱参数的精确优化,实现了对目标化合物精确的定性分析和优异的分离效果。12种有机氯农药在0.005~0.100 μg/mL范围内表现出良好的线性响应(R2>0.999 0);在0.01、0.04、0.10 μg/mL 3个添加水平下,平均加标回收率为69.30%~97.02%;RSD为0.56%~9.27%;12种有机氯农药的检出限均小于1 μg/kg。
LC-MS/MS技术是在液相色谱高效分离的基础上,结合质谱的高分辨率鉴定农药组分的特点形成的一种茶叶复杂基质中痕量农药残留检测技术,主要适用于茶叶中具有高沸点和热不稳定性农药残留的检测。在LC-MS/MS技术中,茶叶样品首先进入液相色谱中进行高效分离,随后进入高灵敏度的质谱检测中,通过时间和质荷比实现待测农药的定性和定量分析。由于液相色谱的一些特点,使其在联用时比GC-MS困难得多。液相色谱是液体的分离技术,而MS是要求在真空系统中工作;此外,液相色谱法(LC)通常适用于分析难以挥发或热不稳定的化合物,这在一定程度上与MS中常用的离子源要求样品汽化是不相适应的,因而将两者匹配起来的困难导致液质联用后于GC-MS发展。电喷雾电离、大气压化学电离等软电离技术,成功地解决了液相色谱和质谱联用的接口问题,使LC-MS逐渐发展成为成熟的技术,成为测定茶叶中农药残留的重要分析方法之一,目前在茶叶农药残留检测领域中使用的离子源以电喷雾电离源和大气压化学电离源居多[31]。
LC-MS/MS是LC-MS的进一步发展,其在质谱仪中增加了一个或多个质量分析器,从而实现对离子进一步的碎裂,产生更详细的碎片信息,通过检测特定的母离子和其碎片离子,使其在结构鉴定方面更加强大,实现更高的选择性和灵敏度。仲伶俐等[65]对超高效液相色谱-串联质谱法(UPLC-MS/MS)和高效液相色谱法(HPLC)两种方法在检测茶叶中10种氨基甲酸酯类农药残留的应用进行了比较分析。研究结果显示,UPLC-MS/MS和HPLC两种方法都展现出了较好的分析性能。UPLC-MS/MS技术在较低的添加水平(0.01~0.10 mg/kg)下,能够达到75.2%~115.6%的回收率,并且RSD为4.4%~16.7%。而HPLC法在稍高的添加水平(0.05~1.00 mg/kg)下,回收率在82.7%~120.7%范围内,RSD为0.8%~12.9%之间。而在检测限方面,UPLC-MS/MS展现出更低的检出限(0.02~0.30 µg/kg),HPLC分析的检出限较高,为3.0~7.5 µg/kg。因此,UPLC-MS/MS技术因其更高的灵敏度和选择性,在茶叶中多种农药残留的痕量检测方面更具有优势。余璐等[66]建立了一种基于超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF/MS)技术的用于茶叶样品中204种农药残留的高效筛查与准确鉴定方法。采用固相萃取技术对茶叶样品进行前处理后利用UPLC-Q-TOF/MS进行检测,建立了茶叶中204种农药的一级精确质量数据库和二级谱图库。在3个添加水平下的平均回收率为68.1%~117.2%,RSD为3.1%~18.9%,定量限均小于10 μg/kg。方俊兰等[67]开发了一种优化的QuEChERS/超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(QuEChERS/UHPLC-Q Exactive Orbitrap MS)技术,用于茶叶中166种农药残留的同步检测分析。通过改进的QuEChERS前处理技术,采用可加热电喷雾离子源(HESI),以全扫描模式下的精确分子离子为定量离子,特征碎片离子与二级质谱信息定性。利用农药混合标准溶液在全扫描质谱模式下获得精确的质量信息,根据所有农药的名称、分子式、保留时间、精确质量数、碎片离子质量数等信息构建了一个包含166种农药的质谱数据库。以绿茶和红茶作为基质验证方法的准确度和精密度。绿茶中15种农药在4~200 µg/L范围内线性关系良好,其余151种农药在2~200 µg/L范围内线性关系良好;红茶中所有农药在2~200 µg/L范围内呈现出良好的线性相关性(R2>0.99)。在4个加标水平下,绿茶和红茶中116种农药的回收率均在70%~130%之间;LOQ为10~25 µg/kg。并应用建立的方法对14份绿茶和6份红茶进行分析,绿茶、红茶样品中各检出9种农药,残留量均低于国家标准最大残留限量。
3 总结与展望
综上,GC、GC-MS、GC-MS/MS、HPLC和LC-MS/MS等常规检测方法因其高灵敏度、高选择性和高准确性在茶叶农药残留检测领域应用广泛。尤其是GC-MS技术,可以在很大程度上提高质谱的分辨能力,是目前茶叶农药残留检测的主流技术。虽然这些方法具有很高的准确性和灵敏度,在茶叶农药残留检测中发挥着重要作用,但不可忽视的是茶叶样品的复杂基质特性以及农药种类的多样性,都对分析方法提出了更高的要求。为了应对这些挑战,开发更加快捷、精准、高效且具备高选择性和高自动化水平的样品前处理技术,实现对大规模样品的快速筛查和多种农药残留的同时检测是今后研究的方向。随着分析技术的不断进步,茶叶农药残留的常规检测方法将更加自动化、智能化和便携化,为实现更快速的样品处理、更准确的数据分析和更广泛的应用范围提供可靠的技术支持,确保茶产品的质量与安全,促进茶产业的持续健康发展。
参考文献
[1] 梅宇, 梁晓. 2023年我国茶叶产销及进出口形势分析[J]. 中国茶叶, 2024, 46(4): 18-26.
[2] 卢兴坤. 茶叶质量安全现状和监管方向研究[J]. 福建茶叶, 2022, 44(3): 227-229.
[3] 赵丽, 陈瑞, 岑铭松, 等. 我国出口欧盟茶叶农药残留状况与控制对策[J]. 中国植保导刊, 2021, 41(5): 69-74.
[4] 黎洪霞, 晏嫦妤. 茶叶农药残留研究进展[J]. 广东茶业, 2017(3): 6-9.
[5] ATTAULLAH M, YOUSUF M J, SHAUKAT S, et al. Serum organochlorine pesticides residues and risk of cancer: A case-control study[J]. Saudi Journal of Biological Sciences, 2018, 25(7): 1284-1290.
[6] 朱雪琴. 茶叶中5种有机磷农药残留检测方法的研究[D]. 武汉: 武汉大学, 2018.
[7] 陈静. 蔬菜中有机磷杀虫剂多残留分析方法研究[D]. 北京: 中国农业大学, 2004.
[8] 马瑾, 潘根兴, 万洪富, 等. 有机磷农药的残留、毒性及前景展望[J]. 生态环境, 2003(2): 213-215.
[9] 田家豪. 氨基甲酸酯类农药活性预测建模及其与AChE作用机制分子模拟[D]. 北京: 中国人民解放军军事科学院, 2022.
[10] 禹子凤. 茶叶中有机磷和氨基甲酸酯类农药残留量的快速检测技术[J]. 农民致富之友, 2018(23): 41.
[11] 石岩. 气相色谱法测定茶鲜叶中有机氯和拟除虫菊酯类农药残留[D]. 泰安: 山东农业大学, 2016.
[12] 郭家刚. 茶叶中24种农药残留UPLC-MS/MS分析方法研究[D]. 合肥: 安徽农业大学, 2016.
[13] 许芮菡. 茶叶中拟除虫菊酯类农药残留检测方法的优化及应用研究[D]. 成都: 成都大学, 2022.
[14] 吴永慧. 杂化整体柱在线富集/热解吸进样方法在拟除虫菊酯类农药分析中的应用[D]. 合肥: 中国科学技术大学, 2020.
[15] 舒小桂, 张媚玉, 贺利民. 食品中拟除虫菊酯类农药残留检测前处理技术研究进展[J]. 食品安全质量检测学报, 2019, 10(18): 6157-6164.
[16] 王伟, 郭自国, 周天明, 等. QuEChERS-气相色谱-串联质谱测定水产品中的12种拟除虫菊酯类农药[J]. 分析科学学报, 2023, 39(5): 565-570.
[17] 王霞, 张小刚, 丰东升, 等. 农产品中新烟碱类农药前处理和检测技术研究进展[J]. 食品安全质量检测学报, 2020, 11(8): 2462-2468.
[18] 吴静怡. 茶叶新烟碱类农药残留变化规律研究与国内外标准分析[D]. 广州: 华南农业大学, 2018.
[19] 施杰, 来庆华, 郭思聪, 等. 茶叶农药残留与检测技术[J]. 食品安全质量检测学报, 2019, 10(5): 1243-1249.
[20] 王艳丽, 李洁, 李海霞, 等. 固相萃取-气相色谱-三重四极杆串联质谱法测定茶叶中45种有机磷农药残留[J]. 农药学学报, 2020, 22(4): 675-684.
[21] 陈昌梅, 林明霞, 兰元. SPE-GC-MS/MS法测定茶叶中的76种农药残留[J]. 中国茶叶, 2020, 42(12): 52-61.
[22] 林明霞. 固相萃取-气相色谱串联质谱法测定茶叶中的6种农药残留[J]. 福建分析测试, 2022, 31(6): 1-6.
[23] 张帆, 张莹, 黄志强, 等. 多壁碳纳米管固相萃取/超高效液相色谱-串联质谱测定茶油中12种氨基甲酸酯类农药[J]. 分析测试学报, 2019, 38(4): 411-416.
[24] GAO L, LIU L H, SUN Y M, et al. Fabrication of a novel azamacrocycle-based adsorbent for solid-phase extraction of organophosphorus pesticides in tea drinks[J]. Microchemical Journal, 2020,153: 1-23.
[25] 胡高华, 曹建荣, 杨蕾文宣, 等. 基于壳聚糖/氧化石墨烯/硅藻土固相萃取-液相色谱串联质谱测定茶叶中多种农药残留[J]. 茶叶科学, 2022, 42(2): 249-262.
[26] 江慧清. 国内茶叶中农药残留检测技术研究进展[J]. 中国茶叶, 2017, 39(6): 27-31, 43.
[27] 袁荷芳, 宋淑文, 高蕙文, 等. QuEChERS-超高效液相色谱-三重四极杆质谱法检测茶叶中250种农药残留[J]. 中国茶叶, 2023, 45(8): 39-48.
[28] CHEN H P, WANG X L, LIU P X, et al. Determination of three typical metabolites of pyrethroid pesticides in tea using a modified QuEChERS sample preparation by ultra-high performance liquid chromatography tandem mass spectrometry[J/OL]. Foods, 2021, 10(1): 189. https://doi.org/10.3390/foods/0010189.
[29] 林金俗, 荣杰峰, 张松艳, 等. 羧基化多壁碳纳米管分散固相萃取-三重四极杆气质联用法测定茶叶中16种农药残留量[J]. 中国茶叶, 2023, 45(1): 50-57.
[30] 周超, 李欣云. 基于多壁碳纳米管改良QuEChERS结合气相色谱法同时检测茶叶中17种有机磷类农药残留[J]. 食品安全导刊, 2023(29): 86-91, 95.
[31] 许芮菡, 谢倩文, 李旭军, 等. 基于多壁碳纳米管改进QuEChERS法结合气相色谱-串联质谱检测茶叶中10种拟除虫菊酯类农药残留[J]. 色谱, 2022, 40(5): 469-476.
[32] 周书威, 傅红, 薛晓康, 等. 基于晶体生长法的磁性石墨化碳黑的制备及在茶叶农药残留检测中的应用[J]. 分析化学, 2022, 50(3): 472-481.
[33] 胡坪, 王氢. 仪器分析[M]. 5版. 北京: 高等教育出版社, 2019.
[34] SOLTANI S, SERESHTI H. A green alternative QuEChERS developed based on green deep eutectic solvents coupled with gas chromatography-mass spectrometry for the analysis of pesticides in tea samples[J/OL]. Food Chemistry, 2022, 380: 132181. https://doi.org/10.1016/j.foodchem.2022..131281.
[35] 何孟, 吴岷贤, 李剑波, 等. 气相色谱与质谱联用在多晶硅生产上的应用进展[J]. 石化技术, 2024, 31(1): 77-81.
[36] 刘腾飞, 杨代凤, 张丽, 等. 茶叶中农药残留分析技术研究进展[J]. 食品科学技术学报, 2017, 35(4): 80-94.
[37] LIU D, MIN S. Rapid analysis of organochlorine and pyrethroid pesticides in tea samples by directly suspended droplet microextraction using a gas chromatography-electron capture detector[J]. Journal of Chromatography A, 2012, 1235: 166-173.
[38] 游飞明, 吴芳, 陆万平, 等. 固相萃取-气相色谱法测定茶叶中多种有机磷农药[J]. 分析测试技术与仪器, 2011, 17(1): 6-10.
[39] 黎亭. 气相色谱法同时测定茶叶中10种有机磷农药残留[J]. 建材与装饰, 2017(41): 223-224.
[40] MOINFAR S, HOSSEINI M R M. Development of dispersive liquid-liquid microextraction method for the analysis of organophosphorus pesticides in tea[J]. Journal of Hazardous Materials, 2009, 169(1/2/3): 907-911.
[41] 曹天亚, 金鑫, 冯正伟, 等. 气相色谱法处理农残检测结果假阳性的方法[J]. 江西农业, 2020(12): 113, 115.
[42] 卢剑, 武中平, 高巍, 等. 气相色谱双柱法测定茶叶中多种有机氯和拟除虫菊酯类农药残留量[J]. 食品科学, 2009, 30(24): 401-404.
[43] 杨森, 何志华, 杨留勇. 茶叶中农药残留分析技术研究进展[J]. 安徽农业科学, 2018, 46(20): 20-22.
[44] KIM S W, EL-ATY A M A, LEE Y J, et al. A simple HPLC-UVD method for detection of etofenprox in green tea using sample hydration[J]. Food Science and Biotechnology, 2014, 23(6): 2097-2101.
[45] 楼正云, 汤富彬, 陈宗懋, 等. 固相萃取-高效液相色谱法测定茶叶和土壤中吡虫啉的残留量[J]. 现代科学仪器, 2008(3): 13-15.
[46] 王晓亮, 毛卫中, 汪新华, 等. QuEchERs-高效液相色谱柱后衍生法测定茶叶中10种氨基甲酸酯类农药残留[J]. 食品工业科技, 2018, 39(14): 190-193.
[47] 冯洁. 茶叶中农药残留分析方法的应用研究[D]. 北京: 北京化工大学, 2014.
[48] 文洋, 谭君, 谭斌, 等. 茶叶中农药残留检测方法研究进展[J]. 食品安全质量检测学报, 2017, 8(3): 826-831.
[49] HUO F F, TANG H, WU X, et al. Utilizing a novel sorbent in the solid phase extraction for simultaneous determination of 15 pesticide residues in green tea by GC/MS[J]. Journal of Chromatography B, 2016, 1023: 44-54.
[50] DENG X J, GUO Q J, CHEN X P, et al. Rapid and effective sample clean-up based on magnetic multiwalled carbon nanotubes for the determination of pesticide residues in tea by gas chromatography-mass spectrometry[J]. Food Chemistry, 2014, 145: 853-858.
[51] CHEN L, SHANGGUAN L M, WU Y N, et al. Study on the residue and degradation of fluorine-containing pesticides in Oolong tea by using gas chromatography-mass spectrometry[J]. Food Control, 2012, 25(2): 433-440.
[52] HOU X, LEI S R, QIU S T, et al. A multi-residue method for the determination of pesticides in tea using multi-walled carbon nanotubes as a dispersive solid phase extraction absorbent[J]. Food Chemistry, 2014, 153: 121-129.
[53] 姚建花, 胡明友, 王芳, 等. QuEChERS结合三重四级杆气质联用法测定茶叶中15种有机氯和拟除虫菊酯类农药残留[J]. 中国卫生检验杂志, 2020, 30(20): 2460-2463.
[54] ZHENG K M, LIN R M, LIU X Z, et al. Multiresidue pesticide analysis in tea using GC-MS/MS to determine 12 pesticide residues (GB 2763—2021)[J]. Molecules, 2022, 27(23): 8419. https://doi.org/10.3390/molecules27238419.
[55] 孔玉婷, 陶志成, 朱丹倩, 等. QuEChERS法结合高效液相色谱-串联质谱法测定茶叶中12种农药残留量[J]. 化工设计通讯, 2020, 46(11): 26-27.
[56] HUANG Y S, SHI T, LUO X, et al. Determination of multi-pesticide residues in green tea with a modified QuEChERS protocol coupled to HPLC-MS/MS[J]. Food Chemistry, 2019, 275: 255-264.
[57] 周鹏, 黄芊, 欧阳立群. 超高效液相色谱-串联质谱法测定茶叶中9种天然植物源农药残留量[J]. 质谱学报, 2020, 41(5): 490-501.
[58] CHEN G Q, CAO P Y, LIU R J, et al. A multi-residue method for fast determination of pesticides in tea by ultra performance liquid chromatography-electrospray tandem mass spectrometry combined with modified QuEChERS sample preparation procedure[J]. Food Chemistry, 2010, 125(4): 1406-1411.
[59] 金莉莉, 郝振霞, 高贯威, 等. 超高效液相色谱-静电场轨道阱高分辨质谱法测定茶叶中21种农药残留量[J]. 茶叶科学, 2018, 38(6): 595-605.
[60] MENG X D, SONG W, XIAO Y, et al. Rapid determination of 134 pesticides in tea through multi-functional filter cleanup followed by UPLC-QTOF-MS[J/OL]. Food Chemistry, 2022, 370: 130846. https://doi.org/10.1016/j.foodchem.2021.130846.
[61] 常巧英. 茶叶农药多残留检测技术研究与应用[D]. 秦皇岛: 燕山大学, 2017.
[62] 陈泽宇, 毛林夏, 袁智, 等. 云南普洱茶主产区茶叶中农药残留的GC-NCI-MS-SIM分析[J]. 安徽农业科学, 2017, 45(28): 88-91.
[63] 杨广, 程章平, 刘新, 等. 茶叶中拟除虫菊酯类农药残留的检测[J]. 福建农业大学学报, 2004(3): 339-342.
[64] 李福敏, 邵林. QuEChERS-气相色谱-三重四级杆串联质谱法测定茶叶中的12种有机氯农药残留[J]. 食品安全质量检测学报, 2018, 9(6): 1377-1382.
[65] 仲伶俐, 胡莉, 郭灵安, 等. UPLC-MS/MS与HPLC测定茶叶中10种氨基甲酸酯类农药残留的比较[J]. 食品工业科技, 2015, 36(2): 70-74.
[66] 余璐, 宋伟, 吕亚宁, 等. 超高效液相色谱-四极杆-飞行时间质谱法快速筛查茶叶中的204种农药残留[J]. 色谱, 2015, 33(6): 597-612.
[67] 方俊兰, 张丹阳, 伊岳星, 等. 基于超高效液相色谱-四极杆/静电场轨道阱高分辨质谱筛查茶叶中166种农药残留方法研究[J]. 分析测试学报, 2023, 42(12): 1537-1546.

