超声辅助酶法优化提取核桃分心木多酚及其抗氧化活性研究




摘要: 【目的】优化核桃分心木多酚提取工艺,并研究其抗氧化活性。【方法】以云南漾濞核桃分心木为原料,利用单因素试验探究纤维素酶添加量、料液比、超声功率、超声时间和乙醇体积分数对核桃分心木多酚提取率的影响,采用响应面法对多酚提取工艺进行优化;通过D101 大孔树脂对粗提物进行初步纯化得到核桃分心木多酚,并分析其纯度;利用DPPH·自由基清除能力、ABTS+自由基清除能力及铁还原能力评价其抗氧化活性。【结果】超声辅助纤维素酶法提取核桃分心木多酚的最佳工艺为:酶添加量0.6%、料液比1∶80(g∶mL)、超声功率600 W、超声时间60 min、乙醇体积分数60%,多酚提取率为7.26%,初步纯化得到的多酚纯度为89%。核桃分心木多酚对DPPH·自由基和ABTS+自由基清除率的 IC50 值分别为11.11 和183.12 μg/mL,铁离子还原能力达到同等质量浓度抗坏血酸的59.62%,表明核桃分心木多酚具有较强的抗氧化活性。【结论】得到核桃分心木多酚的最佳提取工艺,为核桃产业的发展和核桃分心木有效成分的开发利用提供了试验依据。
关键词: 核桃分心木;多酚;超声波;纤维素酶;响应面;抗氧化活性
中图分类号: S664.101 文献标志码: A 文章编号: 1004–390X (2024) 03−0107−09
核桃分心木是核桃果核内的木质隔膜,主要由不易消化的纤维素和木质素组成[1],是核桃副产品之一,在加工过程中常被丢弃[2]。分心木是一种传统中药材,长期以来被用于治疗失眠、腹泻、肾虚、生殖系统疾病等[3-4],也被用作民间文化中凉茶和膳食补充剂[5]。核桃分心木富含多种生物活性成分,包括黄酮、酚酸、多糖等[6-7],且在体外具有抗肿瘤、抗氧化、增强免疫、预防心脏病、降血糖等功效[8-9];其资源丰富,但主要被用于工业,如制作燃料或与核桃壳烧制成活性炭,利用率和附加值低,造成资源的浪费[10-11]。
核桃分心木富含的植物多酚是一类多羟基酚类化合物,具有抗氧化、抗肿瘤、预防心血管疾病等多种功效[12],广泛应用于食品、医药、化妆品等领域[13]。目前,植物多酚新型绿色提取方法主要包括酶解、微波辅助、超声辅助等[14],这些方法具有时间短、能耗低、效率高等优点[15]。其中,超声波法和纤维素酶法联合用于提取植物多酚已被广泛研究。在提取条件优化方面,国内外学者通过试验设计、统计分析等方法,对超声辅助酶技术的参数(如温度、时间、功率等) 进行了深入研究。超声辅助酶技术可有效改善植物多酚的提取效果,提高其抗氧化、抗菌、抗炎等活性,黄敏等[16]采用超声波辅助纤维素酶法提取香蕉皮多酚,发现与单一条件提取相比,酶法联合超声波法可明显提高多酚得率。但有关超声波协同纤维素酶法提取核桃分心木多酚(walnut diaphragmpolyphenol,WDP) 的研究鲜有报道。本研究采用超声—纤维素酶醇提法提取WDP,以多酚提取率为评价指标,通过单因素和响应面设计试验优化提取工艺,并对WDP 的抗氧化活性进行测定,以期为WDP 的开发利用提供技术支撑和理论参考。
1 材料与方法
1.1 试验材料
1.1.1 材料与试剂
核桃分心木(云南漾濞彝岭山货有限责任公司);食品级纤维素酶(1×104 U/g,南宁庞博生物工有限公司);没食子酸标准品(美国Sigma-Aldrich公司);福林酚(Folin-Ciocalteus) 显色试剂(北京鼎国昌盛生物科技有限公司);抗坏血酸(优级,美国Sigma-Aldrich 公司)。
1.1.2 仪器与设备
电子天平FA100 (上海舜宇恒平科学仪器有限公司);低速离心机LC-401 (安徽中科中佳科仪器有限公司);春霖超声波清洗机CR-100 (深圳市春霖清洗设备有限公司);AL204-1C 752 型紫外可见分光光度计(上海光谱仪器有限公司)。
1.2 试验方法
1.2.1 WDP 的提取
干燥好的核桃分心木经多用途粉碎机粉碎,过60 目筛后(含水量≤5%) 保存备用。称取定量核桃分心木干粉, 经超声辅助纤维素酶醇提一定时间后,90 ℃ 高温灭酶活5 min,冷却后4 000 r/min 离心20 min,取上清液冷藏待用。
1.2.2 没食子酸标准曲线的建立
参考《茶叶中茶多酚和儿茶素类含量的检测方法》(GB/T 8313—2018)[17]配制没食子酸标准品样液,于波长760 nm 处测定吸光度(用蒸馏水调零),以吸光度值为纵坐标、没食子酸质量浓度为横坐标绘制标准曲线,得到线性回归方程Y=0.012 1x+0.064 9,R2= 0.999 2。
1.2.3 多酚提取率的测定
按照1.2.2 节的方法测定提取液的质量浓度,并按照公式计算WDP 的提取率(Y):
Y =(C ×V×N/m×1000)×100%。
式中:C 为被测液体质量浓度,mg/mL;V 为试样溶液体积,mL;N 为总稀释倍数;m 为核桃分心木质量,g。
1.2.4 单因素试验设计
根据实验室前期试验,选择超声温度45 ℃且不对其展开探究,分别考察不同纤维素酶添加量 (0.2%、0.4%、0.6%、0.8%、1.0%)、乙醇体积分数 (40%、50%、60%、70%、80%)、料液比[1∶20、 1∶40、 1∶60、 1∶80、 1∶100 (g∶mL)]、超声功率(120、240、360、480、600 W) 和超声时间(25、35、45、55、65 min) 对WDP 提取率的影响,根据结果筛选WDP 最适提取条件范围。
1.2.5 响应面试验设计
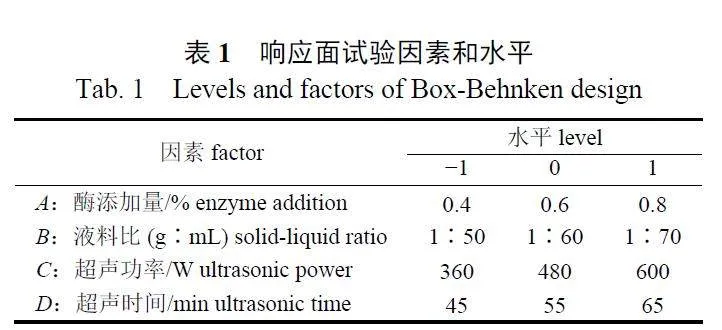
在单因素试验基础上选取对WDP 提取率影响较大的酶添加量(A)、料液比(B)、超声功率(C)、超声时间(D) 4 个因素为自变量,WDP 提取率(Y) 为响应值,利用Design-Expert V8.0.6 软件进行 Box-Behnken 设计试验,进行4 因素3 水平响应面分析(表1)。
1.2.6 多酚粗提物纯化
按照优化所得的提取条件制备提取液并将其真空浓缩、冷冻干燥为粗提物备用。将预处理过的D101 大孔树脂与2 mg/mL 粗提物溶液按料液比1∶10 (g∶mL) 置于2.0 L 锥形瓶中,置于恒温摇床(25 ℃,120 r/min) 上静态吸附6 h;待充分吸附后,将其置于玻璃层析柱中,先用蒸馏水洗涤树脂中未被吸附的杂质,再用30% 乙醇溶液作为洗脱剂,对大孔树脂进行洗脱并收集洗脱液。洗脱液经真空浓缩、冷冻干燥后得到WDP粉末,用于后续试验。
1.2.7 WDP 抗氧化活性的测定
(1) DPPH·自由基清除率的测定
参考蒋金龙等[18]和邵哲等[19]的方法,精确称取3.100 mg DPPH 置于褐色容量瓶中,用甲醇溶解并定容至100 mL,配制成0.079 mmol/L DPPH工作液。取DPPH 工作液2.0 mL 置于5 mL 离心管中,取不同质量浓度(0.2、0.4、0.6、0.8、1.0 mg/mL) 待测样品0.5 mL 与工作液混合,暗处放置10 min,于517 nm 处测定试验组的吸光度。对照组中用等量甲醇代替DPPH 工作液,以DPPH 工作液为空白对照,以抗坏血酸为阳性对照。按照公式计算清除率:
清除率=[1-("A1 - A/A0)]×100%。
式中:A1 为试验组的吸光度;A 为对照组的吸光度;A0 为空白对照的吸光度。
(2) ABTS+自由基清除率的测定
参考胡霞等[20]的方法并略作改进。在5 mL离心管中加入ABTS+工作液3.8 mL,取100 μL 不同质量浓度(0.2、0.4、0.6、0.8、1.0 mg/mL) 的WDP 样液混合,暗反应10 min,于517 nm 处测定试验组的吸光度。以等体积乙醇溶液代替ABTS+工作液为对照组,以ABTS+工作液为空白对照,以抗坏血酸为阳性对照。按照公式计算清除率,计算公式同1.2.7 节(1)。
(3) 还原铁抗氧化能力的测定
参考文献[21-23] 的方法并略作改进。配制2,4,6-三吡啶基-S-三嗪(TPTZ) 工作液和硫酸亚铁(FeSO4) 标准液,取标准液0.1 mL 于10 mL 离心管中,加入TPTZ 工作液3.0 mL,混匀,37 ℃水浴4 min,于593 nm 处测定吸光度,用乙酸溶液(300 mmol/L,pH3.6) 调零。以FeSO4 浓度为横坐标、吸光度为纵坐标绘制FeSO4 标准曲线,得到线性回归方程Y=0.000 4x+0.003 1 (R2=0.997 2)。将FeSO4 溶液替换为不同质量浓度(0.025、0.050、0.100、0.200、0.400、0.800 g/mL) 的WDP 溶液测定其铁还原能力,利用标准曲线计算其抗氧化能力,得到的铁离子还原能力以Fe2+的摩尔数表示。以抗坏血酸为阳性对照。
1.3 数据处理与统计分析
试验均平行重复3 次, 利用SPSS 26.0 和Design-Expert V8.0.6 软件对试验数据进行方差分析,并利用Prism 8.0.2 进行整理和绘图。
2 结果与分析
2.1 单因素试验
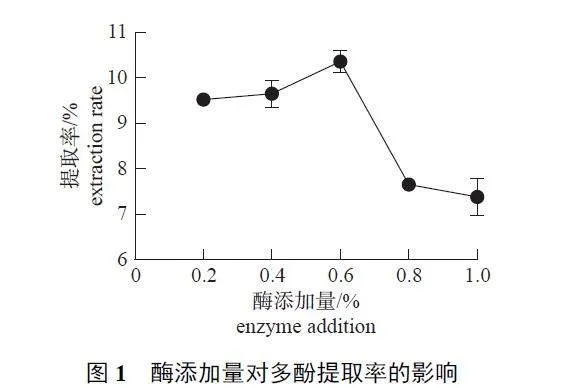
2.1.1 酶添加量
由图1 可知:随着纤维素酶添加量的增加,WDP 提取率呈先升高后降低的变化趋势。当酶添加量为0.6% 时,WDP 提取率达到峰值;当酶添加量超过0.6% 时,提取率下降。这是因为添加过多酶不利于WDP 充分溶解,导致提取率降低。因此,以0.6% 为纤维素酶的最适添加量。
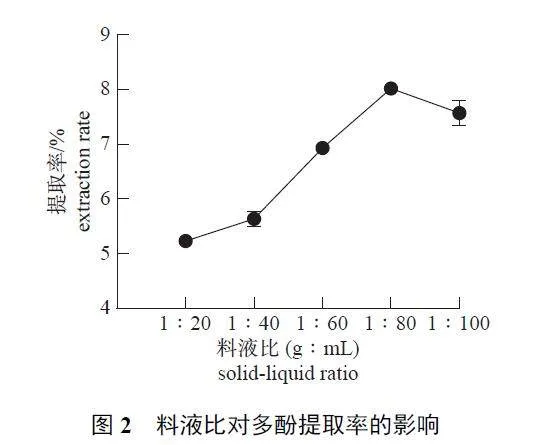
2.1.2 料液比
由图2 可知:在料液比(g∶mL) 为1∶20~1∶80 的变化过程中,WDP 提取率随之升高;当料液比为1∶80 时,提取率达到峰值;之后,提取率随着料液比的升高而下降。这是由于过量提取液会影响细胞壁中多酚的溶出。因此,选择1∶80 (g∶mL) 为最适料液比。
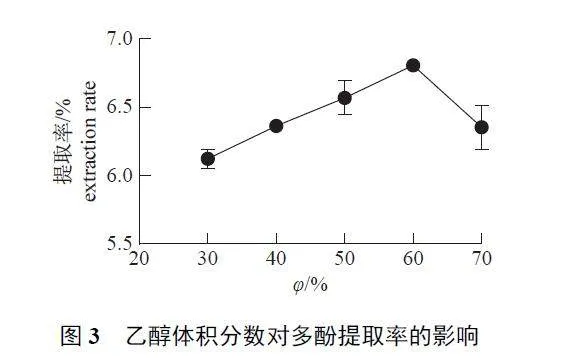
2.1.3 乙醇体积分数
由图3 可知:随着乙醇体积分数由30% 升高至70%,WDP 提取率呈先上升后下降的趋势;当乙醇体积分数为60% 时,提取率达到峰值,继续提高乙醇体积分数,提取率逐渐下降。其原因是乙醇体积分数增加导致脂溶性杂质增多,从而抑制多酚溶出,导致提取率降低。因此,60% 为最适乙醇体积分数。
2.1.4 超声功率
由图4 可知:随着超声功率由120 W 升至600 W,多酚提取率呈先上升后下降的趋势。这是因为超声功率提升,使得超声波的穿透性增强,导致细胞壁破裂增加,进而溶剂更容易渗透到样品中,从而提升多酚溶解率。当超声功率达到480 W 时,提取率达到峰值;当超声功率超过480 W 时,提取率呈下降趋势。这是由于过大功率导致提取体系温度升高,使多酚发生氧化分解反应,提取率下降。因此,480 W 为最适提取超声功率。
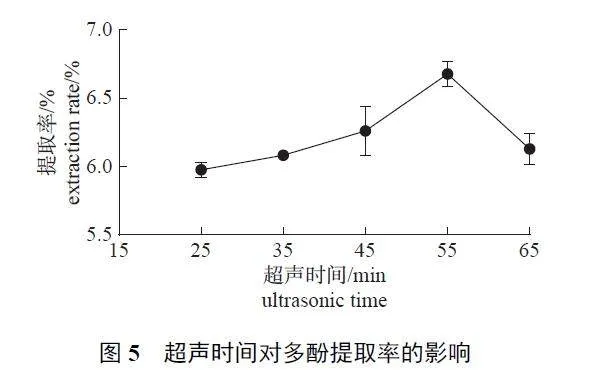
2.1.5 超声时间
由图5 可知:随着超声处理时间由25 min 升至65 min,多酚提取率呈先上升后下降的趋势,在55 min 时达到峰值,进一步增加超声时间后提取率下降。这是由于长时间机械波作用下多酚特殊基团受到破坏,从而导致多酚提取率降低。因此,55 min 为最适超声时间。
2.2 响应面试验优化
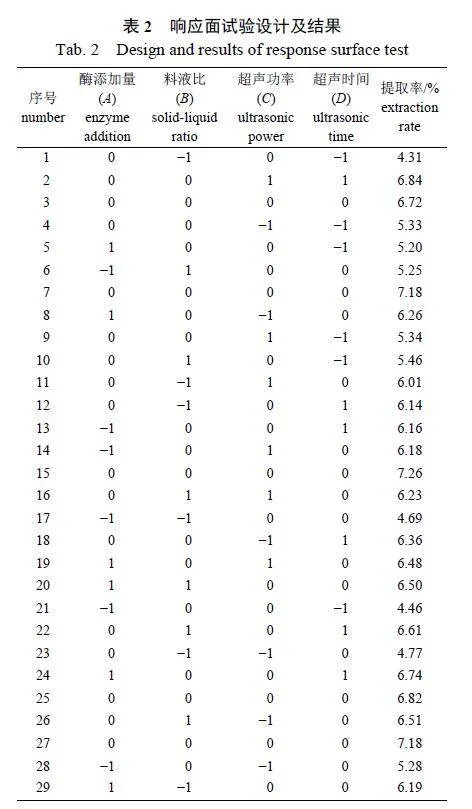
2.2.1 响应面试验设计及结果
在单因素试验基础上,对WDP 提取工艺条件进行优化,响应面试验设计及结果见表2。采用二次多元回归拟合方法获得WDP 提取率(Y)的回归方程:Y=7.03+0.45A+0.37B+0.21C+0.73D−0.06AB−0.17AC−0.04AD−0.38BC−0.17BD+0.12CD−0.65A2−0.74B2−0.37C2−0.70D2。
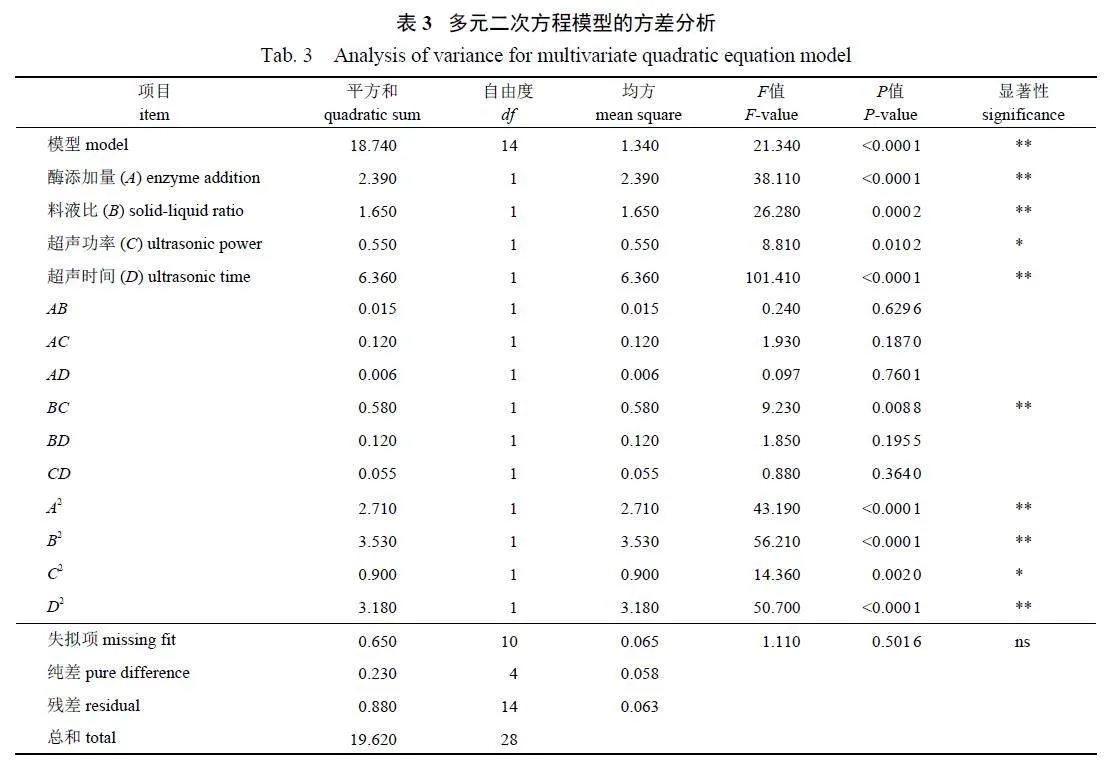
由表3 可知:所选模型具有统计学意义(Plt;0.01),模拟的F gt;1,Pgt;0.05,回归模型的失拟项不显著,R2 为0.955 2,说明该回归模型与实际试验的拟合程度较为接近,可用于预测WDP 的提取率。通过P 值和F 值的比较,得出影响WDP提取率的因素顺序为:超声时间(D)gt;酶添加量(A)gt;料液比(B)gt;超声功率(C)。这表明在试验设计的4 个主要因素中,超声时间和酶添加量对提取率的影响最显著,液料比和超声功率对提取率也有一定影响。
2.2.2 响应面分析
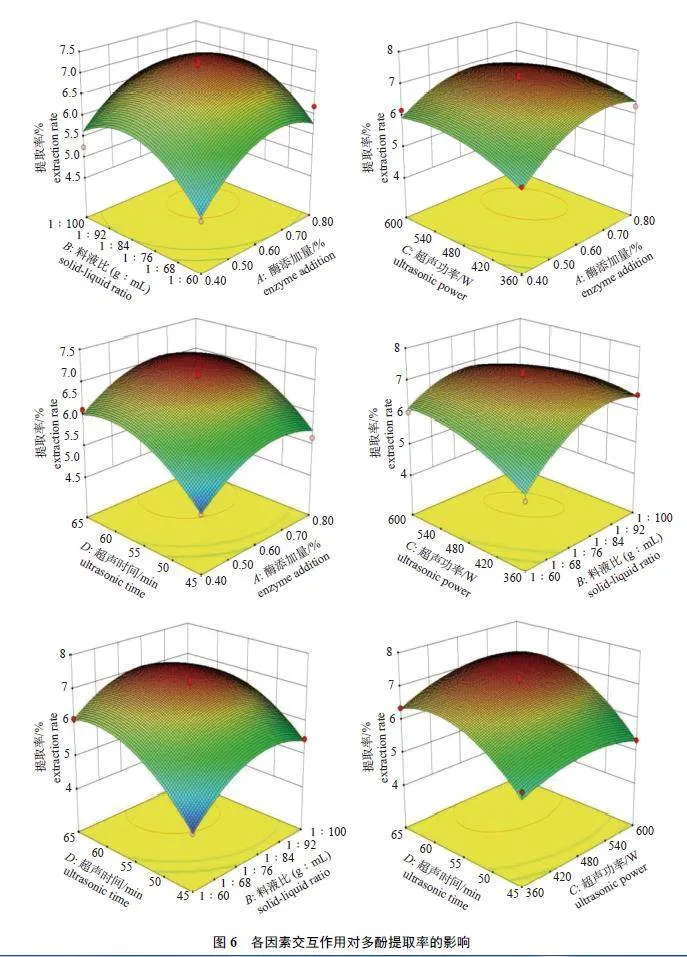
各因素之间的交互作用对WDP 提取率影响的响应面结果(图6) 显示: 6 个响应面均为开口向下的凸形曲面,表明存在极大值点,且响应面曲线较为陡峭,说明各因素的变化对WDP 提取率均有影响,影响程度为BCgt;ACgt;BDgt;CDgt;ABgt;AD,表明料液比(B) 与超声功率(C) 的交互作用对WDP 提取率的影响最显著。
2.2.3 验证性试验
Design-Expert V8.0.6 预测WDP 最佳提取工艺为:酶添加量0.66%、料液比1∶82.34 (g∶mL)、超声功率509.19 W、超声时间60.13 min,WDP提取率为7.33%。结合实际情况将工艺参数调整为:酶添加量0.60%、料液比1∶80 (g∶mL)、超声功率600 W、超声时间60 min。在此条件下进行验证试验,所得WDP 提取率为7.26%,与预测值接近,相对误差(0.96%) 较小。说明该回归模型优化的工艺条件可用于提取WDP。
2.3 WDP 的抗氧化活性
2.3.1 清除DPPH·自由基的能力
随着样品质量浓度的增大,WDP 对DPPH·自由基的清除率呈先增大后趋于平稳的趋势,IC50 为11.11 μg/mL (图7)。当WDP 质量浓度达0.6 mg/mL 时,对DPPH·自由基的清除作用与抗坏血酸相近,说明WDP 有较强的DPPH·自由基清除能力。
2.3.2 清除ABTS+自由基的能力
随着样品质量浓度的增加,WDP 对ABTS+自由基的清除率呈先增大后趋于平稳的趋势,IC50值为183.12 μg/mL (图8)。当WDP 质量浓度达0.6 mg/mL 时,对ABTS+自由基的清除能力基本与抗坏血酸持平,说明WDP 有较强的ABTS+自由基清除能力。
2.3.3 还原铁抗氧化能力
由图9 可知:随着质量浓度的增加,WDP对Fe3+的还原能力也随之增加;不同质量浓度的WDP 和抗坏血酸都可在一定程度上还原Fe3+,但WDP 的还原能力均小于抗坏血酸 (图9)。
3 讨论
作为核桃加工过程中的副产物,核桃分心木的潜在价值并未被忽视。近年来,中医治疗领域对其给予了越来越多关注,原因在于其富含多种活性成分[23-25],这些成分主要是多酚类物质,具有显著的抗氧化性能。若能有效地提取并利用这些化合物,不仅可以进一步开发该资源,还能将其转化为天然抗氧化剂的来源,为保障人类健康提供新途径[26]。
相较于传统植物多酚的提取工艺而言,超声辅助酶法不仅安全、环保、高效,而且可以保护活性成分,是一种比较理想的天然产物活性成分提取方法[27-30]。本研究采用超声波辅助纤维素酶提取WDP,效率高、过程环保,具有很高的应用价值。以多酚提取率为指标,在单因素试验基础上,利用响应面分析优化提取工艺,得到最佳工艺参数为:乙醇体积分数60%、超声功率600 W、超声时间60 min、酶添加量0.6%、料液比1∶80 (g∶mL),在此参数条件下,WDP 提取率为7.26%。刘静等[7]采用超声辅助乙醇提取WDP,利用Box-Behnken 响应曲面设计优化提取工艺,提取率为6.98%。可见,与单一提取方法相比,超声波辅助酶法可提高多酚提取率。
目前,市面上常用的抗氧化剂多为人工合成,在使用中存在安全隐患,也越来越受到限制,因此,研究开发植物中的天然抗氧化剂日益受到重视[31-32]。多酚是植物中的化合物,是天然抗氧化剂。目前常用的抗氧化活性评价指标有DPPH·自由基、ABTS+自由基和总还原能力等[33],因此,本研究采用以上3 种指标评价WDP 的抗氧化活性。研究结果表明:WDP 对DPPH·自由基和ABTS+自由基具有较强的清除能力,且有一定质量浓度依赖性;在同一质量浓度处理下,WDP对铁离子的还原能力为阳性对照的59.62%,表明WDP 具有较强的抗氧化性,可将其开发成为天然抗氧化剂。但本研究仅对超声辅助纤维素酶法提取WDP 的抗氧化活性进行了测定,该技术是否会影响WDP 的生物活性尚不清楚,在后续研究中,可对不同提取方法与生物活性间的关系进行研究。
4 结论
超声辅助纤维素酶法提取核桃分心木多酚的最佳提取工艺为:超声功率600 W、超声时间60 min、酶添加量0.6%、乙醇体积分数60%、料液比1∶80 (g∶mL),该条件下WDP 提取率为7.26%。此外,WDP 清除DPPH·自由基、ABTS+自由基以及还原铁离子的能力较强,有望作为潜在的天然抗氧化剂。本研究结果为开发天然的抗氧化剂和云南核桃分心木多酚的深入研究奠定了基础,并为从农产品副产物中提取生物活性成分提供了实践参考。
[ 参考文献 ]
[1]TAN J Y, CHENG Y G, WANG S H, et al. The chemicalconstituents of Diaphragma juglandis fructus and theirinhibitory effect on α-glucosidase activity[J]. Molecules,2022, 27(10): 3045. DOI: 10.3390/molecules27103045.
[2]ZHANG Y G, KAN H, CHEN S X, et al. Comparison ofphenolic compounds extracted from Diaphragma juglandisfructus, walnut pellicle, and flowers of Juglans regiausing methanol, ultrasonic wave, and enzyme assistedextraction[J]. Food Chemistry, 2020, 321: 126672. DOI:10.1016/j.foodchem.2020.126672.
[3]ZHAO H X, BAI H, JING Y C, et al. A pair of taxifolin-3-O-arabinofuranoside isomers from Juglans regia L.[J].Natural Product Research, 2017, 31(8): 945. DOI: 10.1080/14786419.2016.1258554.
[4]MENG Q R, WANG Y Q, CHEN F, et al. Polysaccharidesfrom Diaphragma juglandis fructus: extraction optimization,antitumor, and immune-enhancement effects[J].International Journal of Biological Macromolecules, 2018,115: 835. DOI: 10.1016/j.ijbiomac.2018.04.121.
[5]肖敏. 核桃壳/分心木黄酮类化合物提取及其抗氧化作用机理研究[D]. 咸阳: 西北农林科技大学, 2022.
[6]肖敏, 赵鑫丹, 郝苑汝, 等. 核桃分心木提取物的抗氧化活性及其对油脂氧化稳定性的影响[J]. 食品研究与开发, 2021, 42(22): 71. DOI: 10.12161/j.issn.1005-6521.2021.22.011.
[7]刘静, 黄慧福, 刘继华, 等. 响应面优化核桃分心木多酚超声辅助提取工艺[J]. 食品研究与开发, 2020, 41(23):155. DOI: 10.12161/j.issn.1005-6521.2020.23.026.
[8]KALOGIOURI N P, SAMANIDOU V F. A validated ultrasound-assisted extraction coupled with SPE-HPLC-DADfor the determination of flavonoids in by-products ofplant origin: an application study for the valorization ofthe walnut septum membrane[J]. Molecules, 2021, 26(21):6418. DOI: 10.3390/molecules26216418.
[9]王嘉佳, 高山, 何爱民, 等. 核桃分心木成分分析及其功能性研究进展[J]. 食品工程, 2019(1): 12. DOI: 10.3969/j.issn.1673-6044.2019.01.005.
[10]ZHAN Y R, MA M G, CHEN Z, et al. A review on extracts,chemical composition and product development ofwalnut Diaphragma juglandis fructus[J]. Foods, 2023,12(18): 3379. DOI: 10.3390/foods12183379.
[11]MOKHTAR M, GINESTRA G, YOUCEFI F, et al. Antimicrobialactivity of selected polyphenols and capsaicinoidsidentified in pepper (Capsicum annuum L.) and theirpossible mode of interaction[J]. Current Microbiology,2017, 74(11): 1253. DOI: 10.1007/s00284-017-1310-2.
[12]SKENDERIDIS P, LEONTOPOULOS S, PETROTOSK, et al. Optimization of vacuum microwave-assisted extractionof pomegranate fruits peels by the evaluation ofextracts’ phenolic content and antioxidant activity[J]. Foods,2020, 9(11): 1655. DOI: 10.3390/foods9111655.
[13]KYRIAKOUDI A, MOURTZINOS I. Green extractiontechnology of polyphenols from food by-products[J]. Foods,2022, 11(8): 1109. DOI: 10.3390/foods11081109.
[14]刘松, 徐鹏, 刘柳. 植物多酚提取工艺研究进展[J]. 分子植物育种, 2024, 22(11): 3729. DOI: 10.13271/j.mpb.022.003729.
[15]周婉, 魏婉倩, 李猛, 等. 植物多酚绿色提取技术研究进展[J]. 农产品加工, 2023(7): 74. DOI: 10.16693/j.cnki.1671-9646(X).2023.04.016.
[16]黄敏, 张帅, 林诗, 等. 超声波辅助酶法提取香蕉皮多酚[J]. 食品工程, 2022(3): 50. DOI: 10.3969/j.issn.1673-6044.2022.03.013.
[17]GB/T 8313—2018. 茶叶中茶多酚和儿茶素类含量的检测方法[S].
[18]蒋金龙, 王姝砚, 缪晓青. 蜂胶挥发油提取及其DPPH自由基清除率的研究[J]. 海峡科学, 2010(10):235. DOI: 10.3969/j.issn.1673-8683.2010.10.076.
[19]邵哲, 喻治达, 钟袁源, 等. 竹荪菌托黄酮的纯化及其抗氧化与抗疲劳活性研究[J]. 食品安全质量检测学报,2023, 14(1): 315. DOI: 10.19812/j.cnki.jfsq11-5956/ts.2023.01.031.
[20]胡霞, 王顺风, 白玉英, 等. 超声辅助纤维素酶法提取辣木籽多酚的工艺优化及其体外活性[J]. 食品工业科技,2023, 44(7): 207. DOI: 10.13386/j.issn1002-0306.2022070221.
[21]郭娇娇, 方敏, 林利美, 等. 苹果多酚的提取及抗氧化活性研究[J]. 食品科学, 2011, 32(20): 95.
[22]FEJÉR J, GRUĽOVÁ D, ELIAŠOVÁ A, et al. Seasonalvariability of Juniperus communis L. berry ethanol extracts:2. In vitro ferric reducing ability of plasma (FRAP)assay[J]. Molecules, 2022, 27(24): 9027. DOI: 10.3390/molecules27249027.
[23]LIU H C, PEI Z, LI W. Hypoglycemic and antioxidativeactivity evaluation of phenolic compounds derived fromwalnut diaphragm produced in Xinjiang[J]. Journal ofFood Biochemistry, 2022, 46(12): e14403. DOI: 10.1111/jfbc.14403.
[24]王纪辉, 耿阳阳, 胡伯凯, 等. 核桃分心木多酚物质响应及组成与抗氧化能力探究[J]. 西南大学学报(自然科学版), 2023, 45(8): 83. DOI: 10.13718/j.cnki.xdzk.2023.08.008.
[25]王纪辉, 耿阳阳, 刘亚娜, 等. 泡核桃果实副产物多酚物质响应及组成探究[J]. 西南林业大学学报(自然科学),2023, 43(3): 172. DOI: 10.11929/j.swfu.202110015.
[26]WANG D, MU Y, DONG H J, et al. Chemical constituentsof the ethyl acetate extract from Diaphragma juglandisfructus and their inhibitory activity on nitric oxideproduction in vitro[J]. Molecules, 2017, 23(1): 72. DOI:10.3390/molecules23010072.
[27]张晶, 陈钰, 邹欣洋, 等. 超声波协同纤维素酶法提取肉豆蔻多酚的工艺条件优化[J]. 饲料研究, 2022, 45(22):97. DOI: 10.13557/j.cnki.issn1002-2813.2022.22.021.
[28]邢颖, 刘芳. 超声波和纤维素酶法提取核桃分心木中的黄酮、多酚及其抗氧化活性分析[J]. 粮食与油脂,2020, 33(11): 111. DOI: 10.3969/j.issn.1008-9578.2020.11.030.
[29]田富林. 麦麸多酚抗氧化活性研究[D]. 武汉: 武汉轻工大学, 2022.
[30]郭俊彤. 覆盆子多酚的提取、抗氧化活性及胃肠道可及性研究[D]. 西安: 陕西师范大学, 2021.
[31]MENG Q R, LI Y H, XIAO T C, et al. Antioxidant andantibacterial activities of polysaccharides isolated and purifiedfrom Diaphragma juglandis fructus[J]. InternationalJournal of Biological Macromolecules, 2017, 105(1):431. DOI: 10.1016/j.ijbiomac.2017.07.062.
[32]SUPALUCK K, UTTHAPON I. A strategic review onplant by-product from banana harvesting: a potentiallybio-based ingredient for approaching novel food and agro-industry sustainability[J]. Journal of the Saudi Societyof Agricultural Sciences, 2021, 21(8): 530. DOI: 10.1016/j.jssas.2021.06.004.
[33]胡付侠. 皱皮木瓜多酚的提取纯化、鉴定及抗氧化与抗炎活性研究[D]. 泰安: 山东农业大学, 2022.
责任编辑:何承刚
基金项目:云南省科技厅重大科技专项计划项目(202002AA100005,202102AE090027-2);云南省科技厅云南绿色食品国际合作研究中心项目(2019ZG00905)。

