北京地区蒙古栎(Quercus mongolica)外生菌根真菌群落特征
赵誉涵 孙佳琦 孙静双 崔建辉 冷平生 胡增辉
doi:10.7606/j.issn.1004-1389.2024.07.018
https://doi.org/10.7606/j.issn.1004-1389.2024.07.018
收稿日期:2023-03-31 修回日期:2023-06-19
基金项目:北京农学院揭榜挂帅项目(20230079);北京市教委生态修复工程学高精尖学科建设项目(GJJXK21010)。
第一作者:赵誉涵,女,硕士研究生,研究方向为园林植物生理生态。E-mail:zhaoyuhan1010@163.com
通信作者:冷平生,男,博士,教授,硕士生导师,从事园林植物生理生态研究。E-mail:lengpsh@tom.com
胡增辉,男,博士,教授,博士生导师,从事园林植物生理生态研究。E-mail:buahuzenghui@163.com
摘 要 为揭示北京地区蒙古栎(Quercus mongolica)外生菌根真菌群落特征,选取北京农学院林场、云蒙山国家森林公园和百花山国家级自然保护区3个蒙古栎山区自然分布地,以及奥林匹克森林公园和中关村森林公园2个平原引种地为采样地,采集土壤和生有外生菌根的蒙古栎根部样品,检测其土壤理化及酶活性指标,采用ITS高通量测序技术对其外生菌根真菌群落进行测定,初步分析真菌群落多样性与环境因子之间的相关性。结果表明,平原采样地和山区采样地的土壤特性存在明显差异,山区分布地的全氮、速效磷含量以及磷酸酶活性较高,而平原引种地的pH、全磷含量较高。测序后经过OTU注释和α多样性分析,发现绒盖牛肝菌属(Xerocomellus)、丝膜菌属(Cortinarius)、红菇属(Russula)、块菌属(Tuber)为北京地区蒙古栎主要外生菌根真菌类群,但各采样地的优势菌各不相同,并且平原采样地蒙古栎根部外生菌根真菌群落多样性指数低于山区采样地。真菌群落与环境因子相关性分析表明,土壤全氮含量、全磷含量、速效磷含量、碳氮比、磷酸酶活性、海拔、坡度等与真菌多样性关系密切。
关键词 蒙古栎;外生菌根真菌;真菌多样性;土壤理化指标;环境因子
外生菌根是外生菌根真菌侵染植物未木栓化的根系幼嫩部位形成的共生体。研究表明,外生菌根对于植物的营养吸收[1]、生长发育[2]、生理代谢[3-5]、抗逆性[6-10]等均有不同程度的提升和促进作用,并在生态系统物质循环和能量流动、及维持生态系统稳定性等方面具有重要意义[11]。
壳斗科栎属植物作为中国天然林中的第一大类树木,是中国山区森林群落重要的建群种和优势种。蒙古栎(Quercus mongolica)是壳斗科栎属的落叶大乔木,抗逆性强,观赏性高,是优质的生态景观树种。近年来,国内关于蒙古栎遗传育种[12-13]、种苗性状[14-15]、生长特性[16-21]、繁殖[22]、抗逆[23]及群落空间结构[24]等方面的研究已逐渐开展。蒙古栎是外生菌根依赖型树种,虽然已通过接种方式证明外生菌根在其生长发育及环境适应中发挥着重要作用[25],也对一些地区的蒙古栎根际土壤的真菌类群多样性[26-28]进行了分析,但对于其重要分布地北京地区群落组成还缺乏足够的认知。
目前已发现的外生菌根真菌有34科、90属,约5 000~6 000种[29],主要类群属于担子菌亚门(Basidiomycota)和子囊菌亚门(Ascomycota),少部分为接合菌亚门(Zygomycota)[30]。菌根真菌赖以生存的土壤内部结构性质复杂多样,受海拔、经纬度、坡度、光照、降水等非生物因子影响,还受动物、植物、真菌和细菌等生物因素影响,同时土壤的理化性质、营养元素、酶活性等土壤特征也会影响外生菌根真菌的多样性和丰富度[31-32]。明确不同因素对外生菌根真菌分布和丰度情况的影响是了解外生菌根资源,进而开发利用的关键。
本研究以北京地区的蒙古栎为对象,测定土壤理化性质,利用ITS高通量测序技术分析其根部外生菌根真菌群落多样性,以此来了解北京地区蒙古栎外生菌根真菌群落组成及分布特点,对其原生地和引种地土壤特性以及形成的外生菌根真菌多样性进行分析,明确多样性规律和影响因素,为促进蒙古栎外生菌根真菌的功能研究及其推广应用提供参考和支撑。
1 材料与方法
1.1 采样地概况
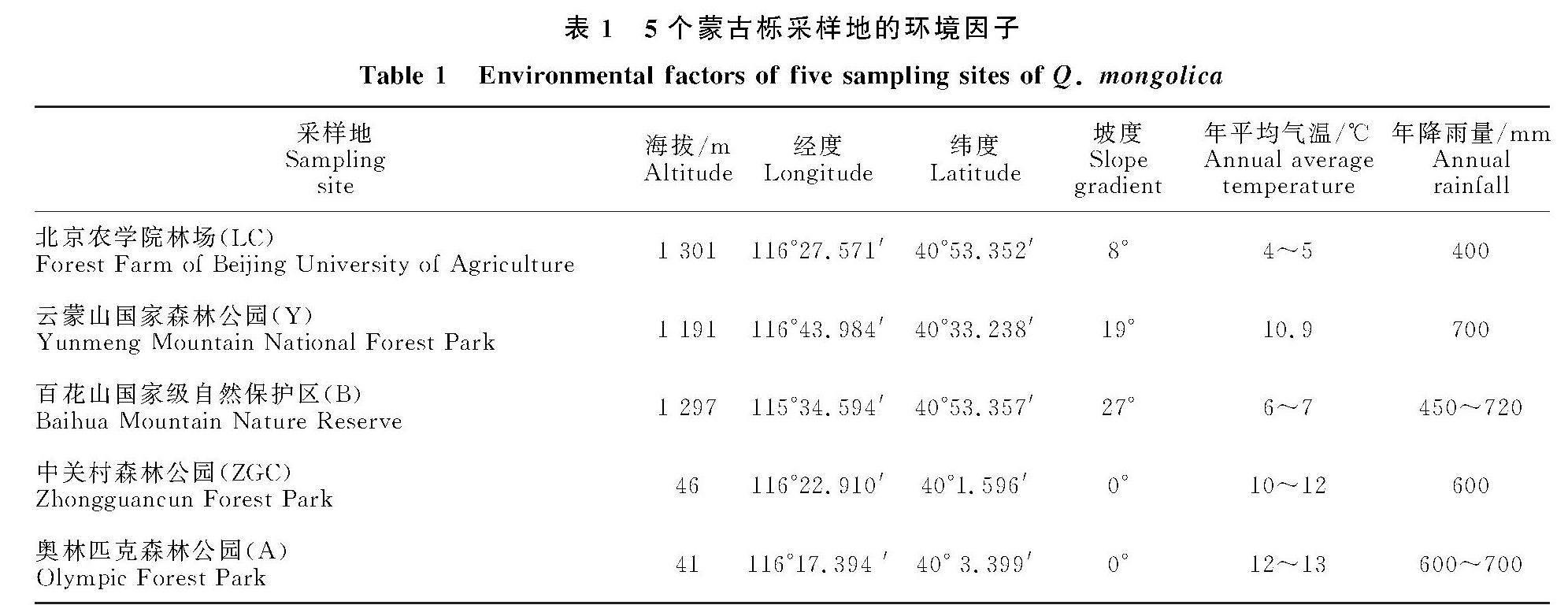
选取北京农学院林场(116°27′E,40°53′N,LC)、云蒙山国家森林公园(116°43′E,40°33′N,Y)、百花山国家级自然保护区(115°34′E,40°53′N,B)3个北京山区的蒙古栎自然分布地以及中关村森林公园(116°22′E,40°1′N,ZGC)和奥林匹克森林公园(116°17′E,40°3′N,A)2个北京城区的平原引种地作为采样地,其主要生态因子及林分特征见表1。
北京农学院林场位于北京市怀柔区宝山镇四道河村,属温带半干旱大陆性季风气候,年平均气温比平原地区低,年降雨量较高。云蒙山国家森林公园位于北京市密云区的西北部地区,与怀柔区相连,气温低,空气湿度良好,通风良好,其森林覆盖率极高,约为95%左右。百花山国家级自然保护区位于北京地区西部的门头沟区清水镇,属于温带大陆性季风气候,昼夜温差大,气温较平原地区偏低,降水量较多,四季分明,春季干旱多风沙,夏季温热多雨,秋季晴朗少风少雨,冬季寒冷多风干燥,其地带性植被为暖温带落叶阔叶林。中关村森林公园位于北京市海淀区唐家岭,园中有大量植被,森林覆盖率高。奥林匹克森林公园位于北京市朝阳区北五环林萃路,属温带大陆型半湿润季风气候。
1.2 样品采集与处理
在5个蒙古栎林采样地群落中设置20 m×20 m的样地,沿S型曲线随机选取5棵树。除去蒙古栎主干周围1 m区域内的杂草及枯落物,用铁锹在表层0~20 cm沿主根生长方向寻找与主根连接的侧根,将带有须根的土块装入采样袋中并编号。每棵树采集3个方位的3个样品,共采样75袋,及时保鲜,时间不得超过10 d。将取回的土壤用抖落法获得根际土壤,放置通风、干燥、凉爽处,风干后过0.25 mm细筛备用。将菌根表面的泥土洗刷干净,剪成2~3 cm的小段,每棵树随机挑选15个根段,分成3组编号并放在2 mL的离心管里,用液氮冷藏后储存于-80 ℃超低温冰箱,然后送武汉康测公司进行绝对定量ITS 测序。
1.3 土壤理化性质测定
土壤酶活性统一采用关松荫[33]的方法测定,土壤过氧化氢酶用H2O2滴定法测定,土壤蔗糖酶采用硫代硫酸钠滴定法测定,土壤脲酶用靛酚蓝比色法测定,土壤磷酸酶采用磷酸苯二钠比色法测定。土壤全磷与全钾的含量采用硫酸与高氯酸消煮ICP测量法,全氮的含量采用国标半微量凯式法,有机质的含量采用国标重铬酸钾法,土壤pH用电位法测定(水∶土=1∶1)。
1.4 DNA提取、PCR扩增与测序
蒙古栎菌根DNA的提取使用天根植物基因组DNA提取试剂盒。将模板DNA用F引物扩增1个循环,扩增结束后,用Ampure XP磁珠纯化。然后使用正向引物ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′和反向引物ITS1R:5′-GCTGCGTTCTTCATCGATGC-3′扩增ITS1区。PCR程序为:95 ℃,3 min→(95 ℃,30 s; 60 ℃,30 s;72 ℃,45 s)×35→72 ℃,10 min→ 4 ℃ hold;反应体系为5×PCR Buffer 10 μL,10 mM dNTPs 1 μL,F和R引物各1 μL,KAPA HiFi DNA Polymerase 1 μL,模板DNA 10 ng。最后,用Ampure XP磁珠纯化回收PCR产物,采用NanoDrop检测纯度并定量,纯化后的扩增产物等物质的量混合,采用Novaseq PE150进行测序。
1.5 OTU聚类和分析
将测序数据预处理,所得的原始数据要进行序列拼接、序列过滤。获得有效序列后,将OTU序列与真菌ITS数据库的模板序列进行比对,获取每个OTU的分类学信息。使用UID去重、纠错后进行OTU聚类和物种分类。然后计算各组共有或特有的OTU数量并采用韦恩图进行展示。最后,使用QIIME软件分别对每组样本计算α多样性指数,包括Chao1、Simpson和Shannon指数,进行β多样性分析[34],确定环境因子对真菌群落影响程度,并分析明确菌根真菌与环境因子的相关性。
2 结果与分析
2.1 不同采样地土壤理化指标
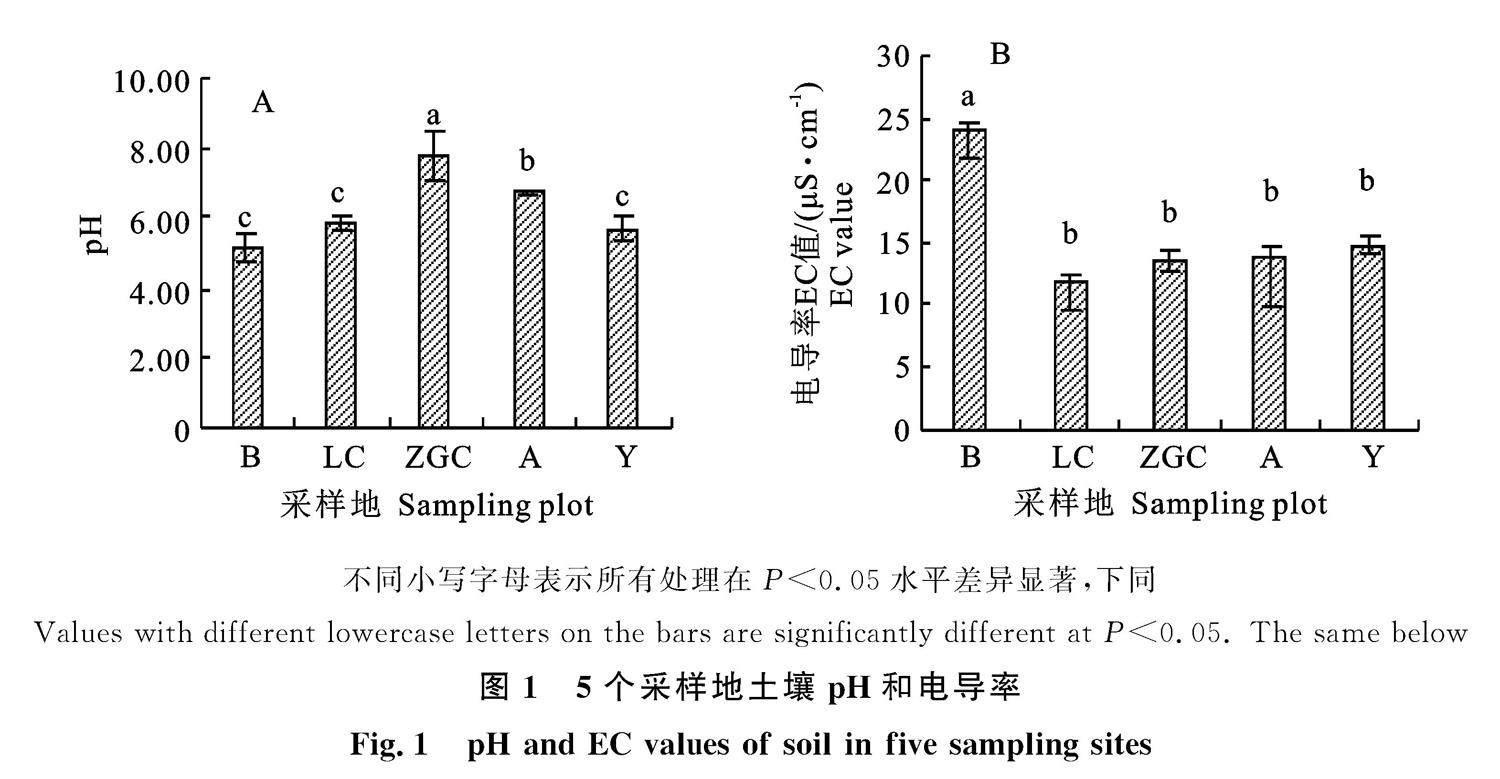
不同采样地土壤环境pH和电导率之间存在明显差异(图1)。5个采样地土壤pH为5~8,除ZGC外其余采样地基本呈现弱酸性,其中ZGC的pH最高为7.84,B的pH最低为5.17(图1-A)。5个采样地土壤EC值为10~25 μS·cm-1,其中B的EC值为23.8 μS·cm-1,显著高于其他采样地,其他采样地间无显著性差异(图1-B, P<0.05)。
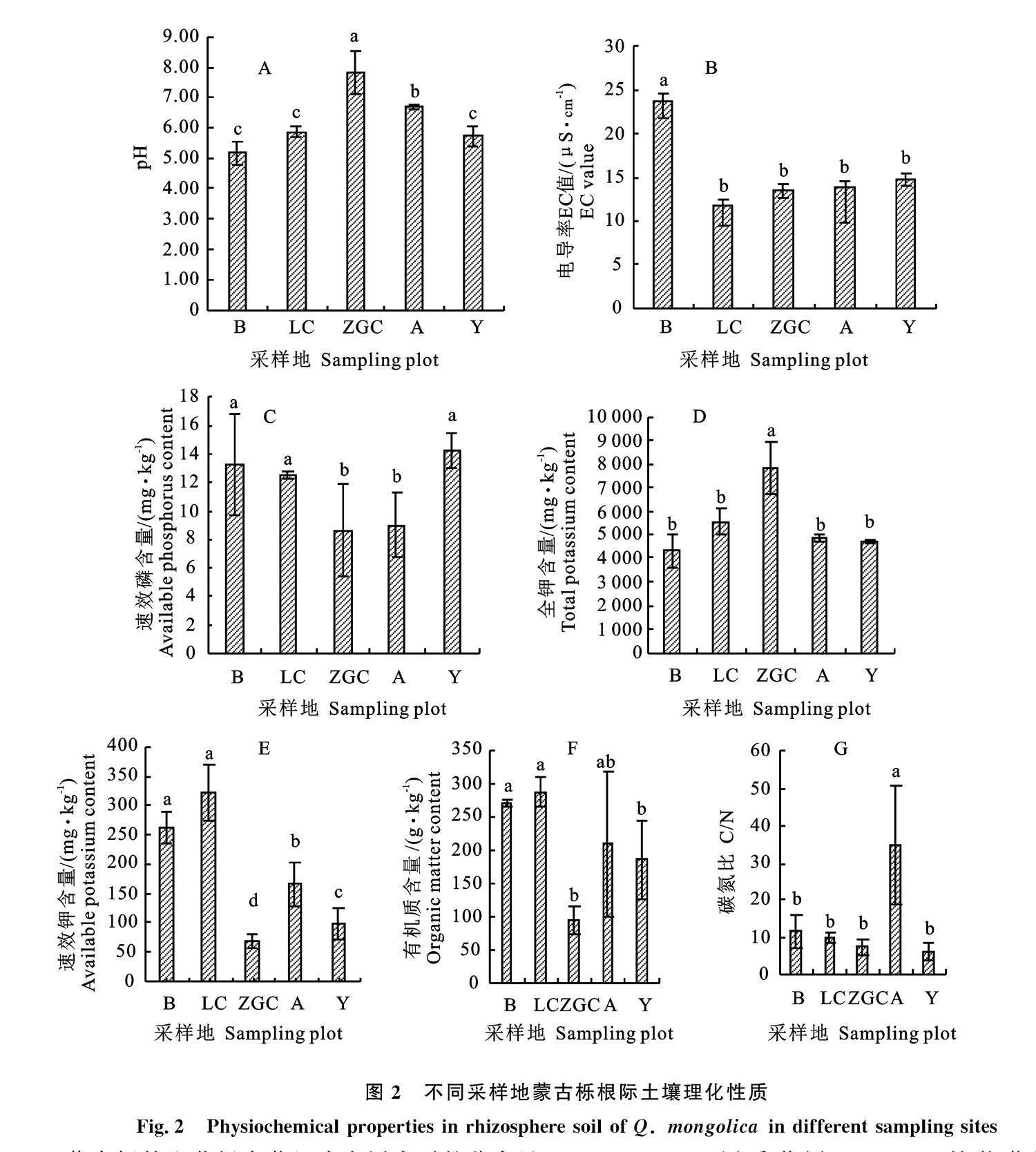
各采样地间的土壤养分含量也存在明显差异(图2)。平原采样地的土壤全氮含量显著低于山区采样地,其中Y含量最高,A最低,含量约为Y的1/5(图2-A)。土壤全磷含量平原采样地显著高于山区,其中ZGC、A约为其他采样地的2倍(图2-B),而其土壤速效磷含量却显著低于B、Y、LC山区采样地,其中最高的Y与最低的ZGC的土壤速效磷含量相差5.5 mg·kg-1 (图2-C)。ZGC土壤全钾含量显著高于其他采样地,达到 7 810 mg·kg-1,其余各采样地间差异不显著(图2-D,P>0.05)。B与LC的土壤速效钾明显高于其他采样地,其中含量最高的LC约为最低ZGC的5倍,A显著低于B与LC但高于Y和ZGC (图2-E,P<0.05)。ZGC的土壤有机质显著低于其他采样地,仅为94.59 g·kg-1,A和Y显著高于ZGC但低于B和LC (图2-F,P< 0.05)。A的土壤C/N显著高于其他采样地,其余各采样地间无显著差异(图2-G,P>0.05)。
不同采样地的4种土壤酶活性见图3。B的土壤过氧化氢酶活性显著低于其他采样地(P<0.05),值为0.66 mg·(g·d)-1,其余采样地之间无明显差异(P>0.05),均在0.7~0.8 mg·(g·d)-1间(图3-A)。各采样地的土壤蔗糖酶活性均在6.18~7.52 mg·g-1·d-1之间,除了Y较低,其他采样地之间无显著差异(图3-B,P>0.05)。除A土壤脲酶活性为18.79 mg·g-1·d-1显著低于B与ZGC,其他采样地则差异不显著(图3-C,P>0.05)。平原的土壤磷酸酶活性显著低于山区,其中ZGC最低,为5.26 mg·g-1·d-1,约为最高值Y的1/5,山区之间差异不显著(图3-D,P>0.05)。
2.2 蒙古栎外生菌根真菌多样性
不同采样地蒙古栎外生菌根真菌测序数见表2,通过标记覆盖率可以看出5个蒙古栎菌根真菌调查地样品检测的标记覆盖率均达到99.9%以上,说明数据可靠,可以进行下一步分析。通过OUT读长可知ZGC的OTU最多为463 353.4,LC的OTU最少为52 343条,5个采样地 OUT数排序为 ZGC>A>Y>B>LC。
蒙古栎外生菌根真菌组成在属水平的分布见图4,5个采样地主要的真菌分别是枝孢瓶霉属Cladophialophora属、砖格孢属(Dictyosporium)、扁孔腔菌属(Lophiostoma)、青霉属(Penicillium)、块菌属(Tuber)、鬼伞属(Coprinopsis)、粉褶菌属(Entoloma)、被孢霉属(Mortierella)、阿太菌属(Piloderma)、绒盖牛肝菌属(Xerocomellus)、丝膜菌属(Cortinarius)、镰刀菌属(Fusarium)、南极树粉孢属(Oidiodendron)、红菇属(Russula)、锤舌菌属(Leotia)、篮状菌属(Talaromyces)。扁孔腔菌属、砖格孢属、南极树粉孢属、块菌属、绒盖牛肝菌属在A表现出较高的富集。还有些属只存在于部分地区的部分样本中,如篮状菌属在A、ZGC北京平原地区的含量较多,锤舌菌属、粉褶菌属只在B的个别样品中存在,红菇属在B、LC、Y的样本中含量较多,被孢霉属、阿太菌属在B、LC中含量较多,丝膜菌属和青霉属在Y富集。
5个采样地蒙古栎根部外生菌根真菌种类的Venn图见图5。5个采样地中有5种共有真菌,其中A有2 419种真菌,区别于其他地区的差异菌有847种。ZGC有2 610种真菌,其中差异于其他地区的有848种真菌。Y共有2 978种真菌,其中有764种真菌与其他地区相比有差异。LC有2 294种真菌,区别于其他地区有466种差异真菌。B有1 959种真菌,差异菌有821种。各个采样点都存在着大量相同菌落,同时也存在不同的差异真菌,不同的立地条件导致菌根真菌的丰富度不相同。
5个蒙古栎分布地的α多样性见图6,LC的Chao1指数最高,ZGC和A较低。Shannon多样性指数最大的是LC,其次是Y、B,ZGC和A较低。而对于Simpson指数,LC值最大,Y其次,A最低。综合Chao1、Shannon、Simpson指数可得知平原采样地的菌根真菌多样性低于山区采 样地。
5个采样地蒙古栎的β多样性见图7,样本点距离越近,相关性越显著。由图7可知,在B、Y和LC的几个样本之间距离较近,而与A和ZGC样本点相距较远,这表明:山区3个采样地的真菌
丰富度与真菌类群较为相似,与平原两采样地真菌同源性较低。
2.3 蒙古栎外生菌根真菌与环境因子的相关性
菌根真菌多样性指数(Chao1、Shannon、Simpson)与土壤理化性质、土壤酶活性、海拔和坡度之间的相关性见表3。土壤全氮、速效磷、磷酸酶、海拔、坡度与真菌多样性指数成显著正相关。其中,速效磷与Shannon指数相关性最大,海拔与Simpson指数相关性最大。全磷、C∶N、
土壤过氧化氢酶活性与真菌多样性指数成显著负相关,其中,全磷与Shannon指数负相关性极显著,C∶N与Simpson指数呈极显著负相关(P<0.01)。与Chao1指数相关性最大的为坡度,有极显著负相关性的为过氧化氢酶活性。此外,各多样性指数与全钾、速效钾、有机质、pH、EC值、土壤蔗糖酶活性以及脲酶活性之间无显著相关性(P<0.05)。由此可知,全氮、全磷、速效磷、 C∶N、磷酸酶活性、海拔和坡度等环境因子对菌根真菌多样性产生深刻的影响。
3 讨 论
蒙古栎是北京山区森林群落的重要组成树种,是外生菌根依赖性树种,外生菌根会影响养分、水分的吸收及其抗逆性,在生长发育及对逆境胁迫的适应中起着重要作用[7-10,35],因此合适的菌根能促进蒙古栎在平原区的应用。但目前对蒙古栎菌根的研究较少,特别是对能形成菌根的真菌多样性还缺乏系统性了解,而且外生菌根真菌的类型和群落组成也会受到环境因子的影响[36-37]。所以本研究测定了北京地区蒙古栎原生地和引种地的土壤特性和外生菌根真菌群落多样性,并对二者之间相关性进行了初步解析。
由于5个采样地彼此间的距离相对较远,所以土壤理化性质和土壤酶活性受不同环境影响会存在一定的差异。从土壤理化指标来看,平原地区森林公园的土壤全氮和速效磷含量相对较低,而全磷含量较高,这可能与城市森林公园蒙古栎林地枯枝落叶较少,腐殖质层较薄,以及养护管理措施有关。其中,奥林匹克森林公园的全磷含量较高而土壤磷酸酶活性较低,这可能是因为较低的土壤磷酸酶活性导致植物可利用态磷的转化量低,植物吸收磷的量较少,从而造成较多的磷保留在土壤中。相反,山区蒙古栎分布区B、LC和Y的土壤全磷含量较低,而土壤磷酸酶活性较高,这是因为在磷缺乏的条件下,外生菌根真菌的分泌物会提高土壤中磷的活性,从而促进宿主植物吸收磷元素,这也是外生菌根真菌对土壤中磷的活化机理之一。杨国亭等[38]在研究中也表明,菌根真菌可以分泌磷酸酶和硝酸还原酶,将土壤中不可吸收的元素转化为可吸收利用的元素从而增加养分的获取。此外,pH与土壤营养元素含量之间也表现出来较高水平的相关性。本研究中的B和LC山区采样地有机质含量较高,这可能是因为这两地土壤pH为5~6,适宜菌根真菌生长,因而土壤营养元素含量较高。
菌种的多样性指数反映该地区菌种丰富度与均匀度,Chao1指数可以估计群落中实际存在的物种数;Shannon指数可以综合考虑群落的丰富度和均匀度,Shannon指数值越高,表明群落的多样性越高;Simpson指数是评价群落多样性的常用指数之一,Simpson指数值越高,表明群落中物种数越多,各种个体分配越均匀,物种多样性程度越高。根据测序结果所得菌根真菌的α多样性与属水平的OTU注释分析以及各个不同地区的热图可以发现:不同地区的菌种分布以及菌根真菌多样性不相同。北京山区和平原采集地的菌根真菌多样性差异较大,北京山区菌种丰富度明显高于平原地区。从各采样地的样品总体情况来看,绒盖牛肝菌属、丝膜菌属、红菇属、块菌属为北京地区蒙古栎主要外生菌根真菌类群。其中,丝膜菌属、红菇属、块菌属也是北京东灵山辽东栎的主要外生菌根真菌类群。此外,杨岳等[39]发现了内蒙古地区白桦根围土壤的外生菌根真菌的优势属也有红菇属、丝膜菌属。
通过分析环境因子对外生菌根真菌群落的影响,发现全氮、全磷、速效磷、C∶N、磷酸酶活性、海拔和坡度等环境因子对菌根真菌多样性的影响较为显著。有研究表明:由于氮含量增加会影响外生菌根真菌的类群转化,所以土壤氮含量也决定着菌根分布[40],并且土壤磷酸酶活性与菌根多样性之间呈显著正相关,这可能是由于磷酸酶将土壤中难溶的有机磷转化为易于吸收的无机磷,无机磷含量增加对于宿主植物生长与菌根真菌生存都起到促进作用。杨岳等[39]研究结果也表明,土壤全磷与pH产生的协同作用对外生菌根真菌群落组成具有显著影响。
此外,海拔、坡度、经纬度等环境因子以及植被情况也都对菌根真菌多样性产生了不可忽视的影响。景跃波[41]就中国已有菌根研究做出综述,土壤类型及质地、土壤酸碱度及养分状况、季节、温度、光照、立地因子、宿主植物等变化都会对外生菌根真菌群落分布造成显著的影响。白淑兰等[37]也发现大青山外生菌根真菌多样性与坡度显著相关。有研究表明气候的变化、火烧、树木种植与砍伐以及动物和人类活动等因素对土壤真菌群落具有明显影响[42]。
本研究利用ITS高通量测序技术首次对北京地区蒙古栎外生菌根的真菌多样性进行了分析,得到了能与蒙古栎共生形成外生菌根的真菌类群,并初步明确了真菌与环境因子的关系,为进一步揭示蒙古栎外生菌根真菌的种类、分布及作用提供了参考,也为培育菌根化苗木和推广应用提供了依据。
参考文献 Reference:
[1] BECQUER A,GUERRERO G,KEVIN C,et al.The ectomycorrhizal contribution to tree nutrition[J].Advances in Botanical Research,2019,89:77-126.
[2] 魏 杰,郭晓笑,杨旭东,等.内蒙古地区5种棉革菌外生菌根形态描述和分子鉴定[J].菌物学报,2017,36(7):870-878.
WEI J,GUO X X,YANG X D,et al.Morphological description and molecular identification of five Tomentella ectomycorrhizae from Inner Mongolia[J].Mycosystema,2017,36(7):870-878.
[3] 刘 静,马 淼.丛枝菌根真菌对超旱生植物刺山柑生长及相关生理指标的影响[J].西北农业学报,2013,22(11):158-162.
LIU J,MA M.Effects of arbuscular mycorrhiza fungi on growth and some physiological indices of capparis spinosa[J].Acta Agriculturae Boreali-occidentalis Sinica,2013,22(11):158-162.
[4] 黄 艺,李 婷,姜学艳.锌对外生菌根植物苏格兰松幼苗锌积累和光合作用的影响[J].环境科学学报,2004(3):508-514.
HUANG Y,LI T,JIANG X Y.Effects of Zn on Zn accumulation and photosynthesis of ectomycorrhizalPinus sylvestris seedlings[J].Acta Scientiae Circumstantiae,2004(3):508-514.
[5] 贺学礼,赵丽莉,周春菊,等.VA菌根真菌对大蒜幼苗生理特性的影响[J].西北农业学报,1999,8(2):89-91.
HE X L,ZHAO L L,ZHOU CH J, et al.Effects of VA mycorrhizal fungi on the physiological characters of garlic seedling[J].Acta Agriculturae Boreali-occidentalis Sinica,1999,8(2):89-91.
[6] 田 方,陈 锡,钟 理,等.丛枝菌根真菌对白刺花苗期抗旱酶系及生理特性的影响[J].西北农业学报,2022, 31(12):1625-1634.
TIAN F,CHEN X,ZHONG L, et al.Effect of arbuscular mycorrhizal fungi on eenzyme system and biochemical indexes of drought resistance in Sophora davidii[J].Acta Agriculturae Boreali-occidentalis Sinica,2022,31(12):1625-1634.
[7] 许平辉,王飞权,齐玉岗,等.丛枝菌根真菌对茶树抗旱性的影响[J].西北农业学报,2017,26(7):1033-1040.
XU P H,WANG F Q,QI Y G, et al.Effect of arbuscular mycorrhiza fungi on drought resistance in tea plant(Camellia sinensis) [J].Acta Agriculturae Boreali-occidentalis Sinica,2017,26(7):1033-1040.
[8] 刘梦娇,张英伟,柴立伟,等.铜胁迫下4种外生菌根真菌的耐受性比较[J].菌物研究,2017,15(1):39-45.
LIU M J,ZHANG Y W,CHAI L W,et al.Comparison the tolerance of four ectomycorrhizal fungi under copper stress[J].Journal of Fungal Research,2017,15(1):39-45.
[9] 温祝桂,王 杰,汤阳泽,等.外生菌根真菌彩色豆马勃(Pisolithu stinctorius)辅助植物修复重金属Cu污染土壤的应用潜力[J].生物技术通报,2017,33(4):149-156.
WEN ZH G,WANG J,TANG Y Z,et al.The application potential of ectomycorrhizal fungus Pisolithus tinctorius assisting plant in phytoremediation of Cu-contaminated soils[J].Biotechnology Bulletin,2017,33(4):149-156.
[10] 赵平娟,安 锋,丁明明.菌根提高植物抗病机理的研究[J].西北林学院学报,2004,19(1):93-97.
ZHAO P J,AN F,DING M M.Advances in the researches of the mechanism of disease resistance promotion ofmycorrhiza[J].Journal of Northwest Forestry University,2004,19(1):93-97.
[11] 张 晶,张惠文,李新宇,等.土壤真菌多样性及分子生态学研究进展[J].应用生态学报,2004,15(10):1958-1962.
ZHANG J,ZHANG H W,LI X Y,et al.Research advances in soil fungal diversity and molecular ecology[J].Chinese Journal of Applied Ecology,2004,15(10):1958-1962.
[12] 李 波,张伟溪,丁 密,等.不同种源蒙古栎遗传变异[J].东北林业大学学报,2022,50(4):8-14,26.
LI B,ZHANG W X,DING M,et al.Genetic variation of Quercus mongolica from different provenances[J].Journal of Northeast Forestry University,2022,50(4):8-14,26.
[13] 孟 鑫,王世杰,江 敏,等.蒙古栎Trihelix转录因子家族鉴定与表达分析[J].植物遗传资源学报,2023,24(5):1448-1460.
MENG X,WANG SH J,JIANG M,et al.Identification and expression analysis of trihelix transcription factor family in Quercus mongolica[J].Journal of Plant Genetic Resources,2023,24(5):1448-1460.
[14] 任俊杰,庞新博,刘昭阳,等.不同种源蒙古栎种子表型性状的多样性[J].浙江农林大学学报,2022,39(6):1221-1228.
REN J J,PANG X B,LIU ZH Y,et al.Diversity of phenotypic characters of Quercus mongolica seeds from different provenance[J].Journal of Zhejiang A&F University,2022,39(6):1221-1228.
[15] 李祉漪,战 昊,张家榕,等.不同种源蒙古栎种子及其苗期生长性状变异研究[J].西北林学院学报,2023,38(1):73-79.
LI ZH Y,ZHAN H,ZHANG J R,et al.Study on variation of seed and seedling growth traits of Quercus mongolica from different provenances[J].Journal of Northwest Forestry University,2023,38(1):73-79.
[16] 王宣璎,张 翼,范秀华.氮沉降对蒙古栎幼苗生长及光合特性的影响[J].森林与环境学报,2023,43(3):280-286.
WANG X Y,ZHANG Y,FAN X H.Effects of simulated nitrogen deposition on growth and photosynthetic characteristics of Quercus mongolica seedlings [J].Journal of Forest and Environment,2023,43(3):280-286.
[17] 马成祥,周广胜,宋兴阳,等.增温、光照时间和氮添加对蒙古栎主要物候期的影响[J].应用生态学报,2022,33(12):3220-3228.
MA CH X,ZHOU G SH,SONG X Y,et al.Effects of warming,photoperiod,and nitrogen addition on the main phenological phases of Quercus mongolica[J].Chinese Journal of Applied Ecology,2022,33(12):3220-3228.
[18] 马靖然,王亚楠,常 璐,等.冠层光谱组成对红松和蒙古栎幼苗生长和光合荧光特性的影响[J].应用生态学报,2022,33(9):2314-2320.
MA J R,WANG Y N,CHANG L,et al.Effects of canopy spectral composition on growth and photosynthetic fluorescence characteristics of pinus koraiensis and Quercus mongolica seedlings[J].Chinese Journal of Applied Ecology,2022,33(9):2314-2320.
[19] 孙忠林,华明阳,尹智博,等.水热条件及坡向对长白山区蒙古栎林土壤呼吸的影响[J].东北林业大学学报,2022, 50(11):78-83.
SUN ZH L,HUA M Y,YIN ZH B,et al.Effects of hydrothermal conditions and slope aspect on soil respiration of Mongolian oak forests in Changbai Mountains[J].Journal of Northeast Forestry University,2022,50(11):78-83.
[20] 陆秀君,张 宇,刘鸣宇,等.不同促根措施对蒙古栎苗木生长的影响[J].福建林学院学报,2011,31(2):140-145.
LU X J,ZHANG Y,LIU M Y,et al.Effects of different rooting measures on the growth of Quercus mongolica seedlings[J].Journal of Forest and Environment,2011,31(2):140-145.
[21] 王玉涛,郭雨竹,李佳宁,等.蒙古栎花芽分化、花器官发育及花粉离体萌发特性研究[J].沈阳农业大学学报,2021,52(5):530-536.
WANG Y T,GUO Y ZH,LI J N, et al.Study on floral bud differentiation,floral organ development and pollen germination of Quercus mongolica[J].Journal of Shenyang Agricultural University,2021,52(5):530-536.
[22] 虞家昕,战 昊,王思进,等.防褐化处理对蒙古栎插穗生根及其生理生化的影响[J].西北林学院学报,2022, 37(1):119-124,229.
YU J X,ZHAN H,WANG S J,et al. Effects of the anti-browning treatmenton the cutting rooting of Quercus mongolica and their physiology and biochemistry[J].Journal of Northwest Forestry University,2022,37(1):119-124,229.
[23] 王天宠,艾万峰,刘汉嶂,等.蒙古栎QmMYC基因家族鉴定及其干旱胁迫下表达分析[J].沈阳农业大学学报,2022,53(2):147-156.
WANG T CH,AI W F,LIU H ZH,et al.Identification of QmMYC gene family in Quercus mongolica and expression analysis under drought stress[J].Journal of Shenyang Agricultural University,2022,53(2):147-156.
[24] 董莉莉,赵济川,汪成成,等.抚育间伐后蒙古栎阔叶混交林径级结构及生长动态研究[J].西南林业大学学报(自然科学),2019,39(6):98-104.
DONG L L,ZHAO J CH,WANG CH CH,et al.Study on diameter structure and growth dynamics of mixed Quercus mongolica broad-leaved natural stands after tending thinnin[J].Journal of Southwest Forestry University(Natural Sciences),2019,39(6):98-104.
[25] 郭 伟,郝 汉,张伟浩,等.外生菌根真菌通过调节离子平衡提高蒙古栎耐盐性[J].应用生态学报,2022,33(12):3303-3311.
GUO W,HAO H,ZHANG W H,et al.Ectomycorrhizal fungi enhance salt tolerance of Quercus mongolica by regulating ion balance[J].Chinese Journal of Applied Ecology,2022,33(12):3303-3311.
[26] 冀瑞卿,邢鹏杰,徐 洋,等.蒙古栎根内及根围土壤中共生真菌和细菌群落组成分析[J].菌物学报,2019,38(11):1894-1906.
JI R Q,XING P J,XU Y,et al.Analyses on the composition of symbiotic fungi and bacteria in the roots and rhizosphere soil of Quercus mongolica[J].Mycosystema,2019,38(11):1894-1906.
[27] 孙渤洋,武英达,员 瑗.东北地区蒙古栎木生大型真菌物种多样性和区系特征[J].菌物学报,2023,42(1):278-289.
SUN B Y,WU Y D,YUAN Y.Species diversity and floral characteristics of wood-inhabiting macrofungi growing onQuercus mongolica in Northeast China [J].Mycosystema,2023,42(1):278-289.
[28] 郭 璞,邢鹏杰,宋 佳,等.蒙古栎根系与根区土壤真菌群落组成及与环境因子的关系[J].菌物研究,2022, 20(3):173-182.
GUO P,XING P J,SONG J, et al.Fungal community in roots and the root zone of Quercus mongolica and the correlations with the environmental factors[J].Journal of Fungal Research,2022,20(3):173-182.
[29] 乌仁陶格斯,王 娟,昭日格,等.外生菌根生态学研究进展[J].安徽农业科学,2018,46(6):26-28,36.
WURENTAOGESI,WANG J,ZHAORIGE,et al.Research advances in ectomycorrhizal ecology [J].Journal of Anhui Agricultural Sciences,2018,46(6):26-28,36.
[30] 黄亦存,沈崇尧,裘维蕃.外生菌根的形态学、解剖学及分类学研究进展[J].真菌学报,1992,11(3):169-181.
HUANG Y C,SHEN CH Y,QIU W F.Studies on the more phology,anatomy and classification of ectomycorrhizae[J].Actamycologicasinica,1992,11(3):169-181.
[31] 张晨洋,付双嘉,高浩英,等.外生菌根真菌多样性对云杉根际土壤生化性质的影响[J].四川农业大学学报,2023, 41(2):230-239,351.
ZHANG CH Y,FU SH J,GAO H Y,et al.Effects of ectomycorrhizal fungal diversity on biochemical properties of spruce rhizosphere soil[J].Journal of Sichuan AgriculturalUniversity,2023,41(2):230-239,351.
[32] 王永龙,张 旋,徐 颖,等.包头市公园林下土壤外生菌根真菌的多样性与群落构建机制[J].应用生态学报,2023,34(5):1225-1234.
WANG Y L,ZHANG X,XU Y,et al.Diversity and community assembly mechanism of soil ectomycorrhizal fungi in urban parks of Baotou City,China[J].Chinese Journal of Applied Ecology,2023,34(5):1225-1234.
[33] 关松荫.土壤酶及其研究方法[M].北京:农业出版社,1986:278-323.
GUAN S Y.Soil Enzyme and Its Research Methods[M].Beijing:Agriculture Press,1986:278-323.
[34] 田诗义,董文统,叶佳伟,等.湖南红壤区三个林龄板栗园外生菌根真菌多样性[J].菌物学报,2023,42(3):677-691.
TIAN SH Y,DONG W T,YE J W,et al.Diversity of ectomycorrhizal fungi in three Castanea mollissima plantations in krasnozem region of Hunan Province [J].Mycosystema,2023,42(3):677-691.
[35] ZWIAZEK J J,EQUIZA M A,KARST J,et al.Role of urban ectomycorrhizal fungi in improving the tolerance of lodgepole pine (Pinus contorta) seedlings to salt stress [J].Mycorrhiza,2019,29(4):303-312.
[36] 袁 超,张盼盼,庞文博,等.天然林与人工林中锥栗外生菌根真菌多样性研究[J].福建农业学报,2023,38(3):367-375.
YUAN CH,ZHANG P P,PANG W B,et al.Ectomycorrhizal fungi communities at natural and cultivated Castanea henryi forests[J].Fujian Journal of Agricultural Sciences,2023,38(3):367-375.
[37] 白淑兰,刘 勇,周 晶,等.大青山外生菌根真菌资源与生态研究[J].生态学报,2006,26(3):837-841.
BAI SH L,LIU Y,ZHOU J,et al.Resources investigation and ecological study on ectomycorrhizal fungi in Daqingshan Mountains,Inner Mongolia [J].Acta Ecologica Sinica,2006,26(3):837-841.
[38] 杨国亭,宋关玲,高兴喜.外生菌根在森林生态系统中的重要性(Ⅰ)──外生菌根对宿主树木的影响[J].东北林业大学学报,1999,27(6):72-77.
YANG G T,SONG G L,GAO X X.The significance of ectomycorrhizas in forest ecosystems:the influence of ectomycorrhizas on host trees[J].Journal of Northeast Forestry University,1999,27(6):72-77.
[39] 杨 岳,闫 伟,魏 杰.内蒙古地区白桦根围土壤外生菌根真菌群落结构[J].菌物学报,2018,37(3):294-304.
YANG Y,YAN W,WEI J.Ectomycorrhizal fungal community in the rhizospheric soil of Betula platyphylla in Inner Mongolia[J].Mycosystema,2018,37(3):294-304.
[40] TRESEDER K K.Nitrogen additions and microbial biomass:a meta-analysis of ecosystem studies[J].Ecology Letters,2008,11(10):1111-1120.
[41] 景跃波.我国树木外生菌根菌资源状况及生态学研究进展[J].西部林业科学,2007(2):135-140.
JING Y B.Resource status of tree ectomycorrhizal fungi in China and studyprogress on its ecology[J].Journal of West China Forestry Science,2007(2):135-140.
[42] XIONG J,CHU H,SUN H,et al.Divergent responses of soil fungi functional groups to short-term warming[J].Microbial Ecology,2014,68(4):708-715.
Community Composition of Ectomycorrhizal Fungi Associated
with Quercus mongolica in Beijing,China
ZHAO Yuhan1,2,SUN Jiaqi1,SUN Jinqshuang3,CUI Jianhui4,LENG Pingsheng1,5 and HU Zenghui1,2
(1.Engineering Technology Research Center for Ancient Tree Health and Ancient Tree Culture of National Forestry and
Grassland Administration/College of Landscape Architecture,Beijing University of Agriculture,Beijing 102206,China;
2.Beijing Laboratory for Urban and Rural Ecological Environment,Beijing 102206,China;3.Nanliyuan Forest Farm of
Fangshan District,Beijing 102425,China;4.Dawopu Collective Forest Farm of Fangshan District,Beijing 102407,China;
5.Beijing Engineering Technology Research Center of Rural Landscape Planning and Design,Beijing 102206,China)
Abstract To evaluate the characteristics of ectomycorrhizal fungal communities associated with Quercus mongolica in Beijing,China,three naturally occurring in mountainous areas of Q. mongolica (Forest Farm of Beijing University of Agriculture,Yunmeng Mountain National Forest Park,and Baihua Mountain National Nature Reserve),and two introduced areas in plains (Olympic Forest Park and Zhongguancun Forest Park) were selected as sampling sites. The soil and ectomycorrhizal roots of Q.mongolica were collected,and the physiochemical properties along with enzyme activity indices of the soil were analyzed.The community structure of ectomycorrhizal fungi in roots was determined using ITS high-throughput sequencing technology. Preliminary analysis was conducted to examine the correlation between the ectomycorrhizal fungal community diversity and environmental factors. The results showed that there were significant differences in soil characteristics between the plain and mountainous areas. Total nitrogen,available phosphorus,and phosphatase activity were higher in mountainous areas,whereas the pH value and total phosphorus content were higher in plain areas.Sequencing and OTU annotation along with α diversity analysis showed that Xerocomellus,Cortinarius,Russula,and Tuber were the main ectomycorrhizal fungi groups of Q. mongolica in Beijing,however,the dominant fungi varied across different sampling sites. Moreover,the diversity indexes of ectomycorrhizal fungi in the roots of Q. mongolica from plain sampling sites were lower compared to those in mountainous areas. The correlation analysis between fungal community and environmental factors showed that soil total nitrogen content,total phosphorus content,available phosphorus content,carbon to nitrogen ratio,phosphatase activity,altitude,and slope were closely related to fungal diversity.
Key words Quercus mongolica; Ectomycorrhizal fungi; Fungal diversity; Soil physiochemical index; Environmental factor
Received 2023-03-31 Returned 2023-06-19
Foundation item Open Competition Project of Beijing University of Agriculture (No.20230079); High-level Disciplinary Construction Project in Ecological Restoration Engineering Funded by Beijing Municipal Education Commission(No.GJJXK21010).
First author ZHAO Yuhan,female,master student.Research area:physiological ecology of landscape plants.E-mail:zhaoyuhan1010@163.com
Corresponding author LENG Pingsheng,male,Ph.D,professor,master supervisor.Research area:physiological ecology of landscape plants.E-mail:lengpsh@tom.com
HU Zenghui,male,Ph.D,professor,Ph.D supervisor.Research area:physiological ecology of landscape plants.E-mail:buahuzenghui@163.com(责任编辑:成 敏 Responsible editor:CHENG Min)

