盐胁迫下AMF和生物质炭耦合系统对玉米籽粒产量和生理生态的调控作用
常青 周生 吴中凯

doi:10.7606/j.issn.1004-1389.2024.07.007
https://doi.org/10.7606/j.issn.1004-1389.2024.07.007
收稿日期:2023-04-27 修回日期:2023-05-29
基金项目:国家自然科学基金(31700270)。
第一作者:常 青,女,副教授,从事生物学研究。E-mail:pychang@126.com
摘 要 旨在探究盐胁迫下丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)和不同生物质炭浓度耦合系统中对玉米籽粒产量以及生理生态的调控作用。设置中盐(20 mmol·L-1)胁迫下对玉米施用生物质炭各0、2%、4%、8%、12%浓度下并接种AMF摩西斗管囊霉Funneliformis mosseae(Fm)、根内根孢囊霉Rhizophagus intraradices(Ri)、共同接种(Fm+Ri)以及不接种对照(CK)共20个处理。结果表明,中盐胁迫下生物质炭能够促进AMF侵染发育,提高AMF泡囊数和侵入点数,与玉米形成良好的共生关系。不同AMF处理和生物质炭协同下均显著增加玉米根长以及叶面积,提高叶绿素含量(SPAD值)以及叶绿素荧光参数,提升植物光合作用并增加玉米产量。在生物质炭添加4%水平下,与对照相比,共同接种Fm+Ri处理的玉米根系长度提高16.8%,叶片叶绿素含量(SPAD值)和叶面积分别提高18.5%和19.9%,玉米籽粒产量提高22.4%;叶片净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)分别增加51.2%、75.5%和24.8%,胞间CO2浓度(Ci)下降28.6%;叶绿素荧光参数中最小荧光值(Fo)、最大荧光值(Fm)、光合性能指数(Plabs)以及PSⅡ的最大光化学量子效率(Fv/Fm)分别提高69.6%、32.1%、173.6%和15.1%。可见,生物质炭浓度以及AMF的种类对作物生长的影响并不一致,本试验中生物质炭添加4%水平下并共同接种Fm+Ri处理增加玉米根系长度和叶面积,提高叶绿素含量和荧光参数,增强光合作用能力,提升玉米产量的效果最为显著,生物质炭协同AMF促进作物增产的效果还需进一步大田试验验证。
关键词 丛枝菌根真菌;生物质炭;盐胁迫;光合;叶绿素;玉米;产量
土壤盐渍化是全球性的热点问题,随人口数量增加以及城市化进程加快,人类对果蔬粮食等需求的增加,导致耕地压力越来越大,由此带来的生态环境问题愈加突出,土壤盐碱化进程逐渐加快[1]。研究发现,土壤含盐量过高会使得作物根系对水分和氮磷钾等营养物质的吸收能力减弱,引起植物“生理干旱”和“缺素症”,同时土壤盐碱化会造成土壤碱性偏重,影响土地资源的合理利用,使得作物生长发育状况变差并间接造成作物产量降低[2-3]。因此,选择有效技术进行改良土壤或增加作物耐盐性、合理利用盐碱地土壤以增加粮食产量是一个亟待解决的问题。
从枝菌根真菌(arbuscular mycorrhiza fungi,AMF)是一类古老的微生物,其与植物共生的历史可追溯到4.6亿年前[4-5]。丛枝菌根是陆生生物与古球囊菌门真菌之间的一种根内共生体,能促进植物水分、养分的吸收,增强植物对生物及非生物胁迫的抗性[6-7];作为回报,共生植物反馈AMF碳水化合物,以帮助真菌完成生活史[8]。赵华等[9]发现,地表多样孢囊霉(Diversispora epigaea)和幼套近明球囊霉(Claroideoglomus etunicatum)能够明显减轻盐胁迫对番茄(Lycopersicon esculentum)的伤害,AMF定殖植物根系后可使丙二醛(MDA)含量增幅减缓,叶片脯氨酸含量显著下降;接种AMF处理能显著提高番茄光合能力,增强SOD、POD和CAT活性,改善植株的全氮、全磷含量,进而增加番茄产量。盐胁迫下接种摩西斗管囊霉(Funneliformis mosseae)可显著增强甜瓜(Cucumis melo)幼苗叶绿素含量、净光合速率(Pn)、光合电子传递速率(ETR)、水分利用率(WUE)和气孔限制因子(Ls),可通过改善叶绿素荧光、气体交换参数和光响应参数来减轻盐胁迫对植株造成的伤害[10]。有研究发现,生物质炭可以通过改良土壤理化性状,如提高土壤pH值和增加营养元素含量等促进植物生长,改善植物光合作用条件和生理效应,间接影响作物生长发育状况和产量[11-12]。生物质炭是富含碳的生物质在缺氧或者无氧条件下热解产生的一种碳素丰富的多孔固体物质,因其具有大孔隙结构、大比表面积、多活性基团以及高稳定性等特质,在全球碳循环、气候变化以及环境调节中发挥重要作用[13]。如盆栽条件下添加生物质炭能有效缓解盐胁迫对玉米幼苗生长的抑制,增加干物质累积量、叶绿素相对含量(SPAD)以及叶面积,提高净光合速率、蒸腾速率和气孔导度,添加生物质炭能减低玉米叶片MDA含量,提高CAT、SOD活性,可作为盐渍化土壤改良剂[14-15]。
另有研究证实,作为土壤改良剂的生物质炭对菌根真菌能够产生潜在的增效作用,促进AMF侵染和植物生长发育[16-17]。AMF能够产生一种球囊霉素相关土壤蛋白(glomalin-related soil protein,GRSP),是土壤有机碳库的重要来源,有利于增加土壤团聚体稳定性,改善土壤耕性等[18]。陈雪冬等[19]认为接种AMF配施300 ℃生物炭能够显著增加土壤可溶性有机碳含量,而Saito等[20]也发现,添加生物质炭能够促进AMF在草本植物根上的定植。基于以上研究,关于AMF与生物质炭协同的作用机制尚不明确,对粮食作物生长以及光合生理的影响未见相关报道。本试验拟通过温室栽培,探究盐胁迫下不同生物质炭浓度与AMF二者联合对玉米生长以及生理生态的调控作用,期望能从生理生态学的角度找出盐胁迫下生物质炭协同AMF促进玉米生长的最适宜浓度,同时为后期合理利用盐碱地增加作物产量提供理论依据。
1 材料与方法
1.1 试验材料
试验于2021年4月-8月在濮阳职业技术学院露天空地进行,供试植物材料为玉米‘郑单528种子来自河南省农业科学研究院。生物质炭购于宁夏荣华生物质新材料科技有限公司,为秸秆生物质炭(pH 9.45,有机质含量842 g·kg-1,全氮含量7.6 g·hg-1)。育苗穴盘基质由蛭石与草炭按1∶1体积比混合而成,盆栽基质为园土(取自濮阳职业技术学院校园)与草炭按1∶1体积比混合,基质均经过高压蒸汽灭菌(120 ℃, 2 h)后备用。供试AMF菌种为摩西斗管囊霉(Funneliformis mosseae)和根内根孢囊霉(Rhizophagus intraradices),由北京市农林科学院植物营养与资源研究所“AMF种质资源库”( BGC) 提供,由三叶草扩繁,以保存于其根系及基质中的孢子、菌丝和菌根根段为接种物(孢子密度为每50 g 340个,菌丝侵染率为76%);供试土样为121 ℃高温高压蒸汽灭菌2 h后的园土。土壤基本理化性质:pH为6.98,全氮2.3 g·kg-1,有机质含量2.6 g·kg-1,全钾4.4 g·kg-1,全磷0.6 g·kg-1,碱解氮64.8 mg·kg-1,速效钾63.1 mg·kg-1,有效磷3.4 mg·kg-1。
1.2 试验方法
种植前准备:选取籽粒饱满,大小一致,玉米种子,用0.1% HgCl2溶液浸泡消毒5 min,再用蒸馏水冲洗5~6次。将消毒后的玉米种子随机播在铺有两层滤纸的培养皿(φ=9 cm),每皿放置20粒。所有的培养皿放入在(25±1) ℃、相对湿度为75%、12 h光照/12 h黑暗的条件下的恒温光照培养箱中培养,光照度4 500 lx。
接种种植:采用盆栽试验,设生物质炭水平各0、2%、4%、8%、12%浓度下,单接种摩西斗管囊霉(Fm)、根内根孢囊霉(Ri)以及二者混合菌种 (Fm+Ri)和不接种对照(CK),共20个处理,随机排列,每个处理重复5次。选择出苗整齐一致的玉米每盆栽植1株,花盆上口直径30 cm、下盆口直径25 cm、高25 cm(每盆6 kg土),将各0、2%、4%、8%、12%浓度的生物质炭混合土壤中。单接种摩西斗管囊霉(Fm)、根内根孢囊霉(Ri)的剂量为每盆100 g的接种物(孢子密度为每50 g 340个,菌丝侵染率为76%),混合接种(Fm、Ri剂量各 50 g),对照(CK)则接种等量灭菌接种物,以保持相同的其他根围微生物区系环境。管理期间注意温度、光线、通气条件的控制,严禁积水,后期根据培养基质肥力水平和植株生长需要于中后期适当补充200 mL 30%的Hoagland营养液。
1.3 测定指标及方法
1.3.1 AMF侵染率的测定 玉米成熟期菌根侵染率、丛枝着生率、侵入位点数和泡嚢数的测定方法均依照刘润进等[21]描述的方法进行测定。采集玉米须根系,洗净,加入5%KOH溶液,80 ℃水浴5 min,清洗3次,加2%HCl浸泡5 min后,加入0.1%酸性品红-乳酸甘油染色液,室温下过夜,加乳酸脱色,制片镜检,计算菌根侵染率、丛枝着生率、侵入位点数和泡嚢数。
菌根侵染率=∑(0×根段数+10%×根段数+20%×根段数+…+100%×根段数)/总根段数
1.3.2 生长指标的测定 玉米吐丝期,采用日本产SPAD-502Plus叶绿素仪测定玉米穗位叶SPAD值,同时测量植株叶面积。玉米成熟期利用根系分析系统WinRmZO(广州航信科学仪器有限公司)进行玉米根系总长度的测定。通过电子天平测定成熟期每株玉米的产量。
1.3.3 叶片气体交换参数的测定 玉米成熟期叶片的气体交换参数采用便携式光合仪CIRAS-3 (PP Systems,USA) 进行测定。于9:00- 12:00进行测量,自玉米植株顶端向下约1/3位置处选取2~3片完全展开的健康成熟叶进行测量,便携式光合仪各参数设置为光照强度1 000 μmol·m-2·s-1,叶室温度25 ℃,湿度60%,CO2浓度400 μmol·mol-1,测量过程中依次记录玉米叶片的净光合速率(net photosynthesis rate,Pn)、蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs)、细胞间隙CO2浓度(intercellular CO2 concentration,Ci)等参数。
1.3.4 叶绿素荧光测定 玉米成熟期时,选择晴朗少云的天气(9:30-11:30),对玉米植株顶端向下约1/3位置处完全展开的健康成熟叶片进行暗处理30 min,用Pocket PEA(Hansatech Instruments Ltd,UK)测定叶片的叶绿素荧光参数,根据暗适应后测定的最小荧光值(Fo)、最大荧光值(Fm)、光合性能指数(Plabs)计算PSⅡ的最大光化学量子效率(Fv/Fm)。
1.4 数据处理
采用Microsoft Excel 2003软件对数据进行处理和绘图,采用DPS 7.5和SPSS 11.5统计分析软件对数据进行差异显著性检验(LSD法,α=0.05)。
2 结果与分析
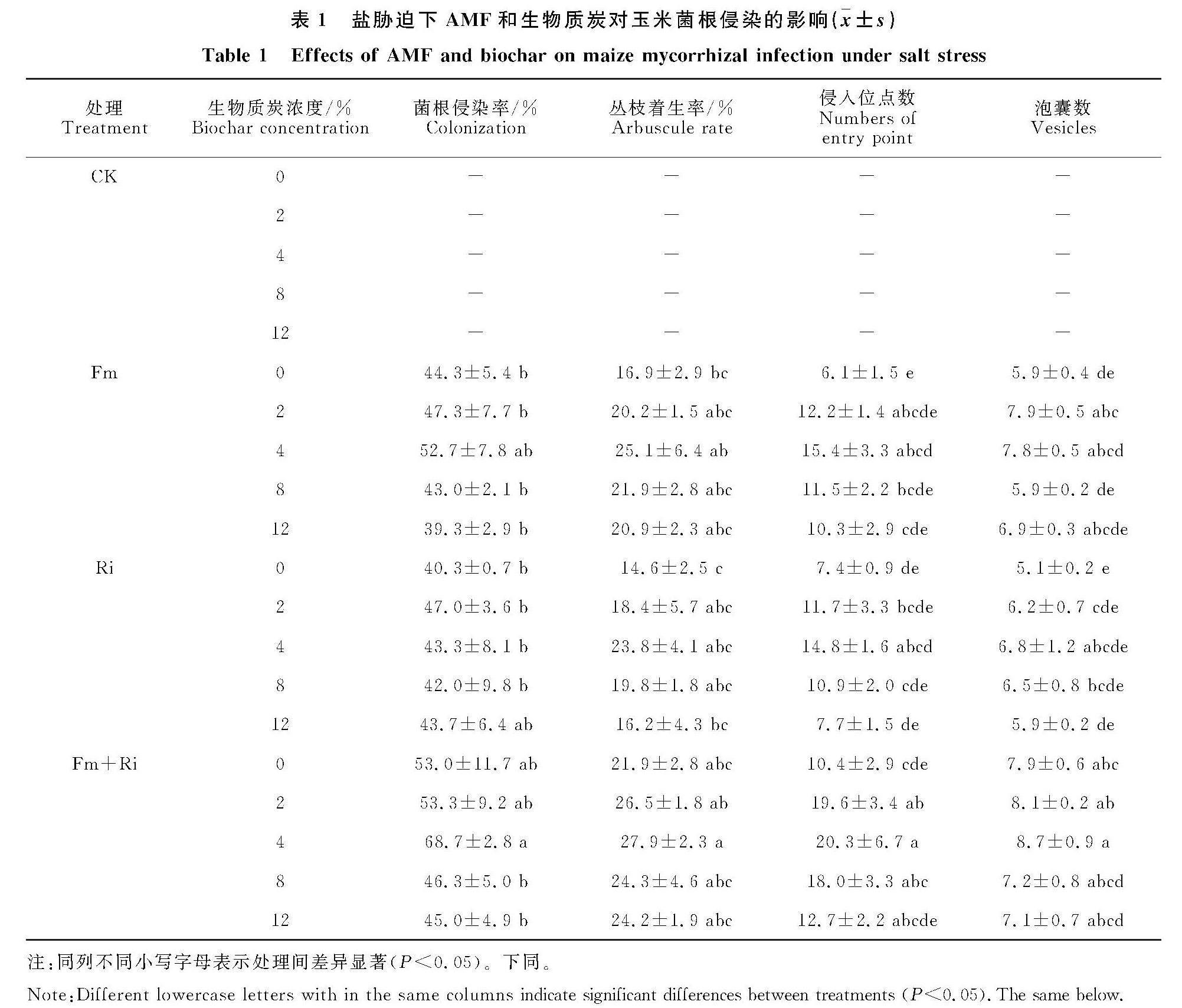
2.1 盐胁迫下AMF和生物质炭对玉米菌根侵染的影响
供试条件下AMF能够在玉米根系中侵染并发育,可建立一定的共生关系(图1)。随着生物质炭浓度的增加,AMF的侵染率在低浓度下无显著差异,高浓度下降低;菌丝密度、侵入位点数以及泡囊数则表现出先增加后下降的趋势。受AMF个体差异的影响,生物质炭添加4%浓度下,Fm+Ri双接种处理表现出最高的侵染率,为68.7%,丛枝着生率最大为27.9%,侵入点位数最多为每厘米20.3个,泡囊数最多为每厘米8.7个,且Fm的侵染效果高于Ri处理(表1)。
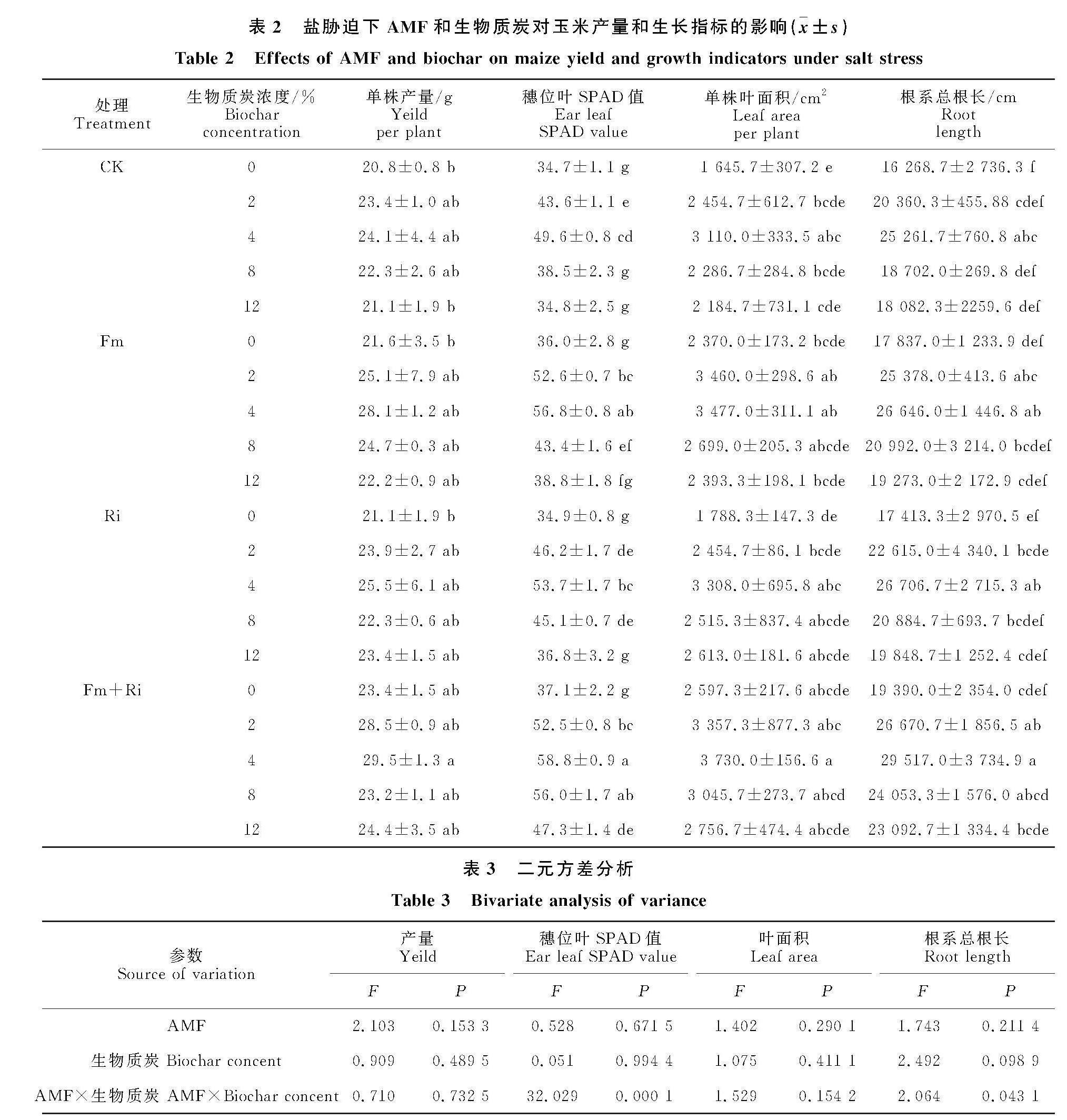
2.2 盐胁迫下AMF和生物质炭对玉米产量和生长指标的影响
同一生物质炭浓度下,接种AMF显著增加了玉米穗位叶SPAD值、叶面积以及根系总根长以及玉米产量。随生物质炭浓度的增加,玉米穗位叶SPAD值、叶面积以及根系总根长呈现先增加后下降的趋势,且在生物质炭添加4%浓度下达到最大值,玉米产量变化不明显。生物质炭添加4%浓度下,与对照相比,接种Fm处理的玉米产量提高16.6%,穗位叶SPAD值增加14.5%,叶面积提高11.8%,根系总根长增加5.5%;接种Ri处理的玉米产量提高5.8%,SPAD值、叶面积以及根系总根长分别提高8.3%、6.4%和5.7%;双接种Fm+Ri处理的玉米产量、SPAD值、叶面积以及根系总根长分别增加22.4%、18.5%、 19.9%和16.8%。综合来看,相较于单一接种Fm或者Ri处理,双接种Fm+Ri处理在4%生物质炭浓度下对玉米产量更高,生长效果最好(表2)。方差分析表明接种处理以及不同生物质炭浓度的交互作用对玉米产量、叶面积以及根系总根长无显著影响,对穗位叶SPAD值影响显著 (表3)。
2.3 盐胁迫下AMF和生物质炭对玉米叶绿素荧光参数的影响
同一生物质炭浓度下,接种AMF显著增加了玉米叶绿素荧光各参数。随生物质炭浓度的增加,玉米初始荧光(Fo)、最大荧光(Fm)、PSⅡ最大光化学量子产量(Fv/Fm)和光合性能指数(Plabs)呈现先增加后下降的趋势,且在生物质炭添加4%浓度下达到最大值,未接种(CK)处理玉米的Plabs在生物质炭各添加浓度下无显著变化。生物质炭添加4%浓度下,与对照相比,接种Fm处理的玉米Fo提高50.9%,Fm增加 32.0%,Plabs提高120.6%,Fm/Fv无显著差异;接种Ri处理的玉米Fm提高10.7%,Fo、Fm/Fv以及Plabs无显著变化;双接种Fm+Ri处理的玉米Fo、Fm、Fv/Fm以及Plabs分别增加69.6%、32.1%、15.1%和173.6%。综合来看,相较于单一接种Fm或者Ri处理,双接种 Fm+Ri处理的效果在4%生物质炭浓度下对叶绿素荧光各参数更优(图2)。方差分析表明接种处理以及不同生物质炭浓度的交互作用对玉米Fo、Fm、Fv/Fm和Plabs无显著影响(表4)。
2.4 盐胁迫下AMF和生物质炭对玉米气体交换参数的影响
同一生物质炭浓度下,接种AMF显著增加了玉米净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs),而降低胞间CO2浓度(Ci)。随生物质炭浓度的增加,玉米Pn、Tr和Gs呈现先增加后下降的趋势,且在生物质炭4%浓度下达到最大值,Ci则表现相反。生物质炭4%浓度下,与对照相比,接种Fm处理的玉米Pn提高24.5%,Tr提高69.1%,Gs提高16.6,Ci无显著差异;接种Ri处理的玉米Gs提高22.6%,Pn、Tr和Ci无显著差异;双接种Fm+Ri处理的Pn、Tr和Gs分别提高51.2%、75.5%和24.8%,Ci下降28.6%。综合来看,双接种Fm+Ri处理的效果在4%生物质炭浓度下对气体交换参数效果更优(图3)。方差分析表明接种处理以及不同生物质炭浓度的交互作用对玉米Pn无显著影响,对Ci、Tr和Gs影响显著(表5)。
3 讨 论
共生是生物适应环境的一种自然现象,从人和动物,到植物和微生物之间都存在一定共生联系[22]。植物与AMF形成共生体后,其生理生化代谢得到明显改善,提高了植物的抗盐性、抗病
性、抗虫性、耐重金属和有毒有机物的毒性、耐高温和低温等多种抗逆性[23-25]。有研究发现,盐胁迫下,AMF的菌丝网络能够帮助玉米提高叶片细胞质膜透性和根系活力,增加玉米的相对产量,提高耐盐能力[26]。而在土壤中添加生物质炭后会改变土壤团聚体、土壤有机碳和微生物群落的级分组成,从而影响土壤有机碳的周转,对植物生长造成影响[27]。朱成立等[28]研究发现生物质炭能缓解玉米受盐胁迫的程度,玉米各生长阶段光合参数与叶绿素含量以及株高和叶面积均有所增加。刘易等[15]也证实生物质炭输入可以显著提高盐胁迫下玉米种子的活力,提高幅度与生物质炭输入量呈正相关。从本试验结果来看,添加不同浓度的生物质炭后玉米叶绿素含量明显增加,光合参数显著增强,进而促进玉米根系长度、叶面积增加,玉米产量也进一步提高,这与上述研究结果一致,但本试验下添加4%生物质炭的玉米生长效果最好,这可能与生物质炭的原材料有关,具体还需进一步试验证实。本试验中接种不同AMF后,其促进效应也不同,双接种Fm+Ri处理的玉米其生长状况、产量以及光合参数显著高于单一Fm或者Ri处理,证实2种AMF能够协同促进玉米生长,与不同浓度生物质炭之间存在协同效应。这可能是在AMF与玉米的共生关系
中,AMF可以获得玉米光合固定碳的一部分,碳以己糖和脂肪酸的形式运输,为真菌的代谢活动提供能量,形成庞大的根外菌丝网络,菌丝网络极大地增加了二者对氮和磷的可用性,促进植物 生长。
在植物生长受到盐胁迫时,叶绿素的含量会明显下降,从而降低植物的光合作用,不利于植物的生长发育。研究发现,生物质炭对于受到胁迫的植物的叶绿素含量均有显著提高,但是在施加生物质炭时应注意根据植物以及胁迫条件的不同,对生物质炭的浓度加以控制[29]。大多数试验中均发现适宜浓度的生物质炭可以提高植物叶绿素含量。如李贞霞等[30]发现邻苯二甲酸二丁酯(DBP)污染下施入生物质炭能够显著增强黄瓜(Cucumis sativus)幼苗SOD活性,降低CAT活性和光合色素(叶绿素a、叶绿素b、叶绿素a+b和类胡萝卜素)含量。许泽宏等[31]则发现生物质炭显著增加了荠菜(Capsella bursa-pastoris)根区土壤微生物总数,土壤酶活性和微生物量均随生物质炭浓度的增加呈先增加后降低趋势,其中以中水平生物质炭(20 t/hm2)处理下效果最好,而高水平生物质炭(30 t/hm2)可能会有一定的抑制作用。本试验也证实了这一点,添加4%生物质炭的玉米SPAD值最高,不同浓度生物质炭协同AMF能够提高盐胁迫下玉米最小荧光值(Fo)、最大荧光值(Fm)、光合性能指数(Plabs)以及PSⅡ的最大光化学量子效率(Fv/Fm)。这可能是因为生物质炭能够提供碳源,促进AMF的菌丝发育,AMF通过调控叶绿素合成酶(CHLG)在内的几个关于叶绿素合成的蛋白表达显著上调,并且参与叶绿素降解的脱镁叶绿酸氧化酶(PAO)显著下调,从而使其叶绿素含量显著高于未接种对照,这在Wang等[32]的研究中得到证实。此外,AMF还能分泌细胞分裂素类似物,促进植物叶绿体发育,从而增加植物体内叶绿素含量[33]。
在盐胁迫下,植物的光合速率、蒸腾作用、气孔导度以及胞间CO2浓度等均会受到影响,接种AMF能够提高植物的光合作用,从而增强植物对逆境条件的抵抗能力[34]。Hajiboland等[35]研究了低和高NaCl浓度下接种AMF对马绊草Aeluropus littoralis的影响,证实植物茎和根的干物质含量分别增加了24%和86%,两种盐分水平的净CO2同化速率都显著增加。贾婷婷等[36]研究发现盐胁迫下的沙枣(Elaeagnus angustifolia)接种AMF后净光合速率、蒸腾速率、胞间二氧化碳浓度和气孔导度显著高于未接种对照,盐胁迫下产生的离子毒害会阻碍光系统Ⅰ(Photosystem Ⅰ,PSⅠ)或光系统Ⅱ(Photosystem Ⅱ,PSⅡ)光能向电能的转化效率,进而增加PSⅡ和PSⅠ间电子传递的不平衡性,相关蛋白会在盐胁迫下降解。本试验下玉米叶片中气孔导度的增加可能与接种AMF诱导的内源激素,包括植物细胞分裂素的变化有关,接种AMF和添加生物质炭能够缓解盐胁迫,保持较高的净光合速率、气孔导度和蒸腾速率;接种AMF后胞间CO2浓度减低,这可能与空气的CO2浓度浓度降低、叶肉导度减小和叶肉细胞的光合活性提高等因素有关,具体还需进一步试验证实。
4 结 论
综上而言,本试验下生物质炭可促进AMF菌丝侵染以及发育,二者具有协同作用,AMF通过增加玉米根系长度,提高SPAD值以及叶绿素荧光参数等条件,进一步提高光合作用,促进次生代谢物积累,促使玉米叶面积增加,提高玉米产量,以4%生物质炭浓度配合双接种Fm+Ri处理的效果最好,盆栽条件下证实了生物炭和AMF耦合系统增加作物产量的可行性。但是生物质炭浓度以及AMF的种类对作物生长的影响并不一致,生物质炭协同AMF促进作物增产的效果还需进一步大田试验验证。
参考文献 Reference:
[1] KITAMURAY,YANO T,YASUDA S.Irrigation-induced salinization of agricultural lands and its remedial measures in the Aral Sea Basin[J].Hitotsubashi Review,2000, 40(6):590-598.
[2]YOSHIYUKI,MAEDA.Plant salt tolerance and removal of salt in saline soil by plants[J].Bulletin of the Society of Sea Water Science,Japan,2012,66(2):92-98.
[3]BHANTANAP,LAZAROVITCH N.Evapotranspiration,crop coefficient and growth of two young pomegranate (Punica granatum L.) varieties under salt stress[J].Agricultural Water Management,2010,97(5):715-722.
[4]段倩倩,杨晓红,黄先智.植物与丛枝菌根真菌在共生早期的信号交流[J].微生物学报,2015,55(7):819-825.
DUAN Q Q,YANG X H,HUANG X ZH.Signal exchange between plants and arbuscular mycorrhizae fungi during the early stage of symbiosis-A review[J].Acta Microbiologica Sinica,2015,55(7):819-825.
[5]谢 伟,郝志鹏,张 莘,等.丛枝菌根网络介导的植物间信号交流研究进展及展望[J].植物生态学报,2022, 46(5):493-515.
XIE W,HAO ZH P,ZHANG SH,et al.Research progress and prospect of signal transfer among plants mediated by arbuscular mycorrhizal networks[J].Chinese Journal of Plant Ecology,2022,46(5):493-515.
[6]DELJOU M J N,MAROUF A,HAMEDAN H J.Effect of inoculation with arbuscular mycorrhizal fungi (AMF) on gerbera cut flower (Gerbera jamesonii) production in soilless cultivation[J].Acta Horticulturae,2014,1034(1034):417-422.
[7]MIRKOHI A K,ASADI M S,TAHERI M R,et al.The effects of arbuscular mycorrhizal fungi and different phosphorus levels on some growth aspects of Lisianthus[J].Journal of Science & Technology of Greenhouse Culture,2015,6(2):57-68.
[8]GHERBIH,MARKMANN K,SVISTOONOFF S,et al.SymRK defines a common genetic basis for plant root endosymbioses with arbuscular mycorrhiza fungi,rhizobia,and Frankiabacteria[J].Proceedings of the National Academy of Sciences,2008,105(12):4928-4932.
[9]赵 华,任晴雯,王熙予,等.丛枝菌根真菌对盐胁迫下番茄抗氧化酶活性和光合特性的影响[J].浙江农业学报,2021,33(11):2075-2084.
ZHAO H,REN Q W,WANG X Y,et al.Effects of arbuscular mycorrhizal fungi on antioxidant enzymes activities and photosynthetic characteristics of Solanum lycopersicum L.under salt stress[J].Acta Agriculturae Zhejiangensis,2021,33(11):2075-2084.
[10] 黄 志,许炜萍,郁昉斌,等.接种AMF对弱光环境及盐胁迫下甜瓜光合特性的影响[J].西北植物学报,2018, 38(2):307-315.
HUANG ZH,XU W P,YU F B,et al.Photosynthesis responses of cucumis melo seedlings to glomus under low light and salt stress[J].Acta Botanica Boreali-Occidentalia Sinica,2018,38(2):307-315.
[11]刘 会,朱占玲,彭 玲,等.生物质炭改善果园土壤理化性状并促进苹果植株氮素吸收[J].植物营养与肥料学报,2018,24(2):454-460.
LIU H,ZHU ZH L,PENG L,et al.Applying biochar to improve soil physical and chemical properties and nitrogen utilization by apple trees[J].Journal of Plant Nutrition and Fertilizers,2018,24(2):454-460.
[12]李 晓,张吉旺,李恋卿,等.施用生物质炭对黄淮海地区玉米生长和土壤性质的影响[J].土壤,2014,46(2):269-274.
LI X,ZHANG J W,LI L Q,et al.Effects of biochar amendment on maize growth and soil properties in huang-huai-hai plain[J].Soils,2014,46(2):269-274.
[13]刘杰云,沈健林,邱虎森,等.生物质炭添加对农田温室气体净排放的影响综述[J].农业环境科学学报,2015, 34(2):205-212.
LIU J Y,SHEN J L,QIU H S,et al.Effects of biochar amendments on net emissions of greenhouse gases from croplands:A Review[J].Journal of Agro-Environment Science,2015,34(2):205-212.
[14]刘 易,祁 通,孟阿静,等.生物质炭输入对盐胁迫下玉米幼苗生长和光合生理特征的影响[J].华北农学报,2017,32(4):182-188.
LIU Y,QI T,MENG A J,et al.Effect studying of biomass carbon input to growth and photosynthetic physiology feature of corn seedling cultivated on saliferous soil[J].Acta Agriculturae Boreali-Sinica,2017,32(4):182-188.
[15]刘 易,孟阿静,黄 建,等.生物质炭输入对盐胁迫下玉米植株生物学性状的影响[J].干旱地区农业研究,2018,36(2):16-22.
LIU Y,MENG A J,HUANG J,et al.Effect of biomass carbon input on corn biological index cultivated under saline stress[J].Agricultural Research in the Arid Areas,2018,36(2):16-22.
[16]MATSUBARA Y I,HASEGAWA N,FUKUI H.Incidence of Fusarium root rot in asparagus seedlings infected with arbuscular mycorrhizal fungus as affected by several soil amendments[J].Journal of the Japanese Society of Horticultural Science,2002,71(3):370-374.
[17]刘耀臣,王 萍,刘润进,等.丛枝菌根真菌和生物质炭对连作西瓜土壤肥力的影响[J].微生物学通报,2020, 47(11):3811-3821.
LIU Y CH,WANG P,LIU R J,et al.Effects of arbuscular mycorrhizal fungi and biochar on the fertility of continuous watermelon cropping soil[J].Microbiology China,2020,47(11):3811-3821.
[18]孙兴宇,王庆贵.砍伐干扰背景下的森林土壤球囊霉素动态研究进展[J].世界生态学,2021,10(3):435-444.
SUN X Y,WANG Q G.Dynamics of forest soil globulin under the background of deforestation disturbance:a review[J].International Journal of Ecology,2021,10(3):435-444.
[19]陈雪冬,刘雪龙,吴孔阳,等.丛枝菌根真菌和生物炭联合施用对土壤有机碳组分及团聚体的影响[J].江苏农业科学,2022,50(14):245-249.
CHEN X D,LIU X L,WU K Y,et al.Influences of combined application of AM fungi and biochar on soil organic carbon components and aggregates[J].Jiangsu Agricultural Sciences,2022,50(14):245-249.
[20]SAITO M,MARUMOTO T.Inoculation with arbuscular mycorrhizal fungi:the status quo in Japan and the future prospects[J].Plant and Soil,2002,244(1):273-279.
[21]刘润进,陈应龙.菌根学[M].北京:科学出版社,2007:1-447
LIU R J,CHEN Y L.Mycorrhizology[M].Beijing:Science Press,2007:1-447.
[22]王四宝,刘润进.互惠共生微生物:新资源,新技术,新机遇,新挑战[J].微生物学通报,2020,47(11):3777-3779.
WANG S B,LIU R J.Mutualistic symbioticmicrobes:new resources,new techniques,new opportunities and new challenges[J].Microbiology China,2020,47(11):3777-3779.
[23]URGILES N,STRAU A,LOJN P,et al.Cultured arbuscular mycorrhizal fungi and native soil inocula improve seedling development of two pioneer trees in the Andean region[J].New Forests,2014,45(6):859-874.
[24]YOOYONGWECH S,PHAUKINSANG N,CHA-UM S,et al.Arbuscular mycorrhiza improved growth performance in Macadamia tetraphylla L. grown under water deficit stress involves soluble sugar and proline accumulation[J].Plant Growth Regulation,2013,69(3):285-293.
[25]CANTON G C,BERTOLAZI A A,COGO A J D,et al.Biochemical and ecophysiological responses to manganese stress by ectomycorrhizal fungus Pisolithus tinctorius and in association with Eucalyptus grandis[J].Mycorrhiza,2016,26(5):475-487.
[26]冯 固,白灯莎,杨茂秋,等.盐胁迫下AM真菌对玉米生长及耐盐生理指标的影响[J].作物学报,2000,26(6):743-750.
FENG G,BAI D SH,YANG M Q,et al.Influence of inoculating arbuscular mycorrhizal fungi on growth and salinity tolerance parameters of maize plants[J].Acta Agronomica Sinica,2000,26(6):743-750.
[27]李东利,蒋 鹏,万佳淼,等.生物质炭对灰钙土土壤有机碳及土壤团聚体分布的影响[J].河南农业大学学报,2021,55(6):1128-1133.
LI D L,JIANG P,WANG J M,et al.Effects of biochar on soil organic carbon and soil aggregates distribution in sierozem[J].Journal of Henan Agricultural University,2021,55(6):1128-1133.
[28]朱成立,吕 雯,黄明逸,等.生物炭对咸淡轮灌下盐渍土盐分分布和玉米生长的影响[J].农业机械学报,2019, 50(1):226-234.
ZHU CH L,L W,HUANG M Y,et al.Effects of biochar on coastal reclaimed soil salinity distribution and maize growth with cycle fresh and saline water irrigation[J].Transactions of the Chinese Society for Agricultural Machinery,2019,50(1):226-234.
[29]韦继光,贾明云,蒋佳峰,等.不同生物质炭对蓝莓幼苗叶片光合性能和生长的影响[J].植物资源与环境学报,2023,32(1):69-76.
WEI J G,JIA M Y,JIANG J F,et al.Effects of different biochars on leaf photosynthetic characteristics and growth of blueberry(Vaccinium spp.)seedlings[J].Journal of Plant Resources and Environment,2023,32(1):69-76 .
[30]李贞霞,孙涌栋,郑万通,等.生物质炭对邻苯二甲酸二丁酯污染土壤黄瓜幼苗生理特性的影响[J].水土保持学报,2019,33(5):243-250 .
LI ZH X,SUN Y D,ZHENG W T,et al.Effects of biochar on physiological characteristics of cucumber seedlings in soils contaminated with dibutyl phthalate (DBP)[J].Journal of Soil and Water Conservation,2019,33(5):243-250.
[31]许泽宏,程晓丹,周明罗,等.生物质炭对荠菜生长过程中根区土壤特性和微生物特性的影响[J].江苏农业科学,2017,45(16):104-109.
XU Z H,CHENG X D,ZHOU M L,et al.Effects of biomass charcoal on root zone soil and microbial characteristics during the growth of shepherd's purse[J].Jiangsu Agricultural Sciences,2017,45(16):104-109.
[32]WANG Y N,LIN J X,HUANG S C,et al.Isobaric tags for relative and absolute quantification-based proteomic analysis of Puccinellia tenuiflora inoculated with arbuscular mycorrhizal fungi reveal stress response mechanisms in alkali-degraded soil[J].Land Degradation & Development,2019,30(13):1584-1598.
[33]THANAA E,NAWAR A.Salinity and mycorrhizal association in relation to carbohydrate status,leaf chlorophyll and activity of peroxidase and polyphenol oxidase enzymes in sour orange seedlings[J].Alexandria Journal of Agricultural Research,1994,39 (1):263-280.
[34]许炜萍,谢晓红,黄 志,等.AMF对弱光及盐胁迫下甜瓜生长和抗氧化酶活性的影响[J].西北植物学报,2017,37(9):1781-1788.
XU W P,XIE X H,HUANG ZH,et al.Physiological responses of melon(Cucumis melo L.)seedlings to glomus under low light and salt stress[J].Acta Botanica Boreali-Occidentalia Sinica,2017,37(9):1781-1788.
[35]HAJIBOLAND R,DASHTEBANI F,ALIASGHARZAD N.Physiological responses of halophytic C4,grass Aeluropus littoralis,to salinity and arbuscular mycorrhizal fungi colonization[J].Photosynthetica,2015,53(4):572-584.
[36]贾婷婷,常 伟,范晓旭,等.盐胁迫下AM真菌对沙枣苗木光合与叶绿素荧光特性的影响[J].生态学报,2018, 38(4):1337-1347.
JIA T T,CHANG W,FAN X X,et al.Effects of Arbuscular mycorrhizal fungi on photosynthetic and chlorophyll fluorescence characteristics in Elaeagnus angustifolia seedlings under salt stress[J].Acta Ecologica Sinica,2018,38(4):1337-1347.
Regulation of AMF and Biochar Coupling System on Maize Yield and Physiological Ecology under Salt Stress
CHANG Qing1,ZHOU Sheng2 and WU Zhongkai3
(1.Puyang Vocational and Technical College,Puyang Henan 457000,China; 2.College of Agronomy,Henan Agricultural
University,Zhengzhou 450003,China; 3.Institute of Plant Nutrition,Agricultural Resources and Environmental
Sciences,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
Abstract The object is to explore the regulatory effects of arbuscular mycorrhiza fungi (AMF) and different concentrations of biochar coupling systems under salt stress on maize grain yield, physiological ecology.Under the stress of moderate salt (20 mmol·L-1), maize was treated with different concentrations (0%, 2%, 4%, 8%, 12%) of biochar, and inoculated with AMF species Funneliformis mosseae (Fm), Rhizophagus intraradices (Ri), co-inoculated with both (Fm+Ri), and a control without inoculation (CK), totaling 20 treatments.The results showed that biochar significantly enhanced the development of AMF infection, increased the number of AMF vesicles and invasion points, and facilitated a beneficial symbiotic relationship with maize under the stress of moderate salt.AMF and biochar significantly increased the root length and leaf area of maize, enhanced chlorophyll content (SPAD value), and improved chlorophyll fluorescence parameters, thereby increasing the plant photosynthesis and yield.At a 4% biochar concentration, maize root length, SPAD value and leaf areae increased by 16.8%, 18.5% and 19.9%, respectively, compared to the control, resulting in a 22.4% increase in maize grain yield.The net photosynthetic rate (Pn), transpiration rate (Tr) and gas pore conductivity (Gs) increased by 51.2%, 75.5% and 24.8%,respectively, while intercellular CO2 concentration (Ci) declined by 28.6%, respectively; The minimum fluorescence value(Fo), maximum fluorescence value(Fm), photosynthetic performance index (Plabs) and maximum photochemical efficiency (Fv/Fm) increased by 69.6% , 32.1%, 173.6%, and 15.1%.respectively.In conclusion, the concentration of biochar and the type of AMF have inconsistent effects on crop growth.Under the experimental conditions, double inoculation with a Fm+Ri treatment and 4% biochar significantly increased the maize root length and leaf area,chlorophyll content,fluorescence parameters,and photosynthesis,leading to increased crop yield.However, the synergistic effect of biochar and AMF on promoting crop yield requires further validation through field experiments.
Key words Arbuscular mycorrhizal fungi;Biochar;Salt stress; Photosynthesis; Chlorophyll; Maize; Yield
Received 2023-04-27 Returned 2023-05-29
Foundation item The National Natural Science Foundation of China(No.31700270).
First author CHANG Qing,female,associate professor.Research area:biology.E-mail:pychang@126.com
(责任编辑:成 敏 Responsible editor:CHENG Min)

