扁荚山黧豆对NaCl胁迫的形态和生理响应
曹宁 吕国雯 张颖 马昊 王若琳 连荣芳 徐全乐

doi:10.7606/j.issn.1004-1389.2024.07.010
https://doi.org/10.7606/j.issn.1004-1389.2024.07.010
收稿日期:2023-04-25 修回日期:2023-06-13
基金项目:陕西省自然科学基金(2023-JC-YB-152);国家食用豆产业技术体系(CARS-08-Z21);细胞活动与逆境适应教育部重点实验室开放基金(lzujbky-2021-kb05)。
第一作者:曹 宁,男,助理研究员,研究方向为豆类新品种选育及示范推广。E-mail:cndx121@163.com
通信作者:连荣芳,女,研究员,研究方向为豆类新品种选育及示范推广。E-mail:gsdxlianrongfang@163.com
徐全乐,男,博士,副教授,研究方向为山黧豆种质资源创新与利用。E-mail:xuql03@163.com
摘 要 为了分析土壤盐渍化对扁荚山黧豆(Lathyrus cicera L.)生长发育的影响及其耐盐的生理机制,利用梯度浓度NaCl对扁荚山黧豆种子的萌发期及幼苗期进行了胁迫处理,统计幼苗形态对NaCl胁迫的响应,检测SOD等抗氧化酶活性及脯氨酸等渗透调节物质含量。结果表明:不同浓度的NaCl均可限制扁荚山黧豆的种子萌发率和幼苗生长,其耐受NaCl的浓度阈值介于100~150 mmol/L之间;APX、POD、PPO和SOD是扁荚山黧豆应对NaCl胁迫的主要抗氧化酶类,使活性氧的积累与清除处于稳态;在100 mmol/L NaCl处理条件下,地上部的脯氨酸可能向根部进行了转运;通过地上部与根部的协同作用,增加扁荚山黧豆的盐耐受性。POD、SOD等抗氧化酶活性和脯氨酸、MDA含量等7个生理指标之间呈显著相关性,共同响应NaCl胁迫并维持了扁荚山黧豆的正常生长。
关键词 扁荚山黧豆;抗氧化酶;NaCl胁迫;脯氨酸;形态生理响应
扁荚山黧豆(Lathyrus cicera L.)是世界上最古老的作物之一,在意大利阿布鲁佐、葡萄牙中部和南部地区、中国四川等地均有种植,并常用于传统菜肴、饲料和绿肥等[1-4]。由于具有较高的蛋白含量[5]、富含多酚等抗氧化剂,扁荚山黧豆也可用作功能性食品添加剂[6-8]。在高海拔地区、贫瘠土壤及降雨量250~300 mm的半干旱地区,扁荚山黧豆均表现出较好的环境适应性,生长良好,可生产8 t/hm2的干草和3.6 t/hm2 的干豆[1];在全球气候变化条件下对于粮食安全具有潜在的保障作用,也可用于中国饲用豆粕减量替代行动等。
然而,干旱半干旱地区长期的低降雨量和高蒸发量环境条件使NaCl、CaCl2、MgCl2、硫酸盐、碳酸盐等易溶性盐分在土壤表层积聚,造成土壤盐渍化[9-10]。其中,以NaCl的分布最为广泛、丰度最高[10]。当土壤中的NaCl含量超过40 mmol/L时,即可认定为盐渍化土壤并可造成作物产量降低。通常,不同作物间的盐胁迫耐受性差异明显。例如,水稻(Oryza sativa L.)呈现高度的盐敏感性而大麦(Hordeum vulgare L.)表现为较强的盐耐受性[10]。在豆科作物中,大豆(Glycine max (L.) Merr.)表现为盐敏感性,紫花苜蓿(Medicago sativa L.)表现为较强的盐耐受性[10-11]。对扁荚山黧豆而言,100 mmol/L NaCl胁迫可显著影响其生长状况,而接种丛枝菌根等促生菌可以上调高亲和性钾转运蛋白(the high-affinity potassium transporter 1, HKT1)基因和 Na+/H+交换体(the Na+/H+ exchanger 7, NHX7) 基因等,促使扁荚山黧豆应对离子胁迫并改善生长状况[12]。然而,扁荚山黧豆在不同梯度NaCl胁迫下的形态及渗透胁迫响应仍然需要进一步研究。
本研究分析了不同浓度NaCl胁迫对扁荚山黧豆种子萌发及幼苗形态的影响,揭示了NaCl胁迫下扁荚山黧豆的渗透胁迫响应机制,为扁荚山黧豆在干旱半干旱地区及轻度盐渍化土壤中的推广栽培提供理论依据。
1 材料与方法
1.1 试验材料及处理
本试验所用扁荚山黧豆(Lathyrus cicera L.)种子由西北农林科技大学生命科学学院山黧豆种质资源利用与创新实验室保存并提供。选取籽粒饱满、大小均匀的扁荚山黧豆种子充分吸胀,置于铺有双层滤纸的150 mm培养皿上,利用不同浓度NaCl(0、50、100、150、200、250 mmol/L)进行处理,隔2 d更换1次滤纸及溶液,于温度23 ℃/19 ℃,湿度70%,光照16 h/ d,光强150 μmol/(m2·s)条件下培养。每个处理设置3个重复,每个重复包含至少20粒种子。
1.2 形态指标统计
经不同浓度NaCl处理7 d和21 d后,分别统计不同处理条件下扁荚山黧豆的种子发芽率、地上部及地下部长度等形态指标。
1.3 生理生化指标检测
称取梯度浓度NaCl处理21 d的扁荚山黧豆根、茎、叶样品各0.5 g,经液氮研磨后加入5 mL预冷的pH 7.5磷酸钾缓冲液(50 mmol/L,含 1 mmol/L乙二胺四乙酸、2%聚乙烯吡咯烷酮、 1 mmol/L 抗坏血酸)混匀,4 ℃、12 000 r/min 离心30 min后取上清用于抗氧化酶活性测定。
参考曹建康等[13]方法检测抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性;利用氮蓝四唑法测定超氧化物歧化酶(superoxide dismutase,SOD)活性、愈创木酚法测定过氧化物酶(peroxidase,POD)活性、紫外吸收法测定过氧化氢酶(catalase,CAT)活性、邻苯二酚法测定多酚氧化酶(polyphenol oxidase,PPO)活性[13];利用茚三酮比色法测定脯氨酸(Proline,Pro)含量、硫代巴比妥酸法测定丙二醛(malondialdehyde,MDA)含量[13]。
1.4 数据分析
采用SPSS 26.0进行数据分析,Origin 2022软件作图。所有数据均表示为“平均值±标准差”,每组试验至少设计3个生物学重复。利用单因素方差分析(one-way analysis of variance,ANOVA)进行显著性分析。利用IBM SPSS Statistics 27计算各生理指标间的皮尔森相关 系数。
2 结果与分析
2.1 NaCl胁迫条件下扁荚山黧豆的形态响应
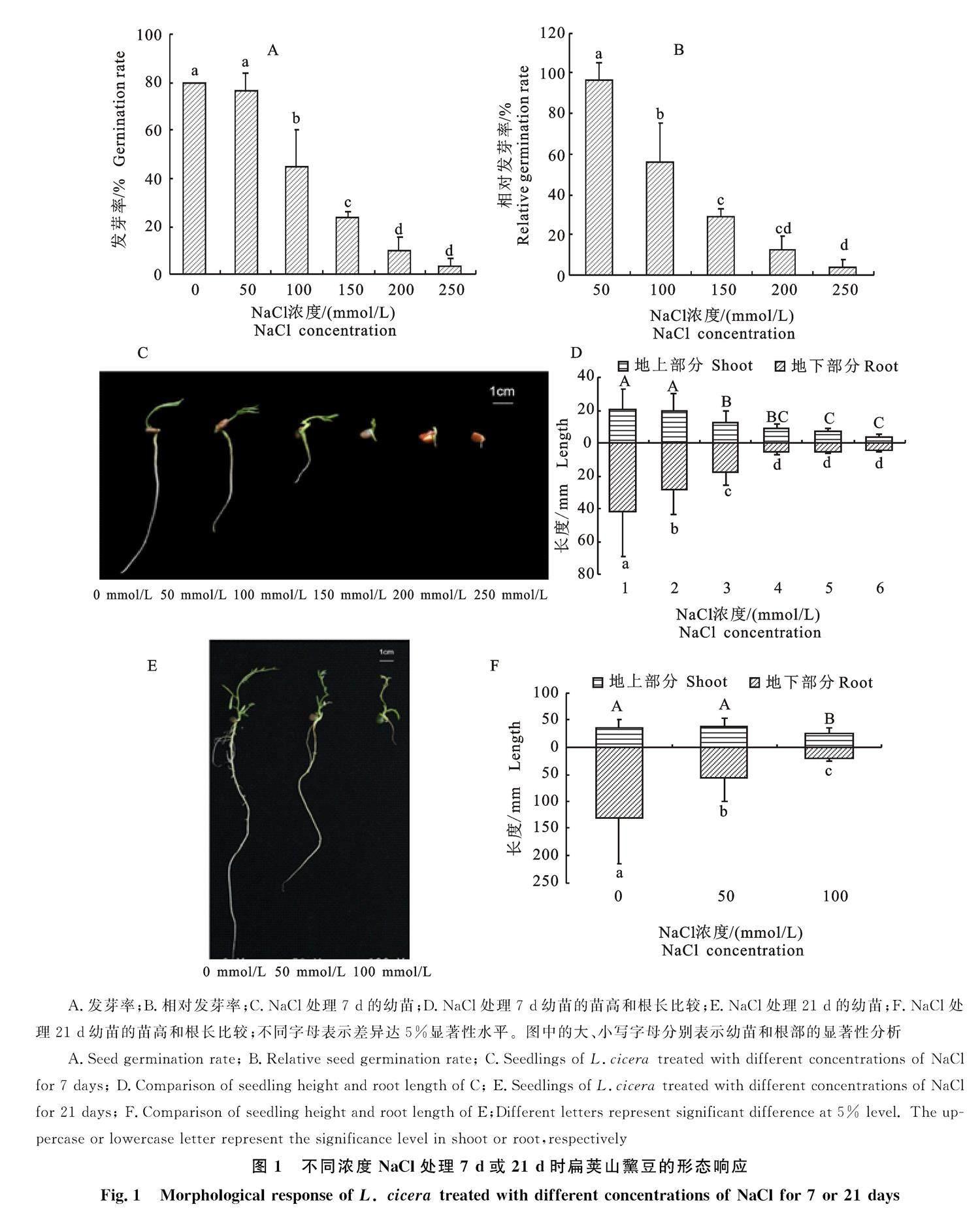
利用不同浓度的NaCl处理扁荚山黧豆种子发现,当NaCl处理浓度高于50 mmol/L时,种子萌发率和相对萌发率随NaCl浓度的升高呈显著降低趋势(图1-A,1-B)。
利用不同浓度NaCl处理7 d时,扁荚山黧豆的幼芽生长即受到明显限制(图1-C)。当NaCl浓度高于50 mmol/L时,幼苗的茎长显著降低,而根长在50 mmol/L NaCl处理时即显著降低(图1-C,1-D)。利用不同浓度NaCl处理21 d时,茎长和根长的变化趋势与处理7 d时相同(图1-E,1-F),这说明扁荚山黧豆根部对于盐胁迫的响应更为敏感。当NaCl浓度超过(含)150 mmol/L时,培养21 d的扁荚山黧豆种子坏死、停止发育(图1-E);而100 mmol/L NaCl浓度处理条件下的扁荚山黧豆叶片变的小而厚、侧芽数目减少,并未呈现成熟叶片的衰老与死亡等离子胁迫的典型表现,表现为典型的渗透胁迫响应。这说明扁荚山黧豆耐受NaCl的浓度阈值为 100~150 mmol/L。
2.2 NaCl胁迫条件下的抗氧化酶活性变化
分别取50 mmol/L和100 mmol/L NaCl处理21 d的扁荚山黧豆根、茎、叶为材料,检测抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)、过氧化物歧化酶(POD)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)等抗氧化酶的活性变化情况。结果表明,CAT活性在不同NaCl胁迫浓度、不同组织中的活性变化不显著,说明APX、POD、PPO和SOD可能是扁荚山黧豆应对NaCl胁迫的主要抗氧化酶类,使活性氧的积累与清除处于稳态(图2)。
在根中,APX、POD和PPO活性仅在100 mmol/L NaCl胁迫条件下发生改变,而SOD活性在50 mmol/L NaCl胁迫处理下即呈增加趋势。这说明根中的SOD对NaCl胁迫更为敏感,可能在扁荚山黧豆应对低浓度NaCl胁迫中起主要作用。在茎中,PPO活性对于50 mmol/L和100 mmol/L NaCl胁迫处理均有响应,SOD和APX仅在100 mmol/L NaCl胁迫处理时活性增加,POD活性变化不显著。在叶中,POD和PPO活性在50 mmol/L和100 mmol/L NaCl胁迫处理下均呈显著增加趋势,SOD仅在100 mmol/L NaCl胁迫处理时增加,APX活性变化不显著。这些结果与根中相应抗氧化酶的变化趋势差异明显,说明扁荚山黧豆的地上部(茎和叶)与地下部(根)对于NaCl胁迫的响应具有不同的生理机制。上述结果表明,扁荚山黧豆的根对于NaCl胁迫的感受更为敏感,其次为叶和茎。
2.3 NaCl胁迫条件下MDA和Pro的含量变化
MDA是植物在逆境条件下发生膜脂过氧化的产物之一,反应了细胞膜的受损情况。在50 mmol/L和100 mmol/L NaCl胁迫处理扁荚山黧豆21 d时,根中的MDA含量没有显著变化,但茎、叶中的MDA含量均呈现下降趋势(图3-A)。说明扁荚山黧豆可能通过抗氧化酶系统维持活性氧水平,从而缓解盐胁迫对质膜的过氧化伤害,改善MDA含量,降低盐胁迫造成的负面生理效应。
利用50 mmol/L和100 mmol/L NaCl胁迫处理扁荚山黧豆21 d时,根中的Pro含量均显著增加;但茎和叶中的Pro含量显著降低(图3-B)。尤其是在100 mmol/L NaCl胁迫处理时,根中的Pro含量增加了85.29%,茎和叶中的Pro含量分别下降了81.56%和76.74%。这可能是茎和叶中的Pro向根部进行了转运,以增加根部的Pro含量并应对NaCl胁迫;说明扁荚山黧豆较强的抗逆性来自地上部(茎和叶)与地下部(根)的协同作用。
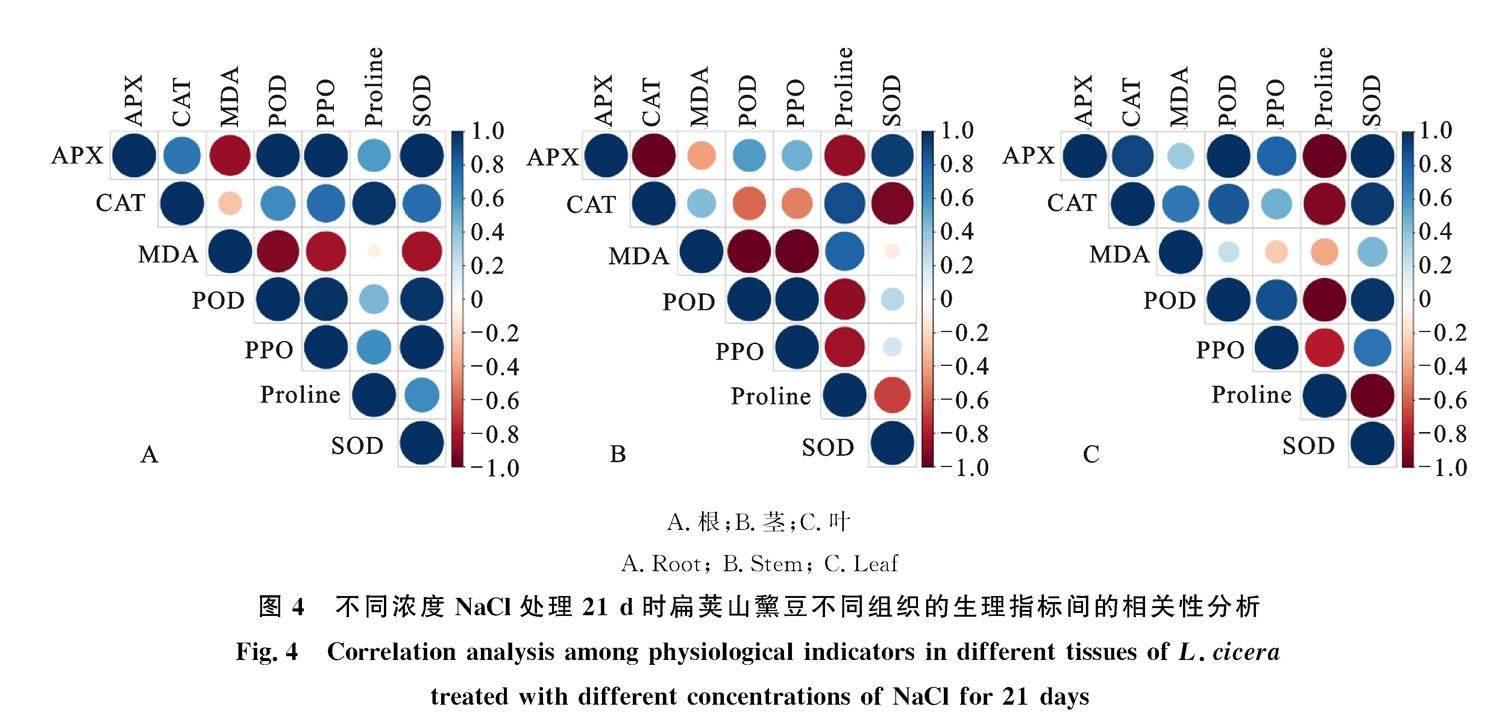
2.4 NaCl胁迫条件下扁荚山黧豆各项生理指标的相关性分析
对上述检测的7项耐盐性指标进行皮尔森相关性分析(图4)表明,根部的POD活性和APX、PPO、SOD活性具有强正相关性(r=1),和Pro含量呈中等程度正相关(r=0.61),和MDA含量呈强负相关(r=-0.98);茎部的POD活性和APX、PPO、SOD活性具有正相关性(POD-APX:r=0.82;POD-PPO:r=1;POD-SOD:r= 0.65),和Pro含量、MDA含量呈强负相关(POD-Pro:r=-0.96;POD-MDA:r=-0.99);叶部的POD活性和APX、PPO、SOD活性具有强正相关性(POD-APX:r=1;POD-PPO:r=0.94;POD-SOD:r=0.99),和Pro含量呈强负相关(r= -0.99),和MDA含量呈弱相关(r=0.38)。
3 讨 论
扁荚山黧豆具有较强的耐贫瘠性、耐旱性,良好的环境适应性和优良的农艺性状,在中国干旱半干旱地区、中低产田区和新开生地等具有潜在的推广应用价值。然而,干旱半干旱地区长期的低降雨量和高蒸发量环境造成的土壤盐渍化[9-10]影响扁荚山黧豆的生长。本研究利用梯度浓度NaCl在扁荚山黧豆种子的萌发期及幼苗期进行了胁迫处理,以分析土壤盐渍化对扁荚山黧豆生长发育的影响及其耐盐的生理机制。
形态学分析表明,NaCl浓度的增加会显著降低扁荚山黧豆的种子萌发率并抑制植株生长;根系对NaCl浓度的响应尤为敏感。这说明在盐胁迫条件下,扁荚山黧豆根系率先感知NaCl胁迫信息,并将胁迫信号传递到地上部分。研究表明,许多双子叶盐生植物在100~200 mmol/L NaCl条件下生长良好[14]。扁荚山黧豆耐受NaCl的浓度阈值为100~150 mmol/L,在50~100 mmol/L NaCl浓度生长良好。这说明扁荚山黧豆虽然不属于盐生植物,但在弱盐渍土和中盐渍土中可正常生长。
通常,植物对短期盐胁迫的形态及生理响应响应主要由渗透胁迫造成,对长期胁迫的响应主要由离子毒害作用造成[15-17]。本研究经100 mmol/L NaCl处理21 d的扁荚山黧豆并未呈现成熟叶片的衰老与死亡等离子胁迫的性状,属于典型的渗透胁迫响应。
在盐胁迫条件下,植物会提高抗氧化酶活性等以应对活性氧的过量积累。其中,SOD是植物抗氧化系统的第一道防线,可将细胞中多余的超氧根阴离子转化为过氧化氢(H2O2);POD等则在清除 H2O2过程中发挥重要作用[18]。在扁荚山黧豆应对NaCl胁迫时,APX、POD、PPO和SOD等是发挥作用的主要抗氧化酶类,使活性氧的积累与清除处于稳态。通常,抗氧化酶的活性越高,其渗透调节能力越强,植物对盐胁迫的耐受性越强[17]。抗氧化酶活性水平也决定了膜脂的过氧化反应水平。当基于SOD、POD等的抗氧化机制不能维持活性氧平衡时,过量的活性氧会导致膜脂发生过氧化反应并产生MDA。因此,MDA含量往往用以衡量细胞膜的损伤程度。本研究中,MDA含量并未呈增加趋势,说明在100 mmol/L NaCl胁迫时,扁荚山黧豆的抗氧化酶系统充分发挥了防御作用,缓解了盐胁迫对质膜的过氧化伤害,进而维持了植株的正常生长。
可溶性糖、脯氨酸和甜菜碱等胞内渗透物质的含量变化是植物应对渗透胁迫的重要机制。其中,脯氨酸因其在植物体内的广泛分布,是主要的有机渗透调节物质。大量研究表明,盐胁迫会引起脯氨酸合成水平的提高和含量的上调[19-21]。然而,低水势条件下玉米根系伸长区Pro的积累主要来源于转运[22],盐胁迫时脯氨酸转运蛋白基因表达上调[23]。这说明Pro的吸收和转运也是调控胁迫诱导条件下Pro含量的重要手段。本研究中,扁荚山黧豆在经100 mmol/L NaCl处理21 d后,根际Pro含量增加的同时茎和叶中的Pro含量分别下降。这可能是茎和叶中的Pro向根部进行了转运,以增加根部的Pro含量并应对NaCl胁迫。这说明Pro从地上部(茎和叶)向地下部的转运、地上部与地下部的协同作用共同造就了扁荚山黧豆较强的抗逆性。
植物的耐盐性受到多种生理因素的统一调控,因此,生理指标之间的显著相关性可以较为全面地反映作物萌发期和苗期的耐盐性[24]。例如,在玉米、油莎豆等作物中采取了多种指标来综评价其耐盐性[25-26]。本研究在用100 mmol/L NaCl处理扁荚山黧豆种子及幼苗21d后,检测的POD、SOD等抗氧化酶活性和Pro、MDA含量等七个生理指标之间呈显著相关性,共同响应于NaCl胁迫处理并维持了扁荚山黧豆的正常生长。
综上所述,本研究利用不同梯度浓度NaCl对扁荚山黧豆种子及幼苗期进行了胁迫处理,统计分析了幼苗形态对NaCl胁迫的响应,检测了SOD等抗氧化酶活性及Pro等渗透调节物质含量。结果表明,扁荚山黧豆在种子萌发期和幼苗期耐受NaCl胁迫的阈值为100~150 mmol/L;在100 mmol/L NaCl胁迫条件下,SOD、POD等抗氧化酶发挥活性氧自由基清除功能、Pro等渗透物质通过地上部和地下部的转运与平衡发挥协同作用,维持扁荚山黧豆的正常生长状态。上述结果为扁荚山黧豆在中国干旱半干旱地区、中低产田区和新开生地的进一步推广利用奠定了一定的基础。
参考文献 Reference:
[1] HAMMER K,LAGHETTI G,DIRENZO P,et al.Resources and opportunities for re-establishing Lathyrus cicera L. as a multipurpose cultivated plant[J].Genet Resources and Crop Evolution,2019,66:523-544.
[2]徐全乐,蒋景龙,焦成瑾,等.山黧豆160年研究历程及进展[J].西北植物学报,2021,41(9):1583-1604.
XU Q L,JIANG J L,JIAO C J,et al.Process and progress of researches on Lathyrus sativus L. over the Past 160 Years[J].Acta Botanica Boreali-Occidentalia Sinica,2021,41(9):1583-1604.
[3]周泽弘,梁 琴,全紫曼,等.翻压山黧豆绿肥与氮肥减施对水稻生长及其养分吸收与产量的影响[J].西北植物学报,2021,41(11):1962-1970.
ZHOU Z H,LIANG Q,QUAN Z M,et al.Effects of turning green manure Lathyrus sativus and reducing nitrogen application on growth,nutrient absorption and yield of rice[J].Acta Botanica Boreali-Occidentalia Sinica,2021,41(11):1962-1970.
[4]ZHANG Q,PENG Y,WANG J,et al.Improving ecological functions and ornamental values of traditional pear orchard by co-planting of green manures of Astragalus sinicus L. and Lathyrus cicera L.[J].Sustainability,2021,13:13092.
[5]HANBURY C D,WHITE C L,MULLAN B P,et al.A review of the potential of Lathyrus sativus L. and L. cicera L. grain for use as animal feed[J].Animal Feed Science and Technology,2000,87:1-27.
[6]AMAROWICZ R,PEGG R B.Legumes as a source of natural antioxidants[J].European Journal of Lipid Science and Technology,2008,110:865-878.
[7]FERRERES F,MAGALHAES S C Q,GIL-IZQUIERDO A,et al.HPLC-DAD-ESI/MSn profifiling of phenolic compounds from Lathyrus cicera L. seeds[J]. Food Chemistry,2017,214:678-685.
[8]LLORENT-MARTNEZ E J,ORTEGA-BARRALES P,ZENGIN G,et al.Evaluation of antioxidant potential,enzyme inhibition activity and phenolic profifile of Lathyrus cicera and Lathyrus digitatus:potential sources of bioactive compounds for the food industry[J].Food and Chemical Toxicology,2017,107:609-619.
[9]RENGASAMY P.Transient salinity and subsoil constraints to dryland farming in Australian sodic soils:an overview[J].Australian Journal of Experimental Agriculture,2002,42:351-361.
[10] MUNNS R,TESTER M.Mechanisms of Salinity Tolerance[J].Annual Review of Plant Biology,2008,59:651-681.
[11]LAUCHLI A.Salt exclusion:an adaptation of legumes for crops and pastures under saline conditions//STAPLES R C,TOENIESSEN G H.Salinity Tolerance in Plants Strategies for Crop Improvement[M].New York:John Wiley & Sons,1984:171-187.
[12]GRITLI T,BOUBAKRI H,ESSAHIBI A,et al.Salt stress mitigation in Lathyrus cicera by combining diferent microbial inocula[J].Physiology and Molecular Biology of Plants,2022,28(6):1191-1206.
[13]曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:102-151.
CAO J K,JIANG W B,ZHAO Y M.Postharvest Physiological and Biochemical Experimental Guidance of Fruits and Vegetables[M].Beijing:China Light Industry Press,2007:102-151.
[14]FLOWERS T J,TROKE P F,YEO A R.The mechanism of salt tolerance in halophytes[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1977,28:89-121.
[15]MUNNS R.Comparative physiology of salt and water stress[J].Plant Cell & Environment,2002,25(2):239-250.
[16]WANG L X,FANG C,WANG K.Physiological responses of Leymus chinensis to long-term salt,alkali and mixed-alkali stresses[J].Journal of Plant Nutrition,2015,38(4):526-540.
[17]王佺珍,刘 倩,高娅妮,等.植物对盐碱胁迫的响应机制研究进展[J].生态学报,2017,37(16):5565-5577.
WANG Q ZH,LIU Q,GAO Y N,et al.Review on the mechanisms of the response to salinity-alkalinity stress in plants[J].Acta Ecologica Sinica,2017,37(16):5565-5577.
[18]KISHOR P B K,ZHONG Z,MIAO G H,et al.Overexpression of [delta]-pyrroline-5-carboxylate synthetase increases proline production and confers osmotolerance in transgenic plants[J].Plant Physiology,1995,108(4):1387-1394.
[19]杨月娟,张 灏,周华坤,等. 盐胁迫对高寒草地牧草老芒麦幼苗生理指标的影响[J].西北农业学报,2015,24(7):156-162.
YANG Y J,ZHANG H,ZHOU H K,et al.Effect of salt stress on physiological characteristics of alpine grassland pasture Elymus sibiricus[J].Acta Agriculture Boreali-occidentalis Sinica,2015,24(7):156-162.
[20]李旭芬,石 玉,李 斌,等.CO2加富对盐胁迫下番茄幼苗生长和渗透调节特性的影响[J].西北农业学报,2019,28(8):1309-1316.
LI X F,SHI Y,LI B,et al.Effectors of CO2 enrichment on seedlings growth and osmotic regulation characteristics of tomato under salt stress[J].Acta Agriculture Boreali-occidentalis Sinica,2019,28(8):1309-1316.
[21]王华笑,刘 环,杨国平,等.Bacillus amyloliquefaciens YM6对盐胁迫条件下玉米幼苗生理及生化的影响[J].西北农业学报,2020,30(3):436-443.
WANG H X,LIU H,YANG G P,et al.Effects of Bacillus amyloliquefaciens YM6 on physiological and biochemical characteristics of maize under salt stress[J].Acta Agriculture Boreali-occidentalis Sinica,2020,30(3):436-443.
[22]VERSLUES P E,SHARP R E.Proline accumulation in maize (Zea mays L.) primary roots at low water potentials. II. Metabolic source of increased proline deposition in the elongation zone[J].Plant Physiology,1999,119:1349-1360.
[23]WADITEE R,HIBINO T,TANAKA Y,et al.Functional characterization of betaine/proline transporters in betaine-accumulating mangrove[J].Journal of Biological Chemistry,2002,277:18373-18382.
[24]张智猛,慈敦伟,丁 红,等. 花生品种耐盐性指标筛选与综合评价[J].应用生态学报,2013,24(12):3487-3494.
ZHANG ZH M,CI D W,DING H,et al.Indices selection and comprehensive evaluation of salinity tolerance for peanut varieties[J].Chinese Journal of Applied Ecology,2013,24(12):3487-3494.
[25]刘丽丽,乔梓启,杜 明,等.一种基于综合指标的耐盐方程式准确预测玉米耐盐性[J].植物生理学报,2022,58(2):458-468.
LIU L L,QIAO Z Q,DU M,et al.A salt tolerance equation based on comprehensive indexes accurately predicts salt tolerance of maize inbred lines[J].Plant Physiology Journal,2022,58(2):458-468.
[26]于馥榕,李毅丹,程云清,等. 油莎豆种质资源苗期耐盐性鉴定与评价[J].干旱地区农业研究,2023,41(2):1-10,85.
YU F R,LI Y D,CHENG Y Q,et al.Identification and evaluation of salt tolerance of Tigernut germplasm resources at seedling stage[J].Agricultural Research in the Arid Areas,2023,41(2):1-10,85.
Morphological and Physiological Response of
Lathyrus cicera L. under NaCl Treatment
CAO Ning1,L Guowen2,ZHANG Ying2,MA Hao2,
WANG Ruolin2,LIAN Rongfang1 and XU Quanle2,3
(1.Dingxi Academy of Agricultural Sciences,Dingxi Gansu 743000,China; 2.College of Life Sciences,
Northwest A&F University,Yangling Shaanxi 712100,China; 3.Key Laboratory for Functional
Genomics and Molecular Diagnostic of Gansu Province,Lanzhou 730000,China)
Abstract To explore the effects of soil salinization on the growth of Lathyrus cicera L. and its physiological mechanism to salt tolerance,seeds of L.cicera were treated with different concentrations of NaCl for 21 days. And then,seedling morphological changes were measured and the enzymatic antioxidant activities including SOD activities,and the content of csmoregulation substance including proline content in different tissues were detected. The results suggested that NaCl limits the seed germination rate and seedling growth of L.cicera,the NaCl tolerance threshold is between 100-150 mmol/L; the antioxidant enzymes of APX,POD,PPO and SOD play vital role under NaCl stress to maintain the level of reactive oxygen species; under the condition of 100 mmol/L NaCl treatment,the proline in the aboveground may transport to roots to increase the salt tolerance of L.cicera; the activities of antioxidant enzymes such as POD and SOD,as well as the content of proline (Pro) and malondialdehyde (MDA),have significant correlations among the seven physiological indicators,collectively responding to NaCl stress and maintaining the normal growth of Psophocarpus tetragonolobus.
Key words Lathyrus cicera;Antioxidant enzymes;NaCl stress;Proline;Morphological and physiological response
Received 2023-04-25 Returned 2023-06-13
Foundation item The Natural Science Foundation of Shaanxi Province (No.2023-JC-YB-152);China Agriculture Research System (Food legume) (No.CARS-08-Z21);the Fundamental Research Fund for the Central Universities (No.lzujbky-2021-kb05).
First author CAO Ning,male,assistant research fellow.Research area:breeding and spreading of food legume.E-mail:cndx121@163.com
Corresponding author LIAN Rongfang,female,research fellow.Research area: breeding and spreading of food legume.E-mail:gsdxlianrongfang@163.com
XU Quanle,male,Ph.D,associate professor.Research area:innovation and utilization of grass pea germplasm.E-mail:xuql03@163.com
(责任编辑:成 敏 Responsible editor:CHENG Min)

