茄子转录因子 SmeWRKY53对盐胁迫的响应
周亚茹 肖凯 张爱冬 吴雪霞

doi:10.7606/j.issn.1004-1389.2024.07.011
https://doi.org/10.7606/j.issn.1004-1389.2024.07.011
收稿日期:2023-06-16 修回日期:2023-08-04
基金项目:国家大宗蔬菜产业技术体系项目(CARS-25)。
第一作者:周亚茹,女,硕士研究生,研究方向为分子遗传育种。E-mail:yaruzhou153@163.com
通信作者:吴雪霞,女,博士,研究员,研究方向为分子遗传育种。E-mail:wuxuexiarose@sohu.com
摘 要 WRKY转录因子在各种生理过程和逆境反应中发挥重要作用,为了探究茄子转录因子 SmeWRKY53抗逆性,对 SmeWRKY53的启动子元件进行预测分析,运用实时荧光定量PCR(RT-qPCR)检测 SmeWRKY53在不同非生物胁迫中表达量的变化,通过遗传转化在茄子中过表达 SmeWRKY53,并对过表达茄子苗期耐盐性进行鉴定。启动子元件预测分析结果显示,该基因启动子序列不仅有启动子基本转录元件,还含有TC-rich repeats、CGTCA-motif、TGACG-motif等与胁迫相关的抗逆元件。实时荧光定量(qRT-PCR)结果显示 SmeWRKY53能够响应高温、低温、干旱以及盐胁迫处理,且在盐胁迫条件下可以被显著诱导。在茄子中过表达 SmeWRKY53可以提高植株的耐盐能力。生理指标检测表明,盐胁迫条件下,过表达植株体内丙二醛(MDA)含量积累显著低于对照。同时过表达植株细胞内脯氨酸、可溶性蛋白的含量和抗氧化酶[过氧化氢酶(CAT)和过氧化物酶活(POD)]的活性显著高于对照植株。对盐胁迫相关基因( SmeSOS1、 SmeCIPK3 和 SmeNHX1)的表达检测发现,盐胁迫处理显著诱导了相关基因( SmeSOS1、 SmeCIPK3 和 SmeNHX1)的表达,且过表达植株中的表达显著高于对照。这些结果表明茄子 SmeWRKY53能正调控提高茄子对盐胁迫的耐受性,对后续研究 SmeWRKY53基因在茄子耐盐胁迫中的分子机制提供了理论依据。
关键词 茄子;转录因子; SmeWRKY53;非生物胁迫;耐盐性
茄子为茄科茄属一年生植物,起源于亚洲东南热带地区[1],是世界范围内广泛种植的重要的经济蔬菜[2]。在低温、高温、干旱和盐胁迫等逆境条件下,茄子的生长和产量会受到严重的损害。茄子作为喜温型蔬菜,35 ℃以上高温时茄子生长发育的各个阶段都会受到高温胁迫影响[3]。低温胁迫下茄子产量和品质会受到严重的影响[4]。干旱也是影响茄子发育的一个重要原因,在干旱条件下茄子植株发育不良,易形成短柱花使果实发育受阻,果形小而且没有光泽[5]。
盐胁迫是世界范围内最有害的非生物胁迫之一,通过影响细胞生长和代谢过程来损害植物的生产力,对种子萌发、幼苗生长和作物产量造成不可逆的损害[6],严重限制了植物生长。设施栽培条件下的连作以及化肥肥料的过度使用使得土壤盐渍化情况越来越严重,对农作物的产量和品质造成重大损失[7]。挖掘耐盐基因是提高植株耐盐性,选育耐盐品种的有效手段。
在大多数真核植物中,转录因子家族(WRKY、MADS-box和MYB)激活独特的细胞水平的非生物和生物胁迫响应策略,被认为是防御和发育过程的关键决定因素[8]。据报道,一些转录因子在植物对盐胁迫的响应中发挥核心作用。在马铃薯中发现过表达NAC转录因子 StNAC053提高拟南芥耐盐耐旱性[9]。秋葵中在盐胁迫下转录因子 AeNAC83基因显著上调,在拟南芥中过表达 AeNAC83基因发现,过表达的拟南芥植株耐盐性有很大的提高[10]。番茄中转录因子 SlWRKY3的表达受外界盐胁迫诱导,且过表达番茄转基因株系具有更高的耐盐性[11]。荞麦中的 FtMYB9在拟南芥中异源过表达会大大增强拟南芥耐盐性[12]。另外已有研究发现转录因子 SmERF1在茄子盐胁迫中起正向调节作用,通过对 SmERF1的沉默显著增强了植物对盐胁迫的敏感性并下调了盐胁迫防御相关标记基因[13]。
在本研究中,盐胁迫处理可以显著诱导转录因子 SmeWRK53的表达。通过基因过表达对 SmeWRKY53的功能进行验证,通过表型观测、生理指标和相关基因表达检测结果表明过表达 SmeWRKY53增强了植株的耐盐能力,该基因可以正向调控茄子耐盐性。
1 材料与方法
1.1 植物材料
供试茄子品种‘卜丽卡由上海市农科院设施园艺所提供。
1.2 试验方法
1.2.1 SmeWRKY53基因启动子序列的获得以及顺式作用元件分析 利用茄子基因数据库网站(http://eggplant.kazusa.or.jp/)下载茄子基因组,提取 SmeWRKY53基因5端上游2 000 bp序列作为启动子序列,然后在PlantCARE数据库中(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行顺式作用元件预测分析。
1.2.2 茄子幼苗非生物胁迫处理 挑选饱满均匀的‘卜丽卡茄子种子播入发芽盒中,28 ℃暗处理催芽,待露白后转入培养箱,培养条件为温度26 ℃,光照度4 000 lx,光照时间12 h,相对湿度为65%。待长出真叶后移栽至转入营养钵中,培养条件同上。植株长至4~5片真叶时进行低温、高温、干旱胁迫和盐胁迫处理。
低温胁迫处理时,培养条件为温度4 ℃,光照度4 000 lx,光照时间12 h,相对湿度为65%;高温胁迫处理时,培养条件为温度45 ℃,光照度 4 000 lx,光照时间12 h,相对湿度为65%;干旱胁迫处理时,用含15%的PEG6000的营养液浇灌幼苗,培养条件为温度26 ℃,光照度4 000 lx,光照时间12 h,相对湿度为65%;盐胁迫处理时,营养液中NaCl的浓度为150 mmol/L,培养条件为温度26 ℃,光照度4 000 lx,光照时间12 h,相对湿度为65%。
不同胁迫处理均于处理后0 h、0.5 h、1 h、 2 h、3 h、6 h、12 h和24 h取苗子叶片进行检测。
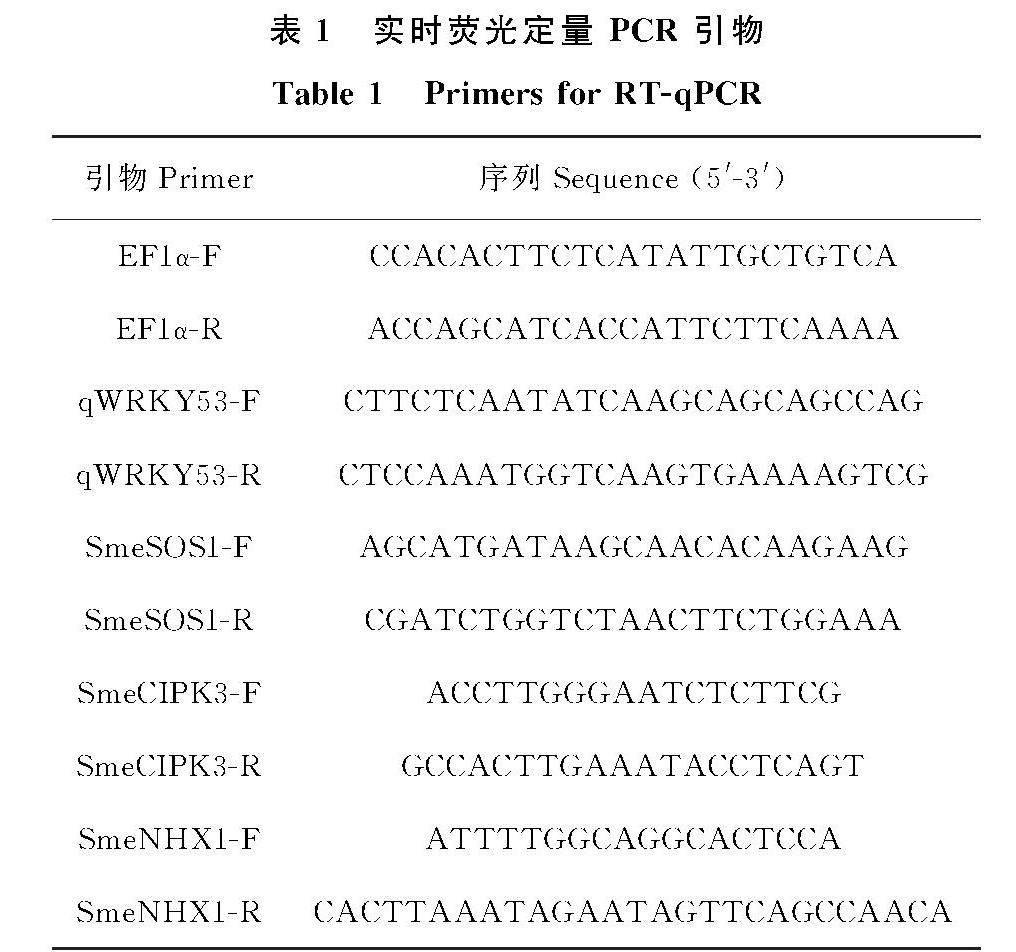
1.2.3 实时荧光定量PCR(RT-qPCR) 样品总RNA的提取以及cDNA第一条链的合成植物RNA提取试剂盒和cDNA反转录试剂盒(均购于艾克瑞生物工程有限公司),操作按说明书进行。以cDNA为模板, EF1α作为内参,使用2×Taq SYBR Green qPCR Premix(购自诺唯赞生物科技股份有限公司)检测 SmeWRKY53在茄子叶片中的表达量。在 qPCR 仪(BIO-RAD CFX96)设置反应程序 :95 ℃ 30 s ;95 ℃ 10 s,60 ℃ 30 s,40 个循环;95 ℃ 15 s ;60 ℃ 60 s ; 95 ℃ 15 s。各样品 3 次重复,2-△△Ct采用文献[14]公式计算基因相对表达水平。所用引物如表1 所示。
1.2.4 转基因茄子(SmeWRKY53-OE)的获得 以茄子叶片cDNA为模板,PCR扩增 SmeWRKY53 CDS序列,将扩增产物连接至pCambia2301,并转化到大肠杆菌DH5α感受态细胞。重组质粒验证后转化根癌农杆菌GV3101感受态细胞。通过农杆菌侵染下胚轴,获得 SmeWRKY53过表达T0代植株。
1.2.5 过表达茄子盐胁迫处理以及生理指标检测 将转基因(T1)和野生型茄子种子平铺于发芽盒,操作同“1.2.2”。待苗子长至4~5片真叶分别挑选生长状态一致的转基因及野生型植株,提取其RNA并反转录为第一链cDNA进行实时荧光定量PCR验证 SmeWRKY53的表达量。对阳性转基因植株和WT植株进行盐胁迫处理,使用200 mmol/L NaCl连续灌溉两周,分别于处理后0 h、6 h、12 h、24 h、48 h和14 d取样,每个时间点将所取样品进行混样检测生理指标,每次试验3次重复。丙二醛(MDA)含量、蛋白含量、脯氨酸含量及过氧化物酶(CAT)和过氧化氢酶(POD)活性测定试剂盒均于苏州科铭生物技术有限公司购买,检测方法参考试剂盒说明书。
2 结果与分析
2.1 SmeWRKY53基因启动子序列元件分析
利用PlantCARE在线数据库对 SmeWRKY53基因启动子元件进行预测,结果显示(表2), SmeWRKY53启动子除有启动子基本转录元件TATA-box外,还有一个防御和应激反应的顺式作用元件TC-rich repeats以及6个参与茉莉酸反应的顺式作用元件, SmeWRKY53启动子中顺式作用元件如图1所示。
2.2 转录因子SmeWRKY53在非生物胁迫下的表达模式分析
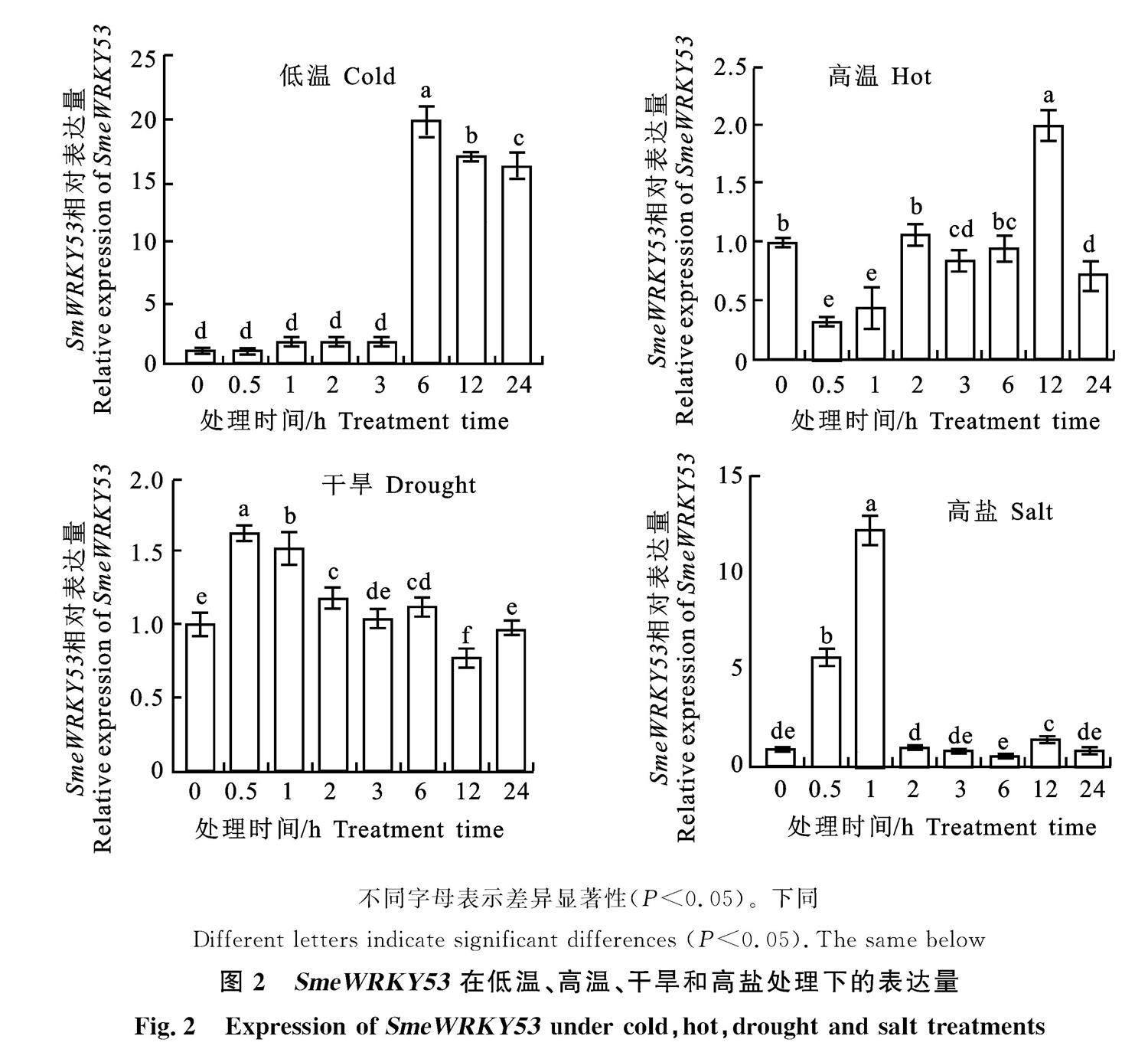
通过RT-qPCR分别检测 SmeWRKY53在高温、低温、盐胁迫以及干旱胁迫下的表达动态。结果表明(图2),低温胁迫处理后, SmeWRKY53的表达量在前3 h变化不明显,到6 h时显著升高,6 h之后 SmeWRKY53表达量逐渐下降;高温胁迫处理后, SmeWRKY53的表达量前6 h变化不明显,在12 h时表达量最高,随后 SmeWRKY53的表达量逐渐下降;干旱胁迫处理后, SmeWRKY53的表达量无明显变化;盐胁迫处理后,1 h可检测到 SmeWRKY53表达量的显著升高,在1 h后 SmeWRKY53的表达量明显下降。以上结果表明 SmeWRKY53在茄子中能够响应低温、高温、干旱以及盐胁迫,推测其可能在茄子遭受非生物胁迫时发挥转录调控作用。
2.3 SmeWRKY53过表达茄子植株的鉴定
通过克隆质粒上的片段来验证阳性植株(图3)并且通过实时定量PCR(qRT-PCR)来验证阳性植株的 SmeWRKY53的表达量(图4)。共得到 SmeWRKY53过表达阳性植株22棵(OE1-OE18)。
2.4 过表达SmeWRKY53植株盐胁迫下表型分析
对SmeWRKY53过表达植株进行盐胁迫处理,使用浓度为200 mmol/L的NaCl溶液连续灌溉两周,观察植株表型。由图5可知,盐胁迫处理下均会对过表达和野生型植株造成伤害,野生型‘卜丽卡在盐胁迫处理后48 h叶片变黄,过表达植株在处理14 d后变黄,与处理0 h相比,野生型植株在14 d盐胁迫后生长明显受到限制,而过表达植株在处理14 d后有明显的成长。
2.5 盐胁迫处理SmeWRKY53过表达植株的理化指标分析
通过对盐胁迫处理后野生型茄子植株和 SmeWRKY53过表达植株的MDA含量、可溶性蛋白含量、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性以及脯氨酸(Pro)含量进行检测。结果表明,在0 h时过表达植株与野生型的MDA含量无明显差异,盐胁迫处理后,MDA的含量总体呈升高趋势(图6-A),且野生型植株的MDA含量显著高于过表达植株。
可溶性蛋白含量测定结果(图6-B)显示,未处理时过表达植株的可溶性蛋白显著高于野生型植株,盐胁迫处理后过表达植株的可溶性蛋白含量在0~48 h内呈降低的趋势,在48 h~14 d显著升高。野生型植株的可溶性蛋白含量在0~ 6 h内呈上升的趋势,在12 h~14 d显著下降。
对CAT和POD活性检测发现(图6-C、图6-D),未处理时野生型和过表达植株的CAT和POD活性无显著差异,盐胁迫处理后0~48 h内过表达植株CAT活性逐渐升高,在14 d时显著下降,野生植株的CAT酶活总体呈下降趋势,并且在6 h~14 d内过表达植株的CAT活性都显著高于野生型;POD活性在野生型植株中呈现先下降后上升的趋势,在过表达植株中POD活性呈上升趋势,在14 d时活性达到最高。脯氨酸含量检测结果显示(图6-E),过表达植株脯氨酸含量在0 h~12 h逐渐上升,在12 h~48 h有所下降,48 h~14 d呈上升趋势,在14 d时达到最大值。野生型植株的脯氨酸含量呈先下降后上升的趋势,在14 d达到峰值。野生型植株的脯氨酸含量在处理期间均显著低于过表达植株。
2.6 盐胁迫相关基因表达量检测
选取茄子中3个盐胁迫相关基因 SmeSOS1、 SmeCIPK3和 SmeNHX1,分别检测其在野生型和过表达植株中盐胁迫前后的表达量变化。如图7所示,盐胁迫处理前,过表达植株中 SmeSOS1、 SmeCIPK3和 SmeNHX1的表达量显著高于野生型植株。对盐胁迫处理14 d后的表达分析发现,野生型植株中 SmeSOS1、 SmeCIPK3和 SmeNHX1的表达量均有明显升高。过表达植株中 SmeSOS1、 SmeCIPK3和 SmeNHX1的表达量显著升高,且显著高于同时期野生型植株。以上结果表明,过表达 SmeWRKY53可以诱导盐胁迫相关基因的表达。
3 讨 论
WRKY基因家族是高等植物中最大的转录因子家族之一。在植物应对生物和非生物胁迫的一些过程中发挥重要作用[15]。许多研究表明WRKY家族可调控植物在盐胁迫下的抗逆性,Bo等[16]发现水稻中过表达玉米 WRKY114基因降低了水稻耐盐性。Liang等[17]从菊花中分离并诱导得到转录因子 DgWRKY5,通过过表达 DgWRKY5证明过表达菊花的耐盐性比野生型菊花强。在本研究中,首先对转录因子 SmeWRKY53的启动子进行分析,发现启动子序列有一个参与防御和应激反应的顺式作用元件TC-rich repeats和多个MeJA反应性的顺式作用调控元件。MeJA作为一种参与植物逆境胁迫反应的激素,可以通过调节无机渗透离子或有机渗透剂来抑制有毒离子的吸收,从而对抗渗透胁迫的不利影响[18]。本研究通过使用盐胁迫处理发现 SmeWRKY53被显著诱导,表明 SmeWRKY53可能在茄子盐胁迫反应中发挥作用。通过过表达 SmeWRKY53可以减缓盐胁迫下茄子植株的不良反应,证明 SmeWRKY53可能在茄子盐胁迫反应中的正向调控作用。
盐胁迫反应的早期信号包括过量的Na+、细胞内钙离子水平的变化,以及活性氧物质(ROS)的积累[19]。有报道表明,转录因子 SlMYB102、 PpCAS1和 FcWRKY40可以显著降低叶片或根中的Na+含量,增加K+/Na+的比率,从而维持这些组织中的离子动态平衡,提高植物的耐盐性。植物通常利用Na+转运蛋白如 SOS1、 NHX1和 HKT1来消除多余的Na+,并在细胞质中保持最合适的Na+/K+比率[23]。CBL-CIPK复合体可作用于离子转运蛋白参与调节逆境胁迫下的离子稳态[24],已有研究表明茄子中CBL1可与CIPK3相互作用响应盐胁迫[25]。本研究对离子转运相关基因进行表达分析,发现过表达植株中 SmeSOS1、和 SmeNHX1表达量显著高于野生型,并且在盐胁迫处理后,过表达植株中 SmeSOS1、 SmeCIPK3和 SmeNHX1受到更强烈的诱导表达。
植物在响应盐胁迫时,往往会在细胞中一些有机分子,如脯氨酸和可溶性蛋白等以维持较高的渗透压[26]。积累脯氨酸是植物为抵御盐胁迫而采取的一种保护措施[27],脯氨酸在渗透调节、保护细胞大分子和清除羟基自由基等方面发挥作用。本研究发现,盐胁迫处理后,在 SmeWRKY53过表达植株可以积累更多的脯氨酸来清除活性氧从而提高植株的耐盐性,并且含有更多的可溶性蛋白以维持渗透压的平衡。
非生物胁迫可引起脂质过氧化,高浓度盐会导致活性氧(ROS)积累,会损害植物的细胞膜,导致脂质过氧化和其他的氧化损伤,进一步导致MDA和H2O2积累[28-29]。MDA的含量可以反映盐胁迫对植物的伤害程度,本研究中, SmeWRKY53过表达植株中MDA的积累更少,植物的受伤害程度更低。对CAT活性检测发现过表达植株中CAT活性更高,CAT可以将H2O2分解为水和氧气,减少膜脂过氧化,增强植物的抗氧化性从而提高耐盐性。
4 结论
茄子中 SmeWRKY53受盐胁迫的诱导。过表达 SmeWRKY53能增强清除ROS的能力,抑制细胞膜损伤和细胞死亡并且产生更多的渗透调节物质提高对盐胁迫的耐受性,减少盐胁迫对植株的伤害。该研究不仅有助于了解茄子 SmeWRKY53基因在茄子耐盐胁迫中的分子机制,而且也为分子育种提供了候选基因。
参考文献 Reference:
[1] 孙保娟.持续高温胁迫对茄子幼苗几个主要生理指标的影响[J].热带作物学报,2010,31(9):1528-1534.
SUN B J.Effects of continuous heat stress on several physiological indexes of eggplant seedlings[J].Chinese Journal of Tropical Crops,2010,31(9):1528-1534.
[2]李元梅,姚金晓,朱田香.茄子幼苗耐低温生理指标的影响[J].浙江农业科学,2023,64(2):337-339.
LI Y M,YAO J X,ZHU T X.Effects of continuous heat stress on several physiological indexes of eggplant seedlings[J].Journal of Zhejiang Agriculture Sciences,2023, 64(2):337-339.
[3]WANG J L,HU H J,WANG W H,et al.Genome-wide identification and functional characterization of the heat shock factor family in eggplant (Solanum melongena L.) under abiotic stress conditions[J],Plants,2020,9(7):915.
[4]朱宗文,吴雪霞,张爱冬,等.茄子耐低温性差异材料的筛选及其转录组分析[J].分子植物育种,2021,19(14):4779-4787.
ZHU Z W,WU X X,ZHANG A D,et al.Screening and transcriptome analysis of different materials with low temperature tolerance in eggplant(Solanum melongena)[J].Molecular Plant Breeding,2021,19(14):4779-4787.
[5]张爱慧,崔群香,杨梦娴,等.聚乙二醇-6000胁迫对茄子幼苗生长及酶活性的影响[J].江苏农业科学,2022,50(17):138-142.
ZHANG A H,CUI Q X,YANG M X,et al.Influences of polyethylene glycol-6000 stress on growth and enzyme activity of eggplant seedlings[J].Jiangsu Agricultural Sciences,2022,50(17):138-142.
[6]HASEGAW P M,BRESSAN R A,ZHU J K,et al.Bohnert,H.J.Plant cellular and molecular responses to high salinity[J].Annual Review of Plant Physiology and Plant Molecular Biology Vol.2000,51:463-499.
[7]刘 峰.设施栽培中连作障害和土壤盐渍化问题及其对策[J].农业工程技术(温室园艺),2006(3):16.
LIU F.Problems of continuous cropping and soil salinization in facility cultivation and their countermeasures[J].Agricultural Engineering Technology (Greenhouse Horticulture),2006(3):16.
[8]ABDULLAH-ZAWAWI M R,AHMAD-NIZAMMUDDIN N F,GOVENDER N,et al.Comparative genome-wide analysis of WRKY,MADS-box and MYB transcription factor families in Arabidopsis and rice[J].Scientific Reports,2021,11(1):19678.
[9]WANG Q,GUO C,LI ZY,et al.Potato NAC transcription factor StNAC053 enhances salt and drought tolerance in transgenic Arabidopsis[J].International Journal of Molecular Sciences,2021,22(5):2568.
[10] ZHAO X,WU TT,GUO SX,et al.Ectopic expression of AeNAC83,a NAC transcription factor from Abelmoschus esculentus,inhibits growth and confers tolerance to salt stress in Arabidopsis[J].International journal of molecular sciences.2022;23(17):10182.
[11]HICHRI I,MUHOVSKI Y,ZIZKOVA,et al.The Solanum lycopersicum WRKY transcription factor SlWRKY3 is involved in salt stress tolerance in tomato[J].Frontiers in Plant Science,2017,8:1343.
[12]GAO F,ZHOU J,DENG RY,et al.Overexpression of a tartary buckwheat R2R3-MYB transcription factor gene,FtMYB9,enhances tolerance to drought and salt stresses in transgenic Arabidopsis[J].Journal of Plant Physiology,214:81-90.
[13]SHEN L,ZHAO E,LIU R,et al.Transcriptome analysis of eggplant under salt stress:ap2/erf transcription factor smerf1 acts as a positive regulator of salt stress[J].Plants (Basel),2022,11(17):2205.
[14]翟 莹,李铭杨,张 军,等.异源表达大豆转录因子GmNF-YA19提高转基因烟草抗旱性[J].生物技术通报,2023,39(5):224-232.
ZHAI Y,LI M Y,ZHANG J,et al.Heterologous expression of soybean transcription factor gmnf-ya19 improves drought resistance of transgenic tobacco[J].Biotechnology Bulletin,2023,39(5):224-232.
[15]JIANG J J,MA S H,YE N H,et al.WRKY transcription factors in plant responses to stresses[J].Journal of Integrative Plant Biology,2016,59(2):86-101.
[16]BO C,CHEN H W,LUO G W,et al.Maize WRKY114 gene negatively regulates salt-stress tolerance in transgenic rice[J].Plant Cell Reports,2020,39(1):135-148.
[17]LIANG Q Y,WU Y H,WANG K,et al.Chrysanthemum WRKY gene DgWRKY5 enhances tolerance to salt stress in transgenic Chrysanthemum[J].Scientific Reports,2017(1):4799.
[18]YU X X,ZHANG W J,ZHANG Y,et al.The roles of methyl jasmonate to stress in plants[J].Functional Plant Biology,2019,46(3):197-212.
[19]PARK H J,KIM W Y,YUN D J.A new insight of salt stress signaling in plant[J].Molecules Cells,2016,39(6):447-59.
[20]DAI W S,WANG M,GONG X Q,et al.The transcription factor FcWRKY40 of Fortunella crassifolia functions positively in salt tolerance through modulation of ion homeostasis and proline biosynthesis by directly regulating SOS2 and P5CS1 homologs[J].New Phytologist,2018,219(3):972-989.
[21]ZHOU Y ,DIAO M ,CHEN X J,et al.Application of exogenous glutathione confers salinity stress tolerance in tomato seedlings by modulating ions homeostasis and polyamine metabolism[J].Scientia Horticulturae,2019,250:45-58.
[22]ZHANG X,CHEN L C,SHI Q H,et al.SlMYB102,an R2R3-type MYB gene,confers salt tolerance in transgenic tomato[J].Plant Science,2020,291:110356.
[23]DU N S,XUE L,Xue D Q,et al.The transcription factor SlNAP1 increases salt tolerance by modulating ion homeostasis and ROS metabolism in Solanum lycopersicum[J].Gene,2023,849:146906.
[24]MA X,LI Y,GAI W X,et al.The CaCIPK3 gene positively regulates drought tolerance in pepper[J].Horticultural Research,2021,8(1):216.
[25]李 静.茄子响应盐胁迫的比较转录组学分析及候选基因 SmeAKT1的研究[D].上海:上海交通大学,2018.
LI J.Comparative transcriptome analysis of eggplant responses to salt stress and functional identification of the candidate gene SmeAKT1[D].Shanghai:Shanghai Jiaotong University,2018.
[26]AZEVEDO N A D D,PRISCO J T,ENAS-FILHO J , et al.Effects of salt stress on plant growth,stomatal response and solute accumulation of different maize genotypes[J].Brazilian Journal of Plant Physiology,2004,16(1):31-38.
[27]SANTA-CRUZ A,ACOSTA M,RUS A,et al.Short-term salt tolerance mechanisms in differentially salt tolerant tomato species[J].Plant Physiology & Biochemistry,1999,37(1):65-71.
[28]HASEGAWA P,BRESSAN R,ZHU J,et al.Plant cellular and molecular responses to high salinity[J].Annual Review of Plant Physiology & Plant Molecular Biology,2000,51(51):463-499.
[29]NETONDO G W,ONYANGO J C,BECK E.Sorghum and salinity:II.Gas exchange and chlorophyll fluorescence of sorghum under salt stress[J].Crop Science,2004, 44(3):806-811.
Response of Eggplant Transcription Factor SmeWRKY53 to Salt Stress
ZHOU Yaru1,XIAO Kai2,ZHANG Aidong2 and WU Xuexia1,2
(1.College of Fisheries and Life Sciences,Shanghai Ocean University,Pudong New Area,Shanghai 201306,China;
2.Institute of Horticulture,Shanghai Academy of Agricultural Sciences,Fengxian District,Shanghai 201403,China)
Abstract WRKY transcription factor plays an important role in various physiological processes and stress responses.To explore the stress resistance of eggplant transcription factor SmeWRKY53,the promoter elements of SmeWRKY53 were predicted and analyzed.Real-time fluorescent quantitative PCR (RT-qPCR) was used to detect the expression changes of SmeWRKY53 under different abiotic stresses. SmeWRKY53 was overexpressed in eggplant through genetic transformation,and the salt tolerance of the overexpressed eggplant at seedling stage was identified.The results of promoter element prediction analysis showed that the promoter sequence of this gene not only contains basic transcriptional elements of promoters,but also contains stress-related elements such as TC-rich repeats,CGTCA-motif and TGACG-motif.Quantitative real-time polymerase chain reaction (qRT-PCR) results showed that SmeWRKY53 could respond to high temperature,low temperature,drought and salt stress in eggplant,and could be significantly induced under salt stress.Physiological tests showed that the accumulation of malondialdehyde (MDA) in overexpressed plants was significantly lower than that in control under salt stress.Meanwhile,overexpression of SmeWRKY53 increased the contents of proline and soluble protein and the activities of antioxidant enzymes (Catalase (CAT) and Peroxidase activity (POD)) to improve the salt tolerance of plants.The expression of salt stress-related genes (SmeSOS1,SmeCIPK3 and SmeNHX1) was detected,and the expression levels of salt stress-related genes (SmeSOS1, SmeCIPK3 and SmeNHX1) in overexpressed plants were significantly increased after salt stress treatment compared with the wild type.These results suggest that eggplant SmeWRKY53,as a positive regulator,can improve the tolerance of eggplant to salt stress.
Key words Eggplant; Transcription factor; SmeWRKY53; Abiotic stress; Salt tolerance
Received 2023-06-16 Returned 2023-08-04
Foundation item National Bulk Vegetable Industry Technology System Project (No.CARS-25).
First author ZHOU Yaru,female,master student.Research area:molecular breeding.E-mail:yrzhou153@163.com
Corresponding author WU Xuexia,female,Ph.D,research fellow.Research area:molecular breeding. E-mail:wuxuexiarose@sohu.com
(责任编辑:潘学燕 Responsible editor:PAN Xueyan)

