栽培小麦Brock中转录因子基因WRKY的克隆与表达分析
肖莹+刘君+刘晓颖+范宝莉+王振英

摘 要: WRKY 类转录因子在植物抵抗外界胁迫上起重要作用。本研究在小麦中分离到一个WRKY类转录因子基因TaWRKY,该基因序列全长1 242 bp,推测编码蛋白含354个氨基酸, 相对分子量为86 kD, 理论等电点为4.96,与小麦中WRKY8序列同源性为97%。进化树分析表明,TaWRKY与小麦中WRKY8亲缘关系较近。基因的诱导表达模式分析显示,TaWRKY受白粉菌诱导, 染菌8 h达到表达最高值。上述试验结果初步说明,TaWRKY基因在小麦抵抗白粉菌侵染过程中可能发挥着重要作用。
关键词:小麦;白粉菌;转录因子;WRKY
中图分类号:S512.1 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2015.02.001
Cloning and Function Analysis of a Transcription Factor TaWRKY Gene in Common Wheat Cultivar Brock
XIAO Ying, LIU Jun, LIU Xiao-ying, FAN Bao-li, WANG Zhen-ying
(College of Life Science, Tianjin Normal University, Tianjin 300387,China)
Abstract: WRKY transcription factors play an important role in plant stress tolerance. In this study, a WRKY-like gene, named TaWRKY, was cloned from common wheat cultivar Brock . TaWRKY cDNA was 1 242 bp in length, and encoded protein of 354 amino acids with an predicted molecular weight of 86 kD and a isoelectric point of 4.96 . On the basis of phylogenetic analysis, TaWRKY shared 97% similarity with WRKY8 from wheat. The expression patterns analysis indicated that TaWRKY was induced by Blumeria graminis f. sp. Tritici(Bgt) and reached the maxium at 8 h in Brock. These results indicated that TaWRKY may play an important role in wheat-Bgt interaction.
Key words: wheat; powdery mildew; transcription factor; WRKY
收稿日期:2014-11-25;修订日期:2015-01-04
基金项目:国家自然科学基金(31071671);天津市科委青年基金(14JCQNJC14900)
作者简介:肖莹(1990—),女,天津人,在读硕士生,主要从事植物抗病分子育种方面研究。通讯作者为王振英。
植物在漫长的进化过程中形成一系列复杂而精确的机制,来抵御生长发育过程中受到的各种生物和非生物胁迫。逆境胁迫下,植物通过一系列生理、生化和分子水平上的改变来适应逆境胁迫。大量研究表明,植物对逆境的响应是自身多个基因和基因家族共同作用的结果,这些基因主要分为功能基因和调节基因两类。转录因子是植物中非常重要的一类调节基因。
WRKY转录因子是近年来在植物中被广泛研究的一类转录因子家族,因其含有一段高度保守的WRKYGQK氨基酸序列而得名[1]。WRKY转录因子广泛参与植物的抗逆胁迫和衰老等生理生化过程,机械损伤、病原菌侵害、植物激素类物质刺激都会引起WRKY基因的表达变化。烟草WRKY3和WRKY6能够响应昆虫取食造成的伤害[2]。水稻中,OsWRKY13可以提高其对细菌和真菌疫病的抗性[3]。拟南芥中转录因子WRKY2介导了依赖于ABA的种子萌发以及萌发后发育的阻滞过程[4]。HvWRKY38 在大麦中受干旱、低温胁迫的诱导[5]。在水稻中,干旱诱导水稻的叶中OsWRKY80的表达量显著增加[6]。1994年,Ishiguro和Nakamura[7]首次从甘薯(Ipomoea batatas)中克隆出第一个WRKY蛋白SPF1,此后人们相继在野生燕麦、欧芹、拟南芥、烟草和水稻等多种植物中都得到了WRKY基因。目前,在拟南芥和水稻中分别发现了72个和107个WRKY基因[8],Wu等[9]和Niu等[10]也分别在小麦中克隆了15个和43个WRKY基因。
前期工作中,笔者在利用cDNA-AFLP技术分析Brock中白粉菌诱导下基因表达谱时,发现一个367 bp的片段 F16,经Blast比对,该片段与NCBI GenBank中小麦WRKY8(Genbank 登录号:DQ323885.1),小麦WRKY71(Genbank 登录号:EF368356.1),小麦WRKY80(Genbank 登录号:JX679079.1),小麦cDNA文库序列(Genbank 登录号:AK331823.1),大麦WRKY1(Genbank 登录号:AJ536667.1),大麦WRKY38(Genbank 登录号:AY541586.1)分别有94%,93%,93%,92%,85%和80%的同源性。笔者根据上述基因序列设计兼并引物,在抗白粉病小麦Brock中克隆了一个WRKY基因cDNA全长序列,命名为TaWRKY。利用荧光定量PCT技术对该基因的表达模式进行了分析,初步认为该WRKY基因参与了小麦抗白粉病早期防御反应过程。
1 材料和方法
1.1 试验材料与试剂
白粉菌抗性品种Brock,由Ray Johnson博士惠赠。
小麦白粉菌15号生理小种,由中国农业科学院植物保护研究所提供。
1.2 TaWRKY基因的克隆
参照Roche公司TriPure Isolation Reagent试剂盒操作手册提取总RNA。利用Nanodrop1000和琼脂糖凝胶电泳检测RNA质量及浓度。然后以4 μg总RNA为模板,利用Oligo(dT)18,在Transcriptor High Fidelity cDNA Synthesis Kit(Roche)的作用下合成cDNA。根据F16的Blast比对结果,设计一对兼并引物,WRKYCDS-F: 5-ATGGATCCATGGRTSRGCAGCC-3; WRKYCDS-R: 5-TTAATTGATGTCCCTGGTCGGCGAK-3进行PCR扩增,扩增体系为5×HF Buffer 10.0 μL,100 mmol·L-1 dNTP Mixture 1.0 μL,WRKYCDS-F 2.5 μL,WRKYCDS-R 2.5 μL,cDNA 1.0 μL,DNA polymerase 0.5 μL,ddH2O补齐至50 μL。PCR反应参数:98 ℃预变性5 min;98 ℃变性10 s,58 ℃退火30 s,72 ℃延伸2 min;反应进行35个循环。72 ℃终延伸7 min。将目标条带回收纯化,纯化产物连接到pGEM-T easy Vector上, 转化大肠杆菌,蓝白斑筛选阳性克隆, 经PCR 验证和酶切验证后, 阳性克隆送公司测序,测序结果提交NCBI GenBank 进行同源性分析。
1.3 TaWRKY基因表达模式分析
在小麦幼苗长至一叶一心期时采用抖落法高密度接种新鲜白粉菌孢子,接种0,2,4,8,12,24和48 h后取叶片用于提取RNA和表达趋势分析。
根据小麦TaWRKY基因的特异区段设计一对荧光定量引物QTaWRKYF:5-AGTCCAATCCCGTCATCTCC-3和QTaWRKYR:5-GTCGCCACGAGTATGGTCTT-3,大小为154 bp。使用FastStart universal SYBR green master (Roche)在荧光定量PCR仪(Corbett rotor gene 6000)上进行基因扩增、荧光信号检测和溶解曲线分析。内参基因为小麦Tubulin基因(GenBank: U76744.1),该基因扩增引物为TubulinF:5-CCGTCTCCTTCTGGCTGCTT-3和TubulinR:5-GCCCGATGTGGATGCTTAT-3,扩增片段大小为186 bp。PCR扩增体系及程序参照试剂盒说明书进行,每个样品设置3个重复,采用2-△△CT法进行数据分析[11]。
2 结果与分析
2.1 TaWRKY基因的克隆
分离白粉菌诱导8 h的小麦Brock叶片总RNA,以Oligo(dT)18为引物进行反转录,获得cDNA,以该cDNA为模版,WRKYCDS-F和WRKYCDS-R为引物,PCR扩增出一个约1.3 kb的基因片段,将该片段连接到T-easy克隆载体,克隆并测序,该片段长1 242 bp,包含F16序列区段,与小麦WRKY8基因(GenBank登陆号:DQ323885.1)有97%同源性。利用ORF funder软件搜索,发现其第109至1 174为ORF区,共1 065 bp,推测编码354个氨基酸, 理论预测该蛋白的分子量为86 kD, 等电点4.96。氨基酸序列分析发现,TaWRKY中后部包含WRKY基因超家族保守结构域WRKYGQK,故将该基因命名为TaWRKY(图1)。利用ClustalW 软件进行系统谱系分析发现, 本研究中克隆的TaWRKY基因与WRKY家族中A1 组亲缘关系较近(图2)。
2.2 TaWRKY基因表达模式分析
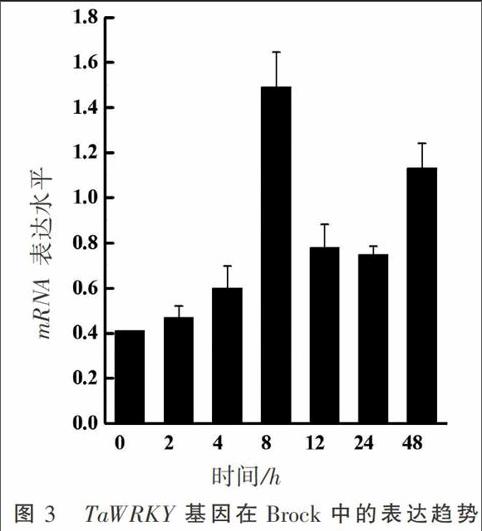
为了研究TaWRKY基因对白粉菌诱导的应答情况,笔者利用荧光定量分析法(qRT-PCR) 分析白粉菌诱导后TaWRKY基因mRNA累计情况。Brock中,TaWRKY基因受白粉菌诱导后的表达趋势呈“W”型曲线特征,在白粉菌诱导2 h达到最低点;随后基因表达水平逐渐上升,侵染8 h时达到最高;之后开始下降但24 h后又开始上升(图3)。以上结果说明,TaWRKY的表达水平与白粉菌的诱导密切相关。
3 结论与讨论
转录因子可以调控多个与同类性状有关的基因表达, 因此通过改良或增强一个关键转录因子的调控能力, 可以通过它增强多个同类功能基因同时发挥作用, 从而使植株获得综合改良效果。WRKY转录因子家族几乎在所有植物中均存在,该转录因子家族成员都含有一段由60个氨基酸组成的结构域,该结构域的N端含有一段高度保守的WRKYGQK氨基酸序列,C端一般含有一个锌指结构。WRKY结构域能够特异性地结合一段TTGACC /T序列,这一结构被称为W-box[12]。W-box序列多存在于抗病、损伤、衰老相关基因和水杨酸诱导基因的上游调控区域,因此推测,WRKY转录因子可能参与植物抗逆、生物胁迫和衰老等过程。
WRKY8是植物众多WRKY类基因家族成员之一,在拟南芥中的功能研究比较多,中国科学院西双版纳热带植物园余迪求实验室发现,拟南芥中,机械损伤诱导的WRKY8介导了拟南芥对病原菌的抵抗[13];WRKY8还与细胞中VQ9互作介导拟南芥抗盐性[14];最近他们又发现WRKY8通过介导脱落酸和乙稀信号,参与了十字花科感染烟草花叶病毒(TMV-cg)的防御反应,认为WRKY8可能介导了TMV-cg与拟南芥相互作用过程中ABA与乙稀信号之间的串扰,从而参与了对TMV-cg的防御反应[15]。小麦中相关WRKY家族成员的报道较多[9],虽然在Genbank中搜索到一个小麦的WRKY8(DQ323885.1),但其作者仅仅提交了一个mRNA的序列,对该序列没有做功能阐述,因此,WRKY8在小麦中的功能研究未见任何报道。TaWRKY是本实验室利用cDNA-AFLP技术分析抗病小麦Brock白粉菌诱导下基因表达谱时发现的表达上调片段,而后结合生物信息学技术克隆到基因cDNA全长,进一步的荧光定量表达趋势分析发现,该基因的本底表达较低,但在8 h时达到表达高峰,随后表达量下降,符合转录因子基因的一般表达规律,推测该基因可能参与了小麦对真菌防御反应调节,进一步的研究正在进行中。
参考文献:
[1] Rushton P J,Macdonald H,Huttly A K,et al. Members of a new family of DNA-binding proteins bind to a conserved cis-element in the promoters of alpha-Amy2 genes [J]. Plant Molecular Biology,1995,29: 691-702.
[2] Skibbe M,Qu N,Galis I,et al. Induced plant defenses in the natural environment Nicotiana attenuata WRKY3 and WRKY6 coordinate responses to herbivory [J].Plant Cell,2008,20(7):1 984-2 000.
[3] Qiu D,Xiao J,Ding X,et al. OsWRKY13 mediates rice disease resistance by regulating defense-related genes in salicylate-and jasmonate-dependent signaling [J]. Molecular Plant-Microbe Interactions,2007,20(5): 492-499.
[4] Jiang W,Yu D. Arabidopsis WRKY2 transcription factor mediates seed germination and postgermination arrest of development by abscisic acid [J]. BMC Plant Biology,2009(9):96.
[5] Mare C,Mazzucotelli E,Crosatti C,et al. Hv-WRKY38: A new transcription factor involved in cold- and drought-response in barley [J]. Plant Molecular Biology,2004,55: 399-416.
[6] Ricachenevsky F K,Sperotto R A,Menguer P K, et al. Identification of Fe-excess- induced genes in rice shoots reveals a WRKY transcription factor responsive to Fe, drought and senescence [J]. Mol Biol Rep,2010,37(8): 3 735-3 745.
[7] Ishiguro S,Nakamura K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5′ upstream regions of genes coding for sporamin and beta-amylase from sweet potato [J]. Molecular General Genetics,1994,244: 563-571.
[8] Wu K L,Guo Z J,Wang H H,et al. The WRKY family of transcription factors in rice and Arabidopsis and their origins [J]. DNA Res,2005,12(1): 9-26.
[9] Wu H, Ni Z, Yao Y,et al. Cloning and expression profiles of 15 genes encoding WRKY transcription factor in wheat Triticum aestivem L [J]. Prog Nat Sci,2008,18: 697-705.
[10] Niu C F,Wei W,Zhou Q Y,et al. Wheat WRKY genes TaWRKY2 and TaWRKY19 regulate abiotic stress tolerance in transgenic Arabidopsis plants [J]. Plant Cell Environ,2012, 35:1 156 -1 170.
[11] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method [J]. Methods,2001,25:402-408.
[12] Eulgem T,Rushton P J,Robatzek S,et al.The WRKY superfamily of plant transcription factors[J].Trends Plant Sci,2000(5): 199-206.
[13] Chen L, Zhang L, Yu D. Wounding-induced WRKY8 is involved in basal defense in Arabidopsis [J]. Mol Plant Microbe Interact,2010, 23(5):558-565.
[14] Hu Y, Chen L, Wang H, et al. Arabidopsis transcription factor WRKY8 functions antagonistically with its interacting partner VQ9 to modulate salinity stress tolerance [J]. Plant J, 2013,74(5):730-745.
[15] Chen L, Zhang L, Li D, et al. WRKY8 transcription factor functions in the TMV-cg defense response by mediating both abscisic acid and ethylene signaling in Arabidopsis [J]. Proc Natl Acad Sci,2013,110(21): 1 963-1 971.
