掌叶大黄4个MYB转录因子的分子克隆及胁迫表达
赵霞 李元敏 李依民 胡晓晨 高静 颜永刚 张岗


doi:10.7606/j.issn.1004-1389.2024.07.017
https://doi.org/10.7606/j.issn.1004-1389.2024.07.017
收稿日期:2023-01-05 修回日期:2023-03-07
基金项目:国家自然科学基金(82104334,81973430);咸阳市中青年科技创新领军人才(L2022CXNLRC009);陕西中医药大学学科创新团队项目(2019-QN01)。
第一作者:赵 霞,女,硕士研究生,研究方向为分子生药学。E-mail:2443284316@qq.com
李元敏,并列第一作者,女,硕士研究生,研究方向为分子生药学。E-mail:1272151264@qq.com
通信作者:张 岗,男,教授,研究方向为分子生药学。E-mail:jay_gumling2003@aliyun.com
李依民,女,副教授,研究方向为分子生药学。E-mail:2051058@sntcm.edu.cn
摘 要 旨在克隆获得 RpMYB2、 RpMYB3、 RpMYB5、 RpMYB6基因ORF,并对其理化特性、系统进化关系、不同组织表达、激素与非生物胁迫下的表达等展开分析。研究结果表明, RpMYB2、 RpMYB3、 RpMYB5、 RpMYB6依次编码333、275、293、291个氨基酸,分子质量分别为34.781、30.525、31.243、33.313 ku,4个RpMYBs蛋白均为亲水性蛋白并具有较高的热稳定性,除 RpMYB2外其余3个基因结构主要为 α-螺旋和无规则卷曲,且均定位于细胞核。由蛋白结构域和保守基序分析发现, RpMYB2、 RpMYB5含有1个HTH-MYB结构域, RpMYB3、 RpMYB6含有2个HTH-MYB结构域,且不同MYB转录因子包含的保守元件数量及种类存在差异,系统进化分析显示 RpMYB2、 RpMYB5属于R1-MYB亚家族, RpMYB3、 RpMYB6属于R2R3-MYB亚家族,与其结构域分类一致。实时荧光定量结果显示,根中 RpMYB2、 RpMYB6转录本丰度最高, RpMYB3、 RpMYB5基因分别在叶片、叶柄中高表达。经200 μmol·L-1脱落酸 (abscisic acid, ABA)处理, RpMYB5于24 h达峰值;200 μmol·L-1茉莉酸甲酯 (methyl jasmonate, MeJA)诱导 RpMYB6 表达,表达量随时间推移呈逐渐上升趋势且于24 h最高(为0 h的10.30倍),抑制 RpMYB3表达;200 μmol·L-1水杨酸 (salicylic acid, SA)诱导 RpMYB6表达最为明显,3 h表达量上调至 0 h的21.84 倍。 RpMYBs 在非生物胁迫处理下表达也各有差异, RpMYB2受高温胁迫诱导表达, RpMYB3在损伤、高温胁迫下表达下调, RpMYB5在损伤胁迫下表达受抑制, RpMYB6响应高温、盐胁迫。
关键词 掌叶大黄;MYB;表达分析;胁迫;实时荧光定量PCR
转录因子在植物生长发育过程中发挥着不可或缺的作用,通常通过与靶基因启动子区域中的相关顺式作用元件相互作用,参与基因表达调控[1]。在众多的转录因子中,MYB存在于所有真核生物中,功能多样且广泛参与到植物生长、发育、防御及次生代谢调控等生理过程。 ZmMYBC1是植物中第一个被发现的MYB转录因子[2],与玉米花青素的生物合成密切相关。近年来,越来越多的植物MYB家族成员相继被报道,如拟南芥[3]、过路黄[4]、辣椒[5]中分别鉴定出197、51、172个MYB转录因子。
通常,MYB蛋白在N端有一段高度保守的DNA结构域,该结构域由50~53个氨基酸残基的重复片段(R)组成[6-7],依据包含的R结构数目又分为4个亚类:4R-MYB,最小的MYB亚家族,相关报道较少;3R-MYB(R1R2R3-MYB),植物中家族成员较少,主要参与调控细胞周期[8-9];R2R3-MYB,植物MYB基因编码蛋白中最丰富的一类,在初生与次生代谢、激素应答以及植物对逆境胁迫的响应等方面具有重要功能[10];R1-MYB是植物中第二大类MYB亚家族,在细胞形态建成、染色体结构维持、根毛形成、生物钟调节等生命过程具有重要调控作用[11]。诸多研究表明,MYB转录因子参与调控苯丙烷类次生代谢,如 McMYB4通过调节苯丙烷代谢和激素信号传导,参与苹果响应温度变化的非生物抗性和生长[12];白杨中 PtoMYB156参与调控苯丙烷途径和次生细胞壁的初步形成[13]; AtMYB4通过苯丙烷代谢途径参与调节拟南芥中花粉壁的形成[14]。
掌叶大黄(Rheum palmatum L.)是目前中国最为正宗、名贵的中药材大黄属三基源植物之一,以其干燥根、根茎为药用,味苦、性寒,主治泻下,清热泻火,凉血解毒,利湿祛黄[15],主要分布于甘肃、青海等高海拔地区。蒽醌类是大黄的主要活性物质,具有保肝、抗肿瘤、抗氧化等作用,其成分积累是影响大黄品质的重要因素[16]。研究发现部分MYB转录因子负调控苯丙烷代谢[17],Perassolo等[18]阐明有效抑制莽草酸途径中苯丙氨酸解氨酶活性可改变代谢流,活化蒽醌类成分合成途径进而导致蒽醌类成分累积。但是,MYB基因家族在掌叶大黄中是否参与调控蒽醌类化合物的合成还有待研究。李元敏[19]对1 a生掌叶大黄根、根茎和叶片进行比较转录组测序分析(SRR10855670),筛选到6条组织差异性表达且包含完整开放阅读框(ORF)的MYB转录因子序列。本研究通过RT-PCR克隆得到4个MYB家族成员基因,并对其进行生物信息学、激素和非生物胁迫响应分析,有助于深入探讨MYB基因在植物防御反应中的重要作用,为揭示大黄中蒽醌类活性成分合成与积累的调控机制及通过遗传工程改良药材品质奠定基础。
1 材料与方法
1.1 材 料
植物材料为1 a生掌叶大黄 (R. palmatum L.)及其成熟种子,2019年10月采集于甘肃省陇南市宕昌县阿坞乡麻界村,陕西中医药大学胡本祥教授对其进行鉴定。取大黄根、根茎、叶、叶柄及种子等样品并置于液氮中速冻后,于-80 ℃冰箱保存。
基于黑小斌等[20]建立的大黄无菌苗体系培育出掌叶大黄无菌苗,参考李元敏等[21]的方法进行植物激素与非生物胁迫处理。选取生长旺盛、生长均匀的1月龄幼苗,激素处理组:喷施200 μmol·L-1茉莉酸甲酯 (MeJA)、200 μmol·L-1水杨酸 (SA)、200 μmol·L-1脱落酸 (ABA);非生物胁迫处理组:包括干旱(10% PEG6000)、机械损伤(针刺叶片)、盐(100 mmol·L-1 NaCl)、低温(4 ℃)、高温(40 ℃);此外,喷施纯溶剂模拟激素对照组,喷洒无菌水作为胁迫对照组;所有样品均于处理后1、3、6、12和24 h进行取样,0 h为空白对照,每个处理组的每个处理时间作3个样本重复,用液氮速冻后于-80 ℃冰箱保存。
1.2 总RNA提取及cDNA合成
采用RN38-EASYspin Plus RNA试剂盒(艾德莱,中国北京)提取大黄各样品总RNA,K5800自动检测超微量分光光度计(凯奥,中国北京)测定质量,并用1.0%琼脂糖凝胶电泳检测RNA完整性。按说明书操作,利用PrimeScriptTM RT Master Mix反转录试剂盒(TaKaRa,日本)合成cDNA,-20 ℃保存。
1.3 基因克隆
利用Primer Premier 5.0对筛选到的4条MYB转录因子序列设计跨ORF引物 (表1)。25 μL标准体系为:12.5 μL 2×Rapid Taq Master Mix、1 μL Forward Primer、1 μL Reverse Primer和1 μL cDNA,并用9.5 μL ddH2O补齐。PCR条件为:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,40个循环;72 ℃ 5 min,15 ℃保温。用1.0%琼脂糖凝胶电泳检测扩增产物。随后用50 μL体系进行扩增、DNA胶回收试剂盒(TianGen,中国北京)纯化回收目的片段,与pUC19连接后并转化大肠杆菌感受态细胞DH5α,挑取阳性克隆送上海生工完成测序。
1.4 生物信息学分析
利用软件及在线工具对掌叶大黄 RpMYBs 进行生物信息分析预测(表2)。
1.5 基因表达模式
利用实时荧光定量PCR检测 RpMYBs 在大黄不同样品中基因表达。以β-actin为内参基因[22],qPCR引物序列见表1。反应体系20 μL:包括10 μL TB Green○R Premix Ex TaqTM Ⅱ (TliRNaseHPlus) (2×)、Forward/Reverse Primer各0.8 μL、2 μL cDNA、0.4 μL ROX Reference Dye (50×)、6 μL ddH2O。反应程序为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,60 ℃ 34 s,40个循环;之后绘制熔解曲线,条件为95 ℃ 15 s, 60 ℃ 1 min,95 ℃ 15 s。设置3次技术和试验重复,包括不加模板的对照。用Step One Plus○R Real-Time (Applied Biosystems,美国)仪器进行qPCR检测,数据分析采用2-△△Ct计算基因相对表达量[23],以SPSS 24软件进行统计分析,P<0.05代表有显著性差异。
2 结果与分析
2.1 基因克隆
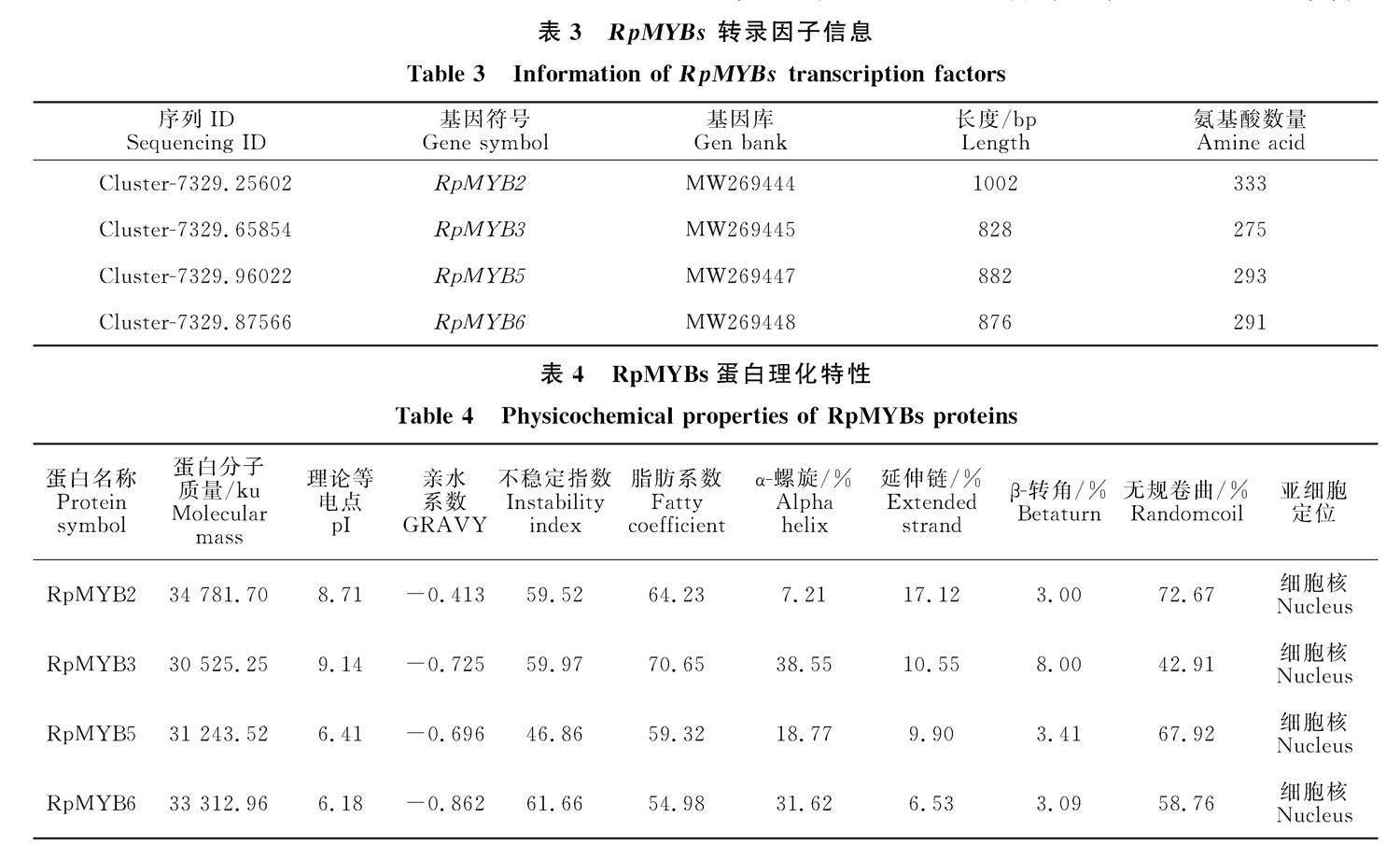
基于陕西中医药大学药学院中药资源与开发课题组前期筛选到的MYB基因家族成员,本研究对其中4条包含完整开放阅读框(ORF)的MYB转录因子序列进行基因克隆研究。提取掌叶大黄全株的总RNA,以反转录的cDNA为模板,采用高保真DNA聚合酶进行RT-PCR扩增,产物各取5 μL经1.0%琼脂糖凝胶电泳检测,分别获得4条清晰且特异性较好的条带 (图1),转录组数据与PCR产物大小相符且与克隆测序ORF序列吻合,基因命名为 RpMYB2、 RpMYB3、 RpMYB5、 RpMYB6 (注册号 MW269444、MW269445、MW269447、MW269448) (表3)。
2.2 蛋白理化特性及结构域分析
利用ProtParam分析RpMYB2、RpMYB3、RpMYB5、RpMYB6蛋白序列的一级结构发现(表4),蛋白的分子质量在30.525 (RpMYB3)~34.781 (RpMYB2) ku,等电点为6.18~9.14,
其中,RpMYB2、RpMYB3属碱性蛋白,RpMYB5、RpMYB6属酸性蛋白。4个MYB蛋白的平均亲水性是负值,说明其均为亲水性蛋白。二级结构预测结果显示,RpMYB2、RpMYB3、RpMYB5、RpMYB6均由α-螺旋(alphahelix, Hh)、延伸链 (extendedstrand,Ee)、β-转角 (betaturn,Tt) 和无规卷曲 (random coil,Cc) 组成,其中,RpMYB3、RpMYB5、RpMYB6主要由α-螺旋和无规卷曲构成,而RpMYB2主要由延伸链和无规卷曲构成。亚细胞定位结果显示其均定位于细胞核,SignalP-5.0和TMHMM在线分析表明RpMYB2属于跨膜蛋白,其余3个均无跨膜结 构域。
借助InterProScan与PROSITE对RpMYBs蛋白结构域分析预测结果一致(图2),显示RpMYB2、RpMYB5含有1个HTH-MYB结构域,属于R1-MYB亚族,RpMYB3、RpMYB6是典型的R2R3-MYB,含有2个HTH-MYB结构。
2.3 系统进化分析
从NCBI和PlantTFDB数据库下载拟南芥、大豆、丹参、水稻、玉米、苦荞麦、羊草7种植物MYB蛋白序列进行多序列比对,筛选出相似度较高的序列,采用MEGA7软件中的邻接法进行MYB蛋白分子演化分析。图3结果表明,RpMYB2与RpMYB5被划入R1-MYB家族,且RpMYB2与GmMYB176、RpMYB5与OsMYBS1蛋白序列相似性最高;RpMYB3与RpMYB6属于R2R3-MYB类型的家族成员,RpMYB3与FtMYB15、RpMYB6与拟南芥S20亚家族中AtMYB62/116同源性较高,可能具有相似的生物学功能。
2.4 保守基序分析
利用在线软件MEME对掌叶大黄4个MYB蛋白序列进行保守基序分析(图4)。结果表明,不同亚类的MYB基因包含的保守元件数量及种类存在差异。4个MYB序列中均包括Motif1,且存在3个均匀分布的氨基酸 (W) 残基,可能是掌叶大黄MYB转录因子的特征基序,但每条序列中Motif所处位置不同,RpMYB3和RpMYB6中Motif1均位于近N端且与Motif2相邻,而RpMYB2和RpMYB5中Motif1单独位于序列中间区段内。Motif3是R2R3亚族的特征基序,Motif4是R1亚族的特征基序,二者均含有6个氨基酸残基,是最短基序。Motif2是最长基序,包括48个氨基酸残基。
2.5 组织表达特异性
以根为参考样本,qPCR检测4个 RpMYBs 基因在大黄根、根茎、叶片、叶柄和种子中的表达情况。从图5可以看出, RpMYB2在根中高表达,叶柄中低表达; RpMYB3在种子中表达量最低,但在叶片中表达量为根中的4.39倍;相反的, RpMYB5在叶片中的表达量仅为根中的0.36倍,而在叶柄中表达量高; RpMYB6在根中表达量最高,在其余器官中均较低。
2.6 激素应答分析
分析MYB基因于MeJA、SA、ABA激素处理下不同时间点 (1、3、6、12、24 h) 的应答情况 (图6),以0 h(CK)为对照: RpMYB2受SA诱导,相对表达量随时间推移呈现先下降后上升的变化趋势,同Mock变化趋势一致,且于24 h最高,为CK的3.57倍;MeJA处理1 h、3 h显著上调基因表达;ABA处理1 h显著上调,12 h、24 h受到显著抑制。
RpMYB3受MeJA抑制表达,相对表达量随时间推移呈现先下降后上升的变化趋势,其中1、3、6 h与Mock相比表达量无差异,但于12 h最低,为CK的0.08倍;同样,SA处理12 h显著抑制基因表达;ABA处理24 h显著上调,6 h下调表达。
RpMYB5受SA诱导,相对表达量呈先上升后下降再上升的变化趋势,24 h最高且与Mock相比无明显变化;ABA处理也于24 h显著上调基因表达;MeJA处理1 h显著诱导。
RpMYB6受MeJA诱导,相对表达量随时间推移呈逐渐上升趋势,且于24 h最高,为CK的10.30倍;SA处理3 h显著诱导表达且为CK的21.84倍,ABA处理6 h、12 h、24 h诱导表达,1 h抑制表达。
2.7 非生物胁迫响应
分析掌叶大黄无菌苗于不同胁迫处理下 RpMYBs 基因在不同时间点 (1、3、6、12、24 h) 的响应情况 (图7),以0 h为对照:
RpMYB2受高温胁迫诱导,相对表达量于24 h达峰值,且为CK的5.19倍;损伤胁迫3 h显著诱导,为CK的2.44倍,1 h显著抑制;干旱、低温、盐胁迫表达水平未见明显变化。
RpMYB3受损伤胁迫抑制表达,相对表达量于3 h达谷值,为CK的0.30倍;干旱和低温处理均在24 h受到显著抑制;相反,盐和高温处理均在24 h显著诱导。
RpMYB5受损伤胁迫抑制表达,相对表达量于24 h达谷值,为CK的0.14倍;干旱和高温胁迫均在1 h、24 h诱导表达;盐胁迫于12 h显著抑制;低温胁迫于3 h、6 h抑制表达。
RpMYB6受高温胁迫诱导,相对表达量随时间推移呈先上升后下降再上升的变化趋势,且于24 h达峰值,为CK的4.68倍;受盐、损伤胁迫抑制,均在24 h达谷值,且都为CK的0.09倍;干旱和低温胁迫均在3 h上调表达。
3 讨 论
MYB蛋白是植物生长发育、代谢、防御和应激反应调控网络中的关键因素[24]。鉴于此,对该类基因的研究不断从模式植物向主要农作物、药用植物、园艺植物等方向扩展,包括拟南芥[7]、小麦[25]、丹参[26]、枣树[27]等。本研究利用RT-PCR技术从掌叶大黄中克隆到 RpMYB2、 RpMYB3、 RpMYB5和 RpMYB6的ORF序列,其中 RpMYB2编码跨膜蛋白,可能介导细胞与外界之间的信号转导,并参与细胞膜内外物质、能量及信号的交换[28],其余3个属于非跨膜蛋白。4个目标序列均具有热稳定性和亲水性,对其进行亚细胞定位预测均为核蛋白,推测基因主要在细胞核内行使功能。
进化树分析主要用于基因家族成员分类及进化关系研究,有助于推测亲缘关系密切相关的蛋白家族成员的生物学功能。 RpMYBs 与其他7种植物MYBs的分子进化分析表明,这些MYBs可分为两个亚族,即R1-MYB和R2R3-MYB。其中 RpMYB2和 RpMYB5具有同源性,归属于R1-MYB亚族。 RpMYB2与 GmMYB176关系最近,R1-MYB转录因子 GmMYB176可调节大豆中异黄酮积累增加的关键基因 CHS8基因表达,从而促进异黄酮生物合成[29],推测 RpMYB2可能作用于苯丙烷类生物代谢途径。同时 RpMYB2与 LcMYB2聚在一大支,猜测其可能具有干旱和ABA处理下促进种子萌发和根系生长的功能[30]。 RpMYB5与 OsMYBS1亲缘关系密切,而 OsMYBS1可抑制葡萄糖传导因子HXK1的表达,使ABA活力下降,继而促进种子发芽及幼苗的早期发育[31];类似地, RpMYB3和 RpMYB6具有同源性,并且聚集在R2R3-MYB亚家族。 RpMYB3与 FtMYB15亲缘关系最近,推测其可能一定程度上参与植物花青素合成的调控[32]。 RpMYB6与拟南芥S20亚家族成员 AtMYB62和 AtMYB116聚在一支,可能通过赤霉素信号通路调节磷胁迫反应[33]。然而,4个RpMYBs是否参与调控大黄蒽醌类化合物合成仍有待深入研究。
基因结构是决定基因功能的前提。分析RpMYBs蛋白结构域和保守基序发现,同一亚家族含有相似的结构域和保守基序。R1-MYB类蛋白中所含Motif数量与分布不同,表明R1-MYB类转录因子的空间位置保守性相对较低。而R2R3-MYB类蛋白中Motif类型和分布情况均较为相似,表明其在R2R3-MYB中的分布不具有随机性,但具有较高的保守性,推测其在植物体内发挥核心调控功能。MYB转录因子家族虽在序列特征上相对保守,但在不同物种不同器官中功能呈现多样化。拟南芥中 AtMYB33、 AtMYB65和 AtMYB101可促进花药和花粉发育[34]。 MoMYB53于叶中高表达,参与调控巴戟天子叶中黄酮醇的合成[35]。本研究采用SYBRGreen实时荧光定量PCR方法,测定 RpMYBs基因在1 a生掌叶大黄不同组织中的相对表达量,揭示 RpMYB2、 RpMYB6在根中高表达特性,推测可能通过调控大黄药用部位根的生长发育及次生代谢进而影响大黄药材品质; RpMYB3、 RpMYB5分别在叶片、叶柄中高表达,可能在地上部分的生长发育中发挥着重要的调控作用。叶片直接暴露于大气中,受到阳光和温差变化的影响大,根深埋地下,受到土壤微生态显著影响,这势必导致MYB基因在表达水平做出响应,从而可能在植物适应环境和介导次生代谢产物合成方面发挥重要作用。
MYB类转录因子广泛参与植物对非生物胁迫的响应,如调控生长发育,影响代谢产物的合成和影响激素信号等[36]。拟南芥 AtMYB41通过促进ABA积累参与植物胁迫反应[37]。 CaMYB306通过调控MDA和H2O2含量、ROS清除酶活性及抗性相关基因的表达,负调控辣椒对低温的响应[38]。 MYB96既能通过CBFs途径参与低温反应,又能通过ABA的信号通路调节其抗旱性[39]。本研究结果表明4个大黄 RpMYBs响应激素和非生物胁迫ABA处理导致 RpMYB2表达下调,而高温胁迫下24 h时显著诱导其表达,说明 RpMYB2可能通过ABA信号通路参与高温胁迫应答。MeJA处理 RpMYB6显著上调表达,且受低温、高温胁迫诱导表达。MeJA是植物CBF/DREB1冷胁迫响应途径的早期关键信号[24],而 RpMYB4[20]在MeJA和低温胁迫处理下均下调表达,可能参与MeJA负调控冻害胁迫的耐受过程。 RpMYB2和 RpMYB4可能响应冷胁迫转录调控网络,更好地维持大黄生存,同时也为激素和冷信号通路互相协调传递和响应寒冷信号的作用机制提供了新的理论基础。 RpMYB3受MeJA应答和高温胁迫响应表达趋势一致,均在12 h达谷值后缓慢恢复,可能通过MeJA信号传递正调控高温胁迫应答。 RpMYB5可能通过ABA和SA信号途径共同负调控大黄的机械损伤胁迫防御。 RpMYBs 基因响应激素和非生物胁迫差异表达,表明它们可能通过参与多种生物学过程的调节影响掌叶大黄的生理 代谢。
4 结 论
基于掌叶大黄转录组数据,对掌叶大黄MYB转录因子进行基因克隆、生物信息学研究,并合理预测了其在掌叶大黄中的部分功能,为进一步揭示 RpMYBs 基因功能探究其生理机制奠定基础,也为掌叶大黄蒽醌类成分合成调控及遗传改良提供科学支撑。
参考文献 Reference:
[1] 张椿雨,龙 艳,冯 吉,等.植物基因在转录水平上的调控及其生物学意义 [J].遗 传,2007(7):793-799.
ZHANG CH Y,LONG Y,FENG J,et al.Transcriptional regulation of plant genes and its signifi-cance biology [J].Proceedings of the National Academy of SciencesProceedings of the National Academy of Sciences,2007(7):793-799.
[2] CONE K C,BURR F A,BURR B.Molecular analysis of the maize anthocyanin regulatory locus C1 [J]. Proceedings of the National Academy of Sciences USA,1986,83:9631-5.
[3] ABDULLAH-ZAWAWI M R,AHMAD-NIZAMMUDDIN N F,Govender N,et al.Comparative genome-wide analysis of WRKY,MADS-box and MYB transcription factor families in Arabidopsis and rice [J]. Scientific Reports,2021,11:19678.
[4] 杨敬天,黎 华,赵 欢,等.过路黄MYB转录因子家族成员的挖掘及鉴定 [J].中草药,2022,53(16):5149-5158.
YANG J T,LI H,ZHAO H,et al.Excavation and identification of members of MYB transcription factor family in Lysimachia christinae [J]. Chinese Traditional and Herbal Drugs, 2022,53(16):5149-5158.
[5] 居利香,雷 欣,赵成志,等.辣椒MYB基因家族的鉴定及与辣味关系分析 [J].园艺学报,2020,47(5):875-892.
JU L X,LEI X,ZHAO CH ZH,et al.Identification of MYB family genes and its relationship with pungency of pepper[J]. Acta Horticulturae Sinica ,2022,47(5):875-892.
[6] OGATA K,KANEI-ISHII C,SASAKI M,et al.The cavity in the hydrophobic core of Myb DNA-binding domain is reserved for DNA recognition and trans-activation [J]. Nature Structural and Molecular Biology,1996,3:178-187.
[7] DUBOS C,STRACKE R,GROTEWORD E,et al.MYB transcription factors in Arabidopsis[J].Trends in Plant Science,2010,15:573-581.
[8] ROSINSKI J A,ATCHLEY W R.Molecular evolution of the Myb family of transcription factors:evidence for polyphyletic origin [J]. Journal of Molecular Evolution,1998,46:74-83.
[9] 位欣欣,兰海燕.植物MYB转录因子调控次生代谢及逆境响应的研究进展 [J].生物技术通报,2022,38(8):12-23.
WEI X X,LAN H Y.Advances in the regulation of plant MYB transcription factors in secondary metabolism and stress response [J]. Biotechnology Bulletin ,2022,38(8):12-23.
[10] STRACKE R,ISHIHARA H,HUEP G,et al.Differential regulation of closely related R2R3-MYB transcription factors controls flavonol accumulation in different parts of the Arabidopsis thaliana seedling [J]. Plant Journal, 2007,50:660-677.
[11] RAMALINGAM A,KUDAPA H,PAZHAMALA L T,et al.Gene expression and yeast two-hybrid studies of 1R-MYB transcription factor mediating drought stress response in chickpea(Cicer arietinum L.) [J]. Frontiers in Plant Science,2015,6:1117.
[12] HAO S X,LU Y F,PENG Z,et al. McMYB4 improves temperature adaptation by regulating phenylpropanoid metabolism and hormone signaling in apple[J]. Horticulture Research,2021,8:182.
[13] YANG L,ZHAO X,RAN L Y,et al. PtoMYB156 is involved in negative regulation of phenylpropanoid metabolism and secondary cell wall biosynthesis during wood formation in poplar[J]. Scientific Reports, 2017,7:41209.
[14] PRESTON J,WHEELER J,HEAZLEWOOD J,et al. AtMYB32 is required for normal pollen development in Arabidopsis thaliana [J]. Plant Journal,2004,40:979-995.
[15] 国家药典委员会. 中华人民共和国药典:一部[M]. 北京:中国医药科技出版社, 2020.
Chinese Pharmacopoeia Commission.Pharmacopoeia of the Peoples Republic of China[M]. Beijing:China Pharmaceutical Science and Technology Press,2020.
[16] 陈艳琰,唐于平,陈嘉倩,等.大黄资源化学研究进展与利用策略 [J].中草药,2018,49(21):5170-5178.
CHEN Y Y,TANG Y P,CHEN J Q,et al.Research progress and utilization strategy on resource chemistry of Rhei Radix et Rhizoma[J]. Chinese Traditional and Herbal Drugs, 2018,49:5170-5178.
[17] DONG N Q,LIN H X,Contribution of phenylpropanoid metabolism to plant development and plant-environment interactions [J]. Journal of Integrative Plant Biology,2021,63:180-209.
[18] PERASSOLO M,QUEVEDO C,BUSTO V,et al.Enhance of anthraquinone production by effect of praline and aminoindan-2-phosphonic acid in Rubia linctorum suspension cultures [J]. Enzyme and Microbial Technology,2007,41:181-185.
[19] 李元敏.掌叶大黄MYB转录因子基因克隆与特征研究 [D].陕西咸阳:陕西中医药大学,2021.
LI Y M.Cloning and characterization of MYB transcription factor gene in Rheum palmatum L [D].Xianyang Shaanxi:Shaanxi University of Chinese Medicine,2021.
[20] 黑小斌,李依民,李 欢,等.掌叶大黄种子特性研究及无菌培养体系的构建[J].中草药,2019,50(18):4430-4437.
HEI X B,LI Y M,LI H,et al.Investigation on seeds characteristics and establishment of aseptic cultural system for Rheum palmatum [J]. Chinese Traditional and Herbal Drugs ,2019,50(18):4430-4437.
[21] 李元敏,张 娜,李 慧,等.掌叶大黄转录因子 RpMYB4基因克隆及分子表达特性 [J].药学学报,2021,56(4):1170-1177.
LI Y M,ZHANG N,LI H,et al.Cloning and expression characteristics of a transcription factor gene RpMYB4 in Rheum palmatum L.[J]. Acta Pharmaceutica Sinica, 2021,56(4):1170-1177.
[22] 王宁杭,陆丹迎,常鹏杰,等.望春玉兰实时定量PCR分析中内参基因的筛选 [J].分子植物育种,2019,17(11):3674-3680.
WANG N H,LU D Y,CHANG P J,et al.Selection of internal reference genes in real-time quantitative PCR analysis of Magnolia biondii[J]. Molecular Plant Breeding,2019,17(11):3674-3680.
[23] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using realtime quantitative PCR and the 2-CT method [J]. Methods,2001,25:402-408.
[24] 邱文怡,王诗雨,李晓芳,等.MYB转录因子参与植物非生物胁迫响应与植物激素应答的研究进展 [J].浙江农业学报,2020,32(7):1317-1328.
QIU W Y,WANG SH Y,LI X F,et al.Functions of plant MYB transcription factors in response to abiotic stress and plant hormones [J]. Acta Agriculturae Zhejiangensis, 2020,32(7):1317-1328.
[25] 王延谦,张 波,陈文杰,等.小麦R2R3-MYB转录因子 TaMYB3-4D的克隆及功能分析 [J].西北植物学报,2015,35(4):646-652.
WANG Y Q,ZHANG B,CHEN W J,et al.Cloning and functional verification of R2R3-MYB transcription factor TaMYB3-4D in wheat[J]. Acta Botanica Boreali-Occidentalia Sinica,2015,35(4):646-652.
[26] 彭晶晶,李 凯,杨 靖,等.丹参转录因子SmMYB52的基因克隆、表达分析和亚细胞定位 [J].基因组学与应用生物学,2021,40(2):802-808.
PENG J J,LI K,YANG J,et al.Gene clone, expression analysis and subcellular localization of transcription factor SmMYB52 in Salvia miltiorrhiza [J]. Genomics and Applied Biology,2021,40(2):802-808.
[27] 王军晓,李 婷,马志博,等.枣树MYB基因家族鉴定、果实表达和盐胁迫响应研究 [J].西北林学院学报,2022, 37(2):20-28,36.
WANG J X,LI T,MA ZH B,et al.Identification,fruitexpression and response to salt stress of MYB gene family in Ziziphus jujuba [J]. Journal of Northwest Forestry University, 2022,37(2):20-28,36.
[28] 宋江华,张立新.植物跨膜蛋白研究进展 [J].生物学杂志,2009,26(6):62-64.
SONG J H,ZHANG L X.Progress on the transmembrane protein in plants [J]. Journal of Biology, 2009,26(6):62-64.
[29] LI X Y,DHAUBHADEL S.14-3-3 proteins act as scaffolds for GmMYB62 and GmMYB176 and regulate their intracellular localization in soybean [J]. Plant Signaling and Behavior,2012,7:965-968.
[30] ZHAO P C,HOU S L,GUO X F,et al.A MYB-related transcription factor from sheepgrass, LcMYB2,promotes seed germination and root growth under drought stress [J]. BMC Plant Biology,2019,19:564.
[31] CHEN Y S,CHAO Y C,TSENG T W,et al.Two MYB-related transcription factors play opposite roles in sugar signaling in Arabidopsis [J]. Plant Molecular Biology,2017,93:299-311.
[32] ZHANG K X,LOGACHEVA M D,MENG Y,et al.Jasmonate-responsive MYB factors spatially repress rutin biosynthesis in Fagopyrum tataricum [J]. Journal of Experimental Botany,2018,69:1955-1966.
[33] DEVAIAH B N,MADHUVANTHI R,KARTHIKEYAN A S,et al.Phosphate starvation responses and gibberellic acid biosynthesis are regulated by the MYB62 transcription factor in Arabidopsis [J]. Molecular Plant,2009,2:43-58.
[34] COSTACHE A,BERGHI ON,CERGAN R,et al.Respiratory allergies:Salicaceae sensitization (Review) [J]. Experimental and Therapeutic Medicine,2021,21(6):609.
[35] 谢德金,叶友杰,杨德明,等.基于巴戟天转录组数据的R2R3-MYB转录因子的鉴定和分析 [J].药学学报,2020,55(1):160-167.
XIE D J,YE Y J,YANG D M,et al.Identification and analysis of the R2R3-MYB transcription factor based on a transcriptome database in Morinda officinalis [J]. Acta Pharmaceutica Sinica ,2020,55(1):160-167.
[36] 杜恬恬,李会萍,王博雅,等.梁山慈竹 DfMYB3基因克隆及启动子分析 [J].植物研究,2021,41(5):729-737.
DU T T,LI H P,WANG B Y,et al.Cloning and promotor analysis of DfMYB3 from Dendrocalamus farinosus [J]. Bulletin of Botanical Research, 2021,41(5):729-737.
[37] LIPPOLD F,SANCHEZ D H,MUSIALAK M,et al. AtMYB41 regulates transcriptional and metabolic responses to osmotic stress in Arabidopsis [J]. Plant Physiology,2009,149:1761-72.
[38] MA X,YU Y N,JIA J H,et al.The pepper MYB transcription factor CaMYB306 accelerates fruit coloration and negatively regulates cold resistance [J]. Scientia Horticulturae,2022,295:110892.
[39] LEE H G,SEO P J. MYB96 recruits the HDA15 protein to suppress negative regulators of ABA signaling in Arabidopsis [J]. Nature Communications,2019,10:1713.
Molecular Cloning and Stress Expression of Four MYB
Transcription Factors in Rheum palmatum
ZHAO Xia1,2, LI Yuanmin1,3, LI Yimin1,2, HU Xiaochen1,2, GAO Jing1,2, YAN Yonggang1,2 and ZHANG Gang1,2
(1.College of Pharmacy and Shaanxi Qinling Application Development and Engineering Center of Chinese Herbal
Medicine,Shaanxi University of Chinese Medicine, Xian 712046, China; 2.Key Laboratory for Research and
Development of “Qin Medicine” of Shaanxi Administration of Traditional Chinese Medicine, Shaanxi
University of Chinese Medicine, Xian 712046,China; 3.The Second Affiliated Hospital
of Shaanxi University of Chinese Medicine, Xian 712046, China)
Abstract In this study,we searched the transcriptome database to obtain the sequence information of four MYB gene family members, RpMYB2, RpMYB3, RpMYB5 and RpMYB6 genes. The corresponding physicochemical properties, phylogenetic relationships, tissue-specific expression, and induced expression under hormonal and abiotic stresses were analyzed. The results showed that RpMYB2, RpMYB3, RpMYB5 and RpMYB6 encoded 333, 275, 293 and 291 amino acids with molecular masses of 34.781, 30.525, 31.243 and 33.313 ku, respectively, and the four RpMYBs proteins were all hydrophilic proteins with high thermal stability, except for RpMYB2. The remaining three gene structures were mainly α-helix and randomly coiled, and all of them were localized in the nucleus. Analysis of the protein structural domains and conserved motifs revealed that RpMYB2 and RpMYB5 contained one HTH-MYB structural domain, and RpMYB3 and RpMYB6 contained two HTH-MYB structural domains, and there were differences in the number and types of conserved elements contained in different MYB transcription factors. Phylogenetic analysis showed that RpMYB2 and RpMYB5 belonged to the R1-MYB subfamily, and RpMYB3 and RpMYB6 belonged to the R2R3-MYB subfamily, consistent with their structural domain classification. The protein structural domains and phylogenetic trees consistently indicated that RpMYB2 and RpMYB5 belonged to the R1-MYB subfamily, and RpMYB3 and RpMYB6 belonged to the R2R3-MYB subfamily. Real-time fluorescence quantification revealed that RpMYB2 and RpMYB6 were the most highly expressed in roots, and RpMYB3 and RpMYB5 were highly expressed in leaves and petioles. Respectively, RpMYB5 peaked at 24 h when treated with 200 μmol·L-1 abscisic acid (ABA). The highest expression of RpMYB6 was induced by 200 μmol·L-1 methyl jasmonate (MeJA), and the expression level increased gradually with time and was 10.30 times higher at 24 h than at 0 h, and inhibited RpMYB3 expression. 200 μmol·L-1 salicylic acid (SA) induced the most pronounced expression of RpMYB6 at 21.84 fold. The expression of RpMYBs also varied under abiotic stress treatments. RpMYB2 was induced by high temperature. RpMYB3 was inhibited by damage and high temperature. RpMYB5 was inhibited by damage stress. RpMYB6 responded to high temperature and salt stress response. This study provides a foundation for the functional identification of RpMYBs , which will be useful for the development of germplasm innovation and molecular breeding of R. palmatum L.
Key words Rheum palmatum; MYB; Expression analysis; Stress; qRT-PCR
Received 2023-01-05 Returned 2023-03-07
Foundation item National Natural Science Foundation of China(No.82104334,No.81973430); Middle Youth Science and Technology Innovation Leaders of Xianyang Municipality (No.L2022CXNLRC009);Project for Discipline Innovation Team of Shaanxi University of Traditional Chinese Medicine(No.2019-QN01).
First author ZHAO Xia, female,master student.Research area:molecular biopharmacology. E-mail:2443284316@qq.com
LI Yuanmin, female,master student.Research area:molecular biopharmacology.E-mail:1272151264@qq.com
Corresponding author ZHANG Gang,male,professor.Research area:molecular biopharmacology. E-mail:jay_gumling2003@aliyun.com
LI Yimin,female,associate professor.Research area:molecular biopharmacology.E-mail:2051058@sntcm.edu.cn
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)

