基于“证据推理与模型认知”的硅及其化合物教学设计
蔡晴 黄昊文
[摘 要]文章基于元素周期表与元素周期律,探讨硅及其化合物的性质。通过实验证实,构建观点、结论和证据之间的逻辑关系;从材料的角度引导学生建立原子结构、元素位置、元素性质、物质性质、物质用途之间的关联,培养学生的“证据推理与模型认知”核心素养。
[关键词]硅及其化合物;证据推理;模型认知;教学设计
[中图分类号] G633.8 [文献标识码] A [文章编号] 1674-6058(2024)14-0077-04
高中化学教学的目标之一是培养学生的核心素养,其中“证据推理与模型认知”是化学学科核心素养的重要组成部分,强调学生应具有证据意识,能基于证据对物质组成、结构及其变化提出可能的假设[1]。这也是化学思维的特点之一。硅作为元素周期表中第三周期第ⅣA族的元素,位于金属元素和非金属元素的分界线上,既具有一般性质,也有着自身的特性[2]。硅、铝位于同周期,金属与非金属的交界处,性质具有一定的相似之处,基于位置分析进行类比,由此得出硅可能具有的化学性质[3]。本文以硅及其化合物为例,结合元素周期表和元素周期律,运用学生已学的元素化合物知识和方法,引导学生进行预测、寻找证据,基于证据加以分析推理,并逐步建立认知模型,从而提高学生的“证据推理与模型认知”核心素养。
一、学情分析
学生已经学习了钠、氯、铁、硫、氮等元素的单质及其化合物的性质,掌握了原子结构的知识;知道元素周期表和元素周期律。因此,可基于元素周期律对硅及其化合物的性质进行预测,再通过实验进行验证。硅作为无机非金属材料的关键元素,在社会发展中具有重要地位。因此,可通过建立“位置—结构—性质”“结构—性质—用途”之间的关联,帮助学生建构元素化合物的认知模型[4]。
二、教学目标与教学思路
(一)教学目标
依据课标对“无机非金属材料”这一主题的学业要求,制订以下教学目标:
1.通过阅读讨论,了解身边的含硅材料;通过已有知识搭建解决陌生问题的桥梁,类比碳、预测硅,形成元素化合物知识的学习思路。
2.通过二氧化硅与氢氧化钠的实验以及玻璃片与氢氧化钠反应的具体操作,培养动手能力和实验观察能力。
3.通过三维认知模型的建构,对所学知识进行再梳理,同时逐级建构“结构—性质—用途”模型,发展“证据推理与模型认知”核心素养。
4.结合身边实例,感受化学就在身边并且正不断帮助人们解决问题,提高学习化学的自信心和民族自豪感。
(二)教学思路
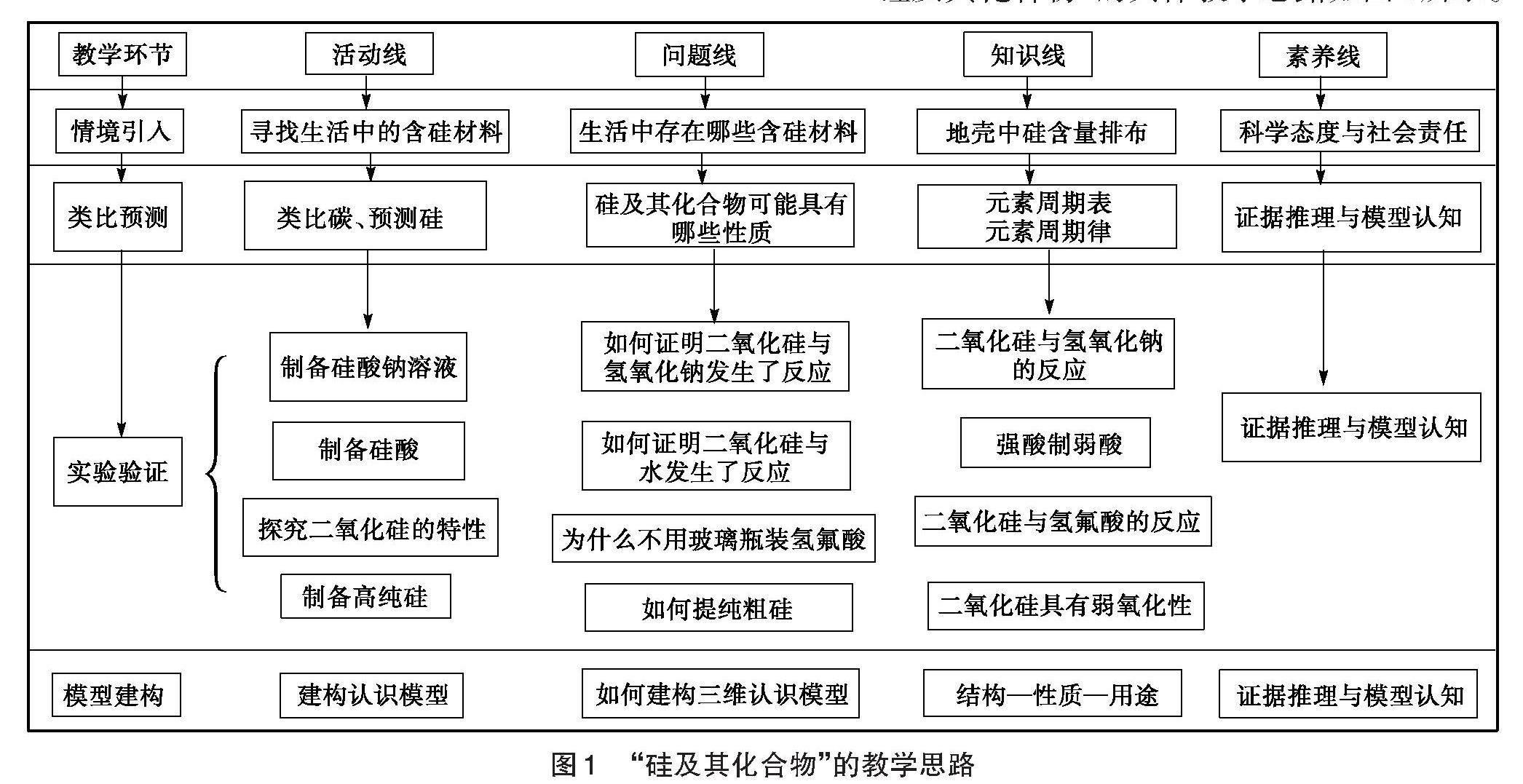
“硅及其化合物”的具体教学思路如图1所示。
图1 “硅及其化合物”的教学思路
三、教学实践过程
(一)情境引入
【引入】日常生活中,我们身边几乎都有硅的存在。比如石头、沙滩、砖头、道路等,这些都是二氧化硅的衍生物,通常被称为无机硅酸盐。在地壳中,硅元素的含量仅次于氧元素,约占27%。可以说,我们生活的世界基本上是由硅元素和氧元素构成的。请大家想一想,除了上述例子,还有哪些含硅的材料?请同学们分组合作,收集资料并以图片形式展示。
设计意图:通过收集资料和展示图片,使学生认识到从不同的角度看待相同的物品会带来不同的体验;通过预先查阅相关资料和整理信息,培养学生的信息处理能力,并让他们认识到化学对我们的生活和社会发展起到重要的作用,从而增强他们的社会责任感,激发他们的学习热情。
(二)类比预测
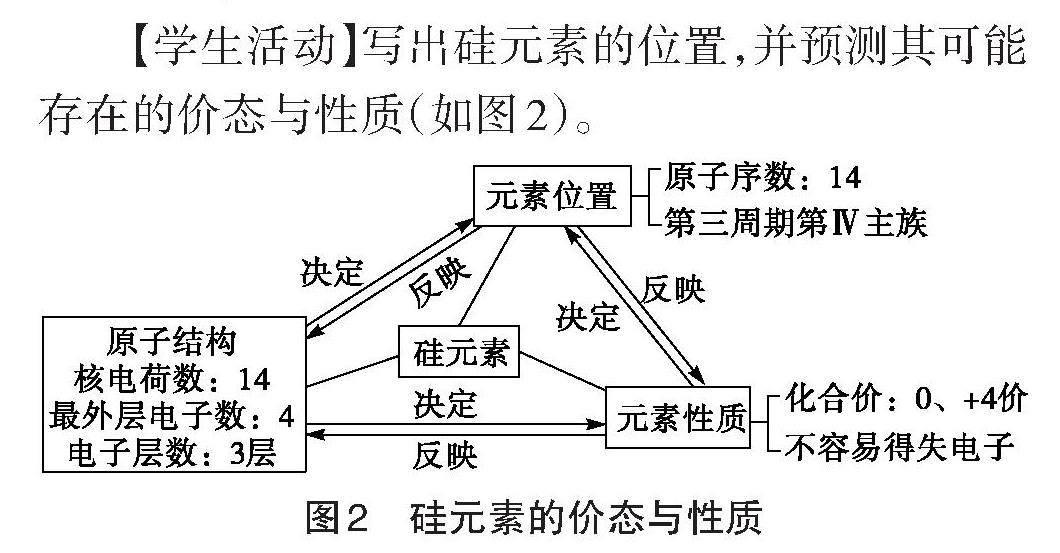
【教师活动】请学生写出硅元素在元素周期表中的位置,并预测硅元素可能具有的价态和性质。
【学生活动】写出硅元素的位置,并预测其可能存在的价态与性质(如图2)。
图2 硅元素的价态与性质
【教师引导】我们知道同主族、同周期元素之间存在一定的规律。如果让你来预测硅元素可能具有的性质,你会类比哪种元素?试着预测硅元素的化学性质,并解释预测依据。
【学生活动】思考并进行预测。
设计意图:结合课标要求“能利用元素在元素周期表中的位置和原子结构,分析、预测、比较元素及其化合物的性质”[5],设计渐进性问题,使学生能够根据所学知识和已有证据预测硅的性质,进一步让学生把握元素化合物的认知模型。
(三)实验验证
1.制备硅酸钠溶液
【PPT展示】展示自然界中的二氧化硅。结晶:石英、水晶、玛瑙、沙子;无定形:硅藻土。
【教师活动】引导学生从物质类别、价态、结构角度预测二氧化硅的性质。提问:二氧化硅的微观结构会是怎样的?
【学生活动】思考分析,猜测二氧化硅的微观结构。
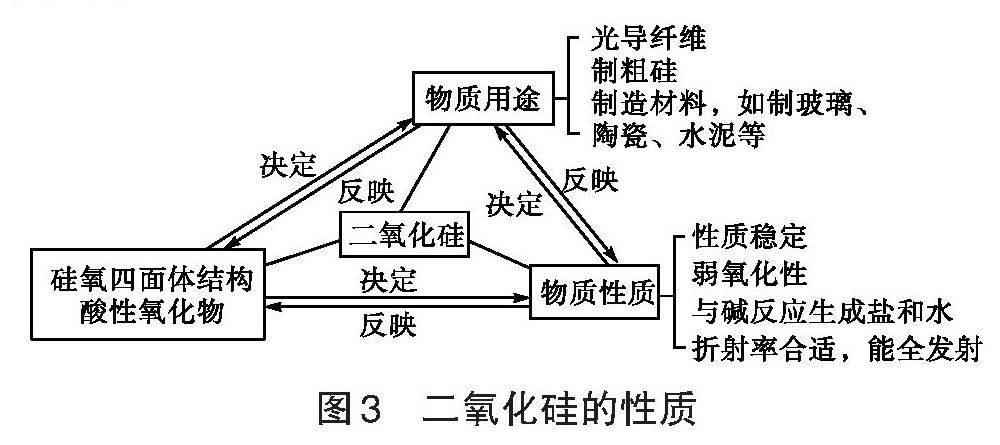
【教师活动】展示二氧化硅的微观结构。提问:二氧化硅的硅氧四面体结构与金刚石的立体网状空间结构相似,这种硅氧四面体结构决定了二氧化硅具有哪些性质?
【学生活动】思考得出:二氧化硅具有性质稳定、硬度大、难溶于水、耐高温、耐腐蚀等性质(如图3)。
图3 二氧化硅的性质
【过渡】新鞋子的包装盒里常会放有一小包硅胶干燥剂。
【教师活动】硅酸通过处理能成为硅胶,那如何制备硅酸呢?
【学生活动】基于预测内容,提出方案。
【学生1】二氧化硅和水反应生成硅酸。
【学生2】先利用二氧化硅和氢氧化钠反应生成硅酸钠,再利用硅酸钠和盐酸反应生成硅酸。
【教师活动】补充信息,评估学生方案的可行性。引导学生从实验中获取证据。提问:根据大家的预测,二氧化硅属于酸性氧化物,可与碱反应生成盐和水。如何证明SiO2+2NaOH=Na2SiO3+H2O反应的发生?
【学生活动】思考并回答。
【学生1】从生成物角度看是否有硅酸钠生成。
【学生2】从反应物角度看二氧化硅是否溶解。
【学生3】从反应物角度看氢氧化钠是否被消耗。
【教师活动】进行实验演示,让学生观察实验结果。
设计意图:从生成物生成与反应物被消耗两个角度引导学生思考证明化学反应发生的方法,并归纳总结,建构证明反应发生的认知模型。
【教师活动】展示装有盐酸的玻璃瓶与装有氢氧化钠溶液的玻璃瓶。提问:为什么氢氧化钠溶液可以用玻璃瓶盛放却不能用玻璃塞?
【学生活动】观察到装有氢氧化钠溶液的玻璃瓶用的是橡胶塞,而装盐酸的玻璃瓶用的是玻璃塞。思考并回答可能的原因。
【教师活动】实验演示:将两块涂有氢氧化钠溶液的玻璃片合在一起。
【学生活动】发现要分开玻璃片有些困难。
【教师活动】提问:说明新生成的硅酸钠具有什么性质?
【学生活动】思考得出:硅酸钠具有粘性。
设计意图:以实验验证的方式,从不同观察角度帮助学生掌握二氧化硅的化学性质,提高学生的实验能力。同时,通过具体操作,加深学生对不同物质之间的相互作用的理解,并进一步认识到二氧化硅的具体应用。
2.制备硅酸
【展示资料】
①强酸可以制备弱酸(强弱是相对关系)。
②同浓度酸性强弱:HCl>H2CO3>H2SiO3。
【教师活动】请学生根据已有资料设计实验方案,利用硅酸钠制备硅酸。
【学生活动】设计实验方案:往硅酸钠溶液中通二氧化碳或者加入盐酸来制备硅酸。
【教师活动】演示实验:在充满CO2的矿泉水瓶中注入少量饱和硅酸钠溶液,拧紧瓶盖并振荡,观察现象。
设计意图:根据资料设计实验方案,培养学生的信息阅读、方案设计、信息内化的能力,引导学生逐步掌握强酸制弱酸的方法。
3.探究二氧化硅的特性
【展示】用塑料瓶装氢氟酸。
【教师活动】提问:为什么不用玻璃瓶装氢氟酸?
【学生活动】根据前面已有的经验,能够快速得出:氢氟酸会与玻璃反应,而且反应进行得很快。
【教师活动】板书:SiO2+4HF=SiF4+2H2O,因此我们可以用氢氟酸来刻蚀玻璃。
设计意图:通过探索,让学生明白碳与硅因为原子结构相似,存在着很多通性,但每个物质均存在自己的特性。通过实例展示氢氟酸不能用玻璃瓶装,让学生明白物质性质决定用途,用途反映性质。
4.制备高纯硅
【过渡】我们知道硅在自然界中以硅酸盐、氧化物的形式存在。自然界中为什么没有硅单质存在呢?请分析硅在元素周期表中的位置,推测硅可能具有的性质以及用途。
【学生活动】思考得出:硅是一种亲氧元素,位于金属与非金属的交界处,导电性介于导体和绝缘体之间,可用作半导体、芯片、太阳能电池板等(如图4)。
图4 硅的用途
【过渡】2023年8月29日,华为Mate 60 Pro突然发售,大家知道这意味着什么吗?意味着中国半导体行业反击的开始,手机、服务器、显卡、芯片等全面国产化。芯片的制作过程大致分为三个步骤:沙子制备高纯硅、高纯硅制备硅晶圆、硅晶圆刻录成芯片。
【教师活动】沙子制备高纯硅,也就是从+4价的二氧化硅到0价的硅单质,怎么实现?选择哪种还原剂?反应条件是什么?
【学生活动】不断思考,逐步得出:根据二氧化硅的价态变化,推出需加入具有还原性的物质,如焦炭、一氧化碳、氢气、氨气、活泼金属等。从经济效益的角度,会选择焦炭,而二氧化硅的结构为立体网状结构,比较稳定,因此要在高温条件下进行。
【过渡】此时获得的硅并不纯净,里面还含有铁、铝、碳等杂质,我们把它称为粗硅,硅含量为98%左右,但制备芯片的硅含量要求为99.99999999%,甚至更高。那么如何提纯呢?
【学生活动】回忆除杂原理、方法,展开讨论。
【教师活动】提示:当遇到杂质很难除的时候,我们可以逆向思维,先把目标物质提取出来,即让硅和氯化氢气体在300 ℃下反应生成三氯硅烷和氢气,再把三氯硅烷中的硅还原为硅单质。你会选择哪种还原剂?为什么?
【学生活动】思考不同还原剂之间的区别:如果使用焦炭,会引入新的杂质,而使用氢气则无影响。
【教师活动】将高纯硅直拉得到硅棒,硅棒经过切割变成硅晶圆,硅晶圆想变成芯片还需要进行光刻等操作,而这是我们国家一直被“卡脖子”的领域。华为Mate 60 Pro的发售意味着这一问题的解决,这对中国半导体产业来说,有着重要的里程碑意义。
设计意图:紧跟时事——芯片国产化的实现,极大地增强学生的民族自豪感,让学生明白化学与工业生产、生活息息相关。从沙子到高纯硅,用的是转化目标物质的方法对固体物质进行提纯,有助于拓宽学生物质提纯的思路。
(四)课堂小结
【过渡】请同学们用价-类二维图小结知识,建立“位置—结构—性质”“结构—性质—用途”之间的关联,从而建构元素化合物的认知模型[6]。
设计意图:引导学生进一步完善“位置—结构—性质”模型,加深学生对硅及其化合物知识的认识,同时激发学生的学习兴趣,培养学生的化学学科核心素养。
四、教学反思
本教学设计旨在基于元素周期表和元素周期律,引导学生进行证据推理和建立认知模型,以提升学生的化学学科核心素养。通过类比思维和实验验证,学生不仅掌握了硅及其化合物的性质,还培养了“证据推理与模型认知”核心素养。此外,本教学设计还紧跟时事,引出了中国半导体产业的重要发展,增强了学生的民族自豪感。通过本课程的学习,学生能够更深入地理解硅及其化合物,同时提高自身的科学素养和综合能力。
[ 参 考 文 献 ]
[1][5] 中华人民共和国教育部.普通高中化学课程标准:2017年版2020年修订[M].北京:人民教育出版社,2020.
[2] 叶跃娟,林海斌.高中化学新教材中铝和硅元素的知识编排及教学逻辑[J].化学教学,2021(4):87-92.
[3] 胡俊洲.“硫、氮和硅元素及其化合物”的“位、构、性”教学模型[J].中学化学教学参考,2023(2):8-11.
[4][6] 王磊,陈光巨,曹居东.普通高中教科书化学必修第二册教师用书[M].济南:山东科学技术出版社,2019.
(责任编辑 罗 艳)

