高中化学课堂“问题式”教学案例


一、教学内容
本单元属于人教版必修第二册的第六章,紧密联系《普通高中化学课程标准(2017年版2020年修订)》的具体要求,集中体现了对学生“宏观辨识与微观探析化学”核心素养的高度重视。本章的开篇即通过化学键的断裂与形成,揭示了化学能向热能转化的过程,之后讲解了原电池的工作原理。第二节以牛奶变质、爆炸、钢桥生锈为例,渗透了化学反应速率的知识点。
二、“问题式”设计思路
“问题式”教学作为以问题为核心的教育方法,将问题置于整个学习过程的中心,借此引发学生的好奇心。在这一教学模式下,教师精心设计如珠链般相扣的问题,帮助学生在探求问题答案的过程中,逐步建立知识之间的联系,完成从未知到已知、从简单到复杂的学习路径。
三、学情分析
高一学生已通过初中及高中早期课程熟悉了化学反应的基本概念,能够从元素的角度加以分类,为其学习本课提供了理论基础。学生虽然初步了解了宏观层面的物质变化,但不清楚如何应对复杂化学反应机理,对电子定向移动产生电流等微观现象的理解尚需加强,并在实验中难以实现精准操作,需要引起教师的广泛重视。
四、教学目标
1.通过实践操作与理论探究相结合的方式,养成物质变化伴随能量变化的系统观念。
2.运用宏观观察与微观分析的方法,从“反应物与生成物的能量变化”及“化学键的断裂与形成”两个维度全面理解化学反应中能量转化的原理。
3.通过原电池的构造与工作原理的学习,树立运用科学模型的意识,进一步激发科学探究的热情。
4.借助多样化的信息来源,全面了解人类如何利用化学反应中的能量变化。
五、教学过程
第一课时:氧化还原反应的微观视角与能量变化
1.能量变化探究
师:大家看看我们的长征火箭成功发射升空的壮观场景。这一刻,有什么特别的化学反应发生了吗?
生:火箭发射时产生了巨大的推力和火焰,应该是燃烧反应。
师:正确!火箭燃料的燃烧是一个典型的化学反应,伴随着能量的大量释放。接下来,我们将混合氢气和氯气,观察它们反应生成盐酸的过程,在这个反应中,能量是如何转化的呢?(准备氢气和氯气,提醒安全措施,演示化学反应)。
生:反应发生得很快,释放了很多热,化学能转化成了热能。
师:在微观层面,氢气和氯气反应时发生了什么变化?
生:氢气和氯气的分子之间的化学键断裂了,然后氢原子和氯原子重新结合形成了盐酸分子。
师:精确地说,这个过程中旧的化学键断裂,新的化学键形成。在这一过程中,能量如何变化呢?我们来分析一下。(如图1)
师:当新的化学键形成时,释放的能量多于断裂旧键时所需的能量,因此整个反应是放热的。这背后的原理正是我们熟悉的能量守恒定律。
(设计意图:教师利用“问题式”学习引领学生通过实际操作和观察,深刻理解化学反应中能量变化的本质。教师提出问题,激发学生的好奇心,促使其思考、探索并找到问题的答案,进而培养他们的科学探究能力、批判性思维。)
2.能量变化的应用与讨论
师:大家知道自热火锅是如何工作的吗?自热火锅的钙氧化物与水反应生成热量的过程是一个放热的过程,为火锅提供了所需的热量。这个例子告诉我们什么?
生:说明我们可以通过设计特定的化学反应来满足实际生活中的需要。
师:正是这样,化学反应中的能量变化在我们的日常生活中有着广泛的应用。大家有没有关注过能源问题?
生:能源问题一直是个大难题,既然化学反应能转化能量形式,是不是意味着我们可以通过化学反应来开发新能源呢?
师:非常棒,实际上,化学反应对于新能源开发来说至关重要。例如,通过水的电解,我们可以获得氢气——干净的未来能源。同样,太阳能电池板将光能转化为电能的过程也涉及一系列化学反应。
第二课时:构建氧化还原反应认识模型
师:谁能告诉我“天宫”空间站需要哪种能源来维持运作?
生:空间站需要电能来维持运作。
师:太阳翼上安装有大量的太阳能电池板,它们由高效率的多晶硅或单晶硅材料制成,能在极端的太空环境中稳定工作。在地球上,我们如何利用原电池呢?
生:通过化学反应产生电能?
师:对,原电池通过氧化还原反应将化学能转化为电能。其实这一反应在我们的生活中无处不在,比如自然界的生物呼吸过程,甚至是你们日常使用的电池。让我们先来了解一下什么是氧化剂和还原剂。
生:氧化剂是获得电子的物质,还原剂是失去电子的物质。
师:非常好!这是氧化还原反应的核心。现在,我们用一个简单的实验来观察氧化还原反应——铜丝放入含有硫酸铜溶液的试管中会发生什么?(演示实验:Cu+2AgNO3===Cu(NO3)2+2Ag)
生:铜丝的表面有铜沉积。
师:铜丝表面的铜沉积是因为铜离子获得电子还原,而铜丝本身失去电子被氧化。让我们讨论一下原电池是怎么工作的?为什么它能产生电能?
生:原电池中的化学反应使一端积累了负电荷,另一端积累了正电荷,产生了电位差,从而产生了电流。
师:非常棒!这个电位差正是由于化学反应中的氧化剂和还原剂电子转移造成的。(板书:锌作为还原剂被氧化,而铜(II)离子作为氧化剂被还原)最后让我们探讨一下生活中都有哪些常见的化学电池,以及它们是如何工作的?
生:比如我们手机中的锂离子电池。
师:正是,锂离子电池通过锂离子在阳极和阴极之间的移动来工作,这也是一种氧化还原反应的应用。
(设计意图:通过“问题式”学习深化学生对氧化还原反应的理解,特别是铜丝放入硫酸铜溶液这一具体实验的探讨,引导学生从实际现象出发,逐步探索、发现背后的化学原理,促使其主动思考、积极寻找答案。)
第三课时:化学反应速率及化学限度
1.化学反应速率探究
师:谁能告诉我什么是化学反应速率?
生:指化学反应发生的快慢,或者说单位时间内反应物的消耗或生成物的产生量。
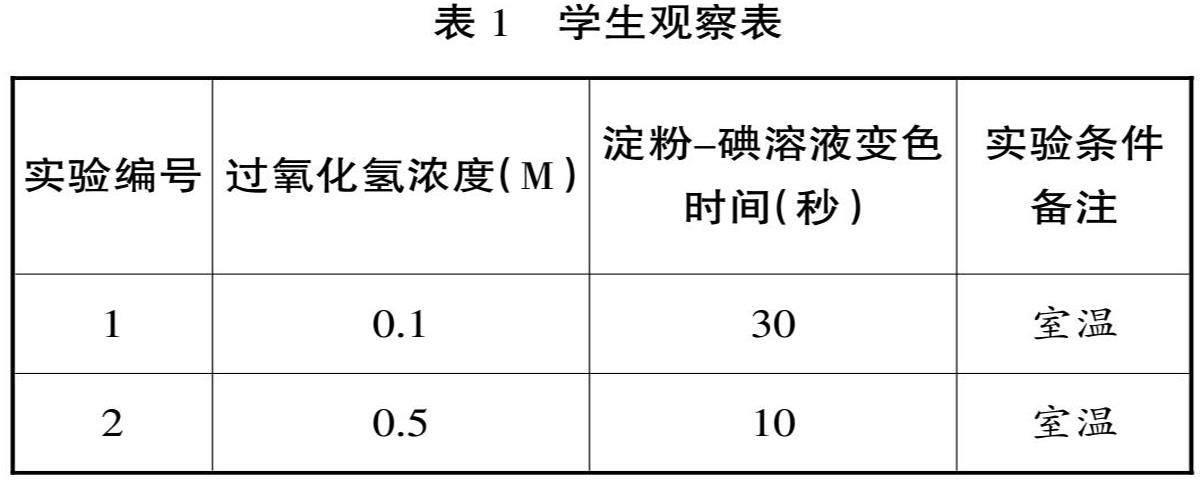
师:那么我们怎么可以直观地观察到这一点呢?我们来进行一个实验:向溶有碘化钾的淀粉溶液中滴入少量的过氧化氢。
实验步骤:
①在一个试管中加入10mL的碘化钾溶液和5mL的淀粉溶液,再加入几滴硫酸溶液作为催化剂。
②准备两个试管,分别加入5mL的0.1M和0.5M过氧化氢溶液。
③将过氧化氢溶液从两个试管中分别滴加到含碘化钾和淀粉的试管中,同时开始计时。
④观察并记录溶液颜色变化的时间,从溶液开始变色到完全变成深蓝色所需的时间。
生:溶液的颜色变了,这是因为过氧化氢溶液和碘化钾反应生成了碘,和淀粉反应产生了蓝色复合物。
师:如果改变反应物的浓度或温度,会发生什么呢?
生:反应速率可能会变化。比如,增加反应物浓度或提高温度可能会使反应速率加快。
师:在接下来的实验中,我们将改变过氧化氢的浓度,并观察颜色变化的速度。(准备不同浓度的过氧化氢溶液,重复实验并填写如表1的观察表)
生:看起来高浓度的过氧化氢反应速度更快,颜色变化也更快。
师:非常好,这说明了什么?
生:说明反应物浓度越高,提供的反应分子越多,碰撞的机会也就越多,从而加快了反应速率。
(设计意图:利用“问题式”学习探究化学反应速率,鼓励学生通过观察、思考和实验来主动学习化学知识,帮助学生建立对化学反应速率的直观认识和深刻理解,同时培养其科学探究能力和实验技能。)
2.化学限度的理解与应用
师:有人能告诉我化学反应限度意味着什么吗?
生:是不是指反应不能无限进行下去,最终会到达一个平衡状态,反应物和生成物的比例不再改变?
师:化学反应限度指的是反应在特定条件下能达到的最大转化程度。让我们来开展实验(板书方程式:AgNO3+HCl=AgCl↓+HNO3,演示实验:向含有硝酸银的溶液中滴加盐酸,观察沉淀的形成)。
生:随着反应的进行,沉淀的形成似乎停止了。
师:当我们看到沉淀不再增加时,意味着反应物之一已经完全消耗,反应达到了它的限度。如果我们想要控制这个反应的速率,可以采取哪些办法?
生:我们可以通过改变温度,使用冷热水浴来调节反应速率,或调整反应物的浓度,浓度高的可能会加快反应速率。(自主探究,完成实验填写表2)
师:化学反应的限度对于确保化学工程的效率和安全性至关重要。了解反应何时达到限度可以帮助我们更有效地设计化学过程和控制产品质量。
六、教学反思
在实践操作与理论探究结合的过程中,学生对化学反应中的能量变化、反应速率以及化学限度等核心概念有了更深入的理解。尤其在实验环节,学生通过观察、记录、分析实验现象,其科学探究能力和批判性思维均有所强化。然而,在实施过程中,我发现部分学生在初次面对复杂实验操作时有一些紧张,对此,教师需要详细指导,增加学生的操作信心。
(作者单位:宁县第一中学)
编辑:李琴芳
作者简介:罗莹(1986—),女,汉族,甘肃庆阳人,职称:中学一级,研究方向:课程思政视角下的高中化学教学。

