黄芪(药材及饮片)微生物污染菌的初步研究
白雯静 王海峰


【摘 要】 目的:对黄芪原药材以及加工后的微生物污染情况进行分析和研究,探讨药材(饮片)微生物污染的主要来源。 方法: 参照2015年版《中国药典》四部通则1105、1106的方法,并结合传统生化和基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)对纯化的菌落进行鉴定。最后,运用SPSS 18.0软件对数据进行进一步地统计和分析。 结果: 黄芪原药材(饮片)在经过100℃、30min热处理后,需氧菌总数呈现均匀性地下降,简单芽孢杆菌、成团泛菌、屎肠球菌、阴沟肠杆菌为黄芪原药材及饮片污染概率较高的菌。 结论: 黄芪药材(饮片)污染菌中肠杆菌科占44%,芽孢菌科占41%。耐热菌鉴定结果显示均为芽孢杆菌。在确保安全和疗效的前提下,对芽孢杆菌的杀灭十分有必要。
【关键词】 黄芪; 基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS); 微生物污染
【中图分类号】R28 【文献标志码】 A【文章编号】1007-8517(2024)10-0067-06
DOI:10.3969/j.issn.1007-8517.2024.10.zgmzmjyyzz202410014
Research on the Microbial Contamination of Astragali Radix (Herbal Medicine and Processecl Herbs)
BAI Wenjing1* WANG Yanwei2
Lanzhou Institute for Food and Drug Control, Lanzhou 730050, China
Abstract:Objective To explore the main sources of microbial contamination of medicinal materials on the basis of analysis and study of the microbial contamination of medicinal materials before and after processing. Methods According to the method of Chinese Pharmacopoeia (2015 edition), the purified colony was identified by combining traditional biochemistry method and matrix assisted laser desorption ionization time-of-flight mass spectrometry (MALDI-TOF-MS). Finally, SPSS 18.0 software was used for further statistics and analysis of the data. Results After the heat treatment (100℃, 30min), the value of lgTAMC was uniformly reduced, and Pantoea agglomerans, Klebsiella oxytoca, Pseudomonas monteilii, Enterobacter faecium, Bacillus subtilis and Enterococcus casseliflavus were the bacteria, which with high contamination probability of the medicinal materials.Conclusion The ratio of gram staining results of contaminated bacteria was close to 1∶[KG-*3/5]1. The contamination of Enterobacter xiangfangensis and Cellulosimicrobium cellulans maybe happened during the processing. Most of the contaminating bacteria are Enterobacteria and Bacillus.Therefore, processing enterprises can establish corresponding measures according to the types of contaminated bacteria.
Key words:Glycyrrhizae Radix et Rhizoma; MALDI-TOF-MS; Microbiological Contamination
1 引言
黄芪属于根类饮片中较为常见的一种[1],为豆科植物蒙古黄芪Astragalus membranaceus(Fish.) Bge.var.mongholius(Bge.) Hsiao 或膜荚黄芪Astragalus membranaceus(Fish.) Bge.的干燥根,具有补气升阳,固表止汗,利水消肿,生津养血等功效。黄连上清丸、黄芪健脾膏、通窍鼻炎颗粒、培坤丸等中成药均以黄芪入药。另外,由于黄芪具有补气升阳的功效,常作为药膳食材中不可或缺的一部分。因而,鉴于黄芪药材广泛的应用范围,其质量安全会严重影响到关联中成药品种的安全,而微生物污染又是其质量安全中十分重要的一部分。
通过文献检索的结果来看,我国中药饮片整体微生物污染情况较为严重,不容乐观[2~10]。根类饮片在《中国药典》[1](2020年版)一部所收集的所有中药材中占有较高的比例,然而由于此类饮片主要来源为植物根茎,因而更容易受到土壤中微生物以及化学物质残留的影响[2],微生物污染情况与其他中药材相比更为严重。对于中药材微生物污染菌的研究目前主要分为两个部分:一部分为中药材内生菌的研究[11~12];另一部分,主要以市场流通的中药材饮片为研究对象,研究不同地区市售中药材微生物污染情况[5~10]。但是,对于基于中药材饮片加工前后微生物污染情况对比的研究或文献比较少见。另外,根据江珍玉等[2]的研究发现:5种根类饮片中,黄芪的污染水平最高,并有2批次黄芪饮片检出大肠埃希氏菌。因此,考虑到黄芪微生物污染这一安全隐患,只有通过从土壤到饮片这一全过程进行跟踪性的研究,才能真正意义上发掘中药材饮片微生物污染的缘由,并由此制定出切实有效的微生物污染的防治措施,从而确保饮片应有的疗效和质量安全。
2 材料
2.1 样品 所有样品均由项目组于产地农贸市场或当地种植者处收购,并经过兰州市食品药品检验检测研究院朱仁愿高级工程师进行鉴别,3批次样品均为豆科植物蒙古黄芪Astragalus membranaceus(Fish.) Bge.var.mongholius(Bge.) Hsiao 或膜荚黄芪Astragalus membranaceus(Fish.) Bge.的干燥根。样品编号详见表1。
所有收到的黄芪样品平均分为5份,1份实验室备用作为基础数据研究,其余4份在保证无菌包装的前提下,分别委托4家中药饮片加工企业进行加工,企业及加工工艺详见表2。
2.2 试验材料 ①仪器信息:生物安全柜(厂家:新加坡艺思高科技有限公司;型号:AC2-6S1);高压灭菌器[厂家:致微(厦门)仪器有限公司;型号:GR-85];恒温培养箱;基质辅助激光解析飞行时间质谱仪(厂家:布鲁克公司)。②培养基:胰酪大豆胨液体培养基(TSB)、胰酪大豆胨琼脂培养基(TSA)、RV沙门菌增菌液体培养基、木糖赖氨酸脱氧胆酸盐琼脂培养基、pH 7.0氯化钠-蛋白胨缓冲液、沙氏葡萄糖琼脂培养基:培养基生产厂家均为北京陆桥股份有限公司。
2.3 试验方法
2.3.1 供试品溶液的制备 以无菌操作的方式将样品打粉,取样品粉末25 g,按照1∶[KG-*3/5]10的比例进行稀释(稀释液:pH 7.0无菌氯化钠-蛋白胨缓冲液),样液均质完全后吸取上清液,作为供试液(1∶[KG-*3/5]10)。
2.3.2 需氧菌总数(TAMC)、霉菌和酵母菌总数(TYMC)的检查 取“2.3.1”项下制备的供试液,分别稀释至1∶[KG-*3/5]100、1∶[KG-*3/5]1000、1∶[KG-*3/5]10000、1∶[KG-*3/5]100000(V/V;稀释液:pH7.0无菌氯化钠-蛋白胨缓冲液)。按照2020年版《中国药典》[13]四部通则1105进行需氧菌总数(TAMC)、霉菌和酵母菌总数(TYMC)的测定,为了便于统计,所得TAMC及TYMC数值取lg值后进行比较和分析。
2.3.3 耐热菌数(NAIRE)的检查 江珍玉等[2]在对5种常见根类中药饮片微生物污染相关因素分析研究时,对耐热菌项目检查采用“100℃、30min热处理”的方式。参照该方法将样品打粉后,取样品粉末25 g,按照1∶[KG-*3/5]10的比例进行稀释(稀释液:pH 7.0无菌氯化钠-蛋白胨缓冲液),样液制备后,于沸水浴(100℃)中进行热处理(时间:30min),均质完全后吸取上清液,作为供试液(1∶[KG-*3/5]10),按照2.3.2中需氧菌总数的检查方法进行耐热菌数的测定。
2.3.4 控制菌的检查
2.3.4.1 耐胆盐革兰阴性菌(定性试验) 取2.3.1项下制备的供试液,参照2020年版《中国药典》[13]四部通则1106项下“耐胆盐革兰阴性菌”定性试验方法进行相关检验。
2.3.4.2 大肠埃希菌 取2.3.1项下制备的供试液,参照2020年版《中国药典》[13]四部通则1106项下“大肠埃希菌”相关方法进行检验。
2.3.4.3 沙门菌 参照2020年版《中国药典》[13]四部通则1106项下“沙门菌”试验方法进行相关检验。
2.3.4.4 铜绿假单胞菌 取2.3.1项下制备的供试液,参照2020年版《中国药典》[13]四部通则1106项下“铜绿假单胞菌”试验方法进行相关检验。
2.3.4.5 金黄色葡萄球菌 取2.3.1项下制备的供试液,参照2020年版《中国药典》[13]四部通则1106项下“金黄色葡萄球菌”的试验方法进行相关检验。
2.3.5 分离和鉴定 对2.3.2项、2.3.3项、2.3.4项下所有培养基平皿上培养出来的菌落按照形态和大小分别挑取并纯化培养至TSA平板上,按照仪器自带提取方法进行操作,再使用 MALDI-TOF-MS进行初步鉴定。如果鉴定结果未检出或低于2.000的打分值,将菌落使用血平板经多次纯化后再上机鉴定。
2.3.6 统计和分析 采用SPSS 18.0软件对数据进行统计和分析,并采用Krona软件对鉴定结果进行描述和分析。涉及到的计数资料均采用描述性分析方法。
3 结果与分析
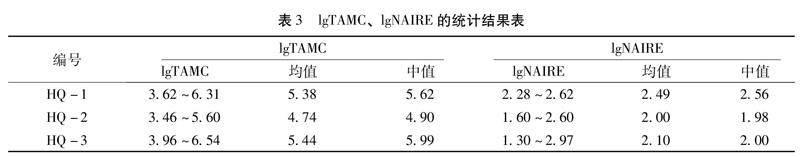
3.1 黄芪样品的lgTAMC、TYMC、lgTYMC、lgNAIRE检查结果 3批黄芪样品的lgTAMC、lgNAIRE结果如表3所示,TYMC、lgTYMC的结果如表4所示:由表3可知,3批黄芪样品lgTAMC、lgNAIRE值均高,提示微生物污染数值较高。由表4可知,与HQ-1(Y)、HQ-2(Y)、HQ-3(Y)相比较,加工企业A和C在加工后,TYMC数值均有不同程度的增加,提示可能与加工工艺中缺少干燥或者干燥环节时长不够而引起霉菌污染有关。
3.2 黄芪样品经100℃、30min热处理[2.3.3耐热菌数(NAIRE)的检查]后lgNAIRE数值与热处理前lgTAMC数值相比下降百分比结果 由表5、表6可知:黄芪原药材以及加工后的饮片经100℃、30min热处理后,数值呈现均匀性下降(数值集中在50%±10%),提示黄芪药材及饮片中耐热菌(NAIRE)的总体数量可能在污染菌总数的50%左右。
3.3 黄芪样品MALDI-TOF-MS鉴定结果 由表7、表8和图1可知:Bacillus simplex简单芽孢杆菌、Pantoea agglomerans成团泛菌、Enterobacter faecium屎肠球菌、Enterobacter cloacea阴沟肠杆菌为黄芪原药材及饮片污染概率较高的菌株;经100℃、30min热处理[2.3.3耐热菌数(NAIRE)的检查]后所得耐热菌进一步分离鉴定显示多为芽孢杆菌。另外,由表7可知(加工后的菌株种类与加工前的菌株种类相比):Enterobacter faeciums屎肠球菌、Enterobacter xiangfangensis香坊区肠杆菌分别可能是由B加工企业与C加工企业在加工环节中引入。因此,加工工艺及环境条件是黄芪微生物污染整个链条中比较重要的一环,加工厂家可能由于环境措施控制不到位而引入其他菌群的污染。
3.4 黄芪样品中控制菌检查结果 根据2.3.4的方法,对控制菌进行检查,15批样品[HQ(Y)1~3、HQ(A)1~3、HQ(B)1~3、HQ(C)1~3、HQ(D)1~3]均未检出耐胆盐革兰阴性菌、大肠埃希菌、沙门菌、铜绿假单胞菌及金黄色葡萄球菌。
4 讨论
通过对鉴定结果进行进一步地整理和分析:鉴定菌株共为44株:其中肠杆菌科占44%,芽孢菌科占41%。耐热菌的鉴定结果显示为芽孢杆菌。因此,在黄芪原药材及加工后的药材中主要的污染菌为肠杆菌与芽孢杆菌。众所周知,芽孢杆菌较难清除,由于其会产生大量的内生芽孢,这些内生芽孢在一定的条件下会被激活从而会大量地增殖,对黄芪中药材的质量安全产生重大的隐患。另一方面,肠杆菌科中往往包括一些致病性较强的菌,此类菌会对人体健康产生不利地影响。
另外,经过对加工前后污染菌菌株种类的对比可知,Enterobacter faeciums屎肠球菌、Enterobacter xiangfangensis香坊区肠杆菌怀疑分别由B加工企业和C加工企业在生产加工环节中带入。对于生产企业而言,内部质量控制十分重要,应该加强其生产加工环境的质量安全控制,在发现有微生物污染时,应该及时排查并制定有效措施加以处理。
综上所述,黄芪药材微生物污染主要来源可能包括内生菌、土壤以及生产加工带入等多个方面。通过对其污染菌的鉴定分型可知污染菌主要为肠杆菌和芽孢杆菌这两类。因此,后期在灭菌工艺研究中,应主要关注这两类污染菌。然而,芽孢杆菌由于可产生大量内生芽孢,这类芽孢抗逆性强,耐高温 、紫外线及电离辐射等,较难清除。因此,应着重考虑该类菌的消杀,进而确保黄芪药材污染菌的种类和数量控制在安全的范围内。
参考文献
[1]国家药典委员会. 中华人民共和国药典:一部[S].北京:中国医药科技出版社, 2020:315.
[2]江珍玉, 陈纯纯, 龚勇祥, 等. 5种常见根类中药饮片微生物污染相关因素分析研究[J].中药材,2018,41(7):1593-1597.
[3]刘洪祥, 曹晓云. 中药饮片中需氧菌、霉菌和酵母菌污染情况的研究及分析[J]. 天津药学, 2017, 29(1): 9-14.
[4]邓彦,王娅珂,韩晓宇, 等. 不同品种根类中药饮片耐胆盐革兰阴性菌污染研究[J]. 中国中药杂志, 2017, 42(21): 4135-4141.
[5]邓海英,龚永祥,李连凤, 等. 中药饮片微生物污染现状及典型菌鉴定研究进展[J].中草药, 2019, 50(9):2242-2256.
[6]张光华,王似锦,江志杰, 等. 北京地区销售的10种中药饮片微生物污染程度考察[J].中国药房, 2018, 29(14):1940-1944.
[7]杨晓莉,李辉,绳金房. 12种中药饮片耐热菌污染状况调查及风险评估[J]. 陕西中医, 2016, 37 (6): 740-743.
[8]绳金房,杨晓莉,李辉. 陕西省12种中药饮片微生物污染调查及风险评估[J]. 陕西中医, 2016, 31 (6): 608-612.
[9]甘永琦,农浚,零文超, 等. 广西等地区9种中药饮片微生物污染状况分析[J].中国药师, 2018, 21 (5): 922-927.
[10]张光华,王似锦,江志杰, 等. 北京地区销售的10种中药饮片微生物污染程度考察[J].中国药房, 2018, 29 (14): 1940-1944.
[11]杨志军,邓毅,曼琼, 等. 内生菌在天然药物研究中的研究进展[J].中国临床药理学杂志, 2018, 34 (5): 593-596.
[12]高红, 盛剑,白旭, 等. 浑源黄芪内生细菌的菌群组成及其功能[J]. 微生物学报, 2020, 60 (8): 1638-1647.
[13]国家药典委员会. 中华人民共和国药典:四部[S].北京:中国医药科技出版社, 2020:160-175.
[14]TAN WS, YUNOS N Y M, TAN P W, et al. Freshwater-borne bacteria isolated from a malaysian rainforest waterfall exhibiting quorum sensing properties[J].Sensors, 2014, 14(6): 10527-10537.
(收稿日期:2023-08-11 编辑:杜玲玉珊)
基金项目:甘肃省陇原青年创新创业人才项目—甘肃省大宗药材微生物污染菌数据库的建立与防治技术研究(甘组通字〔2022〕77号);兰州市科技发展指导性计划项目(2022-5-9; 甘肃省药品产业技术扶持项目(2019KF006)。
作者简介:白雯静(1987—),女,汉族,医学硕士,主管药师,研究方向为食品、药品微生物研究。E-mail:yd08joy@163.com

