蛋白激酶mTOR调控心肌细胞衰老机制的研究进展
王思博 经鹏 杨彤彤 赵迪 王连生
【摘要】人口老龄化导致心血管疾病的发病率持续增高,机体衰老和心肌细胞衰老常相伴而行。心肌细胞衰老的特征主要表现为氧化应激增加、细胞周期活动停滞、代谢紊乱等,其主要与细胞自噬、线粒体功能障碍、端粒缩短以及慢性炎症等途径有关。在这些导致心肌细胞衰老的途径中,常伴有蛋白激酶的异常表达和功能障碍。蛋白激酶mTOR可通过激活一系列级联反应参与衰老相关的心血管疾病的发生和发展。现就mTOR调节心肌细胞衰老的机制进行讨论并总结,提示mTOR未来可能成为预防或治疗心肌细胞衰老的重要靶点。
【关键词】蛋白激酶;哺乳动物雷帕霉素靶蛋白;心肌细胞;衰老;心血管疾病
【DOI】10.16806/j.cnki.issn.1004-3934.2024.05.009
Mechanisms of Protein Kinase mTOR Regulating Cardiomyocyte Aging
【Abstract】The aging of the population has led to a rising incidence of cardiovascular disease,and physical aging and cardiomyocyte aging often accompanies it.The cardiomyocyte aging is characterized by increased oxidative stress,cell cycle activity arrest,and metabolic disorders,which is mainly associated with molecular effects such as autophagy,mitochondrial dysfunction,telomere shortening and chronic inflammation.Among these pathways leading to cardiomyocyte aging,it is usually accompanied by abnormal expression and dysfunction of protein kinases.Particularly,mTOR can be involved in the generation and development of aging-associated cardiovascular disease through the activation of a series of cascading reactions.In this review,we focus on the mechanisms by which mTOR regulates cardiomyocyte aging,suggesting that mTOR may be an important target for preventing or treating cardiomyocyte aging in the future.
【Keywords】Protein kinase;Mammalian target of rapamycin;Cardiomyocyte;Aging;Cardiovascular disease
随着全球人口老龄化趋势愈发明显,心血管疾病(cardiovascular disease,CVD)发病率逐年升高,心肌细胞衰老在CVD中的作用成为近年来研究的热点问题,受到了广泛的关注[1]。
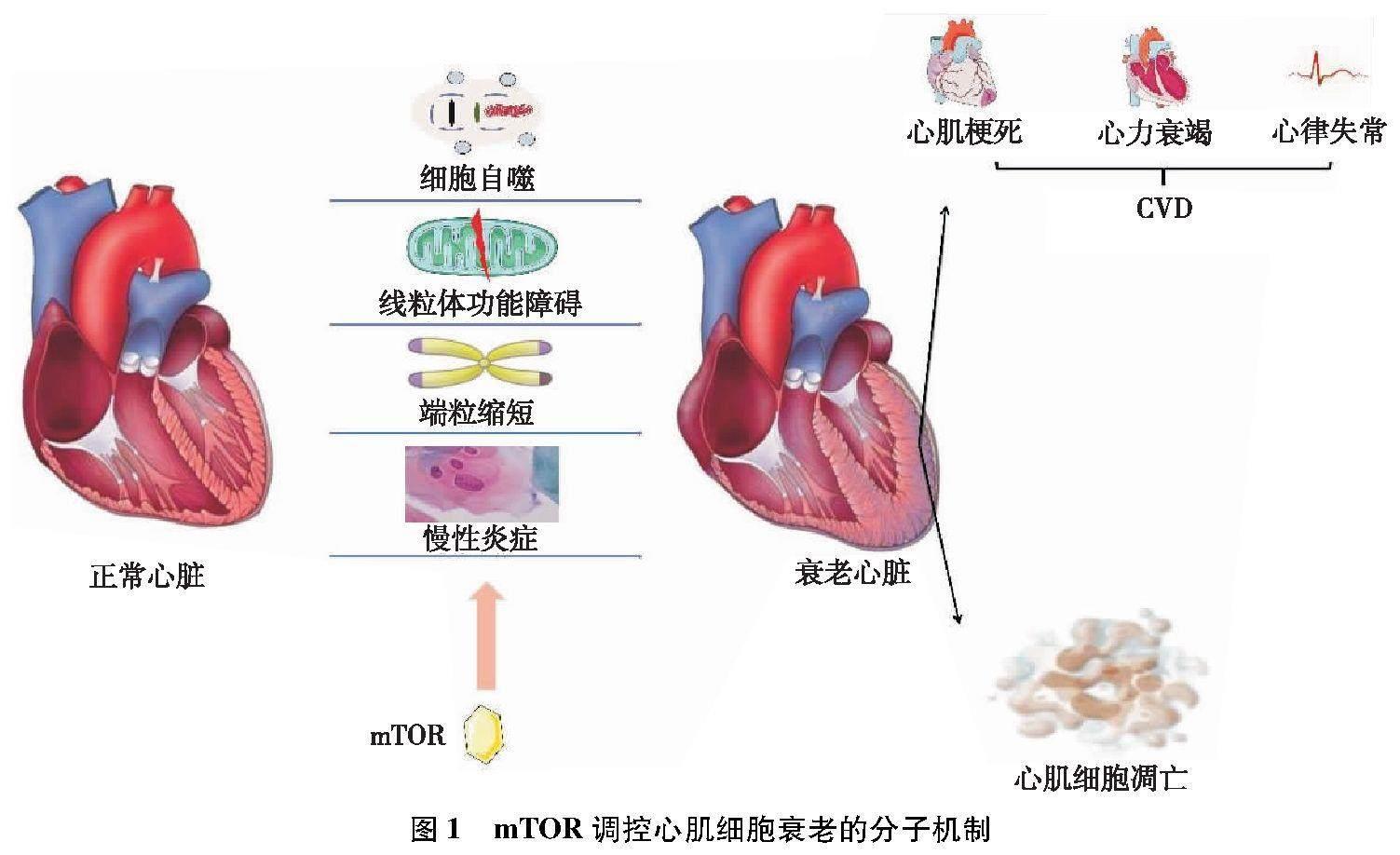
心肌细胞衰老是一种与机体衰老相关的不可逆的细胞周期停滞状态,衰老的心肌细胞主要表现出表观遗传学的改变、端粒缩短、活性氧(reactive oxygen species,ROS)大量积累等特征,引起特定细胞功能水平降低并最终永久丧失潜在的增殖能力 [2]。心肌细胞衰老是一种复杂且持续进展的病理过程,心肌细胞线粒体稳态、DNA损伤修复、自噬和表观调控等活动均在其中发挥重要作用;在心肌细胞不断衰老的过程中,心脏的正常结构和功能受到损害,最终引起心脏泵血功能减退,并导致一系列CVD发生[3]。故而延缓心肌细胞衰老、改善衰老心脏功能一直以来是心血管领域的核心难题之一。
蛋白激酶(protein kinase,PK)主要作为一种通过底物磷酸化作用激活级联反应以发挥某种生物学效应的稳定蛋白,参与多种CVD的发生发展过程。在心肌细胞衰老的过程中,常伴随着PK的异常表达和功能紊乱,针对PK开发的治疗靶点在预防和治疗心脏衰老中具有显著效果[4]。其中,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种重要的PK。近年来,很多实验结果表明mTOR与心肌细胞衰老关系密切,可通过调控细胞自噬、影响线粒体功能、调控端粒缩短以及慢性炎症,进而对心肌细胞的衰老产生重要影响(图1)。因此,基于以上背景,现就mTOR与心肌细胞衰老的研究进展和临床应用前景进行综述。
1 mTOR的结构与功能
20世纪90年代,雷帕霉素靶蛋白(target of rapamycin,TOR)和mTOR分别在酵母和哺乳动物中被发现,二者在进化中高度保守。其中,mTOR是一种丝氨酸/苏氨酸蛋白激酶,是磷脂酰肌醇-3-激酶相关激酶家族的成员之一。大量研究显示mTOR是细胞生长和增殖的重要调节因子,其在衰老中的重要作用首次在秀丽隐杆线虫中得到证实。在后续研究[5]中,抑制TOR/mTOR信号传导延长了酵母菌、果蝇和小鼠的寿命,这一结果进一步证实了mTOR在延长寿命方面具有重要作用。
mTOR可通过招募其他蛋白质形成mTORC1和mTORC2两种复合物[6]。mTORC1是一种异三聚体PK,主要由mTOR、Raptor(一种mTOR调节相关蛋白)和哺乳动物致死性SEC13蛋白8(mammalian lethal with SEC13 protein 8,mLST8)三个核心成分组成。mTORC1还含有两个抑制性亚基,即分子量为4.0×104的富含脯氨酸的Akt底物和含有mTOR相互作用蛋白的DEP结构域(DEP domain-containing mTOR-interacting protein,DEPTOR)。核糖体蛋白S6激酶和真核翻译起始因子4E结合蛋白1是mTORC1的主要影响因子,可通过影响蛋白质翻译、能量供应、各种生物大分子合成以及自噬等来调控细胞生长和代谢,在机体的生理过程和病理生理过程中都起着重要作用。
与mTORC1相似,mTORC2也包含mTOR和mLST8亚基。但是mTORC1中的Raptor在mTORC2中被雷帕霉素不敏感的mTOR伴侣(rapamycin insensitive companion of mTOR,Rictor)所取代,其结构还包括DEPTOR亚基、调控亚基mSin1及Protor1/2。mTORC2主要通过磷酸化PKCα、PKCδ、PKCξ、PKCγ等PKC家族成员影响细胞骨架重塑的各个方面进而调控细胞迁移。此外,mTORC2的另一个重要功能是磷酸化和激活Akt通路进而促进细胞增殖。但目前对于mTORC2功能的研究仍较少。
综上所述,mTOR信号通路是调控营养状态、细胞发育、代谢以及衰老的重要信号通路之一,在心脏的生长、发育和成熟以及维持心脏稳态等方面也起着关键作用,特别是mTORC1已被证明可影响衰老。以下将针对mTOR在心肌细胞衰老中的作用及机制进行系统地总结和讨论。
2 mTOR通过影响细胞自噬调控心肌细胞衰老
自噬是一个高度保守并受到调控的过程,由一系列自噬相关基因控制完成。在该过程中一些损坏的蛋白质和细胞器被双层膜结构的自噬小泡包裹后,送达溶酶体中进行降解,最终得到循环利用[7]。有研究[8]表明自噬的减少会加快心肌细胞衰老的进程,而促进自噬可延缓并改善心肌细胞的衰老。例如,当破坏Beclin1-Bcl2复合体后,自噬将增加,最终延缓心肌细胞衰老。此外,线粒体自噬水平的升高也可有效延缓心肌细胞衰老的进程。
对mTOR通路的研究[9]表明,心脏衰老与心脏多种营养障碍和代谢途径的失调有关,最重要的调节途径之一便是mTORC1,它已被证明是衰老的正调控因子。与Akt活性增加相一致,mTORC1的活性在小鼠心脏中随着年龄的增长而增强。mTORC1的异常激活会导致衰老心脏中自噬水平的下降。而AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)可通过多个步骤负调控mTORC1通路,导致mTORC1受到抑制。AMPK是调节能量稳态的重要激酶,也是参与多种信号转导途径的关键PK,它在细胞衰老中起着至关重要的调节作用。当AMPK被激活时,自噬起始信号mTOR则被抑制,信号传递至ULK复合体,促进磷脂酰肌醇-3-激酶-Beclin1复合体的形成,导致吞噬囊泡扩大。异常的自噬会诱导衰老的发生。抑制mTOR可延缓或阻断衰老过程,这可能成为CVD治疗中的重要靶点。值得注意的是,AMPK也可直接磷酸化并激活ULK1和Beclin1诱导自噬发生。有研究表明,衰老心脏中AMPK活性降低,mTOR被过度激活,也加剧了小鼠心肌细胞的衰老。由于能量障碍是自噬和衰老的关键因素,而mTOR是调节能量稳态和衰老的关键信号,因此mTOR是连接自噬和衰老的关键桥梁。除了调控细胞巨自噬外,mTOR信号也与线粒体自噬调节有关,然而,mTOR调控的线粒体自噬如何影响心肌细胞衰老仍有待进一步实验证明。除mTORC1外,也有研究[10]表明TGFB-INHB可通过抑制mTORC2进而调节年龄依赖性自噬来延长心脏寿命。
此外,某些微RNA(microRNA,miRNA)也可通过影响mTOR的表达进而参与调控心肌细胞衰老。有研究[11]表明,miR-29a可通过下调mTOR的表达诱导自噬增加进而延缓心肌细胞衰老。目前为止,已知能调节细胞衰老的mTOR相关miRNA数量仍然有限,其中包括miR-101、miR-100和miR-107等[12]。
综上所述,衰老是引起心肌细胞质量下降的重要因素,而自噬是一种关键的细胞质量控制途径,其受到诸多PK调节,其中mTOR起到了至关重要的作用,mTORC1抑制剂雷帕霉素可通过抑制mTORC1增强自噬活性。具体而言,mTORC1通过磷酸化ULK1、ATG13和转录因子EB来抑制自噬,而雷帕霉素抑制mTOR导致ULK1去磷酸化,然后启动自噬体形成。这一结果说明,雷帕霉素作为mTORC1抑制剂的作用突出了其在哺乳动物中延长寿命的能力。通过抑制mTORC1,雷帕霉素治疗导致整体蛋白质合成抑制、细胞生长减缓、应激反应激活和自噬增强。因此,抑制mTOR、增强自噬可能是临床延缓心肌细胞衰老的有效手段。
3 mTOR通过影响线粒体功能调控心肌细胞衰老
线粒体在细胞能量供应、细胞内钙稳态、合成和分解代谢反应以及心血管系统的炎症信号启动中起着至关重要的作用。当线粒体功能出现障碍时,细胞内会出现ROS积聚、钙稳态失调并导致炎症反应启动。线粒体功能障碍是心肌细胞衰老的一个特征。为了满足高水平的代谢需求,心肌细胞拥有最高密度的线粒体,这些线粒体实际上是ROS的主要来源。而ROS通过破坏线粒体DNA继而导致线粒体的形态和结构发生改变,引起DNA基因突变,导致细胞功能失调,造成不可逆转的细胞损伤,加速细胞凋亡进程,最终激活细胞衰老或凋亡信号通路,促进心肌细胞衰老[13]。氧化应激可激活转化生长因子-β,进而导致miR-29迅速积聚,促进心肌细胞衰老。而有研究表明,ROS还可激活TRPM2、TRPA1和TRPV1通道增强Ca2+信号转导进而导致CVD的发生。同时随着心肌细胞衰老,心肌细胞线粒体复合物Ⅲ和Ⅳ的活性以及线粒体密度下降,使得衰老心脏对脂肪酸的利用能力减退,其能量代谢向糖代谢模式进行转换。这些都体现了线粒体在心肌衰老发展方面的重要意义,解决线粒体功能障碍问题可能是预防和改善衰老相关心脏病的关键之一。
mTORC2在衰老调节中的作用可能归因于可影响线粒体功能进而调控心肌细胞衰老,其在细胞内可以通过一系列过程激活下游的效应蛋白Akt,进而促进细胞发育增殖、调节肌动蛋白细胞骨架重组,其定位于富含核糖体的线粒体相关内质网膜,mTORC2缺乏会破坏该膜结构,导致线粒体结构缺陷,ATP生成障碍以及钙摄取增加,进而引起心肌细胞衰老[14]。mTORC2除了参与细胞增殖、细胞骨架重组和脂质代谢外,还是一个关键的氧化应激反应途径,其在高脂肪饮食处理和氧化应激时被激活,而内质网应激则被抑制。mTORC2也被证明与Pink1途径相互作用进而调节线粒体稳态,这些发现表明mTORC2在线粒体质量控制(如氧化应激、线粒体自噬)中起着重要作用[15]。
胰岛素样生长因子-1 (insulin like growth factor-1,IGF-1) 是生长激素在发挥生理作用过程中调节合成的一种活性蛋白多肽物质,IGF-1也可调控氧化应激这一过程。IGF-1与其同源受体IGF-1受体(IGF-1 receptor,IGF-1R)结合,在细胞生长发育、分化和组织修复中表现出多种重要作用。值得注意的是,IGF-1/IGF-1R信号与心肌细胞衰老有关,IGF-1和胰岛素都会与IGF-1R结合,通过激活mTOR通路细胞内信号级联反应,动员心肌细胞抵抗氧化应激,从而调节心肌细胞衰老。 mTOR在这一过程中的作用是通过IGF/IGFR过表达而被激活,并导致心脏过早地衰老[16]。
这些研究表明改善线粒体功能可能是预防或延缓心肌细胞衰老的可行目标,即减少ROS产生、维持钙稳态平衡及减轻炎症反应。在雷帕霉素应用过程中,mTORC1的抑制减少了蛋白质翻译的能量需求,导致ROS产生减少,减弱了有害代谢产物的积累,有助于增强受损大分子的自噬清除。值得注意的是,mTORC1是唯一一个对雷帕霉素治疗敏感的mTOR复合体亚型,然而,长期的雷帕霉素治疗也会抑制mTORC2活性。总而言之,抑制mTORC1减少ROS形成、激活mTORC2维持线粒体结构完整很可能在临床延缓心肌细胞衰老中起到重要作用。
4 mTOR通过其他途径介导调控心肌细胞衰老
mTOR通过上述两种途径进而调控心肌细胞衰老的研究已比较深入,除此之外,mTOR还可通过介导端粒缩短以及慢性炎症进而影响心肌细胞衰老,但总体研究报道较少。
端粒是真核细胞中线性染色体末端的DNA短重复序列,端粒与端粒结合蛋白共同构成一种特殊的帽状结构,保护基因在转录过程中不被错误降解,维持染色体的完整性和基因组的稳定性。由于随着细胞不断分裂,端粒序列逐渐变短,最终破坏了帽状结构。当端粒酶缺乏时也会导致端粒明显缩短,引起心功能障碍和心室重塑。此外,研究[17]发现端粒容易受到氧化应激的调节,在ROS作用下,端粒将出现单链断裂,并随着年龄的增长累积,限制细胞增殖,促进细胞转向衰老。更重要的是,有研究表明在衰老过程中,线粒体功能障碍可引起端粒区域DNA持续损伤,导致人类和小鼠的心肌细胞衰老,而不依赖于端粒长度的变化。有研究[18]发现mTOR通路在端粒酶缺陷的短端粒小鼠中上调,在此基础上通过雷帕霉素治疗或通过转基因敲低mTOR表达会加快衰老进程,而接受相同处理的野生型小鼠情况则明显相反。这些发现表明,在端粒酶缺乏和短端粒的情况下,mTOR途径的过度激活是一种延缓衰老的途径,而在该情况下抑制mTOR通路会促进衰老进程。
炎症被认为是影响心肌细胞衰老的重要因素,在大部分与衰老相关的CVD中发挥作用[19]。近年来,有学者提出了“炎症性老化”的概念。这种炎症的特点是促炎介质水平升高,以应对生理环境的变化,并导致免疫系统功能低下,而免疫细胞在低水平状态下持续工作,又会释放大量白细胞介素(interleukin,IL)和趋化因子加重慢性炎症,这也被称为免疫衰老。衰老的心肌细胞也会产生大量的促炎介质,反过来加重慢性炎症的进程,二者相互促进发展。也有研究[20]表明,慢性炎症还与氧化应激存在相互促进的作用,这种循环激活了共同的信号通路,最终引起心肌细胞衰老。有研究[21]表明,IL-37b可通过激活AMPK、抑制mTOR信号通路,一方面抑制IL-31和IL-33的释放,进而降低二者介导的炎症水平,另一方面还增强了细胞自噬,两个方面最终都缓解了心肌细胞衰老的进程。同时,慢性炎症与细胞自噬也有明显的相关性。既往研究表明,适当激活自噬途径可减轻炎症反应,而mTORC1在自噬中起到至关重要的作用,其是否也能在缓解慢性炎症中起到类似的重要作用,仍需进一步研究。
目前对于影响细胞衰老除上述途径外,表观遗传学改变、蛋白质稳态丧失、细胞间通讯改变和微环境失调等也都可以引起细胞衰老[22],但在心肌细胞衰老中是否也存在这种相关性尚未明确,mTOR是否能通过这些途径影响心肌细胞衰老的进程,也有待进一步研究。
5 总结与展望
综上所述,mTOR及其信号调节网络在心肌细胞衰老的发生和发展中扮演着重要的角色,主要通过激活级联反应调控细胞自噬、线粒体功能、端粒缩短、慢性炎症进而对心肌细胞的衰老产生重要影响。整体来讲,各种引起心肌细胞衰老的标志性病理改变紧密相连,任何单一因素的改变都会影响大多数其他标志性病理改变。由心肌细胞衰老引起的CVD的发病率和死亡率逐年增加,这迫切需找到有效的临床策略来干预心脏衰老。有研究[23]表明,临床使用mTOR抑制剂依维莫司可改善线粒体功能,继而预防和延缓心肌细胞衰老,最终显著降低CVD风险。事实上,每个标志性病理改变都可被视为开发新药物以延长心肌细胞寿命的潜在目标,即增加自噬、改善线粒体功能、保护端粒及减轻炎症反应等。而这些因素的关联程度将决定靶向不同标志性病理改变的药物能否组合产生累加效应,甚至起到正协同的作用。尽管有广泛的临床前证据,但也仍需更多的临床研究以实现向临床使用的转化。本综述主要通过总结探讨mTOR对于心肌细胞衰老影响因素的调控,期望以mTOR为切入点,为未来在临床上预防、延缓和治疗由心肌细胞衰老引起的CVD提供新的思路和选择。
参考文献
[1]Pietri P,Stefanadis C.Cardiovascular aging and longevity:JACC state-of-the-art review[J].J Am Coll Cardiol,2021,77(2):189-204.
[2]Shimizu I,Minamino T.Cellular senescence in cardiac diseases[J].J Cardiol,2019,74(4):313-319.
[3]Shah AM,Claggett B,Folsom AR,et al.Ideal cardiovascular health during adult life and cardiovascular structure and function among the elderly[J].Circulation,2015,132(21):1979-1989.
[4]Engin A.Protein kinase-mediated decision between the life and death[J].Adv Exp Med Biol,2021,1275:1-33.
[5]Dai DF,Kang P,Bai H.The mTOR signaling pathway in cardiac aging[J].J Cardiovasc Aging,2023,3(3):24.
[6]Wei X,Luo L,Chen J.Roles of mTOR signaling in tissue regeneration[J].Cells,2019,8(9):1075.
[7]Kaushik S,Tasset I,Arias E,et al.Autophagy and the hallmarks of aging[J].Ageing Res Rev,2021,72:101468.
[8]Miyamoto S.Autophagy and cardiac aging[J].Cell Death Differ,2019,26(4):653-664.
[9]Delbridge LMD,Mellor KM,Taylor DJ,et al.Myocardial stress and autophagy:mechanisms and potential therapies[J].Nat Rev Cardiol,2017,14(7):412-425.
[10]Chang K,Kang P,Liu Y,et al.TGFB-INHB/activin signaling regulates age-dependent autophagy and cardiac health through inhibition of MTORC2[J].Autophagy,2020,16(10):1807-1822.
[11]Shao W,Wang S,Wang X,et al.miRNA-29a inhibits atherosclerotic plaque formation by mediating macrophage autophagy via PI3K/AKT/mTOR pathway[J].Aging(Albany NY),2022,14(5):2418-2431.
[12]Khor ES,Wong PF.The roles of MTOR and miRNAs in endothelial cell senescence[J].Biogerontology,2020,21(5):517-530.
[13]Lin R,Kerkel R.Regulatory mechanisms of mitochondrial function and cardiac aging[J].Int J Mol Sci,2020,21(4):1359.
[14]Pagan LU,Gomes MJ,Gatto M,et al.The role of oxidative stress in the aging heart[J].Antioxidants(Basel),2022,11(2):336.
[15]Daneshgar N,Rabinovitch PS,Dai DF,et al.TOR signaling pathway in cardiac aging and heart failure[J].Biomolecules,2021,11(2):168.
[16]Abdellatif M,Trummer-Herbst V,Heberle AM,et al.Fine-tuning cardiac insulin-like growth factor 1 receptor signaling to promote health and longevity[J].Circulation,2022,145(25):1853-1866.
[17]Moslehi J,DePinho RA,Sahin E,et al.Telomeres and mitochondria in the aging heart[J].Circ Res,2012,110(9):1226-1237.
[18]Ferrara-Romeo I,Martinez P,Saraswati S,et al.The mTOR pathway is necessary for survival of mice with short telomeres[J].Nat Commun,2020,11(1):1168.
[19]Liberale L,Badimon L,Montecucco F,et al.Inflammation,aging,and cardiovascular disease: JACC review topic of the week[J].J Am Coll Cardiol,2022,79(8):837-847.
[20]Papaconstantinou J.The role of signaling pathways of inflammation and oxidative stress in development of senescence and aging phenotypes in cardiovascular disease[J].Cells,2019,8(11):1383.
[21]Hou T,Sun X,Zhu J,et al.IL-37 ameliorating allergic inflammation in atopic dermatitis through regulating microbiota and AMPK-mTOR signaling pathway-modulated autophagy mechanism[J].Front Immunol,2020,11:752.
[22]López-Otín C,Blasco MA,Partridge L,et al.Hallmarks of aging:an expanding universe[J].Cell,2023,186(2):243-278.
[23]Zervantonakis IK,Poskus MD,Scott AL,et al.Fibroblast-tumor cell signaling limits HER2 kinase therapy response via activation of mTOR and antiapoptotic pathways[J].Proc Natl Acad Sci U S A,2020,117(28):16500-16508.