细胞应激性衰老在心肌梗死中的作用及机制研究进展
刘贤玲 陈雪英 郭莹
【摘要】细胞衰老被定义为不可逆的细胞周期停滞,其特征在于基因和蛋白质表达的显著改变以及衰老相关分泌表型的产生。心肌梗死后的心肌中血流需求和供应之间严重失衡可导致细胞应激性衰老的发生,其在决定心肌梗死后心脏功能转归中发挥重要作用。现主要对细胞应激性衰老在心肌梗死后维持心脏功能中的作用及机制,以及针对细胞衰老开发的药物对心肌梗死后心脏功能的影响等进行综述,为通过调节细胞衰老而改善心肌梗死的治疗提供一些新的思路。
【关键词】细胞衰老;衰老相关分泌表型;心肌梗死;药物治疗
【DOI】10.16806/j.cnki.issn.1004-3934.2024.05.008
Role and Mechanism of Stress-Induced Premature Senescence in Myocardial Infarction
【Abstract】Cell senescence is defined as irreversible cell cycle arrest characterized by significant alterations in gene and protein expression and the production of senesence-associated secretory phenotype.A severe imbalance between blood flow demand and supply in the myocardium after myocardial infarction can lead to the occurrence of stress-induced premature senescence,which plays an important role in determining cardiac function outcomes after myocardial infarction.This article mainly reviews the role and mechanism of stress-induced premature senescence in maintaining cardiac function in myocardial infarction,as well as the effect of drugs developed for cell senescence on cardiac function after myocardial infarction,so as to provide some new ideas for the treatment of myocardial infarction by regulating cellular senescence.
【Keywords】Cell senescence;Senesence-associated secretory phenotype;Myocardial infarction;Drug treatment
心肌梗死(myocardial infarction,MI)是一类在国内外发病率及死亡率均较高的疾病。在MI中,易损动脉粥样硬化斑块破裂和冠状动脉继发血栓性闭塞等导致心肌血流需求和供应之间严重失衡[1],心肌受到严重创伤。除了心肌细胞死亡外,还引发了细胞应激性衰老(stress-induced premature senescence,SIPS)的发生。 SIPS与复制性衰老不同,是指细胞在持续的DNA损伤、端粒功能障碍、线粒体功能障碍、氧化应激、衰老相关分泌表型(senesence-associated secretory phenotype,SASP)、辐射、癌基因激活以及代谢变化等应激条件下发生的应激性早衰[2]。现就SIPS在MI中的作用及机制进行阐述。
1 细胞SIPS在MI中的作用及机制
1.1 细胞SIPS在MI中的作用
MI后诱发的细胞衰老相关研究目前主要是针对心肌细胞和成纤维细胞。有研究[3]表明,MI后的细胞大多数是衰老的心肌细胞。衰老的心肌细胞端粒缩短受损,起搏频率增加,收缩及代谢功能障碍[4],且可分泌SASP因子来诱导邻近细胞的衰老。在衰老的心肌细胞中,受损的细胞缩短和延长以及起搏频率的增加是内在的。心肌细胞收缩功能障碍受DNA损伤和烟酰胺腺嘌呤二核苷酸耗竭的调节,心肌细胞更新缓慢,许多心肌细胞在MI后丢失,导致梗死心肌被细胞外基质形成的瘢痕组织替代[5],而替代心肌的瘢痕组织缺乏心肌细胞功能,不能进行正常的心肌收缩活动。代谢功能障碍会对心脏与年龄相关的心功能下降产生很大影响,因为影响能量产生的能量底物或压力源的变化会导致心肌细胞衰老[6]。心脏收缩功能下降以及代谢和线粒体功能的变化也会导致心脏老化。因此,延缓心肌细胞的衰老或促进已有心肌细胞的增殖在改善MI患者心脏功能和预后方面发挥着重要作用[7]。
心脏成纤维细胞约占心脏非心肌细胞群的55%,可调节细胞外基质的重塑、重组和心脏微环境中的旁分泌通信[8]。MI后,成纤维细胞可活化为肌成纤维细胞,活化心脏成纤维细胞的表型是动态的,从促炎状态转变为抗炎状态,而肌成纤维细胞分泌胶原,最终支持瘢痕形成[9]。有研究[10]认为,成纤维细胞衰老后,会大量分泌胶原等细胞外基质,诱导纤维化的发生。而另有研究[11]认为心脏成纤维细胞过早衰老可能限制胶原蛋白表达,不仅会限制早期伤口愈合期间的修复性纤维化,而且会防止慢性伤口愈合期间的过度纤维化。以上两个研究观点有差别,具体来说就是观察时间的不同。在成纤维细胞衰老早期,会限制胶原蛋白纤维化,限制慢性伤口愈合的过度纤维化。而在成纤维细胞衰老晚期,会大量分泌胶原等细胞外基质,诱导纤维化,加上分泌的SASP更会加剧纤维化的发生。因此,细胞衰老尤其是成纤维细胞的衰老是影响MI预后的关键因素。
1.2 DNA损伤与修复是细胞SIPS的触发因素
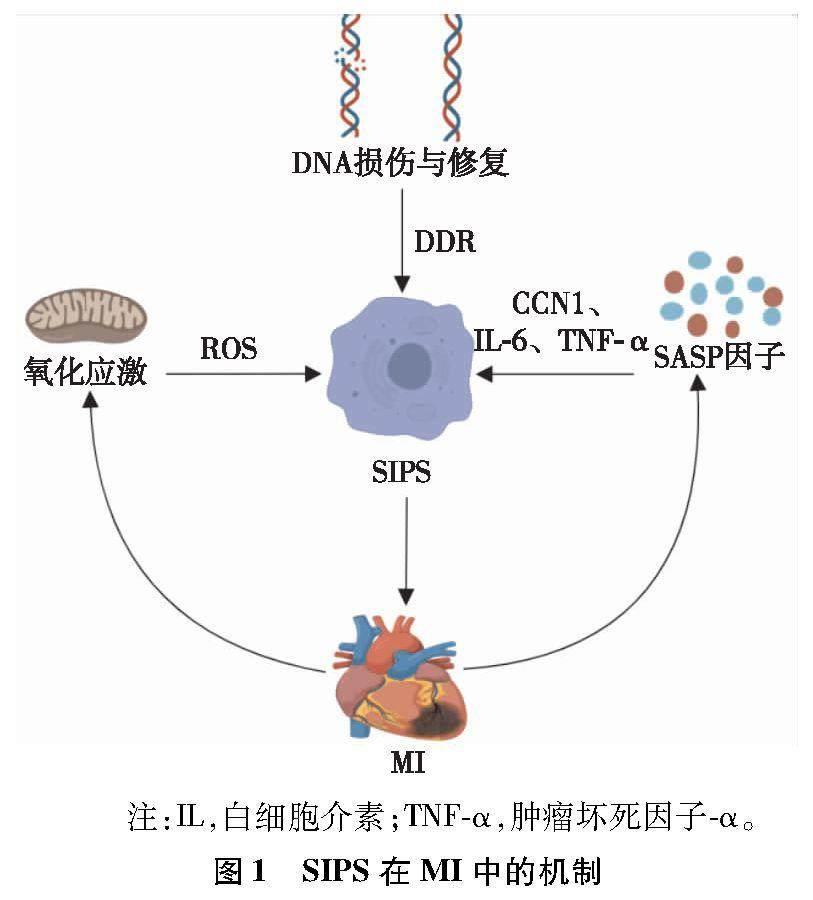
DNA损伤与修复在细胞SIPS中发挥重要作用。细胞DNA在生命过程中会受到多种遗传毒性因子的损伤,导致基因组不稳定和转录紊乱。DNA损伤包括单链和双链断裂、DNA片段缺失、核苷酸修饰和DNA从细胞核中挤出,以及各种DNA损伤应答(DNA damage response,DDR)蛋白表达的改变。简单来说,DDR是通过识别“错误”DNA(碱基错配或单链、双链断裂)启动的。大量的实验证据[12]表明,双链断裂激活DDR是年龄相关的病理生理变化的主要决定因素,所有导致持续DNA损伤的应激源均可诱导细胞SIPS。在机制上,DDR的激活通常伴随着DNA损伤灶的形成,其特征在于组蛋白H2AX在双链断裂的丝氨酸139位点上的磷酸化。在心血管系统中,基因组不断受到衰老、血液流动、脂质、缺血等多种内源性和外源性基因毒性因子的攻击,导致应激性早衰的发生。在心脏损伤模型中,Cui等[13]观察到MI后心肌细胞衰老与DNA损伤增加有关。DNA损伤修复也会导致DNA损伤增加,从而使得细胞衰老加重,一方面DNA损伤修复可阻滞细胞周期,避免损伤的DNA进入子细胞;另一方面,不完全或不正确的DNA修复也会加速DNA损伤,并以很大的比例加剧衰老。Lyu等[14]观察到,H4K20me3减少可通过损害DNA损伤修复和基因组维持而促进心脏老化期间的细胞衰老。因此,持续的DNA损伤激活或DNA损伤修复缺陷是引发心血管疾病中早衰的强有力触发因素。
1.3 氧化应激是细胞SIPS的核心环节
氧化应激已被认为是细胞SIPS的关键。MI后显示最高水平氧化应激的区域可产生最高比例的衰老细胞[15]。衰老的心脏中氧化应激增加,这些变化会因肥胖、高血压和糖尿病等与心血管死亡率相关的疾病而加速[16]。多种因素可导致活性氧(reactive oxygen species,ROS)产生增加,如NADPH氧化酶的活性增加、抗氧化剂活性降低以及功能障碍的线粒体产生[17]。ROS是由O2还原形成的小的、寿命短且反应性高的分子,是生物体内与氧化代谢有关的、含氧自由基和易形成自由基的过氧化物的总称。细胞内ROS的主要来源是氧化磷酸化的副产物。已有研究[18]表明p16/Rb途径参与细胞衰老的发生,其可通过促进有丝分裂信号级联反应,参与ROS诱导,激活蛋白激酶C δ 形成正反馈环以维持衰老。MI中氧化脂蛋白水平升高也会增加ROS,最常见的形式是反应性羟基自由基。ROS通过向DNA碱基添加双键或从DNA碱基移除氢原子来促进DNA损伤,并促进MI中细胞衰老的发生。氧化应激已反复被认为是心脏衰老的病理机制,并且用抗氧化剂如乙酰半胱氨酸治疗已显示可减少心肌细胞中的端粒DNA损伤和衰老[19]。因此,有效降低氧化应激水平,在延缓细胞衰老中具有十分重要的意义。
1.4 SASP因子是SIPS的必要条件
SASP因子促进SIPS的进程。细胞衰老并不是完全静止的,它会破坏正常的组织功能,主要通过向周围不断分泌一系列促炎细胞因子、趋化因子、生长因子和基质金属蛋白酶[20],这些因子统称为SASP因子。SASP因子会加重组织炎症,促进衰老进程,进而破坏组织的结构以及各项生理功能,导致衰老相关疾病的发生和发展[21]。简言之,细胞衰老会产生SASP因子,而SASP因子的积聚又会进一步加重细胞衰老,二者形成正反馈。衰老心肌细胞增加SASP因子的表达,包括CCN家族成员1(CCN 1)、白细胞介素( 1 α、1 β和 6)、肿瘤坏死因子-α、单核细胞趋化蛋白-1、内皮素-3、肿瘤生长因子β和生长分化因子15[22]。心肌细胞的衰老除可通过激活SASP复合物对周围细胞产生调节作用外,还可发挥抗纤维化作用。Cui等[13]研究证明,衰老心肌细胞通过激活缺血心脏中GATA结合蛋白4依赖性CCN1分泌来改善心脏功能。CCN1可抑制心肌纤维化,改善MI后心功能不全。具体地说,GATA结合蛋白4敲低抑制了MI后CCN1的分泌并加重了心功能不全。因此,减少因SASP因子而加重的心肌细胞衰老是预防MI后病理性纤维化和心功能不全的必要条件。
综上,SIPS主要通过DNA损伤与修复、氧化应激以及SASP因子等机制在MI中发挥作用,详见图1。
2 针对细胞衰老的治疗策略
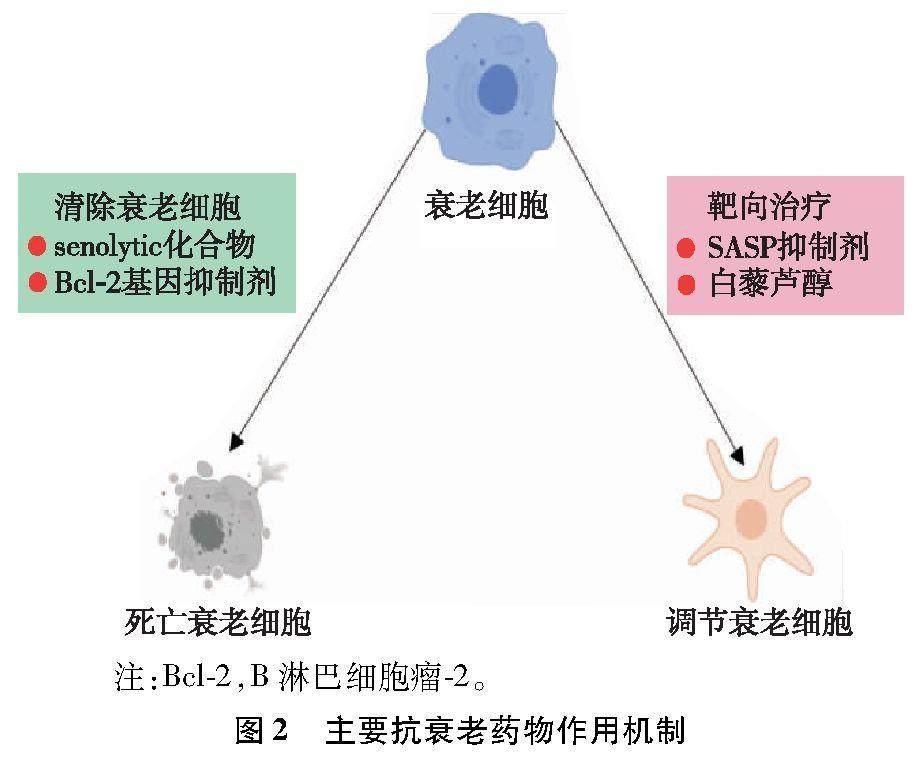
衰老的心肌细胞可表现出代谢功能障碍和收缩功能障碍,从而导致心脏功能障碍和衰竭。此外,衰老的心肌细胞可通过SASP因子部分损害非心肌细胞的功能,包括内皮细胞和成纤维细胞,从而加速心脏损伤。因此,抑制梗死心脏中的衰老心肌细胞可能是治疗MI的新策略。下面介绍在心血管领域应用中主要抗衰老药物的作用机制,见图2。
2.1 清除衰老细胞
2.1.1 senolytic化合物达沙替尼和槲皮素
最早应用的两种抗衰老药物是达沙替尼和槲皮素。达沙替尼是一种酪氨酸激酶抑制剂,通过抑制酪氨酸激酶促进依赖性受体(如肝配蛋白)诱导衰老细胞凋亡[23]。槲皮素是一种抑制磷脂酰肌醇3-激酶的黄酮醇,可增加组蛋白脱乙酰酶的表达,抑制mTOR信号通路传导。达沙替尼和槲皮素联合用药可减少暴露于电离辐射后小鼠体内表达p16的衰老细胞[24],很大程度上改善老年小鼠的左心室收缩功能。有研究[25]表明,在MI前用该药物预处理老年动物,MI后心脏功能和存活率得到改善。
2.1.2 B 淋巴细胞瘤-2基因抑制剂
B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)基因抑制剂navitoclax可抑制抗凋亡Bcl-2家族蛋白的活性。navitoclax促进MI后衰老心肌细胞的清除,减少小鼠纤维化[24]。navitoclax还可改善左心室收缩功能,减少心肌纤维化和心脏肥大,并可改善血管紧张素Ⅱ诱导的心力衰竭小鼠的左心室到左心房的传导速度[26]。navitoclax治疗可减小梗死面积并促进血管生成,但不能促进体内心肌细胞增殖。
2.2 靶向治疗细胞衰老
2.2.1 SASP抑制剂
雷帕霉素是哺乳动物雷帕霉素靶蛋白信号通路的靶标抑制剂,其可减少核糖体生物发生、蛋白质合成、核苷酸以及葡萄糖代谢并促进自噬,延长老年小鼠的中位和最长寿命[27]。据报道,雷帕霉素可延缓甚至逆转小鼠动脉结构和功能的变化、心脏肥大、舒张功能障碍等[28]。
2.2.2 多酚类化合物
白藜芦醇在1940年由Michio Takaoka首先从大花藜芦中分离得到[29]。白藜芦醇对多种疾病具有治疗作用,并被认为具有强大的抗氧化和抗炎特性。研究[30]发现,白藜芦醇对小鼠心脏MI有保护作用,白藜芦醇治疗可降低死亡率并改善心脏血流动力学,从而改善心脏功能。其潜在机制可能与沉默信息调节因子1介导的p53和AC-p53的调节、衰老分子标志物(p53、p16和p19)的抑制、炎性标志物(NOD样受体热蛋白结构域相关蛋白3和胱天蛋白酶 1 p20)的表达以及核因子κB的核转位有关,从而减轻心肌细胞衰老,并且可减小梗死面积,减轻纤维化和细胞凋亡[31]。
2.3 其他药物
芪苈强心胶囊是由11味中药组成的传统中药。近期研究报道,芪苈强心胶囊治疗慢性心力衰竭有效且安全。几项动物研究[32]也证明,在MI、心脏缺血再灌注损伤和压力超负荷模型中,芪苈强心胶囊可减轻心肌重塑,改善心脏功能。然而,其潜在机制并不十分清楚。有实验[3]表明,芪苈强心胶囊能逆转MI诱导的核转录因子红系2相关因子2活性抑制,显著抑制MI诱导的成年野生型小鼠心脏衰老、细胞凋亡和心功能不全,但对核转录因子红系2相关因子2基因敲除小鼠无此作用。
3 药物治疗的局限性
药物清除衰老小鼠衰老细胞可减少年龄依赖性心肌重塑,减弱纤维化介质的表达,促进MI后心脏功能的恢复,最终提高存活率[25]。然而,这种方法的局限性在于它不能区分真正工作的衰老细胞,还可能去除心脏器官中的非衰老细胞,会影响MI后小鼠的存活[25]。因此,有必要进一步研究特异性去除衰老细胞和改善疾病的方法。另一个潜在的问题是,靶向SASP因子可能会损害除衰老的促炎作用之外的其他生理作用,如核因子κB在控制急性炎症和免疫应答中起重要作用,而哺乳动物雷帕霉素靶蛋白可调节细胞生长、增殖和蛋白质合成[33]。因此,治疗策略应考虑在不影响其他功能的情况下抑制SASP因子。
4 总结与展望
细胞衰老已成为心脑血管疾病以及与年龄相关疾病的预防和治疗以及衰老生物学领域的研究热点。细胞衰老在MI中机制的研究目前尚少,还不特别清楚。在未来的研究中,应尽可能多地深入探究其机制,并通过其发挥作用的机制来开发一些有助于调节MI后心肌细胞衰老的干预手段。相信针对细胞衰老的治疗策略未来会有很大的发展前景。
参考文献
[1]Toldo S,Abbate A.The NLRP3 inflammasome in acute myocardial infarction[J].Nat Rev Cardiol,2018,15(4):203-214.
[2]Calcinotto A,Kohli J,Zagato E,et al.Cellular senescence:aging,cancer,and injury[J].Physiol Rev,2019,99(2):1047-1078.
[3]Luo X,Zhou J,Wang Z,et al.An inhibitor role of Nrf2 in the regulation of myocardial senescence and dysfunction after myocardial infarction[J].Life Sci,2020,259:118199.
[4]Tang X,Li PH,Chen HZ.Cardiomyocyte senescence and cellular communications within myocardial microenvironments[J].Front Endocrinol (Lausanne),2020,11:280.
[5]Vujic A,Natarajan N,Lee RT.Molecular mechanisms of heart regeneration[J].Semin Cell Dev Biol,2020,100:20-28.
[6]Chen MS,Lee RT,Garbern JC.Senescence mechanisms and targets in the heart[J].Cardiovasc Res,2022,118(5):1173-1187.
[7]Karra R,Poss KD.Redirecting cardiac growth mechanisms for therapeutic regeneration[J].J Clin Invest,2017,127(2):427-436.
[8]Saucerman JJ,Tan PM,Buchholz KS,et al.Mechanical regulation of gene expression in cardiac myocytes and fibroblasts[J].Nat Rev Cardiol,2019,16(6):361-378.
[9]Daseke MJ 2nd,Tenkorang MAA,Chalise U,et al.Cardiac fibroblast activation during myocardial infarction wound healing:fibroblast polarization after MI[J].Matrix Biol,2020,91-92:109-116.
[10]López-Antona I,Contreras-Jurado C,Luque-Martín L,et al.Dynamic regulation of myofibroblast phenotype in cellular senescence[J].Aging Cell,2022,21(4):e13580.
[11]Zhang Z,Shayani G,Xu Y,et al.Induction of senescence by loss of Gata4 in cardiac fibroblasts[J].Cells,2023,12(12):1652.
[12]Ishida T,Ishida M,Tashiro S,et al.DNA damage and senescence-associated inflammation in cardiovascular disease[J].Biol Pharm Bull,2019,42(4):531-537.
[13]Cui S,Xue L,Yang F,et al.Postinfarction hearts are protected by premature senescent cardiomyocytes via GATA 4-dependent CCN 1 secretion[J].J Am Heart Assoc,2018,7(18):e009111.
[14]Lyu G,Guan Y,Zhang C,et al.TGF-β signaling alters H4K20me3 status via miR-29 and contributes to cellular senescence and cardiac aging[J].Nat Commun,2018,9(1):2560.
[15]Dookun E,Walaszczyk A,Redgrave R,et al.Clearance of senescent cells during cardiac ischemia-reperfusion injury improves recovery[J].Aging Cell,2020,19(10):e13249.
[16]Zhang L,Pitcher LE,Yousefzadeh MJ,et al.Cellular senescence:a key therapeutic target in aging and diseases[J].J Clin Invest,2022,132(15):e158450.
[17]Shekhova E.Mitochondrial reactive oxygen species as major effectors of antimicrobial immunity[J].PLoS Pathog,2020,16(5):e1008470.
[18]Yan C,Xu Z,Huang W.Cellular senescence affects cardiac regeneration and repair in ischemic heart disease[J].Aging Dis,2021,12(2):552-569.
[19]Anderson R,Lagnado A,Maggiorani D,et al.Length-independent telomere damage drives post-mitotic cardiomyocyte senescence[J].EMBO J,2019,38(5):e100492.
[20]Abdellatif M,Rainer PP,Sedej S,et al.Hallmarks of cardiovascular ageing[J].Nat Rev Cardiol,2023,20(11):754-777.
[21]师莹,赵莉莉,秦勤.细胞衰老:心脏疾病治疗新思路[J].中国分子心脏病学杂志,2022,22(3):4725-4730.
[22]Gao Y,Hu Y,Liu Q,et al.Two-dimensional design strategy to construct smart fluorescent probes for the precise tracking of senescence[J].Angew Chem Int Ed Engl,2021,60(19):10756-10765.
[23]Kirkland JL,Tchkonia T.Senolytic drugs:from discovery to translation[J].J Intern Med,2020,288(5):518-536.
[24]Saccon TD,Nagpal R,Yadav H,et al.Senolytic combination of dasatinib and quercetin alleviates intestinal senescence and inflammation and modulates the gut microbiome in aged mice[J].J Gerontol A Biol Sci Med Sci,2021,76(11):1895-1905.
[25]Walaszczyk A,Dookun E,Redgrave R,et al.Pharmacological clearance of senescent cells improves survival and recovery in aged mice following acute myocardial infarction[J].Aging Cell,2019,18(3):e12945.
[26]Jia K,Dai Y,Liu A,et al.Senolytic agent navitoclax inhibits angiotensin Ⅱ-induced heart failure in mice[J].J Cardiovasc Pharmacol,2020,76(4):452-460.
[27]Aman Y,Schmauck-Medina T,Hansen M,et al.Autophagy in healthy aging and disease[J].Nat Aging,2021,1(8):634-650.
[28]Partridge L,Fuentealba M,Kennedy BK.The quest to slow ageing through drug discovery[J].Nat Rev Drug Discov,2020,19(8):513-532.
[29]Pyo IS,Yun S,Yoon YE,et al.Mechanisms of aging and the preventive effects of resveratrol on age-related diseases[J].Molecules,2020,25(20):4649.
[30]Zhou DD,Luo M,Huang SY,et al.Effects and mechanisms of resveratrol on aging and age-related diseases[J].Oxid Med Cell Longev,2021,2021:9932218.
[31]Breuss JM,Atanasov AG,Uhrin P.Resveratrol and its effects on the vascular system[J].Int J Mol Sci,2019,20(7):1523.
[32]Chen H,Lou L,Zhang D,et al.Qiliqiangxin capsule improves cardiac function and attenuates cardiac remodeling by upregulating miR-133a after myocardial infarction in rats[J].Evid Based Complement Alternat Med,2019,2019:7528214.
[33]Kang C.Senolytics and senostatics:a two-pronged approach to target cellular senescence for delaying aging and age-related diseases[J].Mol Cells,2019,42(12):821-827.

