黄芩苷通过调节Nrf2/HO-1信号通路减轻阿霉素诱导的H9c2细胞毒性
李登科 张伟 黄从新

【摘要】目的 探讨黄芩苷对阿霉素(Dox)诱导的H9c2细胞毒性的影响及内在机制。方法 采用50 μmol/L黄芩苷预处理H9c2细胞24 h,然后1 μmol/L Dox处理H9c2细胞24 h,建立体外Dox心肌毒性模型。采用CCK8法检测细胞活力;收集细胞上清检测各组心肌损伤标志物乳酸脱氢酶(LDH)、心肌肌钙蛋白I(cTnI)和肌酸激酶同工酶(CK-MB)的水平以及氧化应激相关指标超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)的水平;使用DHE试剂盒检测各组活性氧(ROS)的含量;使用TUNEL染色检测各组细胞凋亡水平,RT-qPCR和Western blot实验用于检测氧化应激和凋亡相关分子的表达水平。结果 与Dox组相比,黄芩苷能提高H9c2细胞活力,降低LDH、cTnI、CK-MB水平;DHE染色显示黄芩苷能减少ROS的生成,增加SOD、GSH-Px的活性,降低MDA的含量;TUNEL染色结果显示黄芩苷能减少阳性细胞数量;RT-qPCR和Western blot检测显示黄芩苷能上调Nrf2、HO-1、SOD2、Bcl-2的表达,降低Cleaved-caspase 3和Bax的表达。然而,Nrf2的特异性抑制剂ML385可逆转黄芩苷引起的上述变化。结论 黄芩苷通过上调Nrf2/HO-1信号通路减轻氧化应激和凋亡,减轻Dox诱导的H9c2细胞毒性。
【关键词】阿霉素;H9c2细胞;黄芩苷;氧化应激;凋亡
【DOI】10.16806/j.cnki.issn.1004-3934.2024.05.017
Baicalin Reduces Doxorubicin-Induced H9c2 Cell Toxicity by Regulating Nrf2/HO-1 Signaling Pathway
【Abstract】Objective To investigate the effect and underlying mechanism of baicalin on doxorubicin(Dox)-induced H9c2 cell toxicity.Methods H9c2 cells were pretreated with 50 μmol/L baicalin for 24 h,followed by treatment with 1 μmol/L Dox for 24 h to establish an invitro model of Dox-induced myocardial toxicity.Cell viability was assessed using the CCK8 assay.The levels of lactate dehydrogenase (LDH),cardiac troponin I (cTnI),creatine kinase isoenzyme (CK-MB),as well as oxidative stress-related indicators such as superoxide dismutase (SOD),glutathione peroxidase (GSH-Px),and malondialdehyde (MDA) were measured in the cell supernatant of each group.Reactive oxygen species (ROS) content was determined using the DHE assay kit.TUNEL staining was employed to assess cell apoptosis levels in each group.Additionally,RT-qPCR and Western blot experiments were conducted to measure the expression levels of oxidative stress and apoptosis-related molecules.Results Baicalin demonstrated the ability to enhance H9c2 cell viability and decrease LDH,cTnI,and CK-MB levels compared to the Dox group.DHE staining indicated that baicalin reduced ROS generation,increased SOD and GSH-Px activity,and decreased MDA content.TUNEL staining results revealed a reduction in the number of positive cells with baicalin treatment.RT-qPCR and Western blot analysis showed that baicalin upregulated the expression of Nrf2,HO-1,SOD2,and Bcl-2,while downregulating the expression of Cleaved-caspase 3 and Bax.However,ML385,a specific inhibitor of Nrf2,reversed the above changes induced by baicalin.Conclusion Baicalin alleviates oxidative stress and apoptosis by upregulating the Nrf2/HO-1 signaling pathway,thereby mitigating Dox-induced H9c2 cell toxicity.
【Keywords】Doxorubicin;H9c2 cell;Baicalin;Oxidative stress;Apoptosis
阿霉素(doxorubicin,Dox)是一种应用广泛的化疗药物,然而因具有严重剂量依赖性的心肌毒性,使其在临床应用中受到限制[1]。因此有必要寻找一种能减轻Dox心肌毒性的药物。Dox心肌毒性的机制涉及多种,例如氧化应激、内质网应激、钙超载、细胞焦亡、自噬等,其中氧化应激在Dox心肌毒性中发挥关键作用[2]。核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)是一个众所周知的抗氧化转录因子,在调节氧化应激方面起着至关重要的作用[3]。越来越多的研究表明Nrf2/血红素加氧酶-1(heme oxygenase-1,HO-1)信号通路参与调节Dox心肌毒性的病理生理过程。研究[4-5]表明,在Dox引起的急性和慢性心肌毒性模型中,Nrf2的表达水平降低。而激活Nrf2/HO-1信号通路可通过抑制氧化应激和炎症,从而减轻Dox诱导的心肌毒性[6]。黄芩苷(Baicalin)是一种来自黄芩根部的黄酮类物质,已被证明具有抗炎、抗病毒、抗肿瘤、抗氧化等作用[7]。近年来,有研究[8]表明,黄芩苷能通过激活Nrf2/HO-1信号通路减轻炎症和氧化应激,从而改善脂多糖诱导的血脑屏障受损。另有研究[9]表明黄芩苷能通过激活Nrf2/HO-1信号通路减轻缺氧诱导的H9c2细胞凋亡。然而,黄芩苷在Dox诱导的H9c2心肌细胞毒性中的研究少有报道。因此,本研究的目的是基于Nrf2/HO-1信号通路探究黄芩苷对Dox诱导的H9c2心肌细胞毒性的保护作用及内在机制。
1 材料和方法
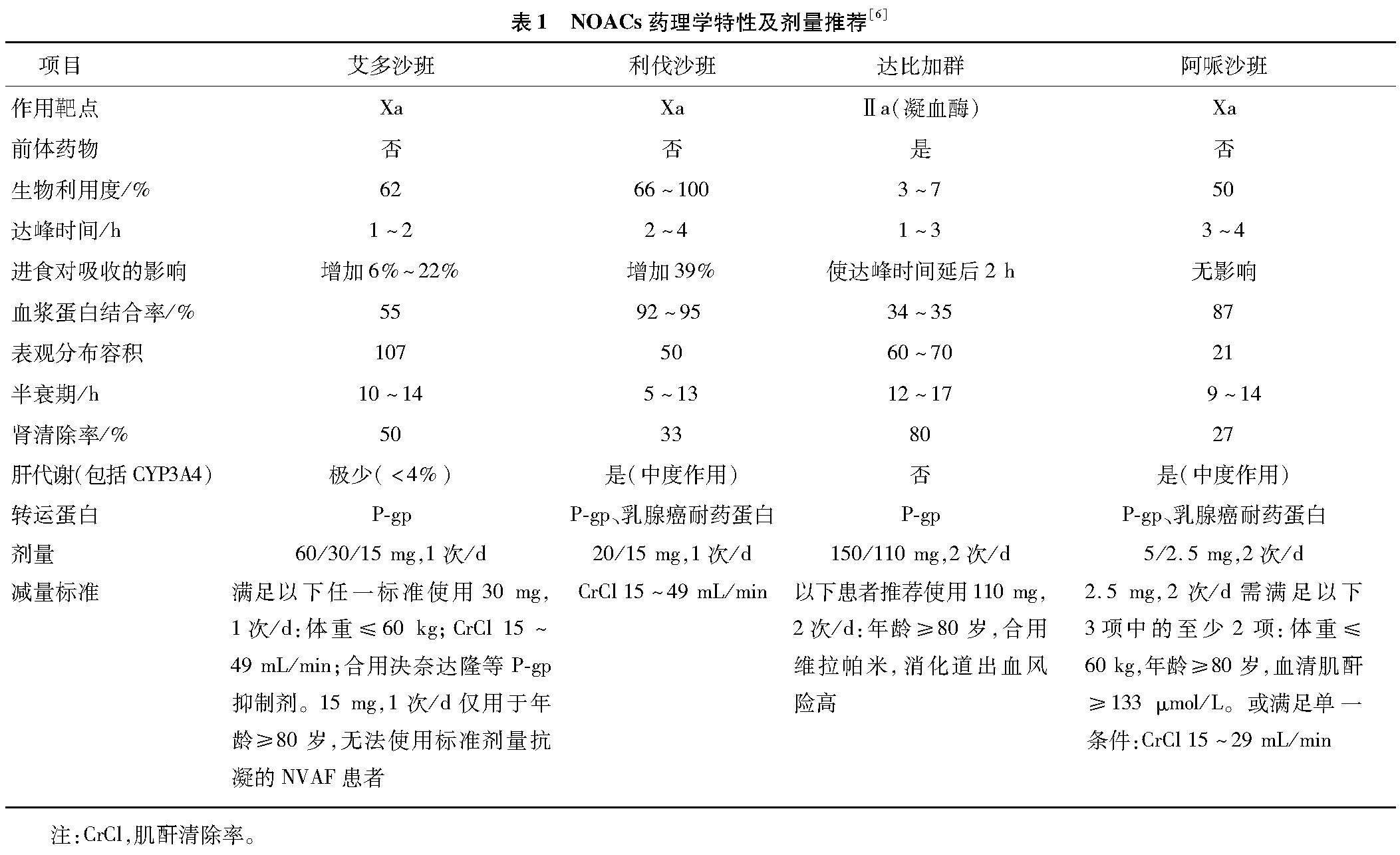
1.1 药物与抗体
黄芩苷(货号:HY-N0197)、Dox(货号:HY-15142)和ML385(货号:HY-100523)购自MedChemExpress公司。抗Nrf2抗体(货号:AF0639)购自Affinity有限公司,抗HO-1抗体(货号:GB12104-100)购自武汉塞维尔有限公司,抗超氧化物歧化酶(superoxide dismutase,SOD)2抗体(货号:A1340)、抗Bax抗体(货号:A11931)和抗Bcl-2抗体(货号:A11931)购自武汉爱博泰克生物科技有限公司,抗活化型半胱氨酸蛋白酶蛋白3(Cleaved-caspase 3,C-caspase 3)抗体(货号:9664)购自Cell Signaling Technology公司。
1.2 细胞培养
H9c2细胞购自武汉普诺赛生命科技有限公司。在含有5% CO2的37 ℃培养箱中,使用含有10%胎牛血清、1%青霉素和链霉素的高糖DMEM培养基培养H9c2细胞。黄芩苷溶于磷酸盐缓冲溶液中,Dox溶于双蒸水中,ML385溶于DMSO中制成浓度分别为50、1和10 mmol/L的母液置于-80 ℃冰箱中储存。基于文献报道及CCK8法结果采用50 μmol/L黄芩苷、1 μmol/L Dox和5 μmol/L ML385进行实验。第一部分的实验分为3组:(1)对照组(Control组):正常培养心肌细胞;(2)模型组(Dox组):用1 μmol/L Dox处理24 h;(3)治疗组(Baicalin组):50 μmol/L黄芩苷预处理24 h后,更换培养基用1 μmol/L Dox和50 μmol/L黄芩苷共处理24 h。第二部分的实验分为4组:(1)对照组(Control组);(2)模型组(Dox组);(3)治疗组(Baicalin组);(4) 添加抑制剂组(ML385组):50 μmol/L黄芩苷预处理24 h后,更换培养基用1 μmol/L Dox、50 μmol/L 黄芩苷、5 μmol/L ML385共处理24 h。其中Control组、Dox组、Baicalin组使用含有0.5 μL DMSO/mL培养基作为对照。
1.3 CCK8法检测细胞活力
将100 μL处于对数生长期的H9c2细胞悬浮液接种于96孔板中,待药物干预完成后向每孔加入10 μL CCK8试剂,37 ℃孵育1.5 h,放置于酶标仪中,读取450 nm波长下的吸光度值,并计算出各组的细胞活力。
1.4 细胞相关指标的检测
超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、丙二醛(malondialdehyde,MDA) 检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒购自南京建成有限公司,乳酸脱氢酶(dehydrogenase,LDH) 检测试剂盒购自雷杜公司,肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB) 检测试剂盒购自长春汇力公司,心肌肌钙蛋白Ⅰ(cardiac troponin Ⅰ,cTNI) ELISA试剂盒购自优尔生公司。收集各组细胞上清,根据说明书中的步骤进行操作。
1.5 DHE染色检测细胞内活性氧水平
将H9c2种于细胞玻片上,待细胞密度达到80%左右时加药处理,根据DHE试剂盒说明书进行检测,在荧光显微镜下采集图像并使用ImageJ软件进行分析。
1.6 流式细胞学检测
使用Annexin V-FITC细胞凋亡试剂盒检测各组细胞凋亡情况。简单来说,用不含EDTA的胰酶消化各组细胞,收集细胞沉淀,经磷酸盐缓冲溶液清洗后用含有Annexin V-FITC和碘化丙锭的混合体系室温避光孵育20 min左右,然后使用流式细胞仪上机检测。
1.7 TUNEL染色检测细胞凋亡水平
将爬片浸于破膜液中孵育5 min,磷酸盐缓冲溶液洗3次后向组化笔圈的范围内滴加buffer,室温孵育10 min后加入适量末端脱氧核苷酸转移酶和脱氧尿嘧啶核苷三磷酸,37 ℃孵育1 h。随后用DAPI染液避光孵育10 min,洗涤封片后置于荧光显微镜下采集图像并使用ImageJ软件分析荧光强度。
1.8 RT-qPCR检测相关基因的表达水平
使用Trizol裂解各组细胞,将裂解液收集于1.5 mL离心管中,待静置3 min后向其中加入氯仿,适当涡旋振荡后于室温静置5 min,然后离心取上清液置于新的离心管中,向其中加入异丙醇,使之充分混匀并静置10 min,12 000 g/min 4 ℃离心10 min后用75%的无水乙醇洗涤离心得到的沉淀,待沉淀晾干后溶于20~80 μL 双蒸水中并测量RNA浓度。根据逆转录试剂盒的步骤将RNA逆转录为互补DNA,将含有互补DNA、前引物、后引物的混合体系置于
聚合酶链反应
扩增仪中进行扩增,使用2-ΔΔCT法计算各目的基因的表达量。目的基因引物序列为:Nrf2的上游引物5-GCCTTCCTCTGCTGCCATTAGTC-3、Nrf2的下游引物5-TGCCTTCAGTGTGCTTCTGGTTG-3;HO-1的上游引物5-TGCACATCCGTGCAGAGAAT-3、HO-1的下游引物5-CTGGGTTCTGCTTGTTTCGC-3;SOD2的上游引物5-TCCCTGACCTGCCTTACGACTATG-3;SOD2的下游引物5-TCGTGGTACTTCTCCTCGGTGAC-3;Bax的上游引物5-AGACACCTGAGCTGACCTTGGAG-3、Bax的下游引物5-TTCATCGCCAATTCGCCTGAGAC-3;GAPDH的上游引物5-GACATGCCGCCTGGAGAAAC-3、GAPDH的下游引物5-AGCCCAGGATGCCCTTTAGT-3。
1.9 Western blot 检测相关蛋白的表达水平
Western blot 检测Nrf2、HO-1、SOD2、Bax、Bcl-2、C-caspase 3的表达水平。将H9c2细胞用加有1%的磷酸酶抑制剂和PMSF的RIPA裂解液冰上裂解30 min,然后进行12 000 r/min,4 ℃离心10 min,收集上清液。取适量蛋白原液用BCA试剂盒进行蛋白定量,其余蛋白液加入5X上样缓冲液置于100 ℃金属浴中变性10 min。取20~30 μg变性后的蛋白经8%或10% SDS-PAGE凝胶电泳,随后转移至NC膜上。用含5%脱脂牛奶的TBST室温封闭1.5 h后转移至一抗中4℃摇床上过夜。随后用HRP标记的二抗室温孵育1 h。最后,将被超敏显影液浸泡过的条带在ChemiDocTM XRS+ system仪器下进行可视化,并使用ImageJ软件进行半定量分析。所有蛋白用α-微管蛋白(α-tubulin)的表达水平进行标准化。
1.10 统计学处理
所有数据使用GraphPad Prism 9.0.2进行分析。定量数据表示为均数±标准差。多组之间的比较采用了非配对单因素方差分析,P<0.05被认为有统计学差异。
2 结果
2.1 黄芩苷最佳浓度的确定
用含有0、0.1、0.5、1、5、10、20 μmol/L Dox的培养基培养H9c2细胞24 h,结果发现0.1 μmol/L Dox对H9c2细胞的活力无显著影响,而0.5、1、5、10、20 μmol/L Dox均能显著降低H9c2细胞的活力,基于文献报道及CCK8法结果,选择使用1 μmol/L Dox作为诱导H9c2细胞毒性的造模浓度。将H9c2细胞置于含有0、1、10、20、50、100 μmol/L黄芩苷的培养基中培养24 h,结果发现,不同浓度的黄芩苷对H9c2细胞活力的影响无显著性差异。先用0、1、10、20、50、100 μmol/L黄芩苷预处理24 h,后与1 μmol/L Dox共处理24 h,结果发现,1和10 μmol/L组细胞活力与Dox组无统计学差异,而20、50和100 μmol/L组细胞活力高于Dox组,其中50 μmol/L组细胞活力最高。因此,在后续实验中,选择50 μmol/L黄芩苷处理H9c2细胞。见图1。
2.2 黄芩苷对Dox诱导的H9c2心肌细胞损伤的影响
检测Control组、Dox组、Baicalin组细胞上清中LDH、cTnI、CK-MB的水平,结果发现,与Control组相比,Dox组的LDH、cTnI、CK-MB水平升高(P<0.05),而Baicalin组LDH、cTnI、CK-MB水平降低,差异有统计学意义(P<0.05)。见图2。
2.3 黄芩苷对Dox诱导的H9c2细胞氧化应激的影响
DHE染色结果显示,Control组有较少的
活性氧(reactive oxgen species,ROS)产生;而Dox处理H9c2细胞24 h后ROS水平显著升高(P<0.05);与Dox组相比,Baicalin组的ROS水平降低,差异有显著性(P<0.05)。与Control组相比,Dox组的SOD活性、GSH-Px活性降低,MDA含量升高,差异有统计学意义(P<0.05),而黄芩苷处理后SOD活性、GSH-Px活性较Dox组升高,MDA含量较Dox组降低(P<0.05)。见图3。
2.4 黄芩苷对Dox诱导的H9c2细胞的抗氧化酶mRNA和蛋白表达水平的影响
RT-qPCR结果显示,与Control组相比,Dox组的Nrf2、HO-1、SOD2的表达降低(P<0.05),而黄芩苷可改善Dox引起的这种改变。与RT-qPCR结果一致,Western blot结果也显示Dox组的Nrf2、HO-1、SOD2的蛋白表达降低,而Baicalin组Nrf2、HO-1、SOD2的蛋白表达较Dox组有所升高(P<0.05)。见图4。
2.5 黄芩苷对Dox诱导的H9c2细胞凋亡的影响
TUNEL染色结果显示,Control组有极少的阳性细胞,Dox组有较多阳性细胞,与Control组比较,这种差异有统计学意义(P<0.05)。经黄芩苷治疗后TUNEL阳性细胞显著减少(P<0.05)。流式细胞学检测也显示,Control组有较少的凋亡细胞,而Dox处理后凋亡细胞显著增加,但黄芩苷可部分减少Dox引起的凋亡。见图5。
2.6 黄芩苷对Dox诱导的H9c2细胞凋亡相关mRNA和蛋白表达水平的影响
RT-qPCR结果显示,与Control组相比,Dox组的Bax的表达水平升高,Bcl-2的表达水平降低(P<0.05),而黄芩苷可逆转Dox引起的这种改变。与RT-qPCR结果一致,Western blot结果也显示Dox组的Bax、C-caspase 3的表达较Control组升高,Bcl-2的表达较Control组降低(P<0.05),而与Dox组相比,Baicalin组Bax、C-caspase 3的蛋白表达有所降低,Bcl-2的表达显著升高(P<0.05)。见图6。
2.7 ML385消除了黄芩苷的抗氧化应激作用
为进一步验证黄芩苷是否是通过上调Nrf2/HO-1信号通路发挥保护作用,使用了Nrf2的特异性阻断剂ML385来进行下一步实验,结果发现,ML385的加入使得黄芩苷减少ROS生成的作用丧失,与Baicalin组相比,ML385组ROS水平增加(P<0.05)。此外,与Baicalin组相比,ML385组的SOD活性、GSH-Px活性降低,MDA含量升高,差异有统计学意义(P<0.05)。见图7。
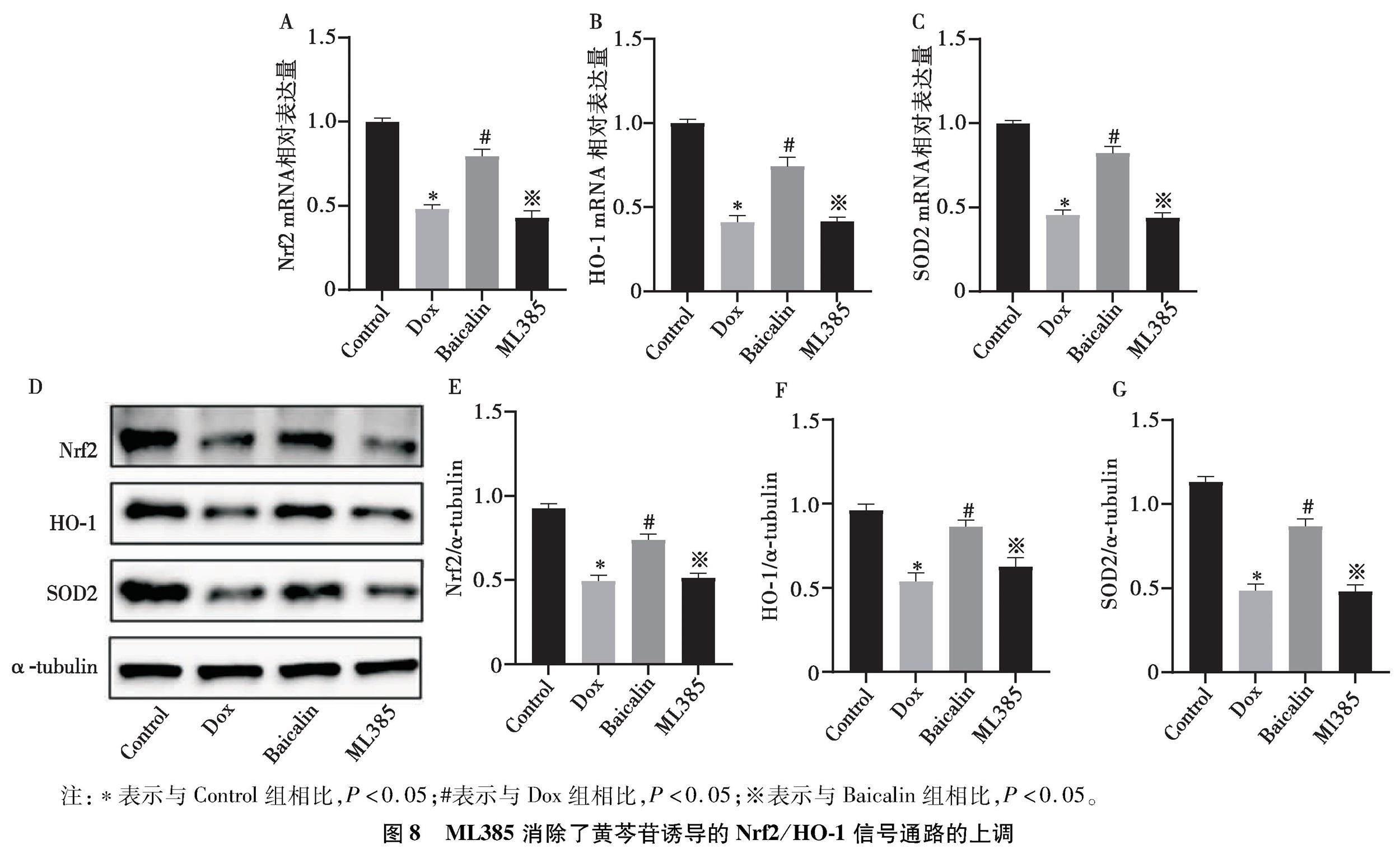
2.8 ML385消除了黄芩苷上调Nrf2/HO-1信号通路的作用
RT-qPCR结果显示,ML385可逆转黄芩苷诱导的Nrf2、HO-1、SOD2基因的表达(P<0.05)。Western blot结果也进一步证实,与Baicalin组相比,ML385组Nrf2、HO-1、SOD2表达降低,提示黄芩苷对Dox诱导的H9c2细胞的抗氧化作用是通过上调Nrf2/HO-1信号通路来实现的(P<0.05)。见图8。
2.9 ML385消除了黄芩苷对Dox诱导的凋亡的保护作用
TUNEL染色和流式细胞学检测显示,加入ML385后黄芩苷对Dox诱导凋亡的保护作用丧失。RT-qPCR和Western blot结果也提示,ML385通过上调Bax、下调Bcl-2的表达,减弱黄芩苷对Dox诱导的凋亡保护作用。见图9和图10。
3 讨论
本研究采用Dox处理H9c2细胞以模拟Dox心肌毒性,结果显示,Dox作用24 h后H9c2细胞活力明显下降,心肌细胞损伤标志物LDH、CK-MB、cTnI水平升高,氧化应激和凋亡水平升高,而黄芩苷可改善Dox导致的细胞活力下降及心肌损伤标志物的升高,并降低氧化应激水平和凋亡水平,具体表现为黄芩苷通过上调Nrf2/HO-1信号通路,增加下游抗氧化酶SOD、GSH-Px的表达,减少ROS的产生,并通过减少C-caspase 3、Bax的表达,上调Bcl-2的表达,减少凋亡的发生,最终保护H9c2细胞免受Dox的损伤。
随着癌症诊疗水平的提升,癌症患者的生存率已大幅提升,然而作为最经典的抗癌化疗药物,Dox引起的心脏毒性已严重影响癌症患者的预后[10]。先前研究[11]显示,Dox对线粒体内膜的心磷脂有较高的亲和力,因此在治疗癌症的同时更容易在富含线粒体的心肌细胞中蓄积。Dox属于蒽环类药物,能被NADH脱氢酶还原,并形成半醌自由基,而这种半醌自由基与游离氧反应,产生大量超氧自由基,使得细胞内氧化系统和抗氧化系统失衡[12]。此外,由于心肌细胞高强度的新陈代谢反应和相对较差的抗氧化防御能力,使得心脏相对于其他脏器更容易受到Dox产生的自由基的损伤。Nrf2是体内调节抗氧化系统的关键分子,发生氧化应激反应时,Nrf2从细胞质转移至细胞核,与抗氧化反应元件结合,激活下游HO-1、醌氧化还原酶1、GSH-Px等抗氧化酶系统的表达,从而提高机体对氧化应激的防御能力[13]。Jiang等[14]表明,Dox诱导的小鼠心肌毒性模型中,Nrf2的表达下调,体内ROS的产生增加。与此一致的是,在实验中也观察到Dox处理后,ROS含量增加,SOD、GSH-Px的水平降低,RT-qPCR实验和Western blot实验也证实了Nrf2在转录水平和蛋白水平的下调,这表明Dox诱导了显著的氧化应激。而黄芩苷干预后,Nrf2的mRNA及蛋白水平得到显著的恢复,并且DHE染色结果及SOD、GSH-Px、MDA的变化也提示氧化应激水平较Dox组明显降低。这提示了黄芩苷减轻Dox诱导的H9c2细胞损伤的机制部分与其抑制氧化应激的作用有关。为进一步验证黄芩苷对Dox诱导的H9c2细胞损伤的保护作用是否是通过上调Nrf2/HO-1信号通路实现,使用了Nrf2的特异性抑制剂ML385来进行下一步实验,结果发现,ML385可增加ROS的产生,降低Nrf2、HO-1、SOD2的表达,抑制黄芩苷的抗氧化应激作用。
研究[15]显示,凋亡也参与Dox诱导的心肌细胞毒性的病理生理过程。Dox发挥抗癌作用的重要机制之一是Dox可与拓扑异构酶Ⅱ(tapoisomeraseⅡ,TopⅡ)结合,TopⅡ有两种形式:TopⅡα和TopⅡβ,其中TopⅡα 在肿瘤细胞中高表达,而TopⅡβ在心肌细胞中高表达。Dox能与心肌细胞中的TopⅡβ及DNA形成复合物,这种三元复合物可诱导心肌细胞DNA双链发生断裂,导致细胞凋亡[16]。另一方面,Dox产生的大量ROS引起线粒体功能障碍、线粒体膜电位转换孔渗透性改变,进而导致细胞色素C的释放。细胞色素C能激活半胱天冬酶的级联反应,导致细胞凋亡。有研究[17]报道,黄芩苷能通过抑制C-caspase 3的表达减少地塞米松诱导的骨髓间充质干细胞凋亡。更重要的是,黄芩苷对过氧化氢或缺氧诱导的H9c2细胞凋亡也有一定程度的保护作用[9,18]。在本研究中,观察到Dox组的凋亡细胞数量增加,C-caspase 3和Bax表达上调,而Bcl-2的表达下降,这验证了Dox的致凋亡作用。而黄芩苷的加入能显著减少凋亡的发生,部分阻止了Dox引起的C-caspase 3和Bax的表达上调以及Bcl-2的表达下调。但ML385的存在使得黄芩苷的抗凋亡作用被抑制。总之,本研究表明黄芩苷可通过抑制促凋亡蛋白的表达以及增加抗凋亡蛋白的表达,减轻Dox诱导的H9c2细胞的凋亡。
综上所述,本研究结果提示,黄芩苷通过激活Nrf2/HO-1信号通路,抑制Dox引起的氧化应激和凋亡,从而降低Dox对H9c2细胞的损伤作用。本研究为蒽环类药物心脏毒性的治疗提供了一种潜在的治疗措施。然而研究结果仅在体外水平得到证实,接下来仍需进行进一步的体内实验。
参考文献
[1]Lefrak EA,Pitha J,Rosenheim S,et al.A clinicopathologic analysis of adriamycin cardiotoxicity[J].Cancer,1973,32(2):302-314.
[2]Christidi E,Brunham LR.Regulated cell death pathways in doxorubicin-induced cardiotoxicity[J].Cell Death Dis,2021,12(4):339.
[3]Ma Q.Role of Nrf2 in oxidative stress and toxicity[J].Annu Rev Pharmacol Toxicol,2013,53:401-426.
[4]Yuan Hsieh DJ,Islam MN,Kuo WW,et al.A combination of isoliquiritigenin with Artemisia argyi and Ohwia caudata water extracts attenuates oxidative stress,inflammation,and apoptosis by modulating Nrf2/Ho-1 signaling pathways in SD rats with doxorubicin-induced acute cardiotoxicity[J].Environ Toxicol,2023,38(12):3026-3042.
[5]Hu S,Liu B,Yang M,et al.Carnosic acid protects against doxorubicin-induced cardiotoxicity through enhancing the Nrf2/HO-1 pathway[J].Food Funct,2023,14(8):3849-3862.
[6]Fang G,Li X,Yang F,et al.Galangin attenuates doxorubicin-induced cardiotoxicity via activating nuclear factor erythroid 2-related factor 2/heme oxygenase 1 signaling pathway to suppress oxidative stress and inflammation[J].Phytother Res,2023,37(12):5854-5870.
[7]Wen Y,Wang Y,Zhao C,et al.The pharmacological efficacy of baicalin in inflammatory diseases[J].Int J Mol Sci,2023,24(11):9317.
[8]Wang X,Yu JY,Sun Y,et al.Baicalin protects LPS-induced blood-brain barrier damage and activates Nrf2-mediated antioxidant stress pathway[J].Int Immunopharmacol,2021,96:107725.
[9]Yu H,Chen B,Ren Q.Baicalin relieves hypoxia-aroused H9c2 cell apoptosis by activating Nrf2/HO-1-mediated HIF1α/BNIP3 pathway[J].Artif Cells Nanomed Biotechnol,2019,47(1):3657-3663.
[10]Curigliano G,Cardinale D,Dent S,et al.Cardiotoxicity of anticancer treatments:epidemiology,detection,and management[J].CA Cancer J Clin,2016,66(4):309-325.
[11]Aryal B,Rao VA.Deficiency in cardiolipin reduces doxorubicin-induced oxidative stress and mitochondrial damage in human B-lymphocytes[J].PLoS One,2016,11(7):e0158376.
[12]Boriev I,Mranovic J,Petrovic D,et al.Nanoformulations of doxorubicin:how far have we come and where do we go from here?[J].Nanotechnology,2018,29(33):332002.
[13]Liu C,Xu X,He X,et al.Activation of the Nrf-2/HO-1 signalling axis can alleviate metabolic syndrome in cardiovascular disease[J].Ann Med,2023,55(2):2284890.
[14]Jiang Q,Chen X,Tian X,et al.Tanshinone Ⅰ inhibits doxorubicin-induced cardiotoxicity by regulating Nrf2 signaling pathway[J].Phytomedicine,2022,106:154439.
[15]Kitakata H,Endo J,Ikura H,et al.Therapeutic targets for DOX-induced cardiomyopathy:role of apoptosis vs.ferroptosis[J].Int J Mol Sci,2022,23(3):1414.
[16]Vejpongsa P,Yeh ET.Topoisomerase 2β:a promising molecular target for primary prevention of anthracycline-induced cardiotoxicity[J].Clin Pharmacol Ther,2014,95(1):45-52.
[17]Jia B,Jiang Y,Yao Y,et al.Baicalin attenuates dexamethasone-induced apoptosis of bone marrow mesenchymal stem cells by activating the hedgehog signaling pathway[J].Chin Med J (Engl),2023,136(15):1839-1847.
[18]Qiu L,Chen J,Lin J,et al.Baicalin alleviates H2O2-induced injury of H9c2 cardiomyocytes through suppression of the Wnt/β-catenin signaling pathway[J].Mol Med Rep,2017,16(6):9251-9255.收稿日期:2023-12-14