miR.200a通过上调Nrf2对老年糖尿病心肌病大鼠心肌的保护作用
杨晓净 肖婷 曹晨 邓向群
摘要 目的: 探讨微小RNA.200a(miR.200a)对老年糖尿病大鼠心肌的保护作用及机制。 方法: 采用高脂饮食+链脲菌素(STZ)诱导大鼠糖尿病心肌病模型,分为对照组和STZ组。通过注射携带miR.200a腺相关病毒9(AAV9)在心肌内过表达miR.200a,分为对照+AAV9.control组、对照+AAV9.miR.200a组、STZ+AAV9.control组、STZ+AAV9.miR.200a组,每组8只。体外培养大鼠心肌细胞H9c2,分为对照组(5.5 mmol/L葡萄糖培养24 h)、高糖+AAV9.control+si RNA组(转染AAV9.control和si RNA 48 h后用33 mmol/L葡萄糖培养24 h)、高糖+AAV9.control+si核因子E2相关因子2(Nrf2)组(转染AAV9.control和si Nrf2 48 h后使用33 mmol/L葡萄糖培养24 h)、高糖+AAV9.miR.200a+siRNA组(转染AAV9.miR.200a和si RNA 48 h后 用33 mmol/L葡萄糖培养24 h)、 高糖+AAV9.miR.200a +si Nrf 2组(转染AAV9.miR.200a和si Nrf2 48 h后用33 mmol/L葡萄糖培养24 h)。使用酶联免疫吸附法(ELISA)试剂盒检测超氧化物歧化酶(SOD)、肌酸激酶同工酶(CK.MB)、乳酸脱氢酶(LDH)、丙二醛(MDA)含量;实时荧光定量聚合酶链式反应(PCR)检测miR.200a表达水平,蛋白免疫印迹法检测相关蛋白表达水平;2′,7′.二氯二氢荧光素二乙酸酯(DCFH.DA)染色检测细胞活性氧(ROS)水平;免疫荧光检测Nrf2表达。 结果: 与对照组比较,STZ组心肌组织miR.200a表达下调( P <0.05)。与对照+AAV9.control组比较,STZ+AAV9.control组心肌组织LDH、CK.MB、MDA水平升高,SOD水平、血红素氧化酶1(HO.1)、细胞核Nrf2蛋白、细胞质Nrf2蛋白表达及Nrf2荧光密度降低( P <0.05)。与STZ+AAV9.control 组比较,STZ+AAV9.miR.200a组心肌组织LDH、CK.MB、 MDA水平及TUNEL阳性细胞率降低,SOD水平、HO.1、细胞核Nrf2蛋白、细胞质Nrf2蛋白表达及Nrf2荧光密度升高( P <0.05)。高糖处理可降低H9c2细胞存活率,提高ROS、MDA、LDH水平( P <0.05);在此基础上转染miR.200a后上述指标被抑制;同时转染miR.200a和si Nrf2后,ROS、MDA、LDH升高,细胞存活率降低( P <0.05)。 结论: miR.200a提高Nrf2表达从而减轻高糖诱导的心肌细胞氧化应激和凋亡,这一效应与Nrf2核易位的促进及下游抗氧化应激信号有关。
关键词 糖尿病心肌病;微小RNA.200a;核因子E2相关因子2;氧化应激;大鼠;实验研究
doi: 10.12102/j.issn.1672.1349.2024.10.008
Protective Effect of miR.200a on Myocardium of Elderly Diabetic Cardiomyopathy Rats by Up.regulating Nrf2
YANG Xiaojing, XIAO Ting, CAO Chen, DENG Xiangqun
Wuhan Third Hospital, Wuhan 430000, Hubei, China
Corresponding Author DENG Xiangqun, E.mail: dengxiangqun@hotmail.com
Abstract Objective: To investigate the protective effect of microRNA.200a(miR.200a) on myocardium of elderly diabetic rats and its mechanism. Methods: The rats diabetic cardiomyopathy model was induced by high.fat diet+streptococcin(STZ) and divided into control group and STZ group.miR.200a was overexpressed in myocardium by injecting miR.200a.carrying adeno.associated virus 9(AAV9),which was divided into control+AAV9.control group,control+AAV9.miR.200a group,STZ+AAV9.control group,and STZ+AAV9.miR.200a group,with 8 rats in each group.The cardiomyocytes H9c2 of rats were cultured in vitro and divided into control group(5.5 mmol/L glucose for 24 h),high glucose+AAV9.control+si RNA group(transfected with AAV9.control and si RNA for 48 h and then cultured with 33 mmol/L glucose for 24 h),high glucose+AAV9.control+si nuclear factor E2.related factor 2(Nrf2) group( transfected with AAV9.control and si Nrf2 for 48 h and incubated with 33 mmol/L glucose for 24 h),high glucose+AAV9.miR.200a+si RNA group(transfected with AAV9.miR.200a and si RNA for 48 h and incubated with 33 mmol/L glucose for 24 h),high glucose+AAV9.miR.200a+si Nrf2 group(transfected with AAV9.miR.200a and si Nrf2 for 48 h and then incubated with 33 mmol/L glucose for 24 h).The levels of superoxide dismutase(SOD),creatine kinase isoenzyme(CK.MB),lactate dehydrogenase(LDH),and malondialdehyde(MDA) were detected using enzyme.linked immunosorbent assay(ELISA).miR.200a expression was detected by real.time fluorescence quantitative polymerase chain reaction(PCR).The protein expression was detected by immunoblotting.The level of reactive oxygen species(ROS) was detected by staining with 2′,7′.dichlorodihydrofluorescein diacetate(DCFH.DA),and Nrf2 expression was detected by immunofluorescence. Results: Compared with the control group,miR.200a expression of myocardial tissue downregulated in the STZ group( P <0.05).Compared with the control+AAV9.control group,levels of LDH,CK.MB,and MDA in the STZ+AAV9.control group were significantly higher,and SOD,heme oxidase.1(HO.1),cytosolic Nrf2 protein,cytoplasmic Nrf2 protein expression,and Nrf2 fluorescence density were significantly lower( P <0.05).Compared with the STZ+AAV9.control group,levels of LDH,CK.MB,MDA and TUNEL.positive cell rate were significantly lower in the STZ+AAV9.miR.200a group,and SOD,HO.1,cytosolic Nrf2 protein,cytoplasmic Nrf2 protein expression and Nrf2 fluorescence density were significantly higher( P <0.05).High.glucose treatment could decrease the survival rate of H9c2 cells and increase the levels of ROS,MDA,and LDH( P <0.05).The levels of the above indexes were opposite expressed after transfection of miR.200a.The simultaneous transfection of miR.200a and si Nrf2 resulted in the elevation of ROS,MDA,and LDH,and the decrease of cell survival rate( P <0.05). Conclusion: miR.200a enhanced Nrf2 expression to attenuate oxidative stress and apoptosis induced by high glucose,which was related to the promotion of Nrf2 nuclear translocation and its downstream anti.oxidative stress signal pathway.
Keywords diabetic cardiomyopathy; microRNA.200a; nuclear factor E2 related factor 2; oxidative stress; rats; experimental study
老年糖尿病性心肌病(elderly diabetic cardiomyopathy, EDC)是糖尿病严重的并发症之一,也是老年人的常见病和多发病,以糖尿病病人心脏结构和功能障碍为特征 [1] 。EDC是糖尿病病人死亡的主要原因,目前尚无有效的策略预防糖尿病的发展。EDC的发病机制涉及多因素,如氧化应激、自噬和焦亡等 [2] 。有研究表明,心肌细胞损伤诱发的氧化应激是EDC病理生理过程的主要因素 [3] 。高血糖、游离脂肪酸和糖基化终产物导致活性氧(reactive oxygen species,ROS)过度释放,被认为是EDC心肌结构和功能损伤的关键 病理信号 [4] 。因此,减轻氧化应激可能是预防EDC的治疗策略。
微小(micro)RNA是高度保守可翻译后修饰mRNA的单链非编码RNA。miRNA失调与高糖引起的心脏毒性有关 [5] 。一项研究表明,miR.200a通过靶向神经胶质瘤中的叉头框蛋白A1(FOXA1)抑制肿瘤 [6] 。miR.200a可减轻氧化应激诱导的心肌坏死 [7] 。核因子E2相关因子2(Nrf2)是调节氧化应激的关键分子,Nrf2从Keap1释放并转移到细胞核以调节抗氧化剂基因,抑制ROS产生 [8] 。有研究表明,miR.200a通过靶向Keap1 mRNA导致Nrf2激活并促进糖尿病病人Keap1 mRNA降解 [9] 。有研究表明,血红素氧化酶1(heme oxidase.1,HO.1)与糖尿病密切相关,其作为Nrf2的下游基因之一,不仅可催化体内血红素的降解,而且参与细胞信号传导、炎症反应和对抗氧化应激的过程,Nrf2通过调控HO.1表达,在抗氧化应激及抗炎中发挥重要作用 [10] 。鉴于miR.200a具有调节氧化应激的功能,miR.200a在EDC中作用的研究报道较少。本研究通过构建糖尿病心肌病大鼠模型,观察miR.200a对疾病的影响并探讨可能的分子机制。
1 材料与方法
1.1 实验材料
大鼠心肌细胞系H9c2购自American Type Culture Collection 公司,miR.200a腺相关病毒(AAV9)购自上海典君生物公司,细胞计数(CCK).8试剂盒购自Solarbio公司,末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL)、乳酸脱氢酶(LDH)试剂盒、逆转录试剂盒购自Roche公司,链脲佐菌素(STZ)购自Sigma.Aldrich 公司,二氢乙锭(DHE)购自武汉塞维尔生物有限公司,杜氏改良Eagle培养基(DMEM)、胎牛血清、胰蛋白酶购自GIBICO公司,超氧化物歧化酶(SOD)、肌酸激酶同工酶(CK.MB)、丙二醛(MDA)购自上海碧云天公司,所有一抗均购自Abcam公司。
1.2 实验动物及分组
选取老年雄性SD大鼠,18~20周龄。将大鼠随机分为对照组、STZ组,各16只。STZ组大鼠尾静脉注射STZ(65 mg/kg)构建糖尿病心肌病模型,对照组大鼠注射等量柠檬酸盐缓冲液。STZ组大鼠 随机分成两组,各8只,分别在注射STZ前1周尾静脉注射1×10 12 病毒拷贝量的AAV9.miRscramble(AAV9.control)或AAV9.miR.200a, 作为STZ+AAV9.control组、STZ+ AAV9.miR.200a组;对照组大鼠随机分为两组,各8只,分别在注射柠檬酸盐缓冲液的1周前尾静脉注射 1×10 12 病毒拷贝量的AAV9.control或AAV9.miR.200a, 作为对照+AAV9.control组、对照+AAV9.miR.200a组。
1.3 细胞培养及分组干预
H9c2细胞在含有10%胎牛血清、1%青霉素.链霉素的DMEM培养基中,37 ℃温度、95%湿度和5% CO 2中培养。H9c2细胞接种至6孔板,每孔1×10 4细胞,常规培养48 h 后,将细胞分为对照组(5.5 mmol/L 葡萄糖培养24 h)、高糖+AAV9.control+si RNA组(转染AAV9.control和si RNA 48 h后用33 mmol/L葡萄糖培养24 h)、高糖+AAV9.control+si Nrf2组(转染AAV9.control和si Nrf2 48 h后用33 mmol/L葡萄糖培养24 h)、高糖+AAV9.miR.200a+si RNA组(转染AAV9.miR.200a和si RNA 48 h后用33 mmol/L葡萄糖培养24 h)、高糖+AAV9.miR.200a +si Nrf2组(转染AAV9.miR.200a和si Nrf2 48 h后用33 mmol/L葡萄糖培养24 h)。
1.4 逆转录实时荧光定量聚合酶链式反应(RT.qPCR)
从心脏组织和各组H9c2细胞中提取总RNA。TRIzol(TaKaRa Bio,Inc.)并通过PrimeScript TM 转化为cDNART预混液。使用SYBR Green PCT Master Mix(TaKaRa Bio,Inc.)的Biosystems Prism 7000检测miR.200a表达水平。
1.5 酶联免疫吸附法(ELISA)检测
收集1.2中各组大鼠心肌组织及1.3中各组H9c2细胞,按照ELISA试剂盒说明书方法检测心肌组织LDH、CK.MB、MDA、SOD水平及H9c2细胞MDA、LDH水平。
1.6 细胞凋亡检测
采用TUNEL染色检测细胞凋亡,在荧光显微镜下观察切片凋亡细胞核占总数百分比,每张切片选取5个随机区域进行统计分析。
1.7 蛋白免疫印迹法(Western Blot)
将大鼠心肌组织按照蛋白提取试剂盒操作说明提取蛋白并定量。将提取后的蛋白进行上样,电泳、转膜、封闭后加入一抗。过夜孵育加入二抗后采用电化学发光(ECL)法显色,检测HO.1、Nrf2表达。
1.8 免疫荧光染色
大鼠心肌石蜡包埋,二甲苯脱蜡,乙醇梯度脱水。抗原100 ℃下修复10 min,切片在37 ℃下用正常山羊血清 (1∶50)渗透并阻断1 h。切片用Nrf2一抗在4 ℃ 下孵育过夜。将相应的辣根酶标记的IgG在37 ℃孵育1 h,4′6.二脒基.2.苯基吲哚(DAPI)原液在室温下孵育10 min,倒置荧光显微镜下观察Nrf2的表达情况。
1.9 CCK.8试剂盒检测细胞活力
H9c2细胞以每孔5×10 3个细胞密度接种在96孔板中;之后转染和48 h处理,加入10 μL CCK.8溶液孵育2 h后,450 nm下测定吸光度。
1.10 ROS检测
37 ℃下通过二氯荧光黄双乙酸盐(DCFH.DA,10 μmol/L)染色30 min,计算DCFH.DA荧光强度测定H9c2细胞ROS水平。
1.11 统计学处理
采用SPSS 22.0统计学软件对数据进行分析,符合正态分布的定量资料以均数±标准差( x ± s )表示,采用单因素方差分析(one.way ANOVA),组间比较采用SNK. q 检验。以 P <0.05为差异有统计学意义。
2 结 果
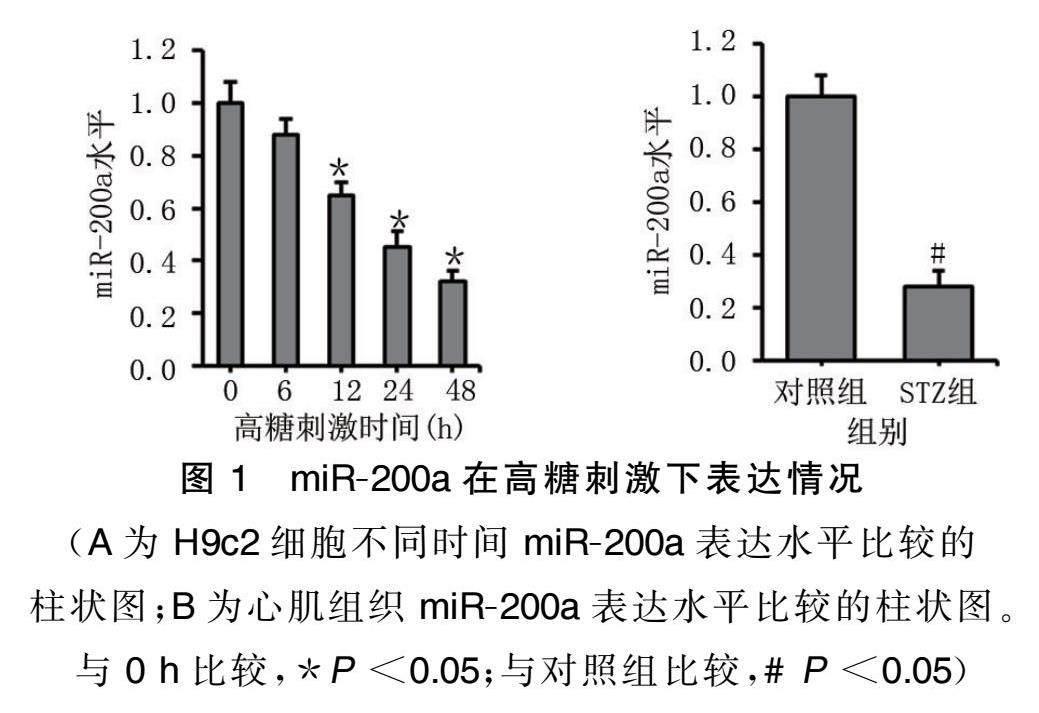
2.1 miR.200a在高糖刺激下表达情况
与0 h比较,高糖刺激H9c2细 胞miR.200a表达水平随着时间的延长而下降,且12、24、48 h的miR.200a 表 达水平降低( P <0.05)。STZ组心肌组织miR.200a 表达 水平较对照组下调( P <0.05)。详见图1。
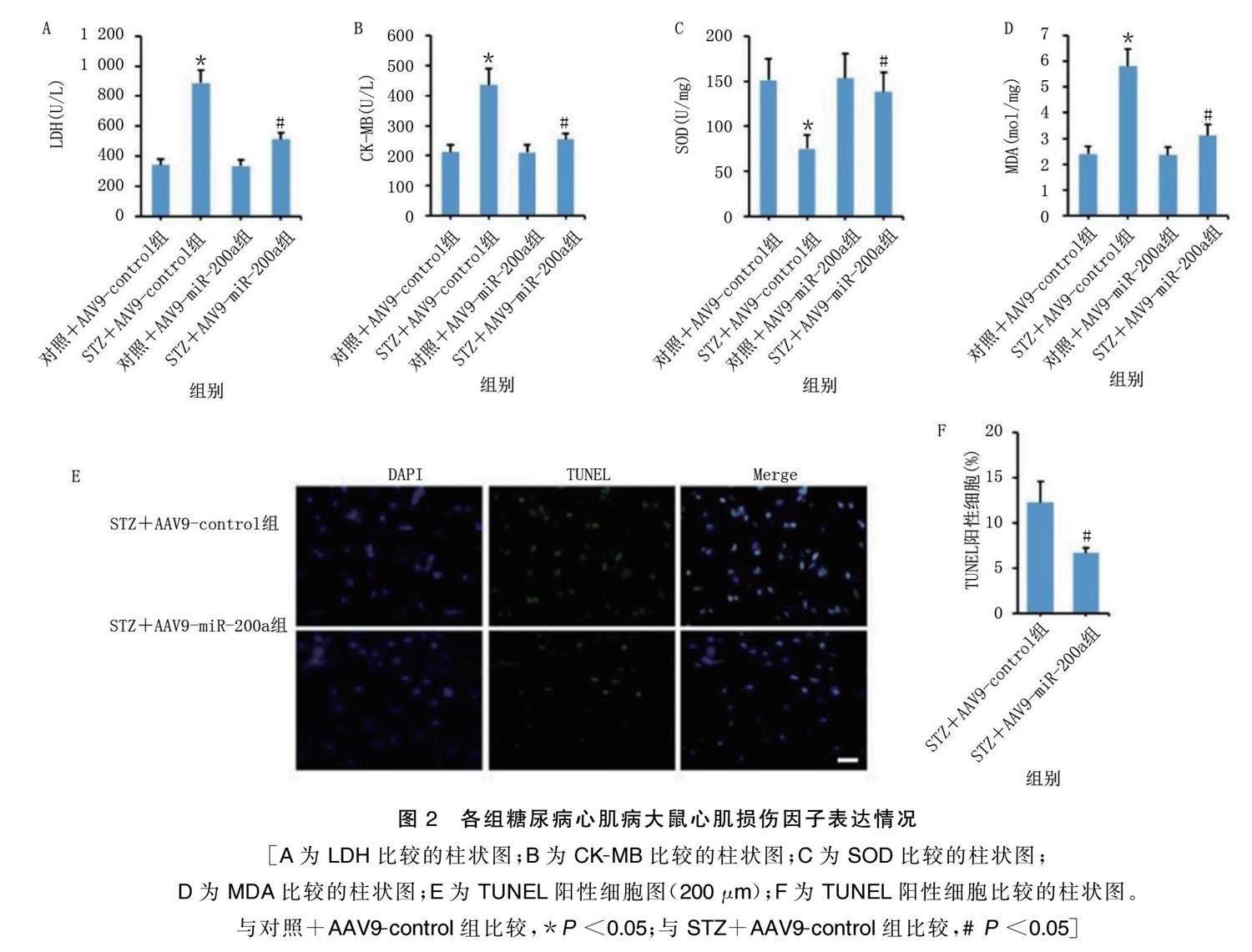
2.2 miR.200a减轻糖尿病心肌病大鼠的心肌损伤
与对照+AAV9.control组比较,STZ+AAV9.control 组心肌组织LDH、CK.MB、MDA水平升高,SOD水平降低( P <0.05)。 与STZ+AAV9.control组比较,STZ+ AAV9.miR.200a组心肌组织LDH、CK.MB、MDA水平及 TUNEL阳性细胞率降低,SOD水平升高( P <0.05)。 详见图2。
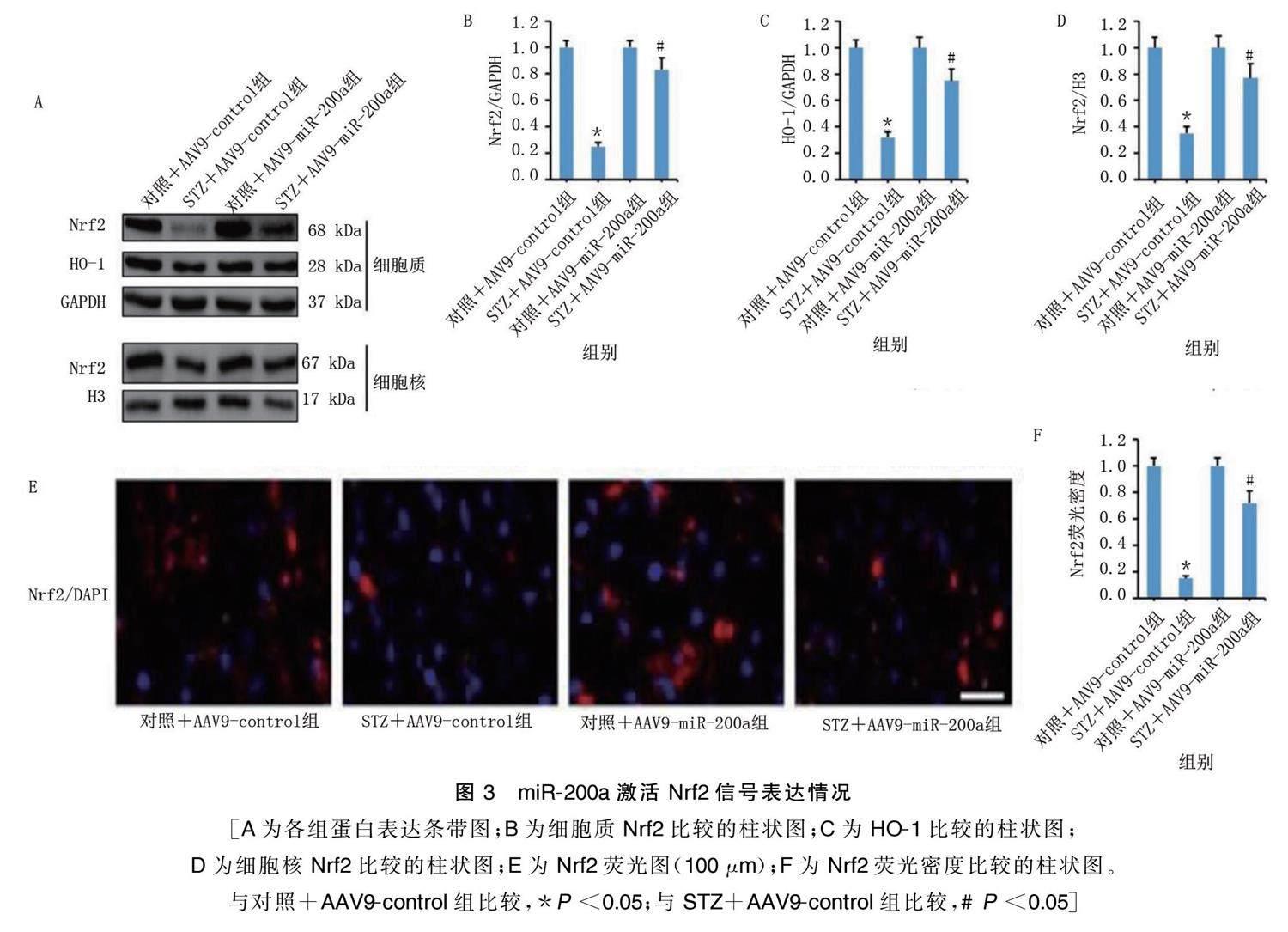
2.3 miR.200a激活Nrf2信号
与对照+AAV9.control组比较,STZ+AAV9.control 组心肌组织HO.1、细胞核Nrf2蛋白、细胞质Nrf2蛋白表达及Nrf2荧光密度降低( P <0.05)。与STZ+AAV9.control组比较,STZ+AAV9.miR.200a组心肌组织HO.1、细胞核Nrf2蛋白、细胞质Nrf2蛋白表达及Nrf2荧光密度升高( P <0.05)。详见图3。
2.4 miR.200a通过Nrf2发挥对心肌细胞的保护作用
与对照组比较,高糖+AAV9.control+si RNA组ROS、MDA、LDH升高,细胞存活率降低( P <0.05);与高糖+AAV9.control+si RNA组比较,高糖+AAV9.control+si Nrf2组ROS、MDA、LDH升高,细胞存活率降低( P <0.05),高糖+AAV9.miR.200a+si RNA组ROS、MDA、LDH降低,细胞存活率升高( P <0.05);与高糖+AAV9.miR.200a+si RNA组比较,高糖+AAV9.miR.200a +si Nrf2组ROS、MDA、LDH升高,细胞存活率降低( P <0.05)。详见表1、图4。
3 讨 论
高血糖引起的氧化应激是导致糖尿病心肌病的关键。STZ诱导的糖尿病大鼠表现为心脏功能障碍,随着促氧化应激物的积聚和抗氧化物的降低 [11] 。高血糖诱导的氧化应激促进了心肌细胞凋亡,最终导致心脏功能障碍。通过恢复Nrf2、HO.1表达和激活Nrf2核转录被证实可显著减轻高糖诱导的心肌损伤 [12] 。
Nrf2是重要的细胞抗氧化转录因子,通过调控下游抗氧化基因表达,对抗氧化应激反应,维持细胞氧化还原稳态 [13] 。本研究结果显示,心脏Nrf2表达在糖尿病大鼠心肌组织表达明显减少,Nrf2抑制蛋白HO.1表达减少。Nrf2被广泛认为是抵抗氧化应激的保护性因素,且已证实糖尿病动物和病人心脏Nrf2表达降低 [14] 。Nrf2一般与细胞质中关联蛋白1(Keap1)结合,Keap1主要负责Nrf2的泛素化和降解。机体抵抗氧化应激时,Nrf2从Keap1释放并转位至细胞核以调节抗氧化剂表达 [15] 。本研究结果显示,Nrf2在糖尿病心肌病的心脏组织中表达降低,伴随核异位减少。恢复Nrf2表达可减轻高糖引起的心脏毒性,因此,靶向调控Nrf2可作为治疗糖尿病心肌病的一种策略。
miRNA是高度保守的单链非编码RNA,通过调控mRNA参与蛋白的翻译后修饰。miRNA失调与多种疾病有关,包括高糖诱导的心脏毒性 [16] 。有研究表明,miR.200a通过靶向Keap1 mRNA激 活Nrf2,促进糖尿病肾病病人Keap1 mRNA降解 [17] 。因此,miR.200a 可能在高糖诱导的心肌损伤中发挥了关键作用。在糖尿病心肌病大鼠中,通过AAV9过表达miR.200a观察miR.200a对心肌细胞氧化损伤和凋亡的影响,探讨miR.200a在糖尿病心肌病中的作用。本研究结果显示,miR.200a在糖尿病心肌病大鼠心肌组织中表达降低,过表达miR.200a可减轻糖尿病心肌病大鼠心肌组织及高糖诱导的心肌细胞中心肌损伤标志物水平,增加凋亡细胞及ROS蓄积。miR.200a可激活Nrf2,且沉默Nrf2后miR.200a失去对氧化应激和细胞的保护作用。
综上所述,miR.200a通过激活Nrf2减轻高糖诱导的氧化应激损伤和细胞死亡,预防糖尿病诱导的心肌损伤。miR.200a补充剂可能作为一种心脏保护剂对抗高糖引起的心脏毒性。
参考文献:
[1] 李华波. 参松养心胶囊改善老年糖尿病性心肌病患者心脏自主神经功能[J].中国老年学杂志,2013,33(2):436.437.
[2] 孙权, 徐伟明,韩雪,等.褪黑素对糖尿病大鼠心功能及氧化应激反应的影响[J].中国老年学杂志,2021,41(3):619.622.
[3] KALUDERCIC N, DI LISA F.Mitochondrial ROS formation in the pathogenesis of diabetic cardiomyopathy[J].Frontiers in Cardiovascular Medicine,2020,7:12.
[4] GUO R, NAIR S.Role of microRNA in diabetic cardiomyopathy:from mechanism to intervention[J].Biochimica et Biophysica Acta Molecular Basis of Disease,2017,1863(8):2070.2077.
[5] KURA B, SZEIFFOVA BACOVA B,KALOCAYOVA B, et al .Oxidative stress.responsive microRNAs in heart injury[J].International Journal of Molecular Sciences,2020,21(1):358.
[6] CHEN X F, LIU K,YANG P, et al .MicroRNA.200a functions as a tumor suppressor by targeting FOXA1 in glioma[J].Experimental and Therapeutic Medicine,2019,17(1):221.229.
[7] ZHAO X J, YU H W,YANG Y Z, et al .Polydatin prevents fructose.induced liver inflammation and lipid deposition through increasing miR.200a to regulate Keap1/Nrf2 pathway[J].Redox Biology,2018,18:124.137.
[8] BELLEZZA I, GIAMBANCO I,MINELLI A, et al .Nrf2.Keap1 signaling in oxidative and reductive stress[J].Biochimica et Biophysica Acta Molecular Cell Research,2018,1865(5):721.733.
[9] SUZUKI T, YAMAMOTO M.Molecular basis of the Keap1.Nrf2 system [J].Free Radical Biology & Medicine,2015,88(Pt B):93.100.
[10] JAIS A, EINWALLNER E,SHARIF O, et al .Heme oxygenase.1 drives metaflammation and insulin resistance in mouse and man[J].Cell,2014,158(1):25.40.
[11] GIACCO F, BROWNLEE M.Oxidative stress and diabetic complications[J].Circulation Research,2010,107(9):1058.1070.
[12] GE Z D, LIAN Q Q,MAO X W, et al .Current status and challenges of NRF2 as a potential therapeutic target for diabetic cardiomyopathy[J].International Heart Journal,2019,60(3):512.520.
[13] SAJADIMAJD S ,KHAZAEI M.Oxidative stress and cancer:the role of Nrf2[J].Current Cancer Drug Targets,2018,18(6):538.557.
[14] CHEN Q M, MALTAGLIATI A J.Nrf2 at the heart of oxidative stress and cardiac protection[J].Physiological Genomics,2018,50(2):77.97.
[15] TAGUCHI K, YAMAMOTO M.The KEAP1.NRF2 system as a molecular target of cancer treatment[J].Cancers,2020,13(1):46.
[16] NANDI S S, MISHRA P K.Targeting miRNA for therapy of juvenile and adult diabetic cardiomyopathy[J].Advances in Experimental Medicine and Biology,2018,1056:47.59.
[17] WEI J, ZHANG Y,LUO Y, et al .Aldose reductase regulates miR.200a.3p/141.3p to coordinate Keap1.Nrf2,Tgfβ1/2,and Zeb1/2 signaling in renal mesangial cells and the renal cortex of diabetic mice[J].Free Radical Biology & Medicine,2014,67:91.102.
(收稿日期:2022.02.07)
(本文编辑 薛妮)

