英夫利西单抗与维得利珠单抗治疗中重度克罗恩病患者的临床疗效比较
梁晓燕 谌黄威 贾柳萍 黄鹤 刘浏

【摘要】目的 比较英夫利西单抗(IFX)与维得利珠单抗(VDZ)治疗中重度克罗恩病(CD)患者的效果,为临床治疗提供参考。方法 选取2022年1月至2022年9月佛山市南海区人民医院收治的25例中重度CD患者的临床资料进行回顾性分析,所有患者均完成52周的评估,根据治疗方法不同分为IFX组(10例)、VDZ组(12例)和免疫抑制剂(MY)组(3例)。比较3组患者的营养状态、炎症因子水平、治疗效果和不良反应发生情况。结果 3组患者BMI、白蛋白(ALB)水平具有时间、交互效应差异,无组间差异;3组患者血红蛋白(Hb)水平具有时间差异,无组间、交互效应差异;3组患者14周和52周的BMI和Hb水平均高于0周(均P<0.05)。0周,IFX组患者超敏 C 反应蛋白(hs-CRP)水平高于VDZ组(P<0.05);3组患者14周和52周的hs-CRP和红细胞沉降率水平比较,差异均无统计学意义(均P>0.05);IFX组患者14周和52周的红细胞沉降率水平低于0周(均P<0.05)。3组患者14周、52周的应答率、缓解率和不良反应总发生率比较,差异均无统计学意义(均P>0.05)。结论 IFX及VDZ均能改善CD患者营养状态和炎症因子水平,IFX可能较VDZ起效更快,但VDZ长期有效率可能优于IFX,且安全性良好。
【关键词】英夫利西单抗;维得利珠单抗;克罗恩病;临床效果
【中图分类号】R57 【文献标识码】A 【文章编号】2096-2665.2024.09.0132.04
DOI:10.3969/j.issn.2096-2665.2024.09.044
克罗恩病(Crohn's disease,CD)是炎症性肠病的一种,CD反复发作可能会导致肠穿孔,需要多次行肠道手术,导致患者逐渐丧失肠道功能[1]。临床治疗重度CD患者主要采用激素诱导后免疫抑制剂维持治疗,但更多研究显示,早期使用生物制剂能提高临床缓解率和黏膜愈合率[2]。指南提出中重度CD患者应尽早使用生物制剂进行治疗[3]。英夫利西单抗(IFX)是最早被批准用于治疗急性中重度CD的抗肿瘤坏死因子-α(TNF-α)药物,对CD患者有较好的疗效[4],维得利珠单抗(VDZ)有助于中重度CD患者达到临床缓解及深度缓解的效果[5]。基于此,本研究比较IFX及VDZ治疗中重度CD患者的效果及安全性,为临床提供参考,现报道如下。
1 资料与方法
1.1 一般资料 选取2022年1月至2022年9月佛山市南海区人民医院收治的25例中重度CD患者的临床资料进行回顾性分析,所有患者均完成52周的评估,根据治疗方法不同分为IFX组(10例)、VDZ组(12例)和免疫抑制剂(MY)组(3例)。IFX组患者中男性6例,女性4例;年龄16~38岁,平均年龄(26.90±8.16)岁。VDZ组患者中男性8例,女性4例;年龄19~52岁,平均年龄(33.83±12.63)岁。MY组患者均为男性;年龄29~47岁,平均年龄(35.67±9.87)岁。3组患者一般资料比较,差异均无统计学意义(均P>0.05),组间具有可比性。本研究经佛山市南海区人民医院医学伦理委员会批准。纳入标准:⑴符合CD的诊断标准[6];⑵年龄16~52岁;⑶简化CD活动指数(CDAI)评分[6]>7分;⑷未使用过任何生物制剂治疗。排除标准:⑴合并严重心、肝及肾功能不全者;⑵合并恶性肿瘤者;⑶合并精神疾病、活动性结核或活动性肝炎病毒、人类免疫缺陷病毒或梅毒感染者;⑷妊娠期或哺乳期者。
1.2 治疗方法 IFX组患者给予IFX进行治疗,在第0、2及6周分别给予IFX(Cilag AG,国药准字SJ20171001,规格:100 mg/支)5 mg/kg进行静脉滴注,最大剂量为400 mg/次,共3次;之后每隔8周给予1次IFX 5 mg/kg进行静脉滴注,最大剂量为400 mg/次。VDZ组患者给予VDZ进行治疗,在第0、2、6周分别给予VDZ(Takeda Pharmaceutical Company Ltd.,注册证号S20200006,规格:300 mg/瓶)进行静脉滴注,300 mg/次,共3次;之后每隔8周给予1次VDZ 300 mg,静脉滴注。MY组患者口服甲泼尼龙进行治疗。给予甲泼尼龙(Pfizer Italia Srl,注册证号H20150245,规格:4 mg/片)0.6~0.8 mg/(kg·d),1周内加用并维持口服硫唑嘌呤(Excella GmbH & Co. KG,国药准字HJ20170288,规格:50 mg/片)50~100 mg,1次/d,如出现白细胞减少则改为口服沙利度胺(常州制药厂有限公司,国药准字H32026129,规格:25 mg/片)25~50 mg/次,1次/d,维持治疗。
1.3 观察指标 ⑴比较3组患者营养状态。观察3组患者0周、14周和52周的BMI、白蛋白(ALB)和血红蛋白(Hb)。采集所有研究对象0周、14周和52周清晨空腹肘静脉血2 mL,采用离心机以3 000 r/min进行离心10 min(离心半径为15 cm),取血清,采用溴甲酚绿法测定ALB水平;采集所有研究对象清晨空腹肘静脉血2 mL,使用血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司,型号:BC-6800)测定Hb水平。⑵比较3组患者炎症因子水平。观察3组患者0周、14周和52周的超敏C反应蛋白(hs-CRP)和红细胞沉降率。血清采集方式同⑴,采用乳胶免疫比浊法检测血清hs-CRP;采集所有研究对象0周、14周和52周清晨空腹肘静脉血2 mL与0.5 mL平衡盐溶液(北京汇恩兰德制药有限公司,国药准字H20233038,规格:500 mL/瓶)混匀后吸入清洁、干燥的标准魏氏血沉管,在室温(18~25 ℃)下严格垂直放置,避免阳光直照、振动和血液外溢,1 h后,读出凹液面底部至沉降红细胞柱顶部之间的距离(mm)即为红细胞沉降率。⑶比较3组患者治疗效果。观察3组患者14周和52周的临床疗效,临床疗效以应答情况与缓解情况进行评估:患者经治疗后简化CDAI评分下降≥3分为应答;患者经治疗后简化CDAI评分下降为缓解;简化CDAI评分不变或升高,则为临床不应答和不缓解[6]。⑷比较3组患者不良反应发生情况。不良反应包括输液反应、膝关节痛、白细胞减少和感染。不良反应总发生率=各项不良反应发生例数之和/总例数×100%。
1.4 统计学分析 采用SPSS 19.0统计学软件进行数据分析。符合正态分布的计量资料以(x) 表示,多组间比较行F检验,不同时间点结果比较采用重复测量方差分析,两两比较采用LSD-t检验;非正态分布的计量资料以[M(P25,P75)]表示,多组间与两组的比较均采用非参数检验;计数资料以[例(%)]表示,多个样本率的多重比较采用 Bonferroni χ2检验。以P<0.05为差异有统计学意义。
2 结果
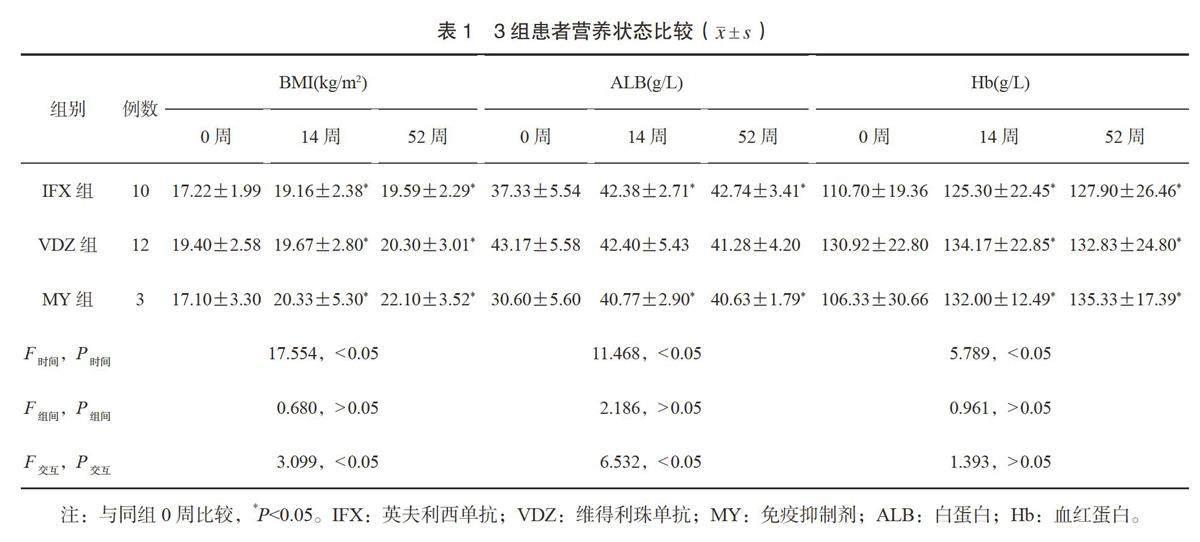
2.1 3组患者营养状态比较 3组患者BMI、ALB水平具有时间、交互效应差异,无组间差异;3组患者Hb水平具有时间差异,无组间、交互效应差异;3组患者14周和52周的BMI和Hb水平均高于0周,差异均有统计学意义(均P<0.05);3组患者14周和52周的BMI、ALB和Hb水平比较,差异均无统计学意义(均P>0.05),见表1。
2.2 3组患者炎症因子水平比较 0周,IFX组患者hs-CRP水平高于VDZ组,差异有统计学意义(P<0.05);3组患者14周和52周的hs-CRP、红细胞沉降率水平比较,差异均无统计学意义(均P>0.05);IFX组患者14周和52周的红细胞沉降率水平低于0周,差异均有统计学意义(均P<0.05),见表2。
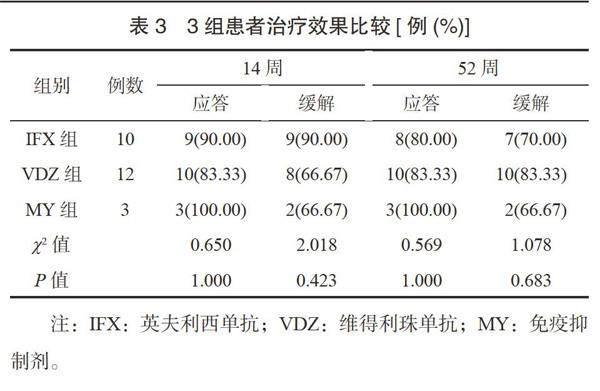
2.3 3组患者治疗效果比较 3组患者14周、52周的应答率和缓解率比较,差异均无统计学意义(均P>0.05),见表3。
2.4 3组患者不良反应发生情况比较 14周,IFX组患者输液反应2例,VDZ组轻度膝关节痛1例,MY组白细胞减少1例;52周,IFX组患者输液反应3例、感染2例,VDZ组轻度膝关节痛2例,MY组白细胞减少1例、感染1例。3组患者14周、52周的不良反应总发生率比较,差异均无统计学意义(χ2值分别为1.781、4.017,均P>0.05)。
3 讨论
CD患者因消化道黏膜损伤,易导致营养物质吸收受阻,进而发生营养不良,BMI、ALB和Hb可用于评价机体的营养状况,反映CD治疗效果及病情变化。本研究结果显示,3组患者BMI、ALB水平具有时间、交互效应差异,无组间差异;3组患者Hb水平具有时间差异,无组间、交互效应差异;3组患者14周和52周的BMI和Hb水平均高于0周,这提示3种治疗方法均能改善中重度CD患者的营养状态。但3组患者14周和52周的BMI、ALB和Hb水平比较,差异均无统计学意义,提示从营养状态方面未能体现治疗方法的优劣性。这可能与营养指标的变化相对滞后于炎症活动有关,也可能与本研究样本量较少有关,需扩大样本量证实。
hs-CRP和红细胞沉降率是反映炎症水平的常用指标,与CD病情活动严重程度呈正相关,本研究结果显示,0周,IFX组患者hs-CRP水平高于VDZ组;3组14周和52周的hs-CRP、红细胞沉降率水平比较,差异均无统计学意义;IFX组14周和52周的红细胞沉降率水平低于0周。这提示IFX较VDZ能在短时间内降低CD患者的炎症水平,但经过一段时间后两者治疗效果持平。有研究显示,VDZ的临床应答率、临床缓解率和黏膜愈合率与抗TNF-α治疗相当[7],但部分研究则指出IFX疗效优于VDZ[8]。本研究结果显示,3组患者14周、52周的应答率、缓解率比较,差异均无统计学意义,其中,VDZ组14周的临床应答率及缓解率均略低于IFX组而52周临床应答率及缓解率均略高于IFX组,差异均无统计学意义。这提示IFX能快速起效,VDZ长期效果与IFX相当,但无统计差异,可能与本研究样本量小有关。分析原因为VDZ可特异性地结合α4β7整合素异源二聚体,但作用靶点为炎症反应上游信号通路,对已分泌的细胞因子没有作用而导致起效慢,但也因该机制,VDZ抗炎作用较为持久;另一方面VDZ抗原性较IFX低,长期使用后失应答率较低[9-10]。本研究结果还显示,3组患者14周、52周的不良反应总发生率比较,差异均无统计学意义,这可能与样本量小有关。IFX组患者不良反应以输液反应、感染为主,VDZ组患者不良反应主要为轻度膝关节痛,IFX较VDZ严重,这提示VDZ治疗CD患者的安全性理想。分析原因与VDZ及IFX的药物特点有关,VDZ是肠道选择性单克隆抗体,可特异性结合α4β7整合素,而IFX选择性较低,不仅在胃肠道上起抑制免疫的作用,还会影响呼吸道、皮肤黏膜等,发生感染及肿瘤风险升高,而且因其人-鼠嵌合体特点,发生过敏、输液反应的概率有一定升高[11-12]。
目前“透壁愈合”已成为治疗CD的最终目标[13],早期使用生物制剂取代“激素+免疫抑制剂”可改善CD患者的预后,且使用免疫抑制剂有可能引起白细胞减少、肝肾功能损害、感染及发生肿瘤,这也是本研究只有少数患者进入MY组的原因。
综上所述,IFX及VDZ均能改善CD患者营养状态和炎症因子水平,IFX可能较VDZ起效更快,但VDZ长期有效率却不劣于甚至可能优于IFX,且安全性良好。
参考文献
李毅.《炎症性肠病外科治疗专家共识》解读:克罗恩病的外科治疗[J].结直肠肛门外科, 2020, 26(6): 644-646.
李青霞,刘立新,郭晓红.抗TNF-α制剂降阶梯治疗克罗恩病的疗效与安全性的Meta分析[J].山西医科大学学报. 2020, 51(12): 1383-1388.
中国炎症性肠病诊疗质控评估中心,中华医学会消化病学分会炎症性肠病学组.生物制剂治疗炎症性肠病专家建议意见[J].中华炎性肠病杂志, 2021, 5(3): 193-206.
兰雨桐,刘威宇,邢俊伟,等.英夫利西单抗治疗中重度活动性克罗恩病的疗效及安全性[J].中国医科大学学报, 2018, 47(4): 333-337.
姜靓婧,陈璐,陈延方,等. 维得利珠单抗治疗活动性克罗恩病疗效观察[J]. 中华消化杂志, 2023, 43(6): 395-400.
中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2018年·北京)[J].中华炎性肠病杂志, 2018, 2(3): 173-190.
张许,高洁,张厚莉,等.维得利珠单抗治疗溃疡性结肠炎的快速卫生技术评估[J].中国医院药学杂志, 2023, 43(19): 2187-2193.
郭婷,党小红.英夫利昔单抗和维多珠单抗治疗炎症性肠病的有效性及安全性比较:间接Meta分析[J].胃肠病学和肝病学杂志, 2022, 31(5): 538-546.
唐健,邓钧,黄梓城,等.单中心回顾性研究维得利珠单克隆抗体治疗活动期克罗恩病的真实世界疗效及安全性[J].中华炎性肠病杂志, 2022, 6(3): 217-222.
王艳,陈延方,陈璐,等. FT3、FT4、FT3/FT4、TSH与克罗恩病维得利珠单抗治疗后临床活动度变化关系的研究[J]. 东南大学学报(医学版), 2023, 42(6): 849-856.
郭婷,党小红. 英夫利昔单抗和维多珠单抗治疗炎症性肠病的有效性及安全性比较:间接Meta分析[J]. 胃肠病学和肝病学杂志, 2022, 31(5): 538-546.
王玉龙,方洒,吴开春,等. 维得利珠单克隆抗体治疗炎症性肠病患者的临床疗效分析[J]. 国际消化病杂志, 2024, 44(1): 24-28, 58.
张明,蒋崇慧.透壁愈合作为评估克罗恩病缓解指标的应用进展[J].中国全科医学, 2020, 23(30): 3884-3887.

