酒精肝与肠道屏障损伤
吴怡 林昂 王丽蕊
酒精性肝病(alcoholic liver disease, ALD)是一种因持续饮酒而引起的肝脏疾病,每年全球有高达50%的肝硬化致死是源于持续的酒精摄入。酒精性肝病按照严重程度可分为相对轻度和可逆的单纯性脂肪肝(fatty liver)和酒精性肝炎(alcoholic hepatitis),以及更严重的肝纤维化(fibrosis)和肝硬化(cirrhosis)。关于酒精性肝病的机制,以往的研究主要集中在酒精代谢产物与脂质过氧化导致的肝细胞凋亡和坏死。近年来,越来越多的研究发现在酒精性肝病患者和实验小鼠的血浆中,一种革兰氏阴性菌分泌的产物内毒素,即脂多糖的含量升高。这让人不禁发问,血浆中的细菌产物从何而来?
肝脏与肠道的联系
解剖学联系
在解剖学上,肠道血液通过门脉系统进入肝脏。十二指肠至结肠左曲以上肠管以及部分胃和胰腺的静脉血汇入肠系膜上静脉,随后,肠系膜上静脉与脾静脉汇合进入门静脉。门静脉是肝脏的营养输入血管,肝脏有75%的血供来自门静脉,因此肠道来源的物质可经门静脉入肝。而肝脏生成的胆汁会通过胆管流入肠道,胆道系统是物质从肝脏转移到肠道的基础。胆道系统始于肝细胞间的毛细胆管,毛细胆管集合成小叶间胆管,然后汇合成左右肝管自肝门出肝。左右肝管出肝后,汇成肝总管,并与胆囊管汇合成胆总管。80%~90%的人胆总管与主胰管在十二指肠壁内汇合,膨大形成胰胆壶腹,从而使肝脏内物质得以转移到肠道。正是基于这样的解剖结构,使得肠道和肝脏之间有了双向的联系。
生理功能联系
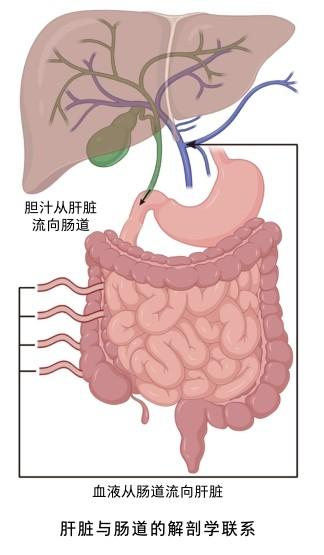
肠道和肝脏在生理功能方面存在着密切的联系。肝脏合成的初级胆汁酸与甘氨酸结合,少部分与牛磺酸结合后生成的次级胆汁酸流入胆囊,在进食后胆汁酸分泌进入肠道,在回肠末端重新被肠上皮细胞吸收进入门脉系统,从而回到肝脏再循环,这是胆汁酸的肠肝循环。从肝脏流入肠道的胆汁酸不仅能帮助吸收脂肪和脂溶性维生素,还对塑造肠道菌群起到关键作用。次级胆汁酸形成后,可在肠上皮通过法尼醇X受体传递信号,进而参与肠道屏障完整性的调控。肠道来源的物质分外源性饮食来源的营养物质与内源性的胆汁酸和氨基酸,它们经肠道菌群作用后可被肠上皮细胞吸收,并通过门静脉进入肝脏储存、代谢或释放进入血液循环。
“肠-肝轴”
肠道与肝脏之间的联系在很久以前就引起了研究者的注意,随着历史的发展,“肠-肝轴”的概念逐渐明确。马歇尔(Marshall)于1998年正式提出“肠-肝轴”的概念:一方面,肠黏膜受到损伤后,肠道细菌及细菌产物会通过门脉系统转移到肝脏;另一方面,肝脏中的免疫细胞,如肝血窦中的巨噬细胞被细菌产物脂多糖等物质激活后,会释放一系列炎症因子到达肠道,引起进一步的损伤[1]。近年来,“肠-肝轴”在酒精性肝病的发生发展机制中的作用越来越受到重视。酒精性肝病常伴有肠道屏障的损伤以及肠道通透性的增加,使得脂多糖等细菌产物有机会从门脉系统向肝脏转移。
肠道屏障的组成和生理功能
人体肠道中存在着数以百万计的肠绒毛,它们如同千里之堤蜿蜒曲折。肠道内黏附了大量细菌,若是有致病菌黏附于肠道,它们便会如同蚂蚁搭建蚁穴一般,使“千里之堤”崩塌,引起肠道屏障的损伤,进而使机体发生一系列疾病。
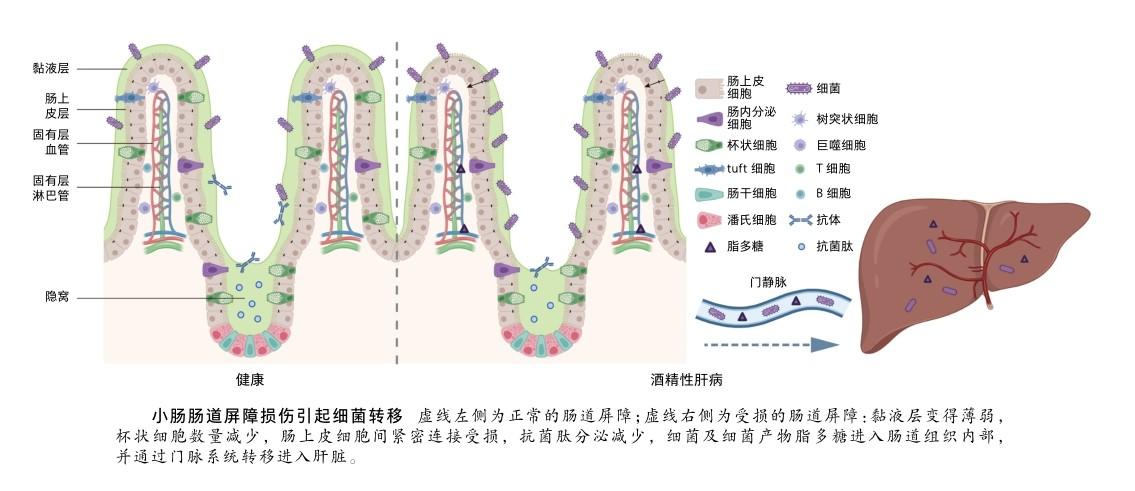
肠道屏障的概念,与肠道的解剖结构有着密切的关系。在肠腔黏液之下,肠道自肠腔由内向外分成了四层,分别是黏膜层(mucosa)、黏膜下层(submucosa)、肌层(muscularis)和浆膜(serosa),其中的黏膜层又分为肠上皮层(epithelium),固有层(lamina propria)与黏膜肌层(muscularis mucosae)。肠上皮由单层上皮细胞组成,固有层则含有大量免疫细胞,以及微血管网络与称之为乳糜管的中央末端淋巴管。肠道屏障主要指的是肠道的黏液屏障,上皮屏障,以及固有层的免疫屏障、血管屏障与淋巴屏障。
肠黏液屏障
肠黏液屏障含有大量黏蛋白组成的黏液,在肠腔内的生理功能主要是减缓肠内容物对肠道的摩擦,将肠道菌群与肠道组织进行物理分隔,是肠道抵御细菌及细菌产物入侵的第一道防线。肠道黏液的分泌是由肠上皮的杯状细胞完成的,杯状细胞产生的黏蛋白是一种高度糖基化的糖蛋白,有5种不同的分泌性黏蛋白分别处于消化道的不同位置,而位于小肠的黏蛋白只有Mucin2。在杯状细胞内,生成的黏蛋白会首先通过分子间的二硫键形成同源寡聚体,随后在内质网完成N-糖基化与C-末端的二聚化,在高尔基体完成O-糖基化,最终在N-末端形成多聚体并组装成分泌型颗粒。杯状细胞分泌的黏蛋白在肠腔的黏液环境中形成了抵御细菌的基质,同时在黏液层中还含有主要由潘氏细胞分泌的a-防御素、溶菌酶,以及包括胰岛再生源蛋白3α和3γ在内的凝集素。这些抗菌分子遍布了整个胃肠道,与黏蛋白组成的凝胶基质共同形成了肠黏液屏障,对肠道组织起到了重要的保护作用[2]。
肠上皮屏障
肠上皮组织包含了数百万个隐窝-绒毛单位,每个单位由一个指状突起的肠绒毛和周围多个内陷的隐窝组成。肠绒毛和隐窝均由单层肠上皮细胞覆盖,单层上皮细胞即可承担着保护肠道组织的屏障功能[2]。肠上皮屏障含有多种不同的细胞类型,分别是组成肠上皮的吸收性上皮细胞、分泌黏液的杯状细胞、分泌激素的肠内分泌细胞、分泌抗菌肽和凝集素的潘氏细胞,以及一种与2型免疫反应有关的分泌性上皮细胞。
吸收性上皮细胞具有面向肠腔的“刷子状”绒毛结构,绒毛顶端具有微绒毛结构,增加了与食物消化物的接触面积,促进了营养物质吸收。肠道上皮细胞之间具有紧密连接结构,使得肠上皮屏障能以单层细胞的形式阻隔肠腔内细菌和肠上皮下方的固有层。肠上皮细胞顶端的紧密连接结构主要由闭锁小带蛋白、闭合蛋白与密封蛋白等紧密连接蛋白组成,朝向基底侧又有E-钙黏蛋白等黏着连接蛋白组成的黏着带和桥粒将上皮细胞连接在一起,限制肠腔内不同分子量的物质通过。肠上皮在隐窝处具有不断分裂的干细胞,这些干细胞分裂成祖细胞最终分化为各种肠上皮细胞,不断地向上移动更新直到肠绒毛顶端,最终发生细胞凋亡并脱落到肠腔[3]。
固有层免疫屏障
固有层的大量免疫细胞构成了肠道的免疫屏障。这些免疫细胞包括巨噬细胞、树突状细胞、T细胞(多为CD4+T细胞)与B细胞(多为效应B细胞,即浆细胞)等。血液循环中的单核细胞逸出血管壁便成为巨噬细胞,巨噬细胞负责吞噬并杀死入侵的微生物,随后将抗原暴露给适应性免疫细胞。巨噬细胞可分泌大量的调节性细胞因子如白介素-10来参与维持肠道的耐受性,避免过度的炎症反应。树突状细胞可伸出突触至肠腔直接获取抗原或从上皮细胞获取抗原,进而将抗原提呈给T细胞和B细胞或直接到达二级淋巴结构派氏结或肠系膜淋巴结。
肠道相关淋巴组织和肠系膜淋巴结中的树突状细胞可进一步促进B细胞分化为产生免疫球蛋白(immunoglobulin, Ig)A(又称抗体)的浆细胞和记忆B细胞。IgA二聚体分泌后穿过肠上皮到达肠腔,与肠道共生菌和病原微生物结合,避免促炎反应的发生并有助于肠道黏膜防御。CD4+T细胞主要包括辅助性T(T helper, Th)细胞17和调节性T细胞,其中的Th17细胞会释放细胞因子IL-17A、IL-17F和IL-22加固肠上皮细胞的紧密连接,并促进上皮细胞再生。在分节丝状菌黏附到肠上皮时,会诱导Th17细胞以促进浆细胞分泌IgA抗体至肠腔[4]。因此,固有层免疫细胞对保护肠道屏障的完整性起到了至关重要的作用。
肠血管屏障
肠血管屏障是斯帕多尼(Spadoni)等在2015年首次提出的,他们证实了肠绒毛固有层的血管具有防止肠道细菌侵入机体血液循环的功能。固有层的肠血管屏障位于肠道深层,可防止细菌和有害毒素进入人体血液循环系统。与肠道上皮细胞一样,肠道血管的单层内皮细胞也有紧密连接与黏着连接结构严格限制物质进出,维持屏障的完整性。肠血管屏障不允许分子量大于70千道尔顿的物质通过,从而阻断肠腔内细菌转移到机体血液循环。
在肠血管内皮细胞的周围包绕着表达结蛋白的周细胞和表达胶质纤维酸性蛋白的肠神经胶质细胞。其中,肠神经胶质细胞可通过与肠神经元的交互作用和释放可溶性因子(如S-亚硝基谷胱甘肽)的方式来帮助维持肠道屏障的完整性。缺乏肠神经胶质细胞的小鼠,其肠上皮的通透性增加,并伴随细菌转移进入血液循环。与血脑屏障类似,经典Wnt/β-catenin信号通路也是维持肠血管屏障完整性的重要因素。
肠淋巴屏障
肠道固有层的中央乳糜管是由单层淋巴内皮细胞构成的盲端,具有通透性的毛细淋巴管,在这里生成的淋巴液沿着集合淋巴管汇总到淋巴干,最终到达胸导管并返回血液循环。毛细淋巴管的内皮细胞通过细胞间不连续的纽扣连接结构形成瓣膜,促使淋巴液单向流动。正是这种不连续的内皮细胞结构,使得固有层的树突状细胞得以获取肠腔内抗原后转移进入肠系膜淋巴管,并到达肠系膜淋巴结进行抗原清除。这便是健康状态下对机体免疫至关重要的一个生理过程。近年来,有学者研究转录因子FOXC2对成人淋巴管内皮细胞的特化作用时曾提及“肠淋巴屏障”这一名词,但还未有学者对肠淋巴屏障的概念做出明确定义。
肠道屏障损伤与酒精肝发生发展的机制
肠黏液屏障与酒精肝
在正常情况下,肠黏液屏障通过分泌黏液起到保护肠上皮的作用。而在酒精性肝病的情况下,肠道黏液层变得薄弱,杯状细胞数量有所减少,并且黏液层的细菌多样性有所增加,个别细菌的数量有所增多,例如革兰氏阴性菌普雷沃氏菌(Prevotella)不仅在回肠黏液层增多,在肝脏中也同样增多[6]。在小鼠实验性酒精性肝病的发生发展过程中,相比对照野生型小鼠,Muc2基因敲除的小鼠表现出更轻的肝损伤,血浆脂多糖水平显著降低。与野生型小鼠相比,喂食等热量饮食或酒精的Muc2基因敲除小鼠的空肠中,抗菌肽的表达水平显著升高,提示Muc2的敲除使得肠道对细菌的杀伤作用增强,进而维持肠道稳态。
酒精还会损害肠道中起到抗菌防御作用的蛋白质。人长期饮酒或小鼠酒精喂养会抑制抗菌肽Reg3β和Reg3γ的表达,从而使细菌在黏膜表面的黏附增多,肠道细菌过度生长。另外,补充益生菌,如嗜黏蛋白-阿克曼氏菌可以逆转急性酒精摄入小鼠的肠道微生态紊乱,并促进肠道黏液分泌,提升肠道屏障的完整性[7]。
肠上皮屏障与酒精肝
肠上皮屏障通过上皮细胞之间的紧密连接结构严格限制肠腔内物质进入肠道,对维持肠上皮屏障的完整性十分重要。相比于对照组,在酒精暴露的大鼠肠上皮中,紧密连接蛋白ZO-1、claudin-1和claudin-4显著降低,黏着连接蛋白β-catenin和E-cadherin,以及桥粒斑蛋白和诸如α-微管蛋白的连接蛋白等均有显著降低,但在CYP2E1基因敲除的小鼠中未发现这样的现象,这说明CYP2E1蛋白质可增强肠上皮屏障完整性。
与此同时,在酒精饲料喂养时,小鼠结肠的紧密连接蛋白claudin-3和occludin的表达降低,但通过嗜黏蛋白-阿克曼氏菌的治疗可以逆转此现象[8]。同时,一种益生菌混合物VSL#3可以通过降低肿瘤坏死因子-α的表达来改善慢性酒精摄入小鼠的肠上皮屏障,这说明有益的肠道菌群对肠道屏障也具有保护作用。此外,研究还发现缺锌饮食可使酒精喂养的小鼠肠上皮屏障功能受损,而补充锌可恢复酒精诱导的肠上皮屏障功能障碍[9]。
固有层免疫屏障与酒精肝
长期酗酒的人或是长期酒精饲养的小鼠均会发生肠道炎症,其空肠固有层中分泌TNF-a的单核细胞与巨噬细胞数量均显著增多。而酒精依赖患者十二指肠中的巨噬细胞数量减少,或与肠道微生物的转移有关。然而,目前尚不清楚十二指肠巨噬细胞数量的减少是由于常驻巨噬细胞减少还是浸润单核细胞减少。
长期酒精饲养的恒河猴的骨髓树突状细胞循环池数量减少,同时,共刺激分子,如CD83受到抑制,这可能削弱树突状细胞促进T细胞增殖的能力。在小鼠酒精诱导的肝病实验模型中,分泌IgA抗体的肠道浆细胞数量减少。在长期饮酒的受试者中,十二指肠的T淋巴细胞的数量减少,Th1与Th17相关细胞因子的基因表达水平保持不变,可能说明T细胞的促炎反应并非细菌转移的驱动因素。与微生物免疫监测缺陷相关的适应性免疫受损不仅发生在酒精性肝病的早期阶段,在晚期的肝炎和肝硬化阶段也很常见。酒精性肝病晚期患者的黏膜相关恒定T细胞数量减少,导致机体抗菌功能和细胞毒性反应受损[4]。因此,在酒精性肝病的不同阶段,不同类型的固有层免疫细胞的数量和功能均有所变化,肠道固有层免疫屏障受损。
肠血管屏障与酒精肝
由于肠上皮下方固有层的肠血管屏障可阻止细菌进入门静脉并到达肝脏,因此即使细菌能够穿过肠黏液屏障和肠上皮屏障并不被固有层免疫细胞捕获,也只有少数细菌能进入机体血液循环。而一些致病菌,如沙门氏菌已经进化出了逃避这种屏障的策略。除此之外,这一屏障在某些病理条件,如乳糜泻、强直性脊柱炎以及非酒精性脂肪肝炎下也会被破坏。研究发现在小鼠实验性酒精性肝病的情况下,回肠PLVAP蛋白质的表达显著升高,说明肠道血管的通透性增高,肠血管屏障受损,而补充嗜黏蛋白-阿克曼氏菌后,可恢复肠血管屏障的完整性[10]。
肠淋巴屏障与酒精肝
在酒精性肝病情况下,目前对肠淋巴屏障的研究尚不充分。有研究显示,长期酒精摄入会使肠系膜淋巴管周围脂肪组织的树突状细胞、CD4+ T细胞和调节性T细胞的出现频率增加,这可能意味着肠系膜淋巴管的通透性增加。而在酒精性肝病的最严重阶段,即肝硬化的情况下,细菌转移至肠系膜淋巴结的淋巴途径与通过门静脉入肝的血管途径是并存的。
总结和展望
“肠-肝轴”在酒精性肝病的发生发展过程中起到了重要的作用,而肠道屏障的削弱给了肠道内细菌及细菌产物通过肠-肝轴侵入人体的机会。在酒精性肝病的情况下,肠黏液屏障、肠上皮屏障、肠血管屏障与起到抗菌防御作用的固有层免疫屏障均受到了不同程度的损伤,而多项研究表明逆转肠道屏障的损伤,保护肠道屏障完整性能够缓解酒精肝,这也为酒精性肝病的治疗提供了新的思路。除了关注疾病本身,未来或许还可以通过提高肠道屏障完整性的方式来实现肝病肠治。
[1]Marshall J C. The gut as a potential trigger of exercise-induced inflammatory responses. Canadian Journal of Physiology and Pharmacology, 1998, 76(5): 479-484.
[2]McGuckin M A, Lindén S K, Sutton P, et al. Mucin dynamics and enteric pathogens. Nature Reviews Microbiology, 2011, 9(4): 265–278.
[3]Gehart H, Clevers H. Tales from the crypt: new insights into intestinal stem cells. Nature Reviews Gastroenterology & Hepatology, 2019, 16(1): 19–34.
[4]Maccioni L, Leclercq I A, Schnabl B, et al. Host factors in dysregulation of the gut barrier function during alcohol-associated liver disease. International Journal of Molecular Sciences, 2021, 22(23): 12687.
[5]Spadoni I, Zagato E, Bertocchi A, et al. A gut-vascular barrier controls the systemic dissemination of bacteria. Science, 2015, 350(6262): 830-834.
[6]Bluemel S, Wang L, Kuelbs C, et al. Intestinal and hepatic microbiota changes associated with chronic ethanol administration in mice. Gut Microbes, 2020, 11(3): 265–275.
[7]Liu H, Kang X, Yang X, et al. Compound probiotic ameliorates acute alcoholic liver disease in mice by modulating gut microbiota and maintaining intestinal barrier. Probiotics and Antimicrobial Proteins, 2023, 15(1): 185–201.
[8]Grander C, Adolph T E, Wieser V, et al. Recovery of ethanolinduced Akkermansia muciniphila depletion ameliorates alcoholic liver disease. Gut, 2018, 67(5): 891–901.
[9]Zhong W, Zhao Y, Sun X, et al. Dietary zinc deficiency exaggerates ethanol-induced liver injury in mice: Involvement of intrahepatic and extrahepatic factors. PLoS One, 2013, 8(10): e76522.
[10]Grander C, Grabherr F, Spadoni I, et al. The role of gut vascular barrier in experimental alcoholic liver disease and A. muciniphila supplementation. Gut Microbes, 2020, 12(1): 1851986.
关键词:肠道屏障 酒精肝 肠-肝轴 菌群转移 ■

