流式细胞仪鉴定青钱柳倍性方法的建立及其应用
收稿日期Received:2023-02-14""" 修回日期Accepted:2023-03-23
基金项目:国家自然科学基金项目(31971642,32271959);江苏省重点研发计划(现代农业)重点项目(BE2019388)。
第一作者:宋子琪(2632583724@qq.com)。
*通信作者:尚旭岚(shangxulan@njfu.edu.cn),副教授。
引文格式:
宋子琪,卞国良,林峰,等. 流式细胞仪鉴定青钱柳倍性方法的建立及其应用. 南京林业大学学报(自然科学版),2024,48(2):61-68.
SONG Z Q,BIAN G L,LIN F, et al. Establishment and application of a flow cytometry method for chromosome ploidy identification of Cyclocarya paliurus. Journal of Nanjing Forestry University (Natural Sciences Edition),2024,48(2):61-68.
DOI:10.12302/j.issn.1000-2006.202302014.
摘要:【目的】利用流式细胞仪检测青钱柳(Cyclocarya paliurus)的染色体倍性,为青钱柳种质鉴定及遗传育种研究提供技术支持和基础数据。【方法】以青钱柳叶片为材料,比较了裂解液种类、离心处理和叶片保存方式对倍性检测效果的影响。建立的青钱柳流式细胞分析倍性的方法为:取参照样本和待测样本叶片各0.50~1.00 cm2,加入1 mL的mGb裂解液中快速切碎,过滤后加入20 μL的碘化丙啶(PI)染色1 min即可上机检测。利用建立的方法对1 395份青钱柳种质资源的倍性进行检测。【结果】mGb裂解液的裂解效果最好,峰图质量最优。细胞核悬浮液过滤后可无需离心而直接染色并进行测定。4" ℃冷藏叶片的测定效果最佳,保存时间以7 d为宜。硅胶干燥样本测定效果优于冷冻,硅胶干燥保存时间以150 d为宜。100份试验样本的DNA含量峰值的变异系数(CV)值为2.13%~5.04%,倍性估算值为1.80~2.40的样本判断为二倍体,倍性估算值为3.60~4.20的样本判断为四倍体。倍性估算值为3.00±0.40时,需采用与初判倍性相同的参照样本进行第2次标定。对1 395份青钱柳种质资源进行倍性鉴定,共检测出二倍体104份,四倍体1 291份。【结论】对于倍性估算值异常的样本,采用二次标定法可快速确定其倍性。该方法操作简单,高效准确,为青钱柳种质倍性鉴定提供了有效方法。
关键词:青钱柳;倍性鉴定;流式细胞术;细胞核裂解液;内标法
中图分类号:S722""""""" 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)02-0061-08
Establishment and application of a flow cytometry method for chromosome ploidy identification" of Cyclocarya paliurus
SONG Ziqi1,2, BIAN Guoliang1, LIN Feng3, HU Fengrong4, SHANG Xulan1*
(1. Co-Innovation Center for Sustainable Forestry in Southern China, College of Forestry and Grassland, Nanjing Forestry University, Nanjing 210037, China; 2. Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210018, China; 3. Advanced Analysis and Testing Center, Nanjing Forestry University, Nanjing 210037, China; 4. College of Landscape Architecture, Nanjing Forestry University, Nanjing 210037, China)
Abstract: 【Objective】 In order to provide a technical support and basic data for germplasm identification and genetic breeding of C. paliurus, this study determined the chromosome ploidy by using flow cytometry. 【Method】 Leaves of C. paliurus were used as materials to compare the ploidy detection effects of nuclei isolation buffers, centrifugation treatments and preserved ways of leaves, and the ploidy of 1395 C.paliurus germplasm resources was determined by the established method. 【Results】 mGb buffer was the best for nuclei isolation, and the nucleus suspension prepared by it has the clearest peak. Nuclear suspensions could be directly stained after filtration without centrifugation treatment. The detection effect of leaves preserved at 4" ℃ was the best, and the suitable storage time was 7 d. The test effect of dried leaves by silica gel was better than that by freezing, and the suitable storage time by silica gel drying was 150 d. CV values of 100 test samples ranged from 2.13% to 5.04%. If the estimated value of ploidy was 1.80~2.40, and this sample was identified as diploid. If the estimated value of ploidy was 3.60~4.20, and this sample was identified as tetraploid. When the estimated value of ploidy was 3.00±0.40, the reference sample with the same ploidy as the initial judgment should be used for the second detection. By using the above established method for ploidy identification of 1395 germplasm resources 104 diploids and 1291 tetraploids were detected. 【Conclusion】 The ploidy identification of C. paliurus by using flow cytometry was as follows: 0.50~1.00 cm2 leaves of the reference sample and the test sample were mixed and chopped with 1 mL of mGb buffer. After filtration, 20 μL PI was added for staining for 1 min. For the samples with abnormal estimated value of ploidy, they could be identified quickly by the second detection" with the same ploidy standard together. The method is simple, efficient and accurate, which provides an effective method for ploidy identification of C. paliurus germplasm.
【Objective】 To provide technical support and basic data for the germplasm identification and genetic breeding of Cyclocarya paliurus, this study determined the chromosome ploidy using flow cytometry. 【Method】 C. paliurus leaves were used as study materials to compare the ploidy detection effects of different nuclei isolation buffers, centrifugation treatments, and leaf preservation methods. The ploidy identification method for C. paliurus using flow cytometry was as follows: 0.50-1.00 cm2 leaves of the reference sample and the test sample were mixed and chopped with 1 mL of mGb buffer. After filtration, 20 μL PI was added for staining for 1 min. The ploidy of 1 395 C. paliurus germplasm resources was determined by the established method. 【Result】 The optimal choice for isolating nuclei and achieving a clear peak in the resulting nucleus suspension was the use of Modified Gitschier buffer (mGb). Nuclear suspensions could be directly stained after filtration without centrifugation treatment. The optimal detection effect was obtained for leaves preserved at 4 ℃, and the most suitable storage time was 7 d. Drying leaves with silica gel yielded superior test results compared to freezing them, and the most suitable storage time for silica gel drying was 150 d. The coefficients of variation of 100 test samples ranged from 2.13% to 5.04%. If the estimated value of ploidy was 1.80-2.40, the sample was identified as diploid. If the estimated value of ploidy was 3.60-4.20, the sample was identified as tetraploid. When the estimated value of ploidy was 3.00 ± 0.40, the reference sample with the same ploidy as the initial judgment was used for the second detection. Using this method for the ploidy identification of 1 395 germplasm resources 104 diploids and 1 291 tetraploids were detected. 【Conclusion】Samples with an abnormal estimated value of ploidy could be identified quickly by the second detection with the same ploidy standard. The method is simple, efficient, and accurate, and provides an effective method for ploidy identification of C. paliurus germplasm.
Keywords:Cyclocarya paliurus; ploidy identification; flow cytometry; nuclei isolation buffer; internal standard method
青钱柳(Cyclocarya paliurus)系胡桃科青钱柳属,是我国特有的单种属植物,广泛分布于江西、福建、浙江、安徽、湖南、湖北、四川、贵州、广东和广西等亚热带地区。青钱柳是一种高大速生乔木,树姿优美,果似铜钱,是优良的观赏绿化树种;其木材强度大、纹理直、切面光滑,是家具良材。此外,青钱柳叶片中含有丰富的次生代谢产物,不仅具有抗氧化、增强免疫力和抗衰老等保健价值,还具有显著的降血糖、降血压和降血脂等药用功效。Qu等研究发现,青钱柳存在二倍体和四倍体两种细胞型。这种多倍化现象通过基因组复制改变植物表型和生理生化特征,是植物进化和物种形成的主要驱动力。植物多倍体常表现出细胞体积增大、叶片增大变厚和代谢物含量增多等特征。有研究表明,杜仲(Eucommia ulmoides)、丹参(Salvia miltiorrhiza)、山茶(Camellia japonica)和紫雏菊(Echinacea purpurea)等多倍化植株的药效成分含量均有大幅度提高,且四倍体青钱柳中的萜类化合物含量高于二倍体。因此,在进行青钱柳种质资源选育与利用时,其倍性鉴定非常重要。
染色体倍性鉴定方法包括形态学鉴定、细胞学鉴定和分子水平鉴定等。其中,染色体计数法是最直接且最准确的鉴定方法,但过程比较复杂,对试验操作能力要求较高,耗时较长。近年来,使用荧光标记细胞核悬浮液的流式细胞术鉴定倍性的方法被广泛应用,该方法对取样时间和取样技术要求较低,制备过程简单,是目前效率较高的倍性检测方法。流式细胞分析成功的关键是制备出可供检测的细胞核悬浮液,悬浮液质量受到细胞核裂解液和制备方法的影响,常因物种不同而异。目前,对青钱柳的流式细胞术方法还缺乏系统研究。本研究以青钱柳叶片为材料,比较细胞核裂解液种类、制备方法和叶片保存方式等对检测效果的影响,建立了快速、准确、高效的青钱柳倍性鉴定方法,并使用该方法对青钱柳种质资源进行鉴定,以期为青钱柳的倍性育种和开发利用提供技术支撑。
1" 材料与方法
1.1" 试验材料
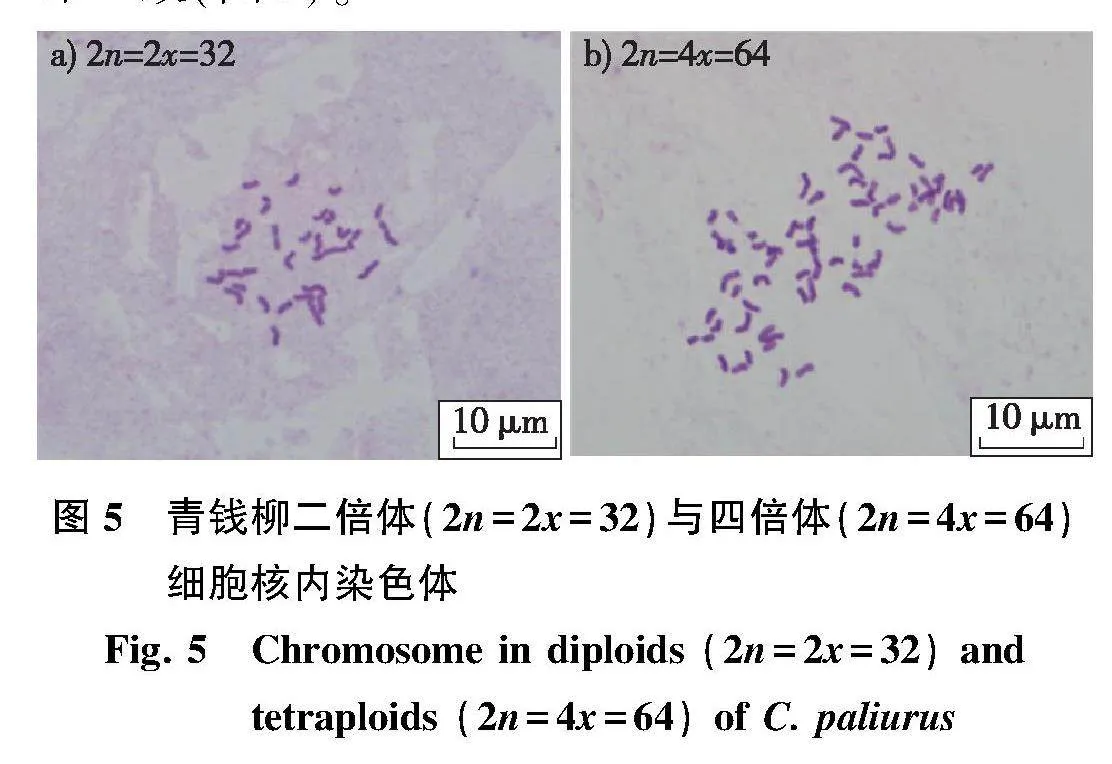
以南京林业大学青钱柳种质资源库中经全基因组测序的二倍体(2n=2x=32)和四倍体(2n=4x=64)植株为参照样本。以采自南京林业大学青钱柳种质资源库的安徽省清凉峰种源15年生四倍体植株幼叶用于青钱柳倍性鉴定方法的优化;以100份采自南京林业大学温室的湖北省五峰种源2根1干盆栽苗幼叶用于该方法的验证试验。1 395份倍性未知的种质材料包括:1 087份(包含15个种源)采自南京林业大学青钱柳种质资源库的15年生植株,308份采自安徽、湖北、四川、江西和广西等5个省/区的天然群落植株。
1.2" 流式细胞术方法的建立
1.2.1" 鉴定流程
参考Galbraith的测定方法并改进。使用非生物标准样本塑料微球在仪器中标定参照二倍体和参照四倍体于峰值直方图中横坐标的相对位置(相对荧光强度),随后对待测样本进行单样测定,通过出峰的相对位置初步判断其倍性,再以与初判倍性不同的参照样本为内标对待测样本进行混样测定。
样品制备和检测过程为:分别取0.50~1.00 cm2的参照(CK)和待测(S)样本叶片(避开主脉),置于冰上的培养皿中,加入预冷的裂解液1 mL,用锋利的双面刀片快速垂直切碎叶片,此过程尽量将材料浸没于裂解液中。吸取混合溶液经孔径0.04 mm滤网过滤,转移至测定管内,得到细胞核悬浮液,加入20 μL的碘化丙啶(PI)染料,混匀后4" ℃避光染色1 min,随后使用Influx流式细胞仪(BD,美国)进行检测。染色的样品经488 nm波长光激发,收集FL2通道(670/30)的荧光,检测PI发射的荧光强度。检测过程中,对每个测试样品低速收集5 000~10 000个细胞核。
1.2.2" 裂解液的筛选方法
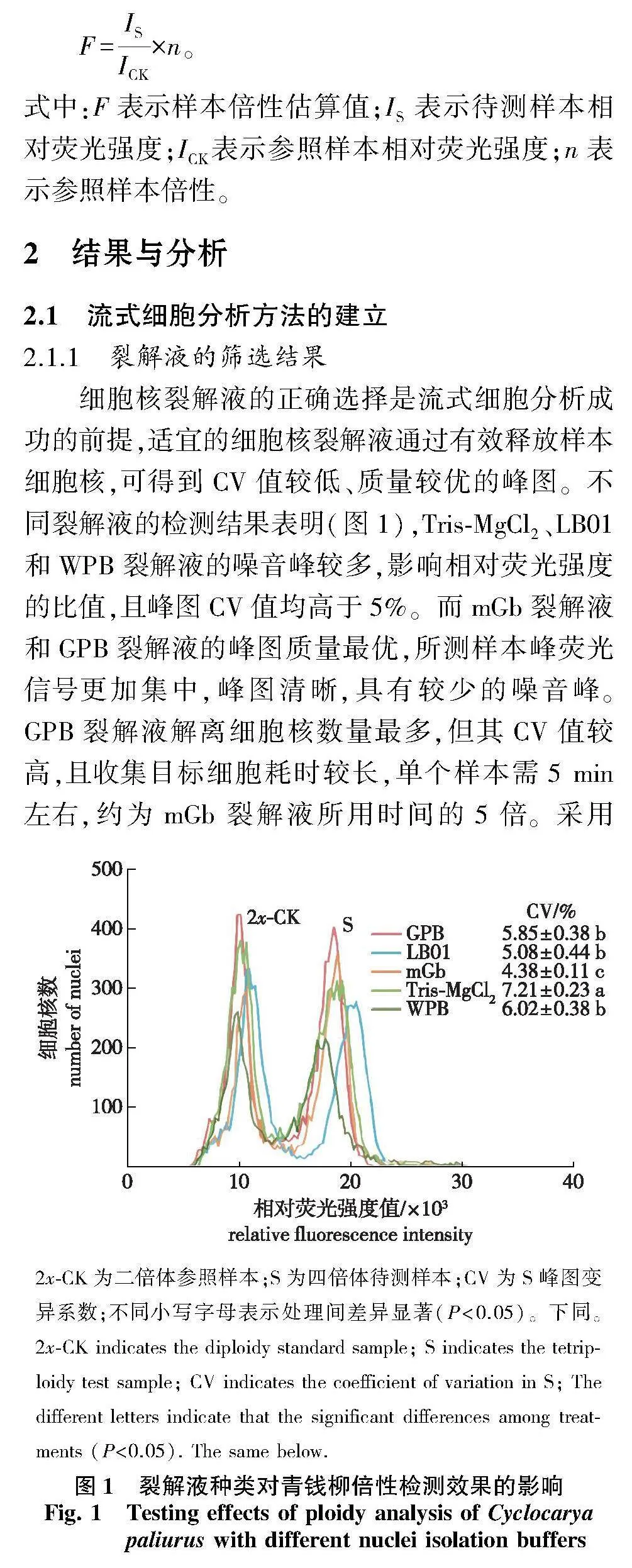
分别取新鲜参照和待测样本叶片0.50~1.00 cm2,参考不同细胞核裂解液配方及适用植物,选用LB01、GPB、mGb、Tris-MgCl2和WPB裂解液(均购于北京雷根生物技术有限公司),每个处理重复3次,比较不同裂解液对检测效果的影响。试验流程同1.2.1。
1.2.3" 离心方案的优化
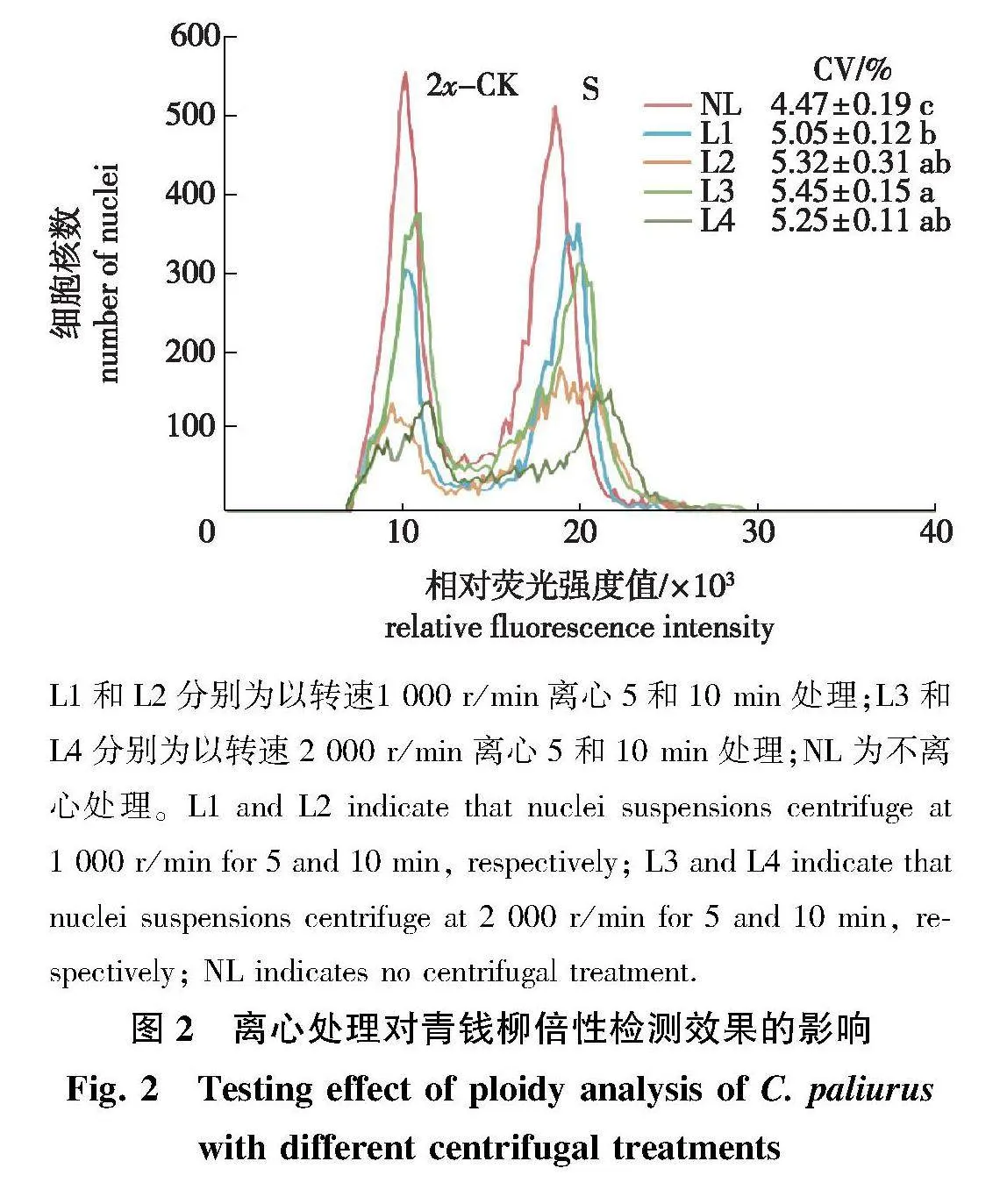
分别取新鲜的参照叶片和待测样本叶片0.50~1.00 cm2,加入1 mL预冷的mGb裂解液快速切碎,过滤至1.50 mL的EP管中进行4" ℃离心处理,离心结束后去上清,保留100 μL沉淀,加入100 μL预冷的裂解液,再加入20 μL预冷的PI染料,混匀后4" ℃避光染色1 min,上机检测。共设置4个离心处理,分别为:以转速1 000 r/min离心5 min(L1),以转速1 000 r/min离心10 min(L2),以转速2 000 r/min离心5 min(L3)和以转速2 000 r/min离心10 min(L4)。以过滤后直接染色不离心的样本作为对照(NL),每个处理重复3次。
1.2.4" 样本保存方式的比较
按照1.2.1的试验流程,取冷藏(4" ℃)、冷冻(-20、-40和-80" ℃)和室温硅胶干燥5种保存方式(均保存7 d)的叶片0.50~1.00 cm2,比较不同保存方式对检测效果的影响。取硅胶干燥7、50、100、150和200 d的叶片0.50~1.00 cm2,比较硅胶干燥保存时间对检测效果的影响。每个处理重复3次。
1.2.5" 方法验证
利用已经优化的流式细胞分析方法,以100株盆栽苗的幼叶进行上机检测。根据倍性估算公式,得出样本的倍性。在取叶样的同时取各植株侧芽茎尖或幼叶参考韩杰等的常规染色体压片法进行制片,镜检计数确定样本的倍性,以验证方法的可靠性。
1.3" 青钱柳种质倍性鉴定
利用建立的方法对1 395份青钱柳种质进行检测,根据倍性计算公式,得出各种质的染色体倍性,并采用染色体计数法确定样本的倍性,方法同1.2.5。进行染色体计数的样本共458份。其中,采自南京林业大学青钱柳种质资源库的样本按每个种源随机抽10株进行取样,150份;采自天然群落的308份样本全部进行染色体计数。
1.4" 数据统计
使用FACSTM 1.0.0.650对流式细胞仪测定结果作图分析,得出各样品的峰值直方图。参照任伟超等计算方法,将倍性公式中待测样本与参照样本相对荧光强度比值作为倍性系数,进而计算得到待测样本的倍性估算值。以DNA含量峰值的变异系数(CV值)的大小作为评价流式测定结果的参数。使用SPSS 22.0进行单因素方差分析与多重比较。倍性公式如下:
F=ISICK×n。
式中:F表示样本倍性估算值;IS表示待测样本相对荧光强度;ICK表示参照样本相对荧光强度;n表示参照样本倍性。
2" 结果与分析
2.1" 流式细胞分析方法的建立
2.1.1" 裂解液的筛选结果
2x-CK为二倍体参照样本;S为四倍体待测样本;CV为S峰图变异系数;不同小写字母表示处理间差异显著(Plt;0.05)。下同。2x-CK indicates the diploidy standard sample; S indicates the tetriploidy test sample; CV indicates the coefficient of variation in S; The different letters indicate that the significant differences among treatments (Plt;0.05). The same below.
细胞核裂解液的正确选择是流式细胞分析成功的前提,适宜的细胞核裂解液通过有效释放样本细胞核,可得到CV值较低、质量较优的峰图。不同裂解液的检测结果表明(图1),Tris-MgCl2、LB01和WPB裂解液的噪音峰较多,影响相对荧光强度的比值,且峰图CV值均高于5%。而mGb裂解液和GPB裂解液的峰图质量最优,所测样本峰荧光信号更加集中,峰图清晰,具有较少的噪音峰。GPB裂解液解离细胞核数量最多,但其CV值较高,且收集目标细胞耗时较长,单个样本需5 min左右,约为mGb裂解液所用时间的5倍。采用mGb裂解液的CV值显著低于其他处理(Plt;0.05),为4.38%。可见,mGb裂解液是青钱柳流式细胞分析的最适裂解液。
2.1.2" 离心方案的确定
对细胞核悬浮液分别进行不离心和不同离心转速和时间的处理。结果表明(图2),不进行离心处理的样本其细胞核染色均匀,噪音峰少,相对荧光强度集中,CV值为4.47%,显著低于其他处理(Plt;0.05)。而离心处理造成峰图噪音峰较多,离心10 min处理的峰值降低最为明显。因此,在制备细胞核悬浮液时,过滤后无需离心,染色后直接上机测定效果最佳。
L1和L2分别为以转速1 000 r/min离心5和10 min处理;L3和L4分别为以转速2 000 r/min离心5和10 min处理;NL为不离心处理。L1 and L2 indicate that nuclei suspensions centrifuge at 1 000 r/min" for 5 and 10 min, respectively; L3 and L4 indicate that nuclei suspensions centrifuge at 2 000 r/min" for 5 and 10 min, respectively; NL indicates no centrifugal treatment.
2.1.3" 样本保存方式和时间的确定
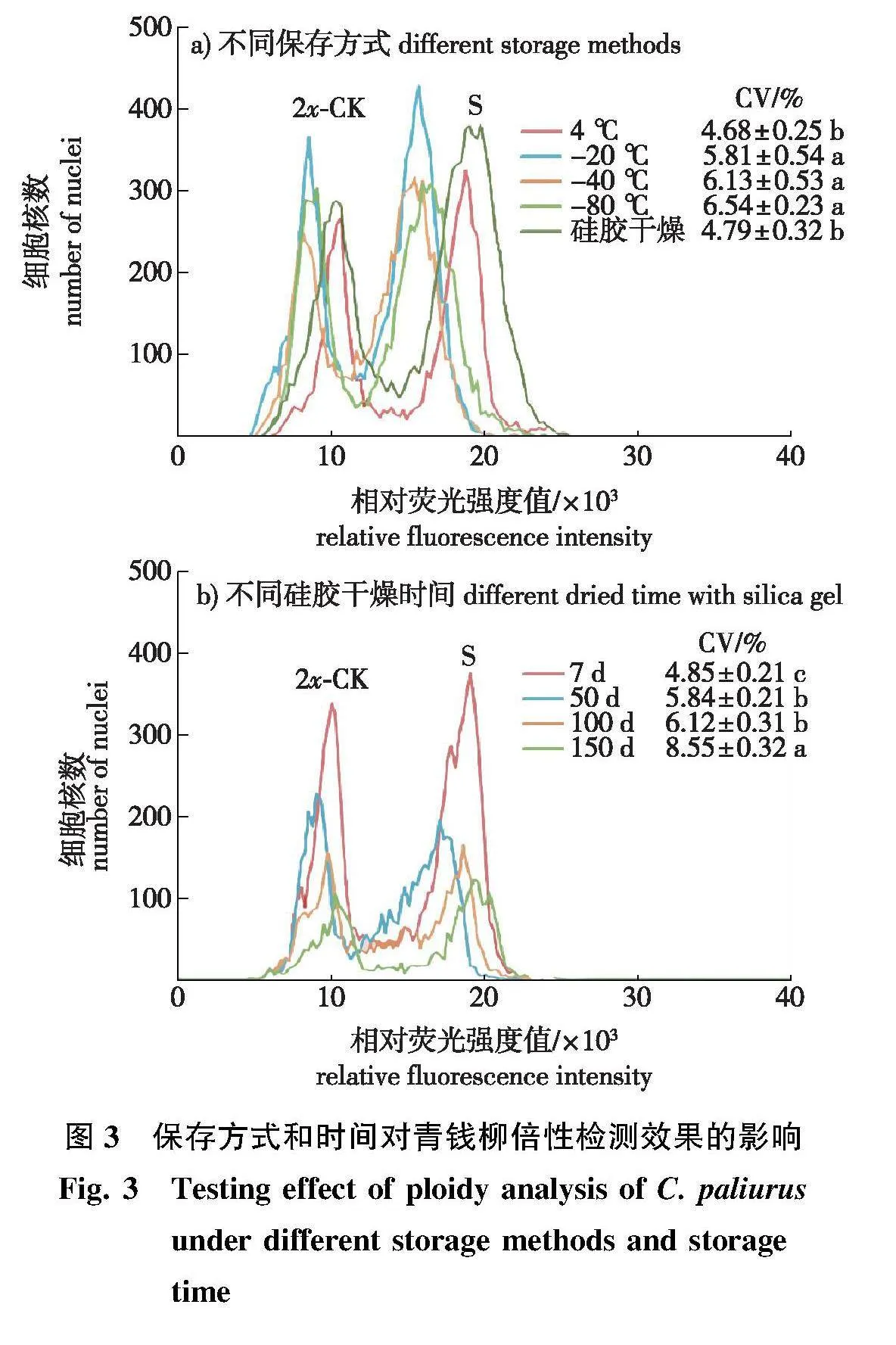
采用冷藏(4" ℃)、冷冻(-20、-40和-80" ℃)和室温硅胶干燥方式保存样本7 d后进行测定,结果表明(图3a),4" ℃冷藏样本测定效果最佳,CV值为4.68%,显著低于其他低温冷冻处理。-40 ℃和-80" ℃冷冻造成峰图噪音峰明显增多,解离细胞核数减少,-20" ℃下冷冻处理对样本的破坏性最小,样本峰细胞核数最高,但冷冻处理的样本峰CV值升高,均大于5%。硅胶干燥样本峰图具有少量噪音峰,其细胞核数较多,样本峰CV值为4.79%。
为进一步探究硅胶干燥样本保存时间对测定效果的影响,将样本分别保存7、50、100、150和200 d后进行测定。随着保存时间的延长,可检测到的细胞核数量减少,保存50 d以上的样本峰细胞核数明显降低,样本峰CV值也随保存时间的增加逐渐升高,150 d时样本峰CV值为8.55%,峰图噪音最多(图3b)。保存200 d时,叶片无法分离出有效细胞核,因此使用硅胶干燥法保存叶片的最长时间以150 d为宜。
2.1.4" 青钱柳倍性检测方法的验证
利用建立的流式细胞分析方法,对100份试验样本进行处理后上机检测,结果见表1。
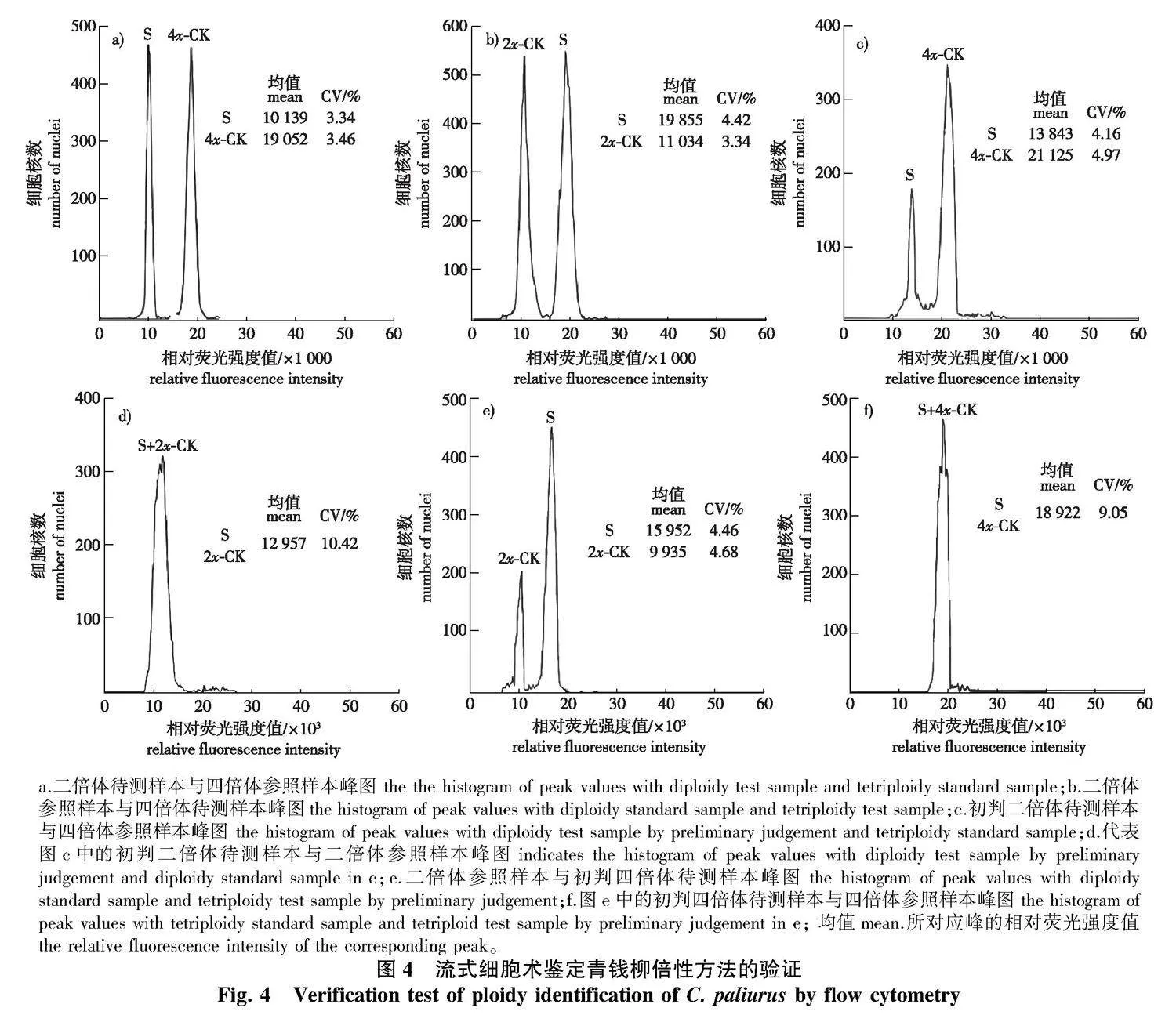
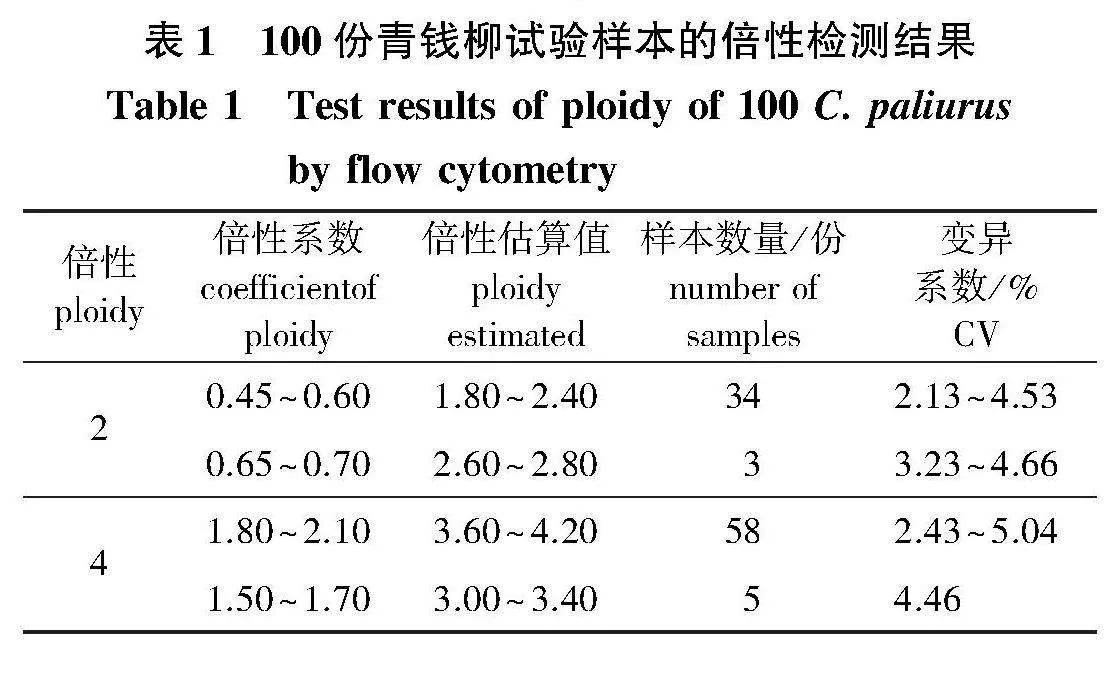
CV值为2.13%~5.04%。其中,34份样品倍性系数为0.45~0.60,倍性估算值为1.80~2.40,判断为二倍体(图4a);58份样品倍性系数为1.80~2.10,倍性估算值为3.60~4.20,判断为四倍体(图4b)。另有8份待测样本出现偏峰的现象,导致待测样本与参照样本的出峰间距较小(图4c和4e)。其中,3份待测样本峰位于参照样本峰前(图4c),初步判断为二倍体,但其倍性系数为0.65~0.70,倍性估算值为2.60~2.80;5份待测样本峰位于参照样本峰后(图4e),初步判断为四倍体,但其倍性系数为1.50~1.70,倍性估算值为3.00~3.40,按倍性估算结果来看,这8份样本应判断为三倍体。但经染色体计数发现,这8份样本的倍性均与初判倍性相同,为此进行第2次标定,即在图4c的待测样本(初判倍性为二倍体)中加入二倍体参照样本,若混样测定所得峰图为单峰,则确定为二倍体(图4d);在图4e的待测样本(初判倍性为四倍体)中加入四倍体参照样本后,若混样测定所得峰图为单峰,则确定为四倍体(图4f)。通过对有疑问的样本进行二次标定,最终从100份待测样本中鉴定出二倍体37株,四倍体63株,与染色体计数结果结果一致(图5)。
2.2" 青钱柳种质资源倍性检测结果
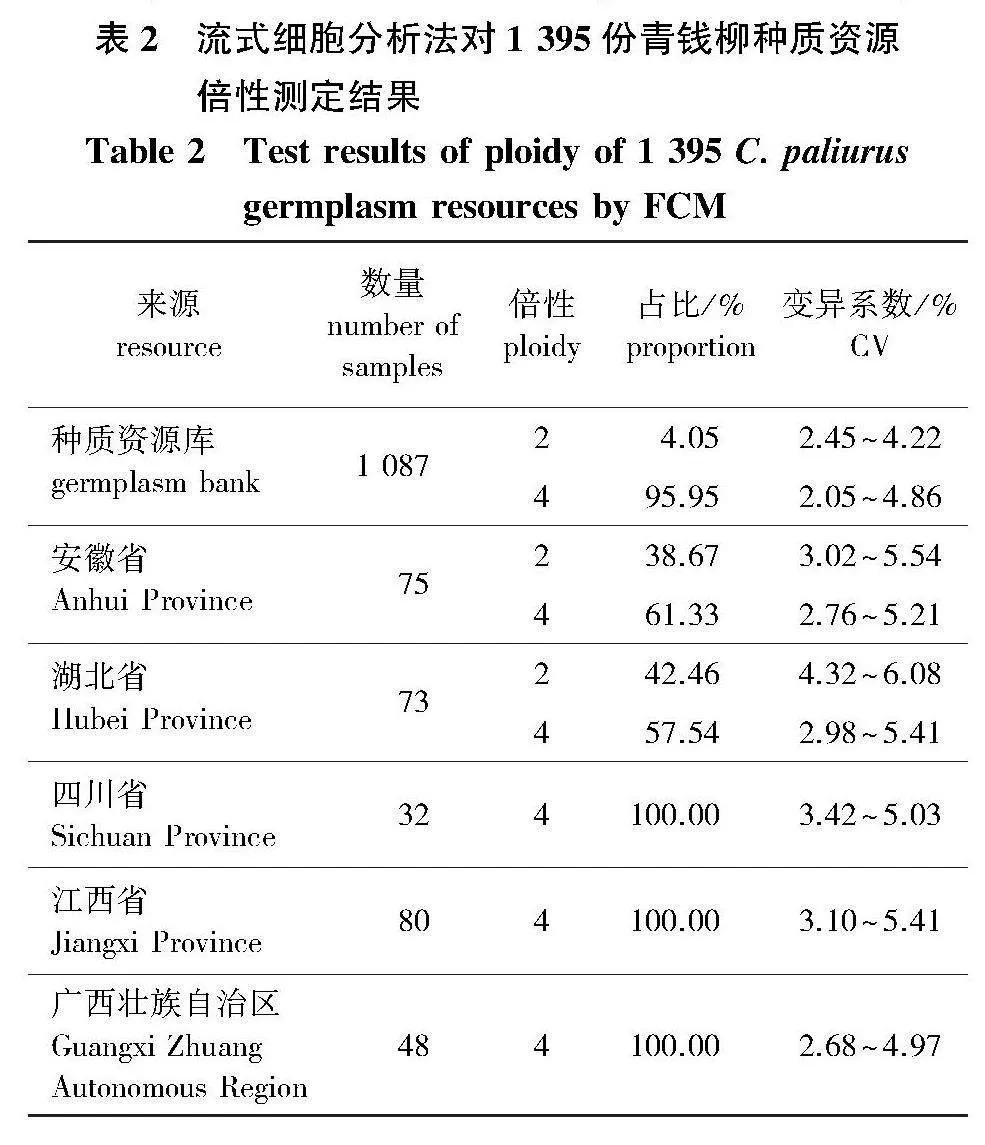
基于优化后的流式细胞分析法对1 395份青钱柳种质资源进行倍性测定,结果(表2)表明,流式分析的CV值为2.05%~6.08%。其中,66份样本倍性系数为0.45~0.60,倍性估算值为1.80~2.40,判断为二倍体;1 206份样本倍性系数为1.80~2.10,倍性估算值为3.60~4.20,判断为四倍体。38份样本倍性系数为0.65~0.70,二次标定后判断为二倍体,85份样本倍性系数为1.50~1.70,进行二次标定后判断为四倍体。对458份种质材料进行染色体计数,结果与流式鉴定法相一致,由此得出1 395份青钱柳种质资源的倍性结果:种质资源库中二倍体为44份,四倍体为1 043份;安徽和湖北二倍体分别为29份和31份,四倍体分别为46份和42份;四川、江西和广西共160份种质资源均为四倍体。总体来看,二倍体样本共104份,占比为7.46%,四倍体样本共1 291份,占比为92.54%。
3" 讨" 论
由于不同植物的组织结构和化学成分存在差异,选择合适的裂解液是获得理想细胞核悬液的关键,但目前没有一种普遍适用的裂解液。柠檬酸钠能起到消除悬浮液中RNA影响的作用,该成分仅在mGb和GPB裂解液中存在,本研究中,这2种裂解液的峰图质量最佳,进一步说明该成分对青钱柳叶片的适用性。TritonX-100能够提取细胞膜蛋白,有效释放细胞核,并具有防止核粘连、维持核完整性的作用。Xu等认为,在LB01裂解液中提高TritonX-100浓度,能够有效增加南五味子属(Kadsura)植物内细胞核的释放量。GPB裂解液中含有比mGb裂解液更高浓度的TritonX-100,使得本研究青钱柳样品解离细胞核较多,但采用GPB裂解液的样本测定时间较长,且CV值较高,这可能与较高浓度的TritonX-100导致细胞碎片增加有关。mGb裂解液中除含有柠檬酸钠和TritonX-100,还含有PVP和β-巯基乙醇,通常认为后两种成分能够消除多酚和其他次生代谢物质对其染色的影响,可提高测定效率和测定结果的准确性。因此,综合分析后认为,mGb裂解液是最适合青钱柳叶片的裂解液。
一般认为,离心处理可减少细胞核悬浮液中的杂质成分。张桂芳等比较了不同离心时间对铁皮石斛(Dendrobium officinale)倍性检测效果的影响,认为转速为2 000 r/min离心8 min后峰图效果最佳;于红梅等在草莓(Fragaria × ananassa)倍性检测中发现,转速1 000 r/min离心5 min,且离心漂洗3次的效果最好;杨静等比较了不离心、离心漂洗1~2次对桑树(Morus alba)倍性检测效果的影响,认为离心对悬浮液质量无显著影响。本研究中,对青钱柳细胞核悬浮液进行离心处理可能使细胞核DNA链断裂,导致碎片增加,荧光信号分散,峰图质量差,CV值升高,因此在制备青钱柳细胞核悬浮液时过滤后即可直接染色测定,无需离心,操作简单,可明显缩短制备样品的时间,提高测定效率。
青钱柳资源主要分布在偏远山区,从野外到实验室测定的过程中,样本保存是一个关键环节,因此对保存方式和时间的探讨十分必要。保存样本的原则是保护细胞核内DNA的完整性,以确保细胞悬浮液的有效制备。因此,新鲜叶片或冷藏数日的叶片使用最广泛。由于实际测定时间受到多方面因素影响,对于部分无法在数日内检测的样本,可对叶片采用低温、干燥和制作标本的方式进行保存。低温会对细胞造成机械损伤,增加细胞内溶质化合物的含量,对测定结果的影响大于硅胶干燥法。对冷藏(4" ℃)、冷冻(-20、-40和-80" ℃)和室温硅胶干燥保存的青钱柳样本检测效果比较后可看出,4" ℃冷藏效果最佳,其次为硅胶干燥法,冷冻保存效果较差。由于青钱柳叶片富含多糖、多酚、色素及其他次生代谢物质,随着冷藏保存时间延长,材料逐渐褐化,因此,幼嫩叶片冷藏保存时间以7 d内为宜,成熟叶保存时间可适当延长。本研究认为,在远距离长时间野外资源调查收集时,硅胶干燥为青钱柳叶片的最佳保存方式,但保存200 d后叶片难以分离出有效细胞核而无法检测,因此硅胶干燥最长保存时间在150 d以内为宜。需要注意的是,制备细胞核悬浮液时新鲜幼叶取0.50 cm2左右即可,但老叶和硅胶干燥保存的样本用量需增加。
对100份试验样本进行倍性检测后,发现CV值为2.13%~5.04%,说明本试验建立的前处理和检测方法是可靠的。其中,34份待测样本的倍性系数为0.45~0.60,其倍性估算值为1.80~2.40,可直接判断为二倍体,58份待测样本的倍性系数为1.80~2.10,其倍性估算值为3.60~4.20,可直接判断为四倍体。但有8份待测样本的倍性系数为0.65~0.70或1.50~1.70,倍性估算值为2.60~2.80或3.00~3.40,疑似为三倍体。倍性系数异常是由于待测样本偏峰所致,对于这种流式检测过程中常见的现象,Castro等认为可采用多次重复检测样品和缩短样品染色后放置时间的方法消除。杨静等在保证样品放置适宜时间的基础上,采取每检测1组样本后用二倍体对照样本调整位置的方法,来减少偏峰现象的出现。鉴于以上方法较为繁琐且无法保证测定结果,本研究对于出现偏峰的待测样本,采用与初判倍性相同的参照样本进行第2次标定,若待测样本与参照样本呈单峰,则可快速确定待测样本的倍性;若采用二倍体和四倍体参照样本分别标定后均呈现双峰,说明样本并非整二倍体或整四倍体,此时需采用染色体计数法予以确定。但据文献检索和本课题组前期研究结果来看,天然青钱柳尚无其他倍性植株存在。
采用优化的流式细胞分析法对1 395份的青钱柳种质资源进行倍性测定,测定CV值均低于6.08%。其中,采自南京林业大学种质资源库的样本均为新鲜幼叶,因此CV值相对较低。而采自天然林的样本,因其幼嫩程度和保存方法不一致,CV值波动范围较大。CV值是判断倍性检测结果可靠与否的关键指标,一般研究认为,CV值小于5.00%时结果最可靠。Georgiev等认为,流式细胞仪检测的CV值在9.00%以内,其检测结果就比较可靠。吕顺等也认为,对于含有较多酚类物质的植物,CV值小于10.00%可达到理想结果。另外,对于1 395份种质材料中倍性系数值异常的123份样本,采用二次标定法可快速确定其倍性。
参考文献(reference):
[1]方升佐. 青钱柳产业发展历程及资源培育研究进展. 南京林业大学学报(自然科学版), 2022, 46(6): 115-126. FANG S Z. A review on the development history and the resource silviculture of Cyclocarya paliurus industry. J Nanjing For Univ (Nat Sci Ed), 2022, 46(6): 115-126. DOI: 10.12302/j.issn.1000-2006.202206019.
[2]洪俊溪. 青钱柳人工林材性试验研究. 福建林学院学报, 1997, 17(3): 214-217. HONG J X. Experimental study on wood properties of Cyclocarya paliurus artificial forest. J Fujian Coll For, 1997, 17(3): 214-217.
[3]ZHOU M M, LIN Y, FANG S Z, et al. Phytochemical content and antioxidant activity in aqueous extracts of Cyclocarya paliurus leaves collected from different populations. Peer J, 2019, 7: e6492. DOI: 10.7717/peerj.6492.
[4]YANG H M, YIN Z Q, ZHAO M G, et al. Pentacyclic triterpenoids from Cyclocarya paliurus and their antioxidant activities in FFA-induced HepG2 steatosis cells. Phytochemistry, 2018, 151: 119-127. DOI: 10.1016/j.phytochem.2018.03.010.
[5]FU X X, ZHOU X D, DENG B, et al. Seasonal and genotypic variation of water-soluble polysaccharide content in leaves of Cyclocarya paliurus. South For, 2015, 77(3): 231-236. DOI: 10.2989/20702620.2015.1010698.
[6]QU Y Q, SHANG X L, ZENG Z Y, et al. Whole-genome duplication reshaped adaptive evolution in a relict plant species, Cyclocarya paliurus. Genomics Proteomics Bioinformatics,2023:S1672-229(23)00033.DOI: 10.1016/j.gpb.2023.02.001.
[7]SOLTIS P S, SOLTIS D E. The role of hybridization in plant speciation. Annu Rev Plant Biol, 2009, 60(1): 561-588. DOI: 10.1146/annurev.arplant.043008.092039.
[8]PIKAARD C S. Genomic change and gene silencing in polyploids. Trends Genet, 2001, 17(12): 675-677. DOI: 10.1016/s0168-9525(01)02545-8.
9〗何法慧,左倩倩,于景金,等.35份狗牙根种质材料指纹图谱构建及染色体倍性鉴定.南京农业大学学报,2023,46(1):42-54.HE F H,ZUO Q Q,YU J J,et al.Fingerprint construction and chromosome ploidy identification of 35 germplasms in bermudagrass.J Nanjing Agric Univ,2023,46(1):42-54.DOI: 10.7685/jnau.202201035.
赵帅琪, 张伟伟, 牛俊芳, 等. 森林草莓和栽培草莓在果实发育和成熟过程中细胞壁变化的比较. 植物生理学报, 2021, 57(12): 2323-2336. ZHAO S Q, ZHANG W W, NIU J F, et al. Comparison of cell wall changes of Fragaria vesca and Fragaria × ananassa during fruit development and ripening. Plant Physiol J, 2021, 57(12): 2323-2336. DOI: 10.13592/j.cnki.ppj.2021.0053.
康向阳. 杜仲良种选育研究现状及展望. 北京林业大学学报, 2017, 39(3): 1-6. KANG X Y. Status and prospect of improved variety selection in Eucommia ulmoides. J Beijing For Univ, 2017, 39(3): 1-6. DOI: 10.13332/j.1000-1522.20160377.
李秀兰, 陈力. 三倍体丹参的培育及其可持续利用研究. 中草药, 2012, 43(2): 375-379. LI X L, CHEN L. Breeding for triploids of Salvia miltiorrhiza and its sustainable utilization. Chin Tradit Herb Drugs, 2012, 43(2): 375-379. DOI: 10.7501/j.issn.0253-2670.
DAS S K, SABHAPONDIT S, AHMED G, et al. Biochemical evaluation of triploid progenies of diploid×tetraploid breeding populations of Camellia for genotypes rich in catechin and caffeine. Biochem Genet, 2013, 51: (5/6). DOI: 10.1007/s10528-013-9569-x.
XU C G, TANG T X, CHEN R, et al. A comparative study of bioactive secondary metabolite production in diploid and tetraploid Echinacea purpurea (L.) Moench. Plant Cell Tiss Organ Cult, 2014, 116(3): 323-332. DOI: 10.1007/s11240-013-0406-z.
陶抵辉, 李小红, 王利群, 等. 植物染色体倍性鉴定方法研究进展. 生命科学研究, 2009, 13(5): 453-458. TAO D H, LI X H, WANG L Q, et al. Progresses on determination of cell chromosome ploidy level of plants. Life Sci Res, 2009, 13(5): 453-458. DOI: 10.16605/j.cnki.1007-7847.2009.05.011.
SCHWARZACHER T, WANG, M L, LEITCH A R, et al. Flow cytometric analysis of the chromosomes and stability of a wheat cell-culture line. Theor Appl Genet, 1997, 94(1): 91-97. DOI: 10.1007/s001220050386.
SLIWINSKA E. Flow cytometry:a modern method for exploring genome size and nuclear DNA synthesis in horticultural and medicinal plant species. Folia Hortic, 2018, 30(1): 103-128. DOI: 10.2478/fhort-2018-0011.
金亮, 徐伟韦, 李小白, 等. DNA流式细胞术在植物遗传及育种中的应用. 中国细胞生物学学报, 2016, 38(2): 225-234. JIN L, XU W W, LI X B, et al. Application of DNA flow cytometry to plant genetics and breeding. Chin J Cell Biol, 2016, 38 (2): 225-234. DOI: 10.11844/cjcb.2016.02.0308.
宫雅昕, 岳涵,向宇, 等. GABA代谢负调控叶片细胞内复制发生的机制研究. 植物生理学报, 2020, 56(2): 235-246. GONG Y X, YUE H, XIANG Y, et al. Mechanism study of negative regulation of GABA metabolism on endoreplication in Arabidopsis thaliana leaf development. Plant Physiol J, 2020, 56(2): 235-246. DOI: 10.13592/j.cnki.ppj.2019.0452.
GALBRAITH D W. Simultaneous flow cytometric quantification of plant nuclear DNA contents over the full range of described angiosperm 2C values. Cytometry A, 2009, 75(8): 692-698. DOI: 10.1002/cyto.a.20760.
田新民, 周香艳, 弓娜. 流式细胞术在植物学研究中的应用检测植物核DNA含量和倍性水平. 中国农学通报, 2011,27(9): 21-27. TIAN X M, ZHOU X Y, GONG N, et al. Applications of flow cytometry in plant research-analysis of nuclear DNA content and ploidy level in plant cells. Chin Agric Sci Bull, 2011, 27(9): 21-27.
韩杰, 沈海萍, 储冬生, 等. 4个薄壳山核桃品种核型分析. 分子植物育种, 2018, 16(17): 5704-5711. HAN J, SHEN H P, CHU D S, et al. Karyotype analysis of four pecan cultivars. Mol Plant Breed, 2018, 16(17): 5704-5711. DOI: 10.13271/j.mpb.016.005704.
任伟超,徐姣,樊锐锋, 等. 应用流式细胞术对柳属染色体倍性与基因组大小测定. 东北林业大学学报, 2021, 49(4): 56-61. REN W C, XU J, FAN R F, et al. Chromosome ploidy and genome size determination of Salix using flow cytometry. J Northeast For Univ, 2021, 49(4):56-61. DOI: 10.13759/j.cnki.dlxb.2021.04.010.
PELLICER J, LEITCH I J. The application of flow cytometry for estimating genome size and ploidy level in plants//Molecular Plant Taxonomy. Totowa, NJ: Humana Press, 2014: 279-307. DOI: 10.1007/978-1-62703-767-9_14.
DPOOLEEL J, BINAROV P, LCRETTI S. Analysis of nuclear DNA content in plant cells by flow cytometry. Biol Plant, 1989, 31(2): 113-120. DOI: 10.1007/BF02907241.
XU J, WEI X P, LIU J S, et al. Genome sizes of four important medicinal species in Kadsura by flow cytometry. Chin Herb Med, 2021, 13(3): 416-420. DOI: 10.1016/j.chmed.2021.05.002.
SONG P, WANG X F, CAI M, et al. Research on identification of polyploids by flow cytometry in Lagerstroemia indica and Lagerstroemia subcostata. Acta Hortic, 2012 (935): 207-212. DOI: 10.17660/actahortic.2012.935.29.
LOUREIRO J, RODRIGUEZ E, DOLEZEL J, et al. Flow cytometric and microscopic analysis of the effect of tannic acid on plant nuclei and estimation of DNA content. Ann Bot-London, 2006, 98(3): 515-527. DOI: 10.1093/aob/mcl140.
张桂芳, 王艳, 闫小巧, 等. 流式细胞仪检测铁皮石斛核DNA初探. 现代中药研究与实践, 2017, 31(1): 16-19. ZHANG G F, WANG Y, YAN X Q, et al. Study on flow cytometer for detecting nuclear DNA contents in Dendrobium officinal. Res Pract Chin Med, 2017, 31(1): 16-19. DOI: 10.13728/j.1673-6427.2017.01.005.
于红梅, 王静, 赵密珍, 等. 利用流式细胞仪检测草莓倍性方法的优化. 南方农业学报, 2012, 43(10): 1530-1533. YU H M, WANG J, ZHAO M Z, et al. Optimization of strawberry ploidy identification method using flow cytometry. J South Agric, 2012, 43(10): 1530-1533. DOI: 10.3969/j.issn.2095-1191.2012.10.1530.
杨静,宋勤霞,宁军权, 等. 利用流式细胞术鉴定桑树染色体倍性的方法. 蚕业科学, 2017, 43(1): 8-17. YANG J, SONG Q X, NING J Q, et al. Establishment of Morus L. chromosome ploidy identification method using flow cytometry. Sci Seric, 2017, 43(1): 8-17. DOI: 10.13441/j.cnki.cykx.2017.01.002.
何婷,郭桂梅,陆瑞菊, 等. 两份大麦材料小孢子诱导愈伤及再生植株的倍性研究. 植物生理学报, 2021, 57(8): 1708-1714. HE T, GUO G M, LU R J, et al. Study on the ploidy of microspore-derived calli and regenerated plants of two barley materials. Plant Physiol J, 2021, 57(8): 1708-1714. DOI: 10.13592/j.cnki.ppj.2021.0100.
REUTEMANN A V, HONFI A I, KARUNARATHNE P, et al. Variation of residual sexuality rates along reproductive development in apomictic tetraploids of Paspalum. Plants, 2022, 11(13): 1639. DOI: 10.3390/plants11131639.
PLASCHIL S, ABEL S, KLOCKE E. The variability of nuclear DNA content of different Pelargonium species estimated by flow cytometry. PLoS One, 2022, 17(4): e0267496. DOI: 10.1371/journal.pone.0267496.
VIRUEL J, CONEJERO M, HIDALGO O, et al. A target capture-based method to estimate ploidy from herbarium specimens. Front Plant Sci, 2019, 10: 937. DOI: 10.3389/fpls.2019.00937.
TOMASZEWSKA P, PELLNY T K, HERNNDEZ L M, et al. Flow cytometry-based determination of ploidy from dried leaf specimens in genomically complex collections of the tropical forage grass Urochloas L.. Genes, 2021, 12(7): 957. DOI: 10.3390/genes12070957.
李雯雯, 刘立强, 帕米尔·艾尼, 等. 利用流式细胞术鉴定新疆野杏染色体倍性和DNA含量. 农业生物技术学报, 2019, 27(3): 542-550. LI W W, LIU L Q, AINI P M E, et al. Identification of chromosomal ploidy and DNA content in Xinjiang Armeniaca vulgaris by flow cytometry. J Agric Biotechnol, 2019, 27(3):542-550. DOI: 10.3969/j.issn.1674-7968.2019.03.019.
CASTRO S, LOUREIRO J, RODRIGUEZ E, et al. Evaluation of polysomaty and estimation of genome size in Polygala vayredae and P. calcarea using flow cytometry. Plant Sci, 2007, 172(6): 1131-1137. DOI: 10.1016/j.plantsci.2007.03.002.
GEORGIEV V,WEBER J,BLEY T, et al. Improved procedure for nucleus extraction for DNA measurements by flow cytometry of red beet (Beta vulgaris L.) hairy roots. J Biosci Bioeng, 2009, 107(4): 439-441. DOI: 10.1016/j.jbiosc.2008.12.023.
吕顺, 任毅, 王芳, 等. 利用流式细胞术快速鉴定169份香蕉种质资源的染色体倍性. 果树学报, 2018, 35(6): 668-684. L S, REN Y, WANG F, et al. Ploidy identification of 169 Musa germplasms by flow cytometry. J Fruit Sci, 2018, 35(6): 668-684. DOI: 10.13925/j.cnki.gsxb.20170419.
(责任编辑" 李燕文)

