老年遗忘型轻度认知障碍执行功能的神经机制及数字干预
刘海宁 董现玲 刘海虹 刘艳丽 李现文
摘 要 阿尔茨海默病具有极高的发病率和致死率。遗忘型轻度认知障碍(Amnestic Mild Cognitive Impairment, aMCI)作为临床前驱期, 探究其形成和发展机制有助于预防阿尔茨海默病的发生。现有研究显示, 多个执行域缺陷与aMCI记忆衰退密切相关, 但尚未回答何种执行域是关键致病因子、关键干预治疗靶标等科学问题。为突破以往研究将执行功能视作整体抑或割裂元素的局限性, 本研究拟从执行功能结构全貌着眼, 在提出aMCI执行功能与记忆损害关系假说的基础上, 利用脑电技术系统考察aMCI抑制、刷新和转换三种执行功能子成分的时域、时频和动态脑网络特征; 并结合三维卷积神经网络筛选、识别执行功能缺陷的特异性神经靶标, 探索将抑制域相关神经标记物加入aMCI早期识别的可能性; 最后, 通过纵向因果设计分析不同靶向数字干预对aMCI患者的训练效果及神经基础, 以揭示抑制域相关额顶控制网络在干预中的重要作用。本研究有望从计算认知神经视角阐明抑制是aMCI执行功能缺损和干预的认知新靶点, 进而为aMCI早期识别和制定精准化诊疗方案提供循证依据。
关键词 执行功能, 遗忘型轻度认知障碍, 认知神经机制, 数字干预, 深度学习
分类号 B845
1 研究意义
自德国医生Alois Alzheimer于1906年报道全球首例阿尔茨海默病(Alzheimers disease, AD)距今100余年的今天, 全球罹患痴呆症(包括AD)的人数逐年攀升, 大约每3秒钟新增1例痴呆症确诊患者, 预计到2025年痴呆症患者将增至1.315亿(Bondi et al., 2017)。2020年, 我国60岁及以上人群中有1507万例痴呆患者, 该疾病造成的医疗成本和收入损失, 预计至2050年将高达18871.8亿美元(Jia et al., 2018)。相应地, 倘若能将痴呆症的发病时间延后5年, 那么痴呆症的患病率和相关
医疗保健费用在接下来的25年内将降低约40% (Anderson, 2019)。轻度认知障碍(Mild cognitive impairment, MCI)作为正常年老化与痴呆早期的中间状态, 表现为主诉报告的认知缺陷和客观检查损伤, 其日常生活能力基本正常(Petersen et al., 1999)。其中, 遗忘型轻度认知障碍(Amnestic MCI, aMCI)作为最常见的亚型, 在确诊后6年内演化为AD的几率高达80%(Gauthier et al., 2006)。虽然, 情景记忆障碍被认为是aMCI的核心症状, 但许多研究者认为执行功能缺陷是该疾病的初始阶段特征(da Costa Armentano et al., 2013; Rabi et al., 2020), 并且可能会导致或加剧患者的记忆症状, 进而增加演化为AD的风险(Panza et al., 2010; Yuan et al., 2016)。因此, 以执行功能为切入点, 极有可能找到aMCI早期识别和干预的新靶点。
執行功能与“执行控制” “中央执行” “执行注意”等术语经常互换使用(De Wit et al., 2021)。它指一系列对思想、行动和情绪的有意识、自上而下控制的神经认知技能, 是实现推理、意志行动、情绪调节等复杂社会功能所必需的认知能力(Blair, 2016; Chatzikostopoulos et al., 2022; Marks, 2019)。根据Baddeley的工作记忆模型, 执行功能通过影响后续干扰信息抑制、工作记忆表征更新、心理定势转换, 使得aMCI患者编码和回忆事件的能力下降, 进而产生记忆症状(Baddeley et al., 1992; Schmeichel, 2007)。影像学研究也表明, 执行功能密切相关的额?顶控制网络, 即背外侧额叶?尾状核的背外侧头部?顶叶皮层形成的神经环路与负责学习、记忆的海马存在相互调节作用(Taylor et al., 2020), 这为理解执行功能与aMCI记忆症状间的关系提供了重要的神经生物学依据。因此, 对执行功能开展评估有可能是早期识别aMCI的重要途径。
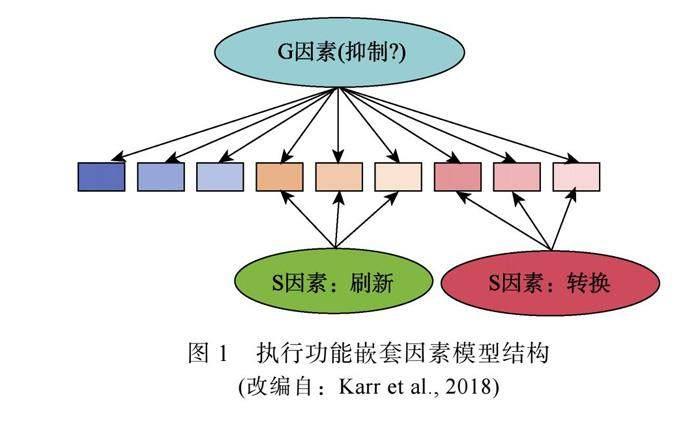
然而, 临床实践中关于执行功能的神经心理学测验仍以问卷和访谈为主, 由于其不敏感、主观性较强, 所以某些执行域缺损在aMCI发病初期可能没有被检测到(Guo et al., 2012)。任务态脑电(Event-related Potential, ERP)具有高时间分辨率, 可以从不同时间尺度敏感地捕捉执行功能任务背后的神经活动异常, 为执行功能的客观评估提供了新途径。研究表明, 执行功能结构具有同一性和特异性的特点, “抑制”可能是刷新、转换其他子成分的潜在共同认知过程(Friedman & Robbins, 2022; May & Kana, 2020)。由此推测以执行功能结构为抓手, 极有可能找到aMCI执行功能缺损的特异性神经靶标。通常, 研究者们采用潜变量结构方程模型等方法来验证某一心理成分的理论结构, 但是由于反映不同执行功能子成分加工过程的脑电信号具有多维性、非平稳性等特点, 传统的统计方法难以统合这类数据(May & Kana, 2020); 而深度学习可以整合高维脑电数据中的时空信息, 并且识别与分类aMCI的性能更优良(Wen et al., 2021)。因此, 有必要引入人工智能中的深度学习算法, 结合脑电技术, 筛选并识别aMCI执行功能缺损的特异性神经靶标, 进而为aMCI临床早期识别提供实证依据。
靶向数字干预(Targeted Digital Intervention)是互联网全民化时代的一种新型认知数字疗法。依靠互联网移动端和高时间分辨率的脑电技术, 研究者得以深入揭示单个执行功能子成分对认知正常老年人的干预效果及脑电信号变化特点, 证实了执行功能具有较强的神经可塑性(Anguera et al., 2013; Tusch et al., 2016)。然而, aMCI作为一种神经网络动力性衰退的脑网络性疾病, 上述训练方案的干预范式、剂量能否直接迁移至aMCI障碍人群仍有待探讨。此外, 执行功能的嵌套因素模型提示“抑制”可能是aMCI患者执行功能结构缺损的认知靶标(Friedman & Robbins, 2022; Karr et al., 2018), 以结构缺损潜在认知靶标“抑制”作为干预靶标的数字干预训练、迁移效果是否优于其他子成分训练尚不清楚。
本研究拟以执行功能为切入点, 采用横向研究设计探究aMCI患者执行功能的结构特点及认知神经机制, 进一步结合深度学习算法筛选并识别其执行功能缺损的特异性神经靶标; 最后, 采用纵向研究设计, 通过靶向数字干预训练寻找干预效果强的执行功能子成分并阐明干预训练、迁移、剂量效应以及干预起效的关键作用。该项目的执行有望为实现老年aMCI人群精准医疗提供新的认知干预靶点, 进而为国家卫生部门制定预防和诊疗新方案提供循证依据。
2 研究现状及发展动态分析
2.1 遗忘型轻度认知障碍执行功能相关的异常神经电生理活动
目前, 国内外aMCI执行功能的评估主要基于神经心理学测验, 这种诊断方式具有主观性较强、易受患者教育程度影响、发病早期不灵敏等缺点(Babiloni et al., 2021)。由于执行功能通常是在快速转换的环境中进行的, 所以不能单纯依赖于传统的神经心理学测试, 而是要采用更为敏感的任务态神经脑电技术, 即事件相关电位(Event- related Potential, ERP)。锁时的神经电生理信号可以从时间尺度明确诸如预备性线索、靶刺激、正确或错误反应等重要事件对执行功能加工过程的相对贡献。因此, 从ERP角度探究aMCI患者执行功能失调的脑神经机制极有可能抓住早期识别的主要环节。
2.1.1 时域和时频特征
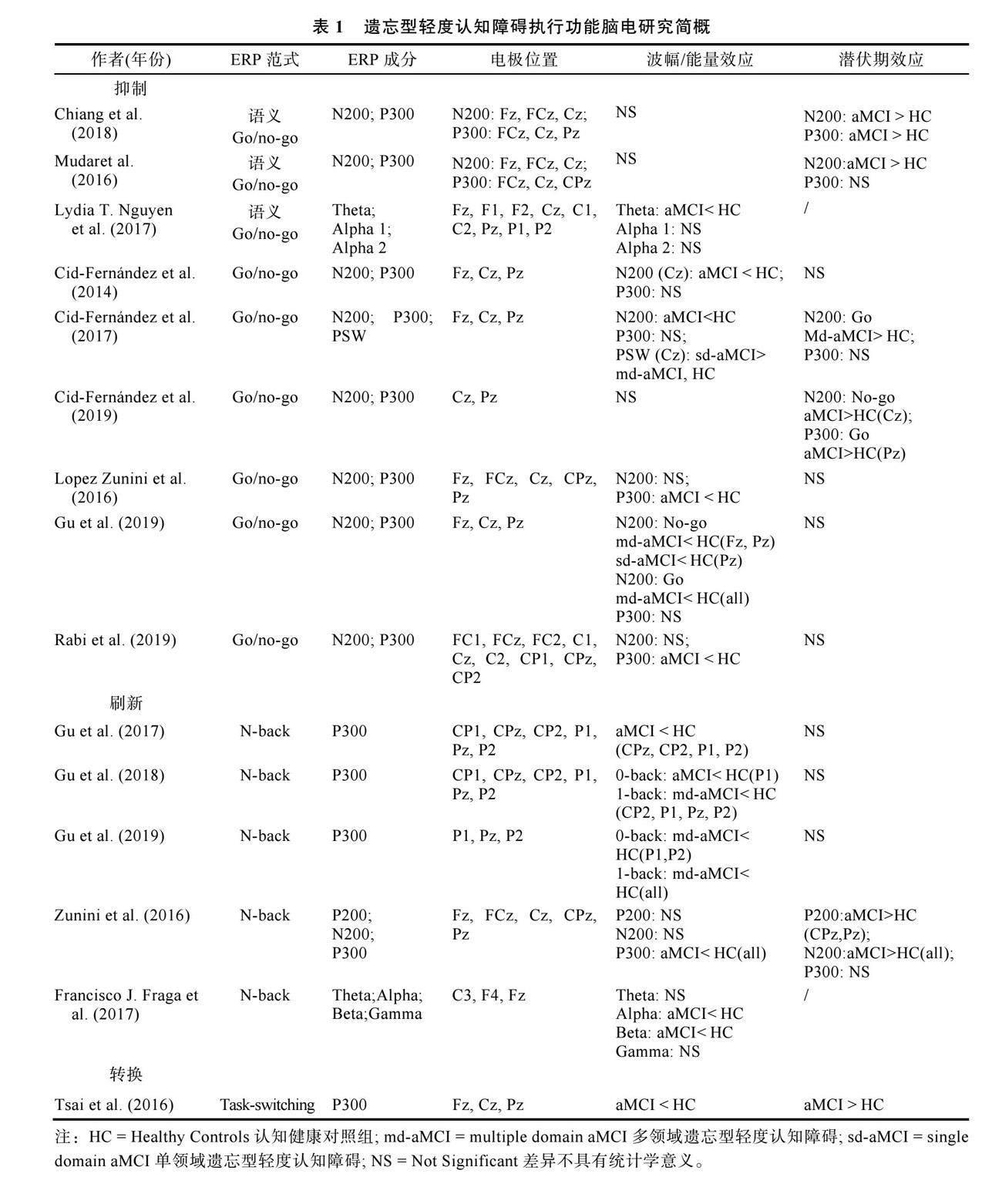
执行功能通常被测量为:抑制、刷新和转换(Karr et al., 2018)。目前, 关于aMCI患者执行功能的神经电生理研究大多从某一单个执行功能子成分着眼, 比如研究者们分别以Go/No-go、N-back和任务转换范式考察aMCI患者抑制、刷新和转换的神经活动特点时, 较为一致的结论是Go/No-go任务在患者组额顶区诱发的N200、P300波幅低于认知正常组, 同时N-back和转换任务在患者顶叶区诱发的P300波幅也表现出类似的趋势。另外, aMCI患者在转换任务中的P300潜伏期延迟于认知正常老年人(见表1)。但是, 尚未有研究系统、综合地比较aMCI患者在抑制、转换和
刷新三个执行功能子成分上的脑电信号特征。通过表1中的文献梳理得出, aMCI患者在三个执行功能子成分间的脑电信号特征可能存在某种重叠(比如, 脑电成分和脑区), 同时也存在部分特异性。由此推测aMCI患者执行功能的神经活动模式可能兼具同一性和特异性的特点。
不过, 以往研究中也存在不一致的发现, 比如有些研究发现aMCI患者在Go/No-go和N-back任务中N200、P300潜伏期延后于认知正常组(Chiang et al., 2018), 有些研究则发现上述脑电成分潜伏期的组间差异不具有统计学意义(Gu et al., 2019)。这可能是因为目前关于aMCI患者执行功能的神经电生理研究大多来源于ERP群体差异性分析, 这种分析方法通常在多个电极位置比较某些成分的振幅和潜伏期, 这样做要么有可能由于多重比较导致假阳性效应的概率增加(Fields & Kuperberg, 2020), 要么由于使用Bonferroni或类似方法调整alpha误差水平导致统计功效下降(Stahl et al., 2012)。因此, 有必要探索优于脑电传统时空平均分析方法的新算法, 以更有效地统合这类高维数据, 进一步探寻aMCI患者执行功能结构受损的特征靶标。
2.1.2 脑网络连接特征
人类的认知加工都会涉及脑区内和脑区间神经元群体的同步化活动。其中, 脑区间的相互协作关系被视作有效完成认知任务的物质基础, 可通过微观(神经元水平)、介观(神经元集群)和宏观(大脑脑区)三个空间尺度的脑网络(Brain Network)分析定量刻画。
关于aMCI执行功能的脑网络分析, 多以功能性磁共振成像(functional MRI, fMRI)为研究工具, 通常采用Pearson相关分析、相干分析、相位同步指数等方法来刻画局部脑区之间血氧活动的动态协调关系(即功能连接); 而采用Granger因果模型(Granger Causality Model, GCM)、部分定向相干、动态因果模型等方法刻画脑区间的因果和调控关系(即效应连接) (Zhong et al., 2022)。比如, Wang等(2019)采用Pearson相关分析发现aMCI患者在工作记忆(刷新)任务中的成绩下降与其右腹外侧前额叶皮层、右背外侧前额叶皮层和左辅助运动区的低频振幅代偿性增加有关。Huang等(2023)采用Granger因果系数分析发现, aMCI患者后扣带皮层与左内侧颞叶的有效连接减少与神经心理学测试(画钟测试)成绩呈负相关。虽然基于fMRI的脑网络分析在aMCI执行功能失调的机理研究上做了大量令人钦佩的工作, 但血液动力学的时间动态性限制了其对瞬态神经活动变化的捕捉。由于脑电具有高时间分辨率特性并可无创性监测皮层神经电活动, 因此应考虑通过脑电信号构建头表脑电脑网络探索aMCI执行功能失调的神经机制。
遗忘型轻度认知障碍作为一种神经网络动力性衰退的脑网络性疾病, 其神经网络具有一定的独特性:首先, 连通性变化呈非线性趋势, 基于不同的皮质萎缩程度, 疾病早期的代償性连通性增强会转为连通性下降甚至失连接; 其次, 社区结构(community structure)的模块度降低, 其特征是节点组之间紧密连接, 而与本地分组之外的节点连接较少; 最后, 前额叶脑区通过自上而下的方式调节后头部顶区的认知加工, 相关神经活动也表现出调控和被调控的模式(Hillary & Grafman, 2017)。时变多层网络模型作为一种多层网络分析, 较之单层网络分析具有能够捕获多频段、多尺度、多层社区以及时空数据集完整神经信息的优势(Li et al., 2017), 恰好能够满足aMCI患者脑网络的分析需求。因此, 有必要利用时变多层网络模型进行社区重构, 以探索aMCI在执行功能加工过程中大脑动态网络的工作机制。
2.2 执行功能的理论结构及数据建模
关于执行功能神经评估的元分析发现, 抑制、刷新和转换三种神经认知技能激活的额顶叶控制和背侧注意网络存在部分重叠区域(May & Kana, 2020); 同时, 前额叶、前/中扣带回以及皮质下涉及刷新、转换任务的脑区均发现特异性激活(Iachini et al., 2021)。上述神经生物学基础的共同性和差异性說明执行功能的三个子成分彼此不是完全独立的, “抑制”子成分可能是其他子成分的潜在共同认知过程。例如, 刷新任务需要“抑制”, 以阻止无关信息进入工作记忆, 并适时从工作记忆中移除不相关信息。类似地, 转换任务需要“抑制”与当前任务定势无关的信息, 以及在规则转换时“抑制”不相关的任务定势。
潜变量研究结果表明, 成年人执行功能的嵌套因素模型拟合度要优于单一维度模型和三因素模型(Friedman & Robbins, 2022; Karr et al., 2018)。该模型表明, 抑制并非是独立的、特异性的执行功能子成分, 而是比更新、转换更为基础的执行功能。换句话说, 可以将大多数执行功能描述为需要某种抑制(Bull & Scerif, 2001)。由此推测执行功能的结构存在类似于智力二因素论中的一般(General, G)因素和特殊(Specific, S)因素。不过, 一方面上述执行功能的嵌套因素模型是针对正常成年人的研究, “抑制”是否是aMCI患者各个执行功能子成分的潜在共同认知过程(见图1)尚需进一步探索; 另一方面, 该模型是基于反应时和正确率等行为数据构建的, 而行为测量反映的是从刺激呈现到行为反应这个心理过程的总和。有研究者指出, 一些初始的注意定向可能捕捉不到就已经发生注意转移了(Kappenman et al., 2015)。因此, 有必要利用高时间分辨率的脑电技术验证aMCI人群执行功能的理论结构。
由于脑电信号涉及时域(如潜伏期、波幅)、时频域(能量、相位一致性)多维数据集, 这类多维数据恰好反映了执行功能神经活动的复杂性。然而, 传统的潜变量分析方法很难统合这类高维数据(区健新 等, 2020)。机器学习作为人工智能的一个分支, 可从高维度且有噪声的脑电信号中提取有意义信息。目前, 研究者多将机器学习与静息态脑电技术结合应用于aMCI患者的分类识别, 分类敏感性大多在60%~73%之间, 特异性在70%以上, 分类准确度可达90%以上(Youn et al., 2020; Kim et al., 2022; Musaeus et al., 2018)。然而, 利用机器学习算法结合任务态脑电技术对探索执行功能结构的研究寥寥无几。经检索文献, 仅有Krumpe等(2018)利用传统机器算法中的支持向量机对正常成年人在Flanker与N-back任务中的ERP、功率谱和瞳孔直径进行跨分类验证, 以提取类之间神经相关特征的潜在重叠信息, 发现执行功能子成分“更新”和“抑制”各自独有一部分特征, 同时也共享一部分特征。由于传统机器学习算法的特征提取和特征分类是分开的两个步骤, 并且对研究人员的先验知识和经验要求较高。深度学习较之传统的机器技术, 可通过多层体系结构拟合复杂的自定义模型, 利用深度神经网络直接提取相关特征, 一步完成脑电信号处理, 有着更优良的分类性能(张军鹏 等, 2023)。最近, Michmizos团队借助深度学习技术提出可从神经电生理学高度解释的三维卷积神经网络(Convolutional Neural Network, CNN), 该网络能够捕获运动过程中EEG特征的时空特性, 保留了大脑诱发活动中至关重要的时间成分(Kumar & Michmizos, 2022)。同时, 国内研究者基于EEG信号开发出一种深度学习算法——单尺度多输入卷积神经网络分类模型。该模型对aMCI伴随Ⅱ型糖尿病患者和正常人群分类的准确率高达95%以上(Wen et al., 2021)。因此有理由认为:利用深度学习技术进行脑电特征提取、跨分类验证、跨人群验证, 可以更客观地验证aMCI患者执行功能的理论结构模型, 进而明确执行功能的G因素——“抑制”是患者执行功能缺损的靶标并且是aMCI记忆症状的可能致病因素。
2.3 老年人执行功能的数字干预及神经机制
美国神经病学学会于2017年发布的最新版轻度认知障碍临床指南中指出, 暂未发现强有力的证据支持药物干预对轻度认知障碍症状缓解有效(Petersen et al., 2018)。相反, 实证研究发现借助计算机系统对注意、记忆、逻辑推理等认知域进行认知训练, 可在一定程度上改善老年aMCI人群的整体认知功能、工作记忆、言语记忆、视觉记忆、注意力, 以及精神运动学习状况(Sherman et al., 2017)。这一研究提示可借助认知训练这种非药物治疗手段提升aMCI患者执行功能的可塑性。
在移动互联网时代, 靶向数字干预是基于神经可塑性理论, 利用智能手机、平板电脑等数字化介质, 以视频游戏为载体, 针对当前个体的认知功能模型, 科学设计干预范式、干预剂量的一种难度自适应性认知训练方法(Kollins et al., 2020)。一方面, 该干预手段具有可及性、便捷性、经济性、无创性等方面的潜在优势; 另一方面, 其高度标准化性质允许在控制其他变量的同时针对特定的认知域进行干预, 从而有助于更好地理解认知训练的作用机制(Domhardt et al., 2021; Holmes et al., 2018)。然而, 目前鲜有关于aMCI患者靶向数字干预及其神经机制的文献报告, 研究者们更多关注认知正常老年人执行功能的训练效果。比如, 《自然》于2013年报道了为期4周的冲突控制类数字干预可以提升其认知成绩, 并且认知改变与前额叶中线区域的Theta功率增加有关(Anguera et al., 2013); 随后研究发现, 为期6周的适应性工作记忆(刷新)训练对认知功能的改善与顶叶中线位置P300振幅增加有关(Tusch et al., 2016), 为期6周的整体执行功能认知训练效果则与顶叶中线位置CNV振幅增加相关(Chainay et al., 2021)。上述成果充分证实了老年人执行功能具有较强的神经可塑性, 但是这些研究或者是单个执行功能子成分训练, 或者是整体执行功能训练, 未曾深入讨论干预范式针对何种靶向执行功能子成分、干预剂量多少可以使干预起效等问题。此外, 上述数字干预的靶向内容、干预频次、时长等能否直接迁移至罹患aMCI的老年人群尚待考证。Moshe等(2021)提出参与者特征、干预范式、剂量恰恰是影响数字干预效果的关键因素。因此, 必须比较以不同执行功能子成分为核心要素的靶向数字干预对aMCI患者的训练、迁移和剂量效应及神经基础, 才能揭示靶向数字干预的起效路径, 阐明训练相关认知与神经变化之间的联系, 进而为aMCI认知数字治疗提供更精确的干预方案。
3 问题提出
本研究拟以执行功能的结构特点为切入点, 理解aMCI人群执行功能的损伤, 并以此为靶点探寻不同靶向数字干预对aMCI患者的训练效果及神经基础, 以揭示抑制域相关额顶控制网络在干预中的重要作用。围绕此提出以下问题:
第一, 如何从神经生理层面探明“抑制”是aMCI患者执行功能结构受损的特征靶标?Baddeley的工作记忆模型指出执行功能与情景记忆间存在某种相互作用关系, 但未细化明确何种执行功能子成分上受损会诱发或加剧aMCI患者的记忆症状。由于脑神经的病理性改变早于认知障碍记忆症状的出现, 因此本研究拟将高时间分辨率的脑电技术作为研究手段, 同时利用深度学习可以统合多维脑电信号时空特征的优势, 重点考察基于抑制功能脑电特征构建的卷积神经网络分类模型在另外两个执行功能子成分——“刷新”和“转换”相关脑电数据集中能否得以验证以及该模型对症状人群分类识别的性能, 进一步从神经生理角度澄清抑制功能是否是执行功能理论结构的G因素。
第二, 以何种执行功能子成分为靶标, “剂量”多大的训练可以有效提升aMCI患者的神经可塑性, 进而改善其记忆症状?针对G因素?抑制域的靶向数字干预效果是否优于刷新和转换?既往针对aMCI患者的在线认知训练大多涉及数个认知域且干预时长不一, 不利于回答认知训练提升患者神经可塑性的关键作用机制。基于此, 本研究拟针对不同执行功能子成分科学设计干预范式, 并根据aMCI患者当前的认知训练成绩反馈, 进行难度自适应调整, 分别在干预4周和8周时考察干预、迁移和剂量效应以及相应神经电生理指标和动态脑网络连接的变化, 重点关注针对抑制域的靶向数字干预措施对aMCI患者情景记忆的改善程度是否优于刷新和转换靶向数字干预。
4 研究构想
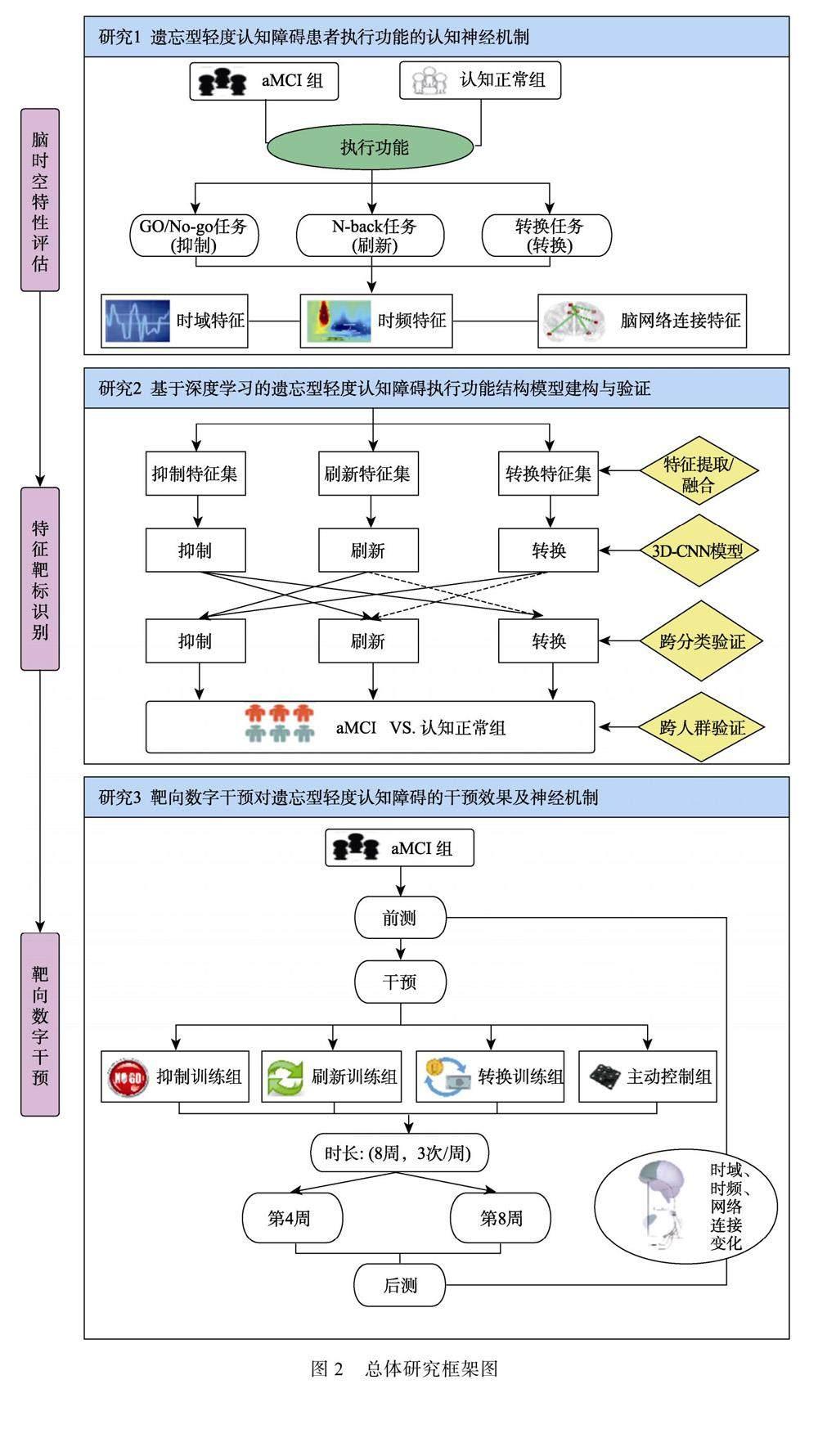
本研究总体思路遵循aMCI患者执行功能“脑神经时空特性评估→特征靶标识别→靶向数字干预”的路径, 将采用行为、ERP脑电技术与深度学习、纵向干预相结合的研究方法。首先, 利用脑电技术通过Go/No-go、N-back和定势转换任务3个范式, 得出aMCI不同执行功能子成分的脑内神经活动特点(研究1); 在此基础上, 再使用深度学习筛选出可信度高的特征, 初步构建基于不同执行功能子成分的三维卷积神经网络分类模型, 并进行跨分类、跨人群验证, 识别aMCI执行功能缺损的特异性神经靶标(研究2); 最后, 通过纵向干预研究检验以不同执行功能子成分为核心要素的靶向数字干预对aMCI患者训练的干预、迁移、剂量效应及相应的神经基础, 明确干预的起效机制(研究3), 见图2。
4.1 遗忘型轻度认知障碍患者执行功能的神经电生理活动
研究1利用高时间分辨率脑电技术, 探究aMCI患者不同执行功能子成分的神经电生理活动。该部分包含1个脑电基线实验和3个执行功能脑电實验, 通过比较aMCI和正常认知老年组在Go/No-Go、N-back和转换任务中的时域、时频分析域和动态脑网络连接变化, 揭示aMCI患者在不同执行功能子成分抑制、刷新和转换的认知神经机制及脑功能网络损伤特点。本研究采用2 (组别:aMCI组vs.认知正常老年组) × 2 (刺激类型:X vs. Y)两因素混合设计。其中, 组别为组间因素, 刺激类型为组内因素。在Go/No-Go、N-back和转换任务中, 组内因素(X vs. Y)分别为Go vs. No-Go、一致vs.不一致、重复规则vs.转换规则。为保证实验材料的同质性, 上述实验任务的刺激材料为上、下、左、右四个朝向不同方位的箭头。在Go/No-go任务中, 要求被试对绿色闪烁箭头的指向既快又准地做出反应, 而对红色闪烁箭头不做任何反应; 在N-back任务中, 要求被试比较当前箭头朝向与前N个箭头是否相同; 在转换任务中, 当闪烁箭头为绿色(重复规则)时, 要求被试对箭头指向做出一致反应; 当为红色(转换规则)时, 则要求被试做出相反的按键反应。本研究假设aMCI患者在上述执行功能任务中的表现显著差于认知正常老年个体, 其神经表征可能是N200波幅、P300波幅以及Alpha、Theta等频段能量的变化。另外, 由于神经系统的退行性, aMCI患者在不同执行功能任务中可能具有不同的脑电脑网络连接模式。
4.2 基于深度学习的遗忘型轻度认知障碍执行功能结构模型建构与验证
研究2利用深度学习统合脑电时、空多维数据的优势, 构建aMCI患者抑制、刷新和转换3个执行功能子成分的三维卷积神经网络分类模型, 证实“抑制”是不同执行功能子成分的潜在共同认知过程, 即G因素。具体流程如下(图3): (1)频域特征提取:提取研究1中aMCI患者不同执行功能任务态的脑电数据, 将ERPs的theta, alpha及beta 3个频段形成的图像按照RGB通道顺序形成多光谱图像。将不同脑区的多光谱图像分别作为输入数据, 同步输入到不同的卷积通道, 经过三层二维卷积层和三层池化层提取频域特征。(2)时空特征提取:将不同任务不同时刻的脑地形图作为输入, 采用五层三维卷积层和一层二维卷积层生成空间特征图, 同时通过反向传播获取梯度加权类激活热图(Gradient-weighted Class Activation Mapping, Grad-CAM), 分析网络对于3个执行功能子成分分类的关注脑区, 进一步提取重点脑区的空间特征。(3)脑功能连接特征提取:首先, 从任务态脑电中提取基于拓扑的复杂网络度量的大脑连接特征; 其次, 提取不同频段的连通特征, 作为三维卷积神经网络分类器集成的输入; 最后, 将不同频带上连接复杂网络特征的一维向量转换成二维张量, 作为一维的输入, 进一步提取重点脑区的脑功能连接特征。(4)构建深度学习分类模型:将上述多维神经生理学脑电频域和时空特征进行融合; 之后, 进行特征组合集群分析, 筛选出有效特征值, 区分基线、抑制、刷新和转换四个不同因子水平, 搭建机器学习分类架构, 在每个执行功能子成分与基线条件的差异间各训练1个分类器; 通过5倍交叉验证, 初步构建遗忘型轻度认知障碍抑制、刷新和转换模型。(5)跨分类验证:以其余执行功能子成分的脑电特征值作为测试集, 对上述aMCI抑制、刷新和转换模型进行执行功能子成分特征集两两间交叉验证, 比较不同模型分类结果的准确度、敏感度、特异度, 以考察不同子成分神经特征间的“重叠”程度。(6)跨人群验证:按照研究1的研究流程, 对30名认知正常老年人群进行ERP脑电实验。将临床诊断结果作为金标准, 对aMCI抑制、刷新和转换域神经相关分类模型的分类效果进行准确度、敏感度、特异度的跨人群验证。本研究假设aMCI患者抑制域神经分类模型与刷新、转换子成分的交叉分类验证的准确度显著高于偶然水平; 同时, 抑制域神经分类模型在跨人群验证中的分类性能优于刷新、转换分类模型。
4.3 靶向数字干预对遗忘型轻度认知障碍的干预效果及神经机制
在前面研究基础上, 研究3力图寻找干预效果强的执行功能子成分靶向数字干预方案。采用靶向数字干预, 并结合脑电技术, 重点考察以不同执行功能子成分为核心要素的靶向数字干预对aMCI患者的训练、迁移和剂量效应及其神经基础。采用4 (组别:抑制组/刷新组/转换组/主动控制组) × 3 (测量时间:前测/后测1/后测2)两因素混合设计。其中, 组别为组间变量, 测量时间为组内变量。本研究对抑制组、刷新组和转换组分别实施“打地鼠” “风景如画” “一心二用”难度自适应的靶向数字干预, 主动控制组仅实施加工速度的训练; 每周训练3次, 每次训练30分钟, 分别在第4周和第8周进行后测。本研究前、后测任务同研究1。本研究假设针对aMCI患者抑制功能训练会涉及到额顶控制网络相关脑区的活动, 其干预效果最佳, 并可能远迁移至刷新和转换任务。
5 理论建构
本研究提出aMCI执行功能与记忆损害关系假说。从执行功能的同一性角度出发, 训练高阶控制系统会使各种执行功能子成分受益; 而从模块化角度来看, 迁移的范围应取决于受训练任务和迁移任务之间特定领域神经基础上重叠的程度(Ulbl & Rakusa, 2023)。由此推导出aMCI执行功能训练可能的迁移效果, 即针对aMCI患者抑制子成分的训练效果可迁移至刷新和转换, 而刷新和转换的训练收益则不能迁移至彼此。此外, 鉴于皮质?边缘系统背侧通路中主司执行功能的背外侧前额叶与主司学习、记忆的海马结构存在相互调节作用, 故作者提出 aMCI执行功能与记忆损害关系假说, 并推测训练涉及额顶控制网络范围较大的抑制子成分更有助于减弱或延缓aMCI患者的记忆损害(见图4)。
本研究有三点创新之处。第一, 本研究聚焦于aMCI早期的一种高级认知过程异常?执行功能缺损, 并深入探讨其认知神经机制。执行功能缺损与工作记忆、情景记忆、视觉语义等认知障碍紧密相关, 并影响后续的计划、推理、决策、解决问题等高阶认知功能, 这为寻找aMCI认知衰退关键致病认知因子及早期精准化干预提供了重要抓手。以此为切入点, 系统阐明aMCI执行功能结构的神经特点和干预调节机制, 为深度学习建模及靶向数字干预提供理论指引, 带动方法创新, 体现出较为深厚的理论积淀和特色。
第二, 本研究坚持以科学问题为导向推动方法创新。根据任务态脑电信号具有高维度、易受噪声影响的特点, 针对性采用三维卷积神经网络对脑电时空信息特征进行分析, 使得从神经层面揭示aMCI执行功能结构成为可能。另外, 利用时域、时频域、动态脑功能网络分析方法, 捕捉抑制、转换和刷新执行功能任务中功能脑区的时?频?空耦合信息, 多层次描绘大脑神经活动的时空特征。采用“典型异常脑电特征?主要兴趣脑区?重点驱动脑区?特异性致病特征”的思路, 尝试探索并阐明aMCI干预调控候选靶向目标。此外, 借助多模态脑电指标体系优势, 进一步揭示aMCI脑网络尤其是额?顶网络早期出现素质性连接下降在病理改变中的关键作用。
第三, 在上述基础上, 力图在临床认知康复应用中进一步验证不同靶向数字干预方法的干预效果。通过精准靶向调控不同执行功能子成分, 以期改善aMCI患者的临床认知表现。将可能的特异性损伤靶标(“抑制”)作为重点关注的干预调控靶标, 并细致比较其与其他干预调控靶标(如“刷新”、“转换”)的干预、迁移和剂量效应差异, 同时明晰脑功能动态连接变化, 实现“记忆症状?靶向目标识别?认知训练?执行功能神经可塑性?记忆改善”的闭环调控策略, 显示出技术应用创新。凭借医理融合的学术和临床实践优势, 不仅有利于新型靶向数字干预的技术创新, 而且实际干预效果也可以为aMCI执行功能失调理论及神经机制提供实证依据。
综上, 本研究将从神经生理层面探究aMCI患者执行功能的理论结构特点及其认知神经机制, 并利用深度学习进行脑电特征提取、跨分类验证、跨人群验证, 以验证执行功能的嵌套因素结构模型, 进一步证明抑制是患者执行功能缺损的特征靶标; 此外, 进一步对患者实施以不同执行功能子成分为核心要素的靶向数字干预, 从行为和神经生理上比较不同干预措施的近、远迁移效果及剂量效应, 寻找干预效果强的执行功能子成分及神经电生理标记物, 力图阐明执行功能G因素(抑制)相关的额顶控制网络在靶向数字干预中的关键作用, 进而证明“认知训练?执行功能神经可塑性?记忆改善”这一起效路径。
参考文献
区健新, 吴寅, 刘金婷, 李红. (2020). 计算精神病学:抑郁症研究和临床应用的新视角. 心理科学进展, 28(01), 111?127.
张军鹏, 施玉杰, 蒋睿, 董静静, 邱昌建. (2023). 基于脑电信号的认知功能障碍识别与分类进展综述. 计算机应用, 43(10), 3297?3308.
Anderson, N. D. (2019). State of the science on mild cognitive impairment (MCI). CNS Spectrums, 24(1), 78?87.
Anguera, J. A., Boccanfuso, J., Rintoul, J. L., Al-Hashimi, O., Faraji, F., Janowich, J., ... Gazzaley, A. (2013). Video game training enhances cognitive control in older adults. Nature, 501(7465), 97?101.
Babiloni, C., Arakaki, X., Azami, H., Bennys, K., Blinowska, K., Bonanni, L., ... Guntekin, B. (2021). Measures of resting state EEG rhythms for clinical trials in Alzheimer's disease: Recommendations of an expert panel. Alzheimers & Dementia, 17(9), 1528?1553.
Baddeley, A. D., Bressi, S., Sala, S. D., Logie, R. H., & Spinnler, H. (1992). The decline of working memory in Alzheimer's disease: A longitudinal study. Brain, 114(Pt 6), 2521?2542.
Blair, C. (2016). Developmental Science and Executive Function. Current Directions in Psychological Science, 25(1), 3?7.
Bondi, M. W., Edmonds, E. C., & Salmon, D. P. (2017). Alzheimer's disease: Past, present, and future. Journal of the International Neuropsychological Society, 23(9-10), 818?831.
Bull, R., & Scerif, G. (2001). Executive functioning as a predictor of children's mathematics ability: Inhibition, switching, and working memory. Developmental Neuropsychology, 19(3), 273?293.
Chainay, H., Joubert, C., & Massol, S. (2021). Behavioural and ERP effects of cognitive and combined cognitive and physical training on working memory and executive function in healthy older adults. Advances in Cognitive Psychology, 17(1), 58?69.
Chatzikostopoulos, A., Moraitou, D., Tsolaki, M., Masoura, E., Papantoniou, G., Sofologi, M., ... Papatzikis, E. (2022). Episodic memory in amnestic mild cognitive impairment (aMCI) and Alzheimer's disease dementia (ADD): Using the "doors and people" tool to differentiate between early aMCI-Late aMCI-Mild ADD diagnostic groups. Diagnostics (Basel), 12(7), 1768.
Chiang, H. S., Spence, J. S., Kraut, M. A., & Mudar, R. A. (2018). Age effects on event-related potentials in individuals with amnestic Mild Cognitive Impairment during semantic categorization Go/NoGo tasks. Neuroscience Letters, 670, 19?21.
Cid-Fernández, S., Lindín, M., & Díaz, F. (2014). Effects of amnestic mild cognitive impairment on N2 and P3 Go/NoGo ERP components. Journal of Alzheimers Disease, 38(2), 295?306.
Cid-Fernández, S., Lindín, M., & Díaz, F. (2017). Neurocognitive and behavioral indexes for identifying the amnestic subtypes of mild cognitive impairment. Journal of Alzheimers Disease, 60(2), 633?649.
da Costa Armentano, C. G., Porto, C. S., Nitrini, R., & Dozzi Brucki, S. M. (2013). Ecological evaluation of executive functions in mild cognitive impairment and Alzheimer disease. Alzheimer Disease & Associated Disorders, 27(2), 95?101.
De Wit, L., Marsiske, M., O'Shea, D., Kessels, R. P. C., Kurasz, A. M., DeFeis, B., ... Smith, G. E. (2021). Procedural learning in individuals with amnestic mild cognitive impairment and Alzheimer's dementia: A systematic review and meta-analysis. Neuropsychology Reveiw, 31(1), 103?114.
Domhardt, M., Steubl, L., Boettcher, J., Buntrock, C., Karyotaki, E., Ebert, D. D., ... Baumeister, H. (2021). Mediators and mechanisms of change in internet- and mobile-based interventions for depression: A systematic review. Clinical Psychology Reveiw, 83, 101953.
Fields, E. C., & Kuperberg, G. R. (2020). Having your cake and eating it too: Flexibility and power with mass univariate statistics for ERP data. Psychophysiology, 57(2), e13468.
Fraga, F. J., Ferreira, L. A., Falk, T. H., Johns, E., & Phillips, N. D. (2017). Event-related synchronisation responses to N-back memory tasks discriminate between healthy ageing, mild cognitive impairment, and mild Alzheimer's disease. New Orleans, LA.
Friedman, N. P., & Robbins, T. W. (2022). The role of prefrontal cortex in cognitive control and executive function. Neuropsychopharmacology, 47(1), 72?89.
Gauthier, S., Reisberg, B., Zaudig, M., Petersen, R. C., Ritchie, K., Broich, K., ... Winblad, B. (2006). Mild cognitive impairment. Lancet, 367(9518), 1262?1270.
Gu, L., Chen, J., Gao, L., Shu, H., Wang, Z., Liu, D., ... Zhang, Z. (2019). Deficits of visuospatial working memory and executive function in single- versus multiple-domain amnestic mild cognitive impairment: A combined ERP and sLORETA study. Clinical Neurophysiology, 130(5), 739?751.
Gu, L. H., Chen, J., Gao, L. J., Shu, H., Wang, Z., Liu, D., ... Zhang, Z. J. (2017). The effect of Apolipoprotein E ε4 (APOE ε4) on visuospatial working memory in healthy elderly and amnestic mild cognitive impairment patients: An event-related potentials study. Frontiers in Aging Neuroscience, 9, 145.
Gu, L. H., & Zhang, Z. J. (2017). Exploring potential electrophysiological biomarkers in mild cognitive impairment: A systematic review and meta-analysis of event-related potential studies. Journal of Alzheimers Disease, 58(4), 1283?1292.
Guo, Q. H., Zhou, B., Zhao, Q. H., Wang, B., & Hong, Z. (2012). Memory and Executive Screening (MES): A brief cognitive test for detecting mild cognitive impairment. BMC Neurology, 12(1), 119.
Hillary, F. G., & Grafman, J. H. (2017). Injured brains and adaptive networks: The benefits and costs of hyperconnectivity. Trends in Cognitive Sciences, 21(5), 385?401.
Holmes, E. A., Ghaderi, A., Harmer, C. J., Ramchandani, P. G., Cuijpers, P., Morrison, A. P., ... Craske, M. G. (2018). The Lancet Psychiatry Commission on psychological treatments research in tomorrow's science. Lancet Psychiatry, 5(3), 237?286.
Huang, J. (2023). Functional and effective connectivity based classification and prediction of Alzheimers disease. North Carolina State University.
Iachini, T., Ruotolo, F., Iavarone, A., Mazzi, M. C., & Ruggiero, G. (2021). From aMCI to AD: The role of visuo-spatial memory span and executive functions in egocentric and allocentric spatial impairments. Brain Sciences, 11(11), 1536.
Jia, J., Wei, C., Chen, S., Li, F., Tang, Y., Qin, W., ... Gauthier, S. (2018). The cost of Alzheimer's disease in China and re-estimation of costs worldwide. Alzheimers & Dementia, 14(4), 483?491.
Kappenman, E. S., MacNamara, A., & Proudfit, G. H. (2015). Electrocortical evidence for rapid allocation of attention to threat in the dot-probe task. Social Cognitive and Affective Neuroscience, 10(4), 577?583.
Karr, J. E., Areshenkoff, C. N., Rast, P., Hofer, S. M., Iverson, G. L., & Garcia-Barrera, M. A. (2018). The unity and diversity of executive functions: A systematic review and re-analysis of latent variable studies. Psychological Bulletin, 144(11), 1147?1185.
Kim, J. G., Kim, H., Hwang, J., Kang, S. H., Lee, C. N., Woo, J., ... Park, K. W. (2022). Differentiating amnestic from non-amnestic mild cognitive impairment subtypes using graph theoretical measures of electroencephalography. Scientific Reports, 12(1), 6219.
Kollins, S. H., DeLoss, D. J., Ca?adas, E., Lutz, J., Findling, R. L., Keefe, R. S. E., ... Faraone, S. V. (2020). A novel digital intervention for actively reducing severity of paediatric ADHD (STARS-ADHD): A randomised controlled trial. Lancet Digital Health, 2(4), Article e168?e178.
Krumpe, T., Scharinger, C., Rosenstiel, W., Gerjets, P., & Spüler, M. (2018). Unity and diversity in working memory load: Evidence for the separability of the executive functions updating and inhibition using machine learning. Biological Psychology, 139, 163?172.
Kumar, N., & Michmizos, K. P. (2022). A neurophysiologically interpretable deep neural network predicts complex movement components from brain activity. Scientific Reports, 12(1), 1101.
Li, J., Broster, L. S., Jicha, G. A., Munro, N. B., Schmitt, F. A., Abner, E., ... Jiang, Y. (2017). A cognitive electrophysiological signature differentiates amnestic mild cognitive impairment from normal aging. Alzheimer's Research & Therapy, 9(1), 3.
López Zunini, R. A., Knoefel, F., Lord, C., Breau, M., Sweet, L., Goubran, R., ... Taler, V. (2016). P300 amplitude alterations during inhibitory control in persons with Mild Cognitive Impairment. Brain Research, 1646, 241?248.
López Zunini, R. A., Knoefel, F., Lord, C., Dzuali, F., Breau, M., Sweet, L., ... Taler, V. (2016). Event-related potentials elicited during working memory are altered in mild cognitive impairment. International Journal of Psychophysiology, 109, 1?8.
Marks, D. F. (2019). I am conscious, therefore, I am: Imagery, affect, action, and a general theory of behavior. Brain Science, 9(5), 107.
May, K. E., & Kana, R. K. (2020). Frontoparietal network in executive functioning in autism spectrum disorder. Autism Research, 13(10), 1762?1777.
Moshe, I., Terhorst, Y., Philippi, P., Domhardt, M., Cuijpers, P., Cristea, I., ... Sander, L. B. (2021). Digital interventions for the treatment of depression: A meta-analytic review. Psychological Bulletin, 147(8), 749?786.
Mudar, R. A., Chiang, H. S., Eroh, J., Nguyen, L. T., Maguire, M. J., Spence, J. S., ... Hart, J. (2016). The effects of amnestic mild cognitive impairment on go/nogo semantic categorization task performance and event-related potentials. Journal of Alzheimers Disease, 50(2), 577?590.
Musaeus, C. S., Engedal, K., H?gh, P., Jelic, V., M?rup, M., Naik, M., ... Andersen, B. B. (2018). EEG theta power is an early marker of cognitive decline in dementia due to Alzheimer's disease. Journal of Alzheimers Disease, 64(4), 1359?1371.
Nguyen, L. T., Shende, S. A., Rackley, A., Chapman, S. B., & Mudar, R. A. (2018). Strategy-based cognitive training effects on event-related neural oscillations in amnestic mild cognitive impairment. Alzheimer's & Dementia, 14(7), 1067.
Panza, F., Frisardi, V., Capurso, C., D'Introno, A., Colacicco, A. M., Imbimbo, B. P., ... Solfrizzi, V. (2010). Late-life depression, mild cognitive impairment, and dementia: Possible continuum? American Journal of Geriatric Psychiatry, 18(2), 98?116.
Petersen, R. C., Lopez, O., Armstrong, M. J., Getchius, T. S. D., Ganguli, M., Gloss, D., ... Rae-Grant, A. (2018). Practice guideline update summary: Mild cognitive impairment: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology, 90(3), 126?135.
Petersen, R. C., Smith, G. E., Waring, S. C., Ivnik, R. J., Tangalos, E. G., & Kokmen, E. (1999). Mild cognitive impairment: Clinical characterization and outcome. Archives of Neurology, 56(3), 303?308.
Rabi, R., Vasquez, B. P., Alain, C., Hasher, L., Belleville, S., & Anderson, N. D. (2020). Inhibitory control deficits in individuals with amnestic mild cognitive impairment: A meta-analysis. Neuropsychology Reveiw, 30(1), 97?125.
Schmeichel, B. J. (2007). Attention control, memory updating, and emotion regulation temporarily reduce the capacity for executive control. Journal of Experimental Psychology- Genaral, 136(2), 241?255.
Sherman, D. S., Mauser, J., Nuno, M., & Sherzai, D. (2017). The efficacy of cognitive intervention in mild cognitive impairment (MCI): A meta-analysis of outcomes on neuropsychological measures. Neuropsychology Review, 27(4), 440?484.
Stahl, D., Pickles, A., Elsabbagh, M., & Johnson, M. H. (2012). Novel machine learning methods for ERP analysis: A validation from research on infants at risk for autism. Develomental Neuropsychology, 37(3), 274?298.
Taylor, R. L., Cooper, S. R., Jackson, J. J., & Barch, D. M. (2020). Assessment of neighborhood poverty, cognitive function, and prefrontal and hippocampal volumes in children. JAMA Network Open, 3(11), e2023774.
Tsai, C. L., Pai, M. C., Ukropec, J., & Ukropcová, B. (2016). The role of physical fitness in the neurocognitive performance of task switching in older persons with mild cognitive impairment. Journal of Alzheimers Disease, 53(1), 143?159.
Tusch, E. S., Alperin, B. R., Ryan, E., Holcomb, P. J., Mohammed, A. H., & Daffner, K. R. (2016). Changes in neural activity underlying working memory after computerized cognitive training in older adults. Frontiers in Aging Neuroscience, 8, 255.
Ulbl, J., & Rakusa, M. (2023). The importance of subjective cognitive decline recognition and the potential of molecular and neurophysiological biomarkers-A systematic review. International Journal of Molecular Sciences, 24(12), 10158.
Wang, P., Li, R., Liu, B., Wang, C., Huang, Z., Dai, R., ... Li, J. (2019). Altered static and temporal dynamic amplitude of low-frequency fluctuations in the background network during working memory states in mild cognitive impairment. Frontiers in Aging Neuroscience, 11, 152.
Wen, D., Cheng, Z., Li, J., Zheng, X., Yao, W., Dong, X., ... Zhou, Y. (2021). Classification of ERP signal from amnestic mild cognitive impairment with type 2 diabetes mellitus using single-scale multi-input convolution neural network. Journal of Neuroscience Methods, 363, 109353.
Youn, Y. C., Kang, S. W., Lee, H., & Park, U. (2020). Machine-learning based EEG biomarker for early screening of amnestic mild cognitive impairment (aMCI). Alzheimer's Dementia, 16(S4), e044381.
Yuan, B., Chen, J., Gong, L., Shu, H., Liao, W., Wang, Z., ... Zhang, Z. (2016). Mediation of episodic memory performance by the executive function network in patients with amnestic mild cognitive impairment: A resting-state functional MRI study. Oncotarget, 7(40), 64711?64725.
Zhong, X., Chen, B., Hou, L., Wang, Q., Liu, M., Yang, M., ... Ning, Y. (2022). Shared and specific dynamics of brain activity and connectivity in amnestic and nonamnestic mild cognitive impairment. CNS Neuroscience & Therapeutics, 28(12), 2053?2065.
Neural mechanisms and digital promotion of executive function
in older adults with amnestic mild cognitive impairment
LIU Hai-ning1, DONG Xian-ling2, LIU Hai-hon1, LIU Yan-li2, LI Xian-wen3
(1 Department of Psychology, Chengde Medical University, Chengde 067000, China)
(2 Department of Biomedical Engineering, Chengde Medical University, Chengde 067000, China)
(3 School of Nursing, Nanjing Medical University, Nanjing 211166, China)
Abstract: Alzheimer's disease (AD) is very common and is associated with a high mortality rate. Therefore, exploring the mechanisms of the onset and development of amnestic mild cognitive impairment (aMCI), a clinical prodromal stage of AD, can help prevent the disease. Previous studies have suggested a close relationship between memory decline in aMCI and multiple executive domain defects; however, key scientific questions, such as which executive domain is the key pathogenic factor, remain unanswered, and key intervention targets remain unknown. To overcome the limitations of previous studies that considered executive function as a whole or fragmented element, this study will focus on the overall structure of executive function based on the hypothesis that executive function in aMCI is associated with memory impairment. This study will use electroencephalography (EEG) technology to investigate the time domain, time-frequency, and dynamic brain network characteristics of three sub-components of executive function (inhibition, updating, and switching) in patients with aMCI. Using a three-dimensional convolutional neural network, specific neural targets of executive function defects will be identified, and the possibility of adding neural markers related to the inhibition domain for early identification of aMCI will be explored. In addition, the effects of training and the neural basis of different targeted digital interventions in patients with aMCI will be analyzed using a longitudinal design, thus revealing the crucial role of the inhibition domain-related frontal-parietal control network in the interventions. This study aims to elucidate inhibition as a new cognitive target for aMCI executive function defects and explore interventions from the perspective of computational cognitive neurology. It also aims to provide evidence-based support for the early identification, precise diagnosis, and development of treatment plans for aMCI.
Keywords: executive function, amnestic mild cognitive impairment, cognitive neural mechanism, digital intervention, deep learning

