儿童青少年高尿酸血症风险预测模型的构建与验证
肖宁婷 李莉 郭雪梅 陈丽吏

Construction and validation of a risk prediction model for hyperuricemia in children and adolescents
XIAO Ningting, LI Li, GUO Xuemei, CHEN Lili
Affiliated Hospital of North Sichuan Medical College, Sichuan 637000 China
Corresponding Author LI Li, E?mail: 850249381@qq.com
Abstract Objective:To investigate the risk factors for the development of hyperuricemia in children and adolescents and to construct a risk prediction model.Methods:The clinical data of 9 857 cases of children and adolescents aged 6~17 years attending the Affiliated Hospital of Chuanbei Medical College from January 2017 to December 2021 were retrospectively analyzed,and 8 689 cases from January 2017 to December 2020 constituted the modeling group,and 1 168 cases from January to December 2021 constituted the validation group for internal validation.Referring to the definition of hyperuricemia,they were divided into hyperuricemia group and non?hyperuricemia group.Univariate analysis and Logistic regression were applied to analyze the influencing factors of hyperuricemia in children and adolescents,and prediction models were developed.The area under the subject operating characteristic(ROC) curve(AUC) and C?index were used to assess the predictive ability of the model,and Bootstrap repeated sampling method(1 000 times of sampling) was used for internal validation of the model.Results:The results of multifactorial analysis showed that age,gender,body mass index,creatinine,urea nitrogen,estimated glomerular filtration rate,triglycerides,high?density lipoprotein as influencing factors of hyperuricemia in children and adolescents.The area under the ROC curve AUC of the model was 0.876,the sensitivity was 0.809,the specificity was 0.796,the Youden index was 0.611,and the C?index was 0.877.the area under the ROC curve AUC of external validation was 0.838,and the overall correctness of the model was 77.8%.Conclusion:The risk prediction model for hyperuricemia in children and adolescents has good predictive efficacy and implementability,and provides a reference for clinical staff to assess the risk of hyperuricemia in children and adolescents.
Keywords children; adolescents; hyperuricemia; risk factors; prediction model
摘要 目的:探讨儿童青少年高尿酸血症的危险因素,并构建风險预测模型。方法:回顾性分析2017年1月—2021年12月在川北医学院附属医院就诊的9 857例6~17岁儿童青少年的临床资料,将2017年1月—2020年12月的8 689例构成建模组,2021年1月—12月的1 168例构成验证组进行内部验证。根据是否患高尿酸血症分为高尿酸血症组和非高尿酸血症组。应用单因素分析和Logistic回归分析儿童青少年高尿酸血症的影响因素,并建立预测模型。采用受试者工作特征(ROC)曲线下面积(AUC)及一致性指数(C?index)评估模型的预测能力,采用Bootstrap重复取样法(取样次数1 000次)进行模型内部验证。结果:多因素分析结果显示,年龄、性别、体质指数、肌酐、尿素氮、肾小球滤过率估计值、三酰甘油、高密度脂蛋白胆固醇是儿童青少年高尿酸血症的影响因素。构建模型的AUC为0.876,敏感度为0.809,特异度为0.796,约登指数为0.611,C?index为0.877。模型内部验证的AUC为0.838,模型总正确率为77.8%。结论:儿童青少年高尿酸血症风险预测模型具有良好的预测效能及可实施性,为临床工作人员评估儿童青少年高尿酸血症发生风险提供参考。
关键词 儿童;青少年;高尿酸血症;危险因素;预测模型
doi:10.12102/j.issn.1009-6493.2024.11.005
血清尿酸(serum uric acid,SUA)是人体嘌呤代谢的最终产物,高尿酸血症(hyperuricemia,HUA)是嘌呤代谢紊乱导致血清尿酸生成过多或排泄障碍引起的一种代谢异常疾病[1?2]。既往研究发现,高尿酸血症不仅可导致痛风[2],还是慢性肾脏病、心血管疾病及糖尿病的独立危险因素[3]。随着我国经济水平的快速提升,生活方式和饮食结构发生改变,我国高尿酸血症发病率呈增长趋势且逐渐低龄化[4]。儿童青少年阶段高尿酸血症的痛风石、痛风性关节炎及其他典型临床症状不明显,故易被忽视。因此,识别儿童青少年高尿酸血症的危险因素,早期进行预防和干预,有助于降低儿童及青少年的高尿酸血症发病率,降低发生并发症的风险。既往对儿童青少年高尿酸血癥的研究多集中于对危险因素的探讨,但鲜见相应的风险预测模型报道。故本研究通过回顾性分析,基于川北医学院附属医院的临床资料,筛选儿童青少年高尿酸血症的危险因素,构建风险预测模型并进行内部验证,以期为临床医护人员对儿童青少年高尿酸血症的预防和早期干预提供便捷的量化评估工具。
1 资料与方法
1.1 一般资料
收集2017年1月—2021年12月在川北医学院附属医院就诊的9 864例6~17岁儿童青少年的临床资料,以2017年1月—2020年12月的8 696例构成建模组,2021年1月—12月的1 168例构成验证组进行内部验证。纳入标准:1)6~17岁儿童青少年;2)数据资料完整。排除标准:1)半年内进行过降尿酸治疗者;2)合并严重心脑血管疾病、恶性肿瘤、严重感染者。本研究已获得川北医学院附属医院伦理委员会审查(伦理批件号:2022ER578?1)。
1.2 研究方法
1.2.1 高尿酸血症诊断方法
目前国际上关于儿童青少年高尿酸血症的诊断标准暂未达成统一,本研究采用《诸福棠实用儿科学》[5]中高尿酸诊断标准:男≥416 μmol/L,女≥357 μmol/L。
1.2.2 收集临床资料
利用川北医学院附属医院临床科研平台回顾性收集研究对象的病例资料。1)一般资料:年龄、性别、体质指数(body mass index,BMI)。2)实验室检查数据:白细胞计数、红细胞计数、血红蛋白、白蛋白、血肌酐、尿酸、尿素氮、肾小球滤过率估计值、总胆固醇、三酰甘油、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇等。
1.2.3 统计学方法
使用SPSS 25.0及R 4.2.2软件进行统计分析。服从正态分布的定量资料采用均数±标准差(x±s)描述,组间比较采用t检验,非正态分布的定量资料采用中位数(四分位数)[M(P25,P75)]描述,组间比较采用非参数Wilcoxon检验;定性资料采用例数、百分比(%)描述,组间比较采用χ2检验。采用Logistic回归分析影响因素,构建风险预测模型,使用受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)及计算一致性指数(C?index)对模型的预测能力进行评估。运用R 4.2.2对数据进行Bootstrap重复抽样(取样次数1 000次)进行模型内部验证并绘制校准曲线。
2 结果
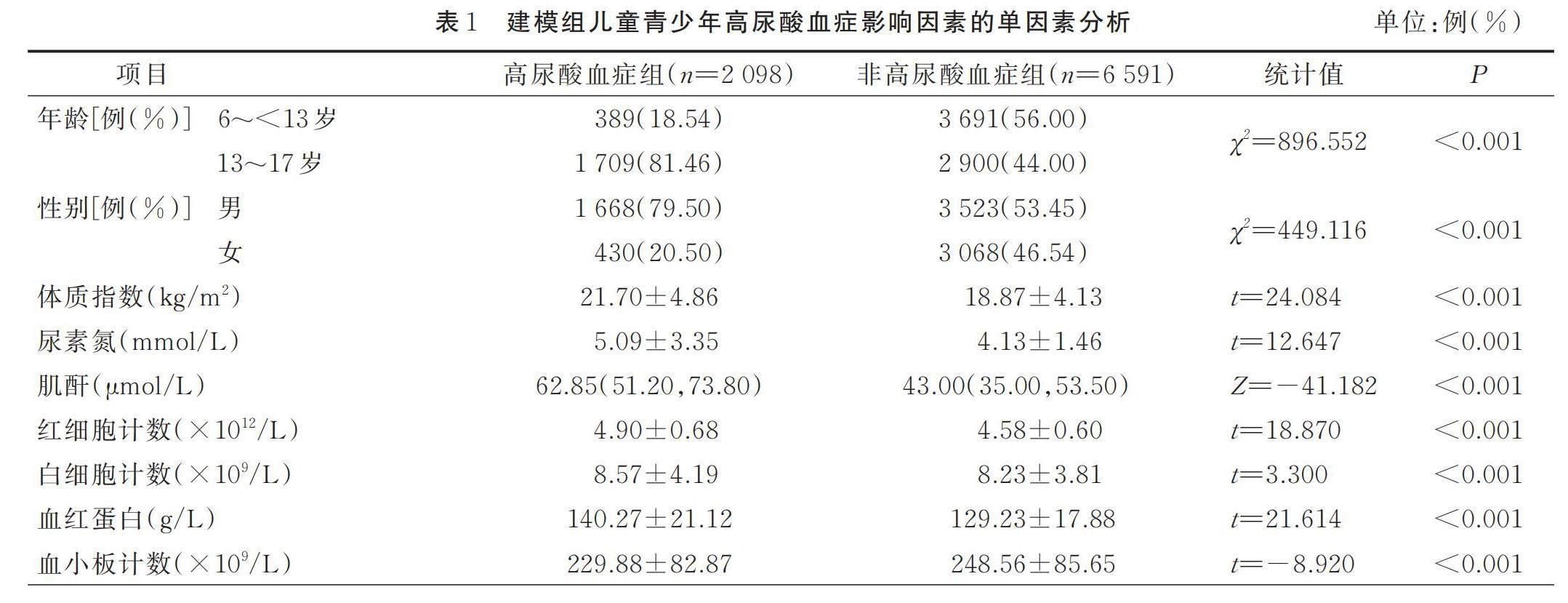
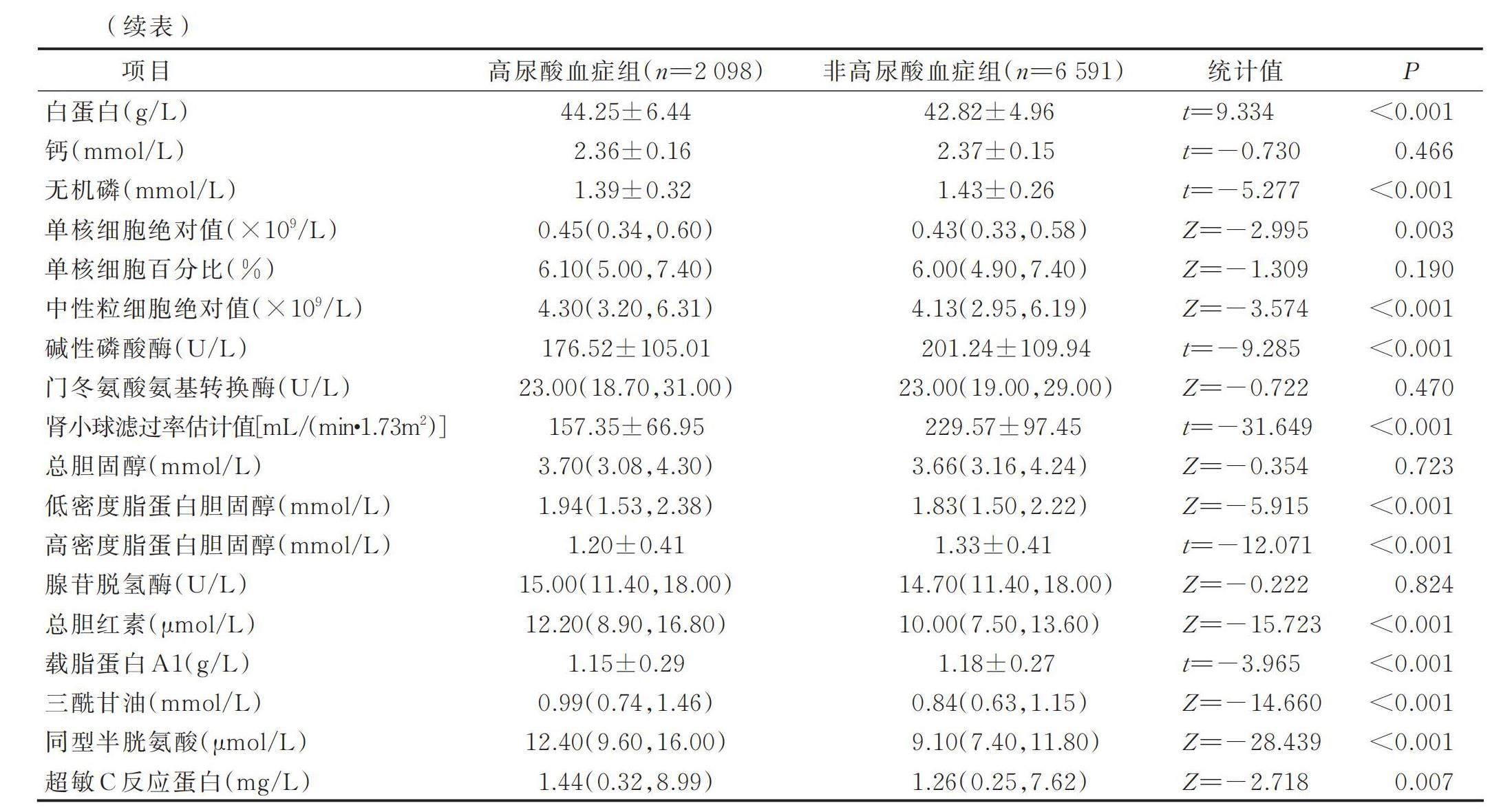
2.1 高尿酸血症儿童青少年一般资料及影响因素的单因素分析
建模组8 689例儿童青少年中,高尿酸血症2 098例(24.15%),非高尿酸血症6 591例(75.85%);男5 191例(59.74%),女3 498例(40.26%)。验证组1 168例中,高尿酸血症403例(34.50%),非高尿酸血症765例(65.50%);男702例(60.10%),女466例(39.90%)。单因素分析结果显示,两组年龄、性别、体质指数、尿素氮、肾小球滤过率估计值、三酰甘油、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、红细胞计数、白细胞计数、血红蛋白、血小板计数、白蛋白、无机磷、单核细胞绝对值、中性粒细胞绝对值、碱性磷酸酶、载脂蛋白A、同型半胱氨酸、总胆红素、超敏感C反应蛋白、肌酐差异有统计学意义(P<0.05),详见表1。
2.2 儿童青少年高尿酸血症影响因素的多因素分析
将单因素分析中有统计学意义(P<0.05)的因素作为自变量,以是否发生高尿酸血症作为因变量,进行Logistic回归多因素分析。结果显示,性别、年龄、体质指数、尿素氮、肌酐、肾小球滤过率估计值、高密度脂蛋白、三酰甘油是儿童青少年发生高尿酸血症的独立危险因素,详见表2、表3。
2.3 儿童青少年高尿酸血症风险预测模型评价
以Logit(P)为检验变量,是否发生高尿酸血症为状态变量,绘制模型的ROC曲线,结果显示,AUC为0.876[95%CI(0.868,0.885)],敏感度为0.809,特异度为0.796,C?index为0.877,表明模型具有良好的区分度,提示模型的预测能力较强,预测准确度较高。约登指数为0.611,提示该模型根据最佳截断值(0.611)为依据,当临界值>0.611时提示儿童青少年存在高尿酸血症的发生风险。详见图1。
2.4 儿童青少年高尿酸血症风险预测模型内部验证
2.4.1 Bootstrap法
运用Bootstrap重复抽样1 000次进行内部验证并绘制校准曲线图,显示校准曲线图围绕理想曲线波动,几乎与理想曲线重合,提示模型预测性能良好,具有较好的可重复性,详见图2。平均绝对误差(mean absolute error,MAE)表明预测值与实际值的吻合程度,取值范围为[0,+∞);误差越大,MAE取值越大,该模型的MAE为0.008,表明模型的预测误差小,吻合程度较高。
2.4.2 模型验证
对1 168例儿童青少年进行模型的内部验证,403例实际发生高尿酸血症,模型预测251例发生高尿酸血症,误判152例;实际765例非发生高尿酸血症,模型预测665例发生高尿酸血症,误判100例。内部验证AUC为0.838[95%CI(0.814,0.861)],灵敏度为0.742,特异度为0.800,模型总正确率为77.8%。表明模型预测能力良好,可实施性较强。详见图3。
3 討论
3.1 儿童青少年高尿酸血症风险预测模型具有重要临床意义
我国居民的饮食结构从传统的以碳水化合物和蔬菜为主的饮食模式转变为以富含丰富嘌呤的肉类、海鲜类食物种类为主的饮食模式[6],使我国高尿酸血症的发病率逐年升高并呈现低龄化。2009—2019年我国儿童青少年高尿酸血症的总体患病率为23.3%[7],高于我国成人高尿酸血症患病率[2],现已成为继糖尿病后第二大代谢性疾病。高尿酸血症的发生、发展与多种因素密切相关,早期识别各种危险因素对于儿童青少年高尿酸血症的预防具有重要意义。儿童青少年高尿酸血症风险预测模型的构建有助于将医护人员的关注重点从儿童青少年高尿酸血症的诊疗转移到患病前的早期干预,加强高风险人群的一级、二级预防,以降低儿童青少年高尿酸血症的发生率及相关并发疾病的发生风险,提升我国儿童青少年的健康水平。
3.2 儿童青少年高尿酸血症相关危险因素
本研究中儿童青少年高尿酸血症发生率为24.15%,多因素分析结果显示:性别、年龄、体质指数、尿素氮、肌酐、三酰甘油是儿童青少年发生高尿酸血症的独立危险因素,肾小球滤过率估计值、高密度脂蛋白胆固醇是其保护因素。
3.2.1 性别
本研究结果显示,男性较女性更易发生高尿酸血症。与陈京蓉等[4?5]研究结果一致。可能与雄激素促进肾小管尿酸盐分泌后重吸收,并降低了磷脂膜对尿酸结晶的易感性[8];而雌激素利于尿酸盐的排泄及降低血清尿酸水平[9]有关。
3.2.2 年龄
本研究结果显示,年龄13~17岁的青少年更易发生高尿酸血症。肌肉组织被认为是体内嘌呤产生的最主要来源[10],进入青春期后青少年的肌肉质量较儿童更大,随着年龄不断增长,性激素水平上升和肌肉质量增加,青少年体内的嘌呤来源增多,而肾脏对尿酸的排泄速率下降导致其较儿童更易发生高尿酸血症。
3.2.3 肾功能下降
本研究结果显示,肌酐、尿素氮水平升高而肾小球滤过率估计值水平下降更易发生高尿酸血症。一项调查结果显示,在校正年龄、性别、高血压病史等因素后,肾小球滤过率估计值<60 mL/min的个体发生高尿酸血症的可能性是肾小球滤过率估计值>90 mL/min的10倍[11]。高尿酸血症发生的原因可概括为尿酸生成过多和排泄不足2个方面,其中排泄不足是高尿酸血症发生的主要原因[12],人体70%左右的尿酸通过肾脏的滤过、吸收、分泌、分泌后重吸收等步骤排出体外[13]。肌酐、尿素氮升高及肾小球滤过率下降表明肾脏功能受损,影响了肾脏尿酸重吸收转运蛋白和分泌转运蛋白的功能表达[14?15],使血清尿酸的重吸收减少,分泌增多,导致血清尿酸排泄不足。
3.2.4 血脂异常
本研究结果显示,三酰甘油水平升高,高密度脂蛋白胆固醇水平下降更易发生高尿酸血症。三酰甘油水平升高增加了动脉血管粥样硬化及堵塞的风险,高密度脂蛋白胆固醇水平下降减弱了对胆固醇的转运能力,增加了胆固醇在血管壁的沉积,导致血管管壁狭窄、硬化或形成斑块,影响肾小球的入球小动脉和出球小动脉的功能状态,降低肾脏对血清尿酸的清除速率[16]。
3.2.5 体质指数
本研究结果显示,体质指数高的儿童青少年更易发生高尿酸血症。研究显示,体质指数与高尿酸血症的患病风险呈线性正相关[17],体质指数升高导致内脏脂肪堆积、血清游离脂肪酸增加,脂肪代谢产生的酮酸增多,而酮酸具有抑制肾小管对血清尿酸的排泄作用[18],同时体质指数较高的儿童青少年血清中miR?27a mRNA高表达、PPAR?γ mRNA低表达,两者与胰岛素抵抗密切相关[19],胰岛素刺激肾小管对氢离子(H+)排泄的同时增加了对血清尿酸的重吸收[20],从而增加了高尿酸血症的发病风险。
Logistic回归分析是预测疾病发生风险的重要方法之一,该方法可对二分类或多分类变量进行判别,通过计算不同自变量情况下患病的概率,实现对疾病发生风险的预测[21],目前采用Logistic回归分析建立预测模型已广泛运用于静脉血栓、缺血性脑卒中、认知功能障碍等多种疾病,并具有良好的预测效能。本研究基于儿童青少年发生高尿酸血症的独立危险因素构建预测模型,结果显示,该模型的灵敏度为0.809,特异度为0.796,C?index为0.877,经过内部验证,该模型预测儿童青少年发生高尿酸血症的总体准确度为77.8%,提示该模型具有良好的预测效能。
4 小结
本研究通过回顾性分析儿童青少年的临床资料构建了儿童青少年高尿酸血症的风险预测模型并经过内部验证,结果显示,该预测模型具有良好的预测效能及外部移植性,为早期识别儿童青少年高尿酸血症的危险因素提供参考。本研究为回顾性研究横断面研究,仅收集单次临床资料,未来可开展前瞻性纵向研究,探讨儿童青少年尿酸水平的动态影响因素及产生的危害。
参考文献:
[1] 徐洁,毛建华.儿童高尿酸血症与高血压关系的研究进展[J].中国实用儿科杂志,2018,33(11):914-919.
XU J,MAO J H.Research progress in the relationship between hyperuricemia and hypertension in children[J].Chinese Journal of Practical Pediatrics,2018,33(11):914-919.
[2] 中华医学会内分泌学分会.中国高尿酸血症与痛风诊疗指南(2019)[J].中华内分泌代谢杂志,2020,36(1):1-13.
Chinese Medical Endocrinology Branch.Guideline for the diagnosis and management of hyperuricemia and gout in China(2019)[J].Chinese Journal of Endocrinology and Metabolism,2020,36(1):1-13.
[3] LI X,MENG X R,TIMOFEEVA M,et al.Serum uric acid levels and multiple health outcomes:umbrella review of evidence from observational studies,randomised controlled trials,and Mendelian randomisation studies[J].BMJ,2017,357:j2376.
[4] 陈京蓉,罗书全,熊鹰,等.基于回归和分类树模型的重庆7~17岁儿童青少年高尿酸血症影响因素分析[J].中国食品卫生杂志,2022,34(5):1077-1082.
CHEN J R,LUO S Q,XIONG Y,et al.Analysis on the influencing factors of hyperuricemia among children and adolescents aged 7-17 years in Chongqing:based on regression and classification tree models[J].Chinese Journal of Food Hygiene,2022,34(5):1077-1082.
[5] 江載芳,申昆玲,沈颖.诸福棠实用儿科学[M].8版.北京:人民卫生出版社,2015:1.
JIANG Z F,SHEN K L,SHEN Y.Zhu Futang's practical pediatrics[M].Version 8.Beijing:People's Health Publishing House,2015:1
[6] 陈莉惠,陈海冰.青少年高尿酸血症和痛风的流行现状、病因及临床特征[J].海南医学,2020,31(12):1618-1620.
CHEN L H,CHEN H B.Epidemiology,etiology and clinical characteristics of adolescent hyperuricemia and gout[J].Hainan Medical Journal,2020,31(12):1618-1620.
[7] RAO J H,YE P Y,LU J,et al.Prevalence and related factors of hyperuricaemia in Chinese children and adolescents:a pooled analysis of 11 population-based studies[J].Annals of Medicine,2022,54(1):1608-1615.
[8] 李洪军,杨艳娜,江南.2015—2019年北京市通州区超重肥胖中小学生高尿酸血症流行病学特征及影响因素[J].江苏预防医学,2022,33(5):611-613.
LI H J,YANG Y N,JIANG N.Epidemiological characteristics and influencing factors of hyperuricemia among overweight and obese primary and secondary school students in Tongzhou district of Beijing from 2015 to 2019[J].Jiangsu Journal of Preventive Medicine,2022,33(5):611-613.
[9] GUAN S C,TANG Z,FANG X H,et al.Prevalence of hyperuricemia among Beijing post-menopausal women in 10 years[J].Archives of Gerontology and Geriatrics,2016,64:162-166.
[10] ALVIM R O,SIQUEIRA J H,ZANIQUELI D,et al.Influence of muscle mass on the serum uric acid levels in children and adolescents[J].Nutrition,Metabolism,and Cardiovascular Diseases,2020,30(2):300-305.
[11] RUSSO E,VIAZZI F,PONTREMOLI R,et al.Association of uric acid with kidney function and albuminuria:the uric acid right for heart health(URRAH) project[J].Journal of Nephrology,2022,35(1):211-221.
[12] 辛家东,周嘉宝,吴志远,等.尿酸排泄及其相关转运蛋白在高尿酸血症中的研究进展[J].中国全科医学,2023,26(15):1916-1922.
XIN J D,ZHOU J B,WU Z Y,et al.Advances in urate excretion and urate transporters in hyperuricemia[J].Chinese General Practice,2023,26(15):1916-1922.
[13] 王旭,罗冬平,茹彦海,等.从慢性肾脏病角度看高尿酸血症与痛风的指南更新要点[J].中国全科医学,2021,24(33):4191-4195.
WANG X,LUO D P,RU Y H,et al.Interpretation of the major updates of guidelines regarding hyperuricemia and gout in chronic kidney disease[J].Chinese General Practice,2021,24(33):4191-4195.
[14] 王惠芳,刘雪梅,刘孟春,等.慢性肾脏病3-5期患者高尿酸血症的临床研究[J].中國综合临床,2017,33(3):221-226.
WANG H F,LIU X M,LIU M C,et al.Clinical study of hyperuricemia in patients with chronic kidney disease stages 3-5[J].Clinical Medicine of China,2017,33(3):221-226.
[15] 韩琳,贾兆通,李长贵.人尿酸盐转运子1基因多态性与中国汉族人群高尿酸血症相关性研究[J].中华内科杂志,2010,49(11):925-929.
HAN L,JIA Z T,LI C G.The association between single-nucleotide polymorphisms of hURAT1 and hyperuricemia in Han Chinese[J].Chinese Journal of Internal Medicine,2010,49(11):925-929.
[16] HAN Q X,ZHANG D,ZHAO Y L,et al.Risk factors for hyperuricemia in Chinese centenarians and near-centenarians[J].Clinical Interventions in Aging,2019,14:2239-2247.
[17] JURASCHEK S P,MILLER E R,GELBER A C.Body mass index,obesity,and prevalent gout in the United States in 1988-1994 and 2007-2010[J].Arthritis Care & Research,2013,65(1):127-132.
[18] PINGMUANGKAEW P,TANGVARASITTICHAI O,TANGVARASIT TICHAI S.Association of elevated serum uric acid with the components of metabolic syndrome and oxidative stress in abdominal obesity subjects[J].Indian Journal of Clinical Biochemistry,2015,30(3):286-292.
[19] 寇永妹,陈新春,谷小娜,等.肥胖儿童血清microRNA-27a、PPAR-γ与胰岛素抵抗的相关性研究[J].中国现代医学杂志,2022,32(15):14-19.
KOU Y M,CHEN X C,GU X N,et al.Correlation of serum microRNA-27a and PPAR-γ expression with insulin resistance in obese children[J].China Journal of Modern Medicine,2022,32(15):14-19.
[20] 王靖宇,常宝成.高尿酸血症/痛风流行病学特点及危险因素[J].国际内分泌代谢杂志,2016,36(2):78-81;88.
WANG J Y,CHANG B C.Epidemiological characteristics and risk factors of hyperuricemia/gout[J].International Journal of Endocrinology and Metabolism,2016,36(2):78-81;88.
[21] WEI J T,ZHANG Y N,LIU Y Q,et al.Construction and validation of a risk-scoring model that preoperatively predicts lymph node metastasis in early gastric cancer patients[J].Annals of Surgical Oncology,2021,28(11):6665-6672.
(收稿日期:2023-02-21;修回日期:2024-05-20)
(本文编辑 曹妍)

