两种种植模式下草豆蔻的营养器官药用成分比较
罗敦 吴桐 陆素君 余凤强 黎婷演 杨梅 陈振生


摘要:以桉樹(Eucalyptus spp.)林套种的草豆蔻(Alpinia katsumadae Hayata)和自然生长的草豆蔻为研究对象,测定草豆蔻营养器官(根、茎、叶)中总黄酮、多糖、总酚、总皂苷含量和折干率。结果表明,自然生长的草豆蔻整株折干率是桉树林套种的1.11倍;草豆蔻的总黄酮含量为10.27~32.13 mg/g,其中桉树林套种的草豆蔻叶总黄酮含量最高,达32.13 mg/g;草豆蔻多糖含量为21.50~37.28 mg/g,自然生长条件下草豆蔻整株多糖含量是桉树林套种的1.15倍;桉树林套种条件下草豆蔻整株总酚含量是自然生长条件下草豆蔻总酚含量的2.10倍;桉树林套种条件下草豆蔻整株总皂苷含量是自然生长条件下草豆蔻整株总皂苷含量的1.25倍;由主成分分析可知,桉树林套种条件下草豆蔻的营养器官综合得分和排名均高于自然生长。综上,2种种植模式下草豆蔻营养器官的药用成分含量均处于较高水平,且桉树林套种条件下草豆蔻更有利于有效成分的累积。
关键词:草豆蔻(Alpinia katsumadae Hayata);桉树(Eucalyptus spp.)林;药用成分;营养器官
中图分类号:S759.82 文献标识码:A
文章编号:0439-8114(2024)04-0158-05
Comparison of nutritional organs medicinal components of Alpinia katsumadae Hayata under two planting models
Abstract: Using Alpinia katsumadae Hayata from Eucalyptus forest intercropping and Alpinia katsumadae Hayata from natural growth as research objects, the total flavonoid, polysaccharide, total phenolic, total saponin content and drying rate of Alpinia katsumadae Hayata nutritional organs (roots, stems, leaves) were determined. The results showed that the whole plant drying rate of Alpinia katsumadae Hayata with natural growth was 1.11 times that of Eucalyptus forest intercropping;the total flavonoid content of Alpinia katsumadae Hayata was 10.27~32.13 mg/g, among which Eucalyptus forest intercropping had the highest total flavonoid content in the leaves of Alpinia katsumadae Hayata, reaching 32.13 mg/g;the polysaccharide content of Alpinia katsumadae Hayata was 21.50~37.28 mg/g. Under natural growth conditions, the total polysaccharide content of Alpinia katsumadae Hayata was 1.15 times that of Eucalyptus forest intercropping;the total phenolic content of Alpinia katsumadae Hayata under the condition of Eucalyptus forest intercropping was 2.10 times that of Alpinia katsumadae Hayata under the condition of natural growth;the total saponin content of Alpinia katsumadae Hayata under the condition of Eucalyptus forest intercropping was 1.25 times that of Alpinia katsumadae Hayata under the condition of natural growth;according to principal component analysis, under the condition of Eucalyptus forest intercropping, the comprehensive score and ranking of the nutritional organs of Alpinia Katsumadae Hayata were higher than those of natural growth. In summary, the medicinal component content of the nutritional organs of Alpinia katsumadae Hayata was at a high level under both planting modes, and the Eucalyptus forest intercropping condition was more conducive to the accumulation of effective ingredients of Alpinia katsumadae Hayata.
Key words: Alpinia katsumadae Hayata; Eucalyptus spp. forest; medicinal components; nutritional organs
草豆蔻(Alpinia katsumadae Hayata)为姜科(Zingiberaceae)山姜属多年生植物,喜温暖潮湿,多生长于水分充足、土质疏松的山地、沟谷,主要分布于中国海南省、广东省、广西壮族自治区、福建省、云南省等南方地区[1]。草豆蔻为传统的药食同源常用中药,收载于《中华人民共和国药典》2015年版,其干燥近成熟种子内含有黄酮、多糖、皂苷等药用成分,具有燥湿行气、温中止呕等功效[2],有研究发现,草豆蔻根、茎、叶中也含有此类药用成分[3,4]。随着对草豆蔻药用价值的深入研究,其市场需求逐步扩大,人工种植草豆蔻的规模也迅速扩大。桉树(Eucalyptus spp.)是桃金娘科(Myrtaceae)桉属植物,具有生长速度快、环境适应性强和经济价值高等特点,广泛栽植于广东省、广西壮族自治区等地[5,6]。桉树树冠稀疏,透光度大,利用其下层空间套种药用植物不仅能提高桉树林的空间利用率,还能在相对较短的时间内增加经济效益。已有学者开展了桉树与草珊瑚(Sarcandra glabra)、金银花(Lonicera japonica)、扶芳藤(Euonymus fortunei)等套种模式的研究,但桉树林套种草豆蔻的研究鲜有报道[7]。鉴于此,本研究以桉树林套种的草豆蔻和自然生长的草豆蔻为研究对象,发掘不同生长条件下草豆蔻营养器官根、茎、叶的药用潜力,以期为草豆蔻的高效栽培及综合利用提供理论参考。
1 材料与方法
1.1 试验地概况
试验地位于广西壮族自治区玉林市博白县博白林场(109°38′—110°17′E,21°39′—22°30′N),属亚热带季风气候。该地区光照充足,雨量充沛,年平均温度为21.9 ℃,月平均最低温度为13.4 ℃(1月),月平均最高温度为28 ℃(7月),全年积温为80 819 ℃·d,年平均降水量为1 756.2 mm,年平均日照为1 778.3 h,对培育桉树等速生树种十分有利。地形以丘陵为主,土壤类型是酸性壤土、沙壤土。
1.2 林分结构与样品采集
于2021年4月在桉树纯林中构建桉树-草豆蔻复合经营模式,株行距设置为1.6 m×2.0 m,种植密度为200株/667 m2,采用垂直等高线混交,一列种植桉树,一列种植草豆蔻。桉树树龄为2年,树高约11 m。造林后,每年施肥2次,基肥和追肥均施用复合肥,N∶P∶K=17∶17∶17(质量比),采用人工挖坑施肥,每个坑施肥1 kg。定植后,每年安排2次割灌除草。自然生长的野生草豆蔻生长于距桉树林约20 m的沟谷内,后期未进行任何抚育管理。于2022年3月在桉树林套种草豆蔻的林分及自然生长的林分中设置3个6 m×30 m样带,样带之间相隔20 m,于各样带的上、中、下坡分别采集5株样品带回实验室,用于折干率及有效成分的测定。各样带的基本情况如表1所示。
1.3 测定方法
1.3.1 主要仪器、试剂与对照品 INFINITE M200 PRO型全自动全波长酶标仪(瑞士帝肯有限公司);KS-120D型超声波仪(宁波海曙科声超声设备有限公司);XPN-100型超速冷冻离心机[贝克曼库尔特商贸(中国)有限公司]。乙醇、硫酸、蒽酮、亚硝酸钠、硝酸铝、氢氧化钠、香草醛、冰醋酸、福林酚均为分析纯;对照品葡聚糖(纯度≥98%)、芦丁标准品(纯度≥98%)、齐墩果酸(纯度≥98%)、香草酸(纯度≥98%)均购自广西南宁壹棵松生物科技有限公司。
1.3.2 折干率的测定 将草豆蔻分成根、茎、叶3部分,洗净后测鲜重,105 ℃杀青30 min,75 ℃烘干至恒重,测干重,计算折干率,计算公式如下。
折干率=(干重/鲜重)×100% (1)
1.3.3 总黄酮含量的测定 采用乙醇提取法测定草豆蔻的总黄酮含量[8]。以芦丁试剂为标准溶液,准确称取1.0 g草豆蔻粉末,按照料液比1∶20的比例集中加入70%的乙醇溶液,在80 ℃下提取2 h,在酶标仪中于波长510 nm处测吸光度,绘制标准曲线,得到回归方程y=7.476 4x+0.048 1,计算总黄酮含量。
1.3.4 多糖含量的测定 草豆蔻的多糖含量采用苯酚-硫酸法测定[9]。以葡聚糖溶液作为标准液,取2.0 g草豆蔻粉末,用苯酚-硫酸法在沸水浴条件下提取2 h,离心后弃去上清液,加入苯酚和硫酸并在485 nm波长处测吸光度,得到回归方程y=2.770 5x+0.081 3,计算多糖含量。
1.3.5 总酚含量的测定 总酚的测定使用福林酚法[10],精密称取香草酸对照品1 mg,加10 mL 20%甲醇制成质量浓度为0.1 mg/mL的溶液即得标准应用液,称取2 g草豆蔻粉末与70 mL 20%甲醇混合后在索氏提取器中回流提取60 min,加福林酚試剂和10% Na2CO3后加去离子水定容,暗处放置1 h后在波长735 nm处测吸光度,绘制标准曲线,得到回归方程y=9.611 1x+0.167 9,计算总酚含量。
1.3.6 总皂苷含量的测定 采用香草醛-冰醋酸显色法测定总皂苷含量[11],以齐墩果酸为对照品溶液,向提取的草豆蔻样品溶液中分别加入0.2 mL 5%香草醛-冰醋酸溶液、5 mL高氯酸,混匀密塞后水浴15 min后冰浴,再加入5 mL冰醋酸静置1 h,在 540 nm波长处用酶标仪测吸光度,以质量浓度为横坐标、吸光度为纵坐标,绘制标准曲线,得到回归方程y=0.026 3x+0.085 5,计算总皂苷含量。
1.4 数据统计方法
采用Microsoft Excel 2016软件进行数据汇总与初步处理;IBM SPSS Statistics 23软件进行方差分析、多重比较及主成分分析;Origin Pro 2021软件制作图表。
2 结果与分析
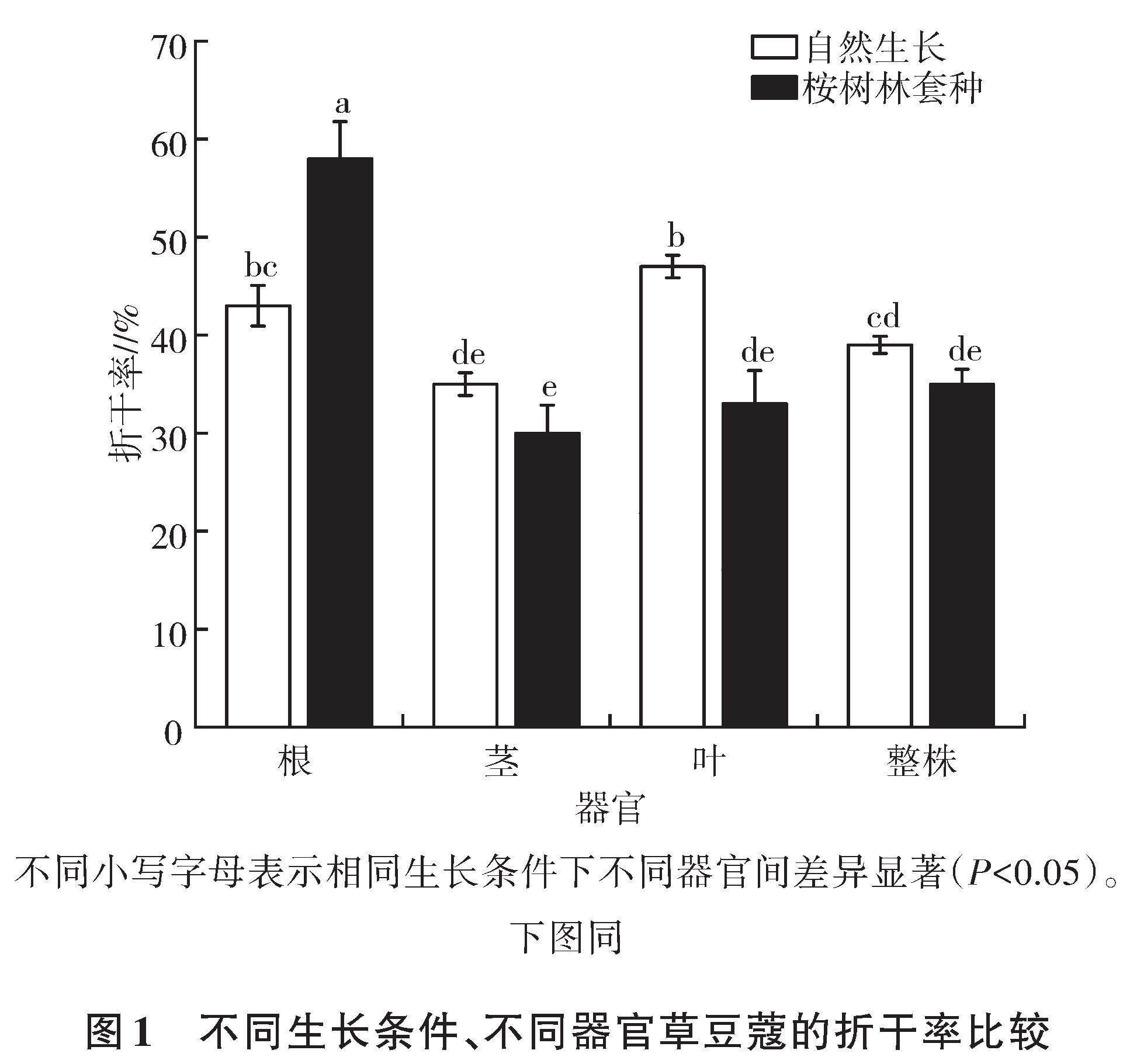
2.1 不同生长条件、不同器官草豆蔻折干率比较
由图1可知,不同生长条件下草豆蔻不同器官的折干率存在差异。自然生长的草豆蔻整株折干率是桉树林套种的1.11倍。自然条件下草豆蔻各器官的折干率由大到小依次为叶(47%)、根(43%)、茎(35%);桉树林套种条件下,草豆蔻根折干率为58%,分别是茎、叶折干率的1.93、1.76倍。
2.2 不同生长条件、不同器官草豆蔻总黄酮含量比较
由图2可知,草豆蔻的总黄酮含量在10.27~32.13 mg/g,其中自然生长条件下的草豆蔻不同器官总黄酮含量从高到低依次为叶(13.33 mg/g)、茎(12.09 mg/g)、根(11.06 mg/g);桉树林套种的草豆蔻叶总黄酮含量最高,达32.13 mg/g,分别是桉树林套种下草豆蔻根、茎总黄酮含量的3.13、1.74倍,三者间存在显著差异(P<0.05)。桉树林套种的草豆蔻整株总黄酮含量是自然生长条件下的1.87倍。
2.3 不同生长条件、不同器官草豆蔻多糖含量比较
由图3可知,草豆蔻多糖含量为21.50~37.28 mg/g,自然生长条件下草豆蔻整株多糖含量是桉树林套种的1.15倍。自然生长条件下草豆蔻根多糖含量最高,达37.28 mg/g,其含量分别是自然生长条件下草豆蔻茎、叶多糖含量的1.45、1.20倍,分别是桉树林套种下草豆蔻根、茎、叶多糖含量的1.05、1.43、1.73倍。
2.4 不同生长条件、不同器官草豆蔻总酚含量比较
由图4可知,不同生长条件下草豆蔻叶总酚含量均显著高于根和茎(P<0.05),其中桉树林套种的草豆蔻叶总酚含量最大,为81.05 mg/g,分别是桉树林套种下草豆蔻根、茎总酚含量的9.90、2.40倍。就生长条件而言,桉树林套种条件下草豆蔻整株总酚含量是自然生长条件下草豆蔻总酚含量的2.10倍。
2.5 不同生长条件、不同器官草豆蔻总皂苷含量比较
对不同生长条件下草豆蔻的总皂苷含量进行测定,结果如图5所示。草豆蔻总皂苷含量为5.75~25.40 mg/g,其中桉树林套种的草豆蔻叶总皂苷含量最高,为25.40 mg/g,分别是桉树林套种条件下草豆蔻根、茎的4.42、1.78倍;就生长条件而言,桉树林套种条件下草豆蔻整株总皂苷含量是自然生长条件下草豆蔻整株总皂苷含量的1.25倍。
2.6 主成分分析
采用主成分分析比较2种生长环境下草豆蔻不同器官药用品质的优劣。由表2可知,当主成分个数达到2时,主成分累计贡献率为91.988%,其中主成分1(PC1)的贡献率为68.607%;主成分2(PC2)的贡献率为23.381%。用以上2个主成分对草豆蔻不同器官的药用价值进行综合评价,得到综合函数(F),计算公式如下。
F=0.686F1+0.234F2 (2)
式中,F1、F2分别为主成分1、主成分2的得分。
根据该函数可知,主成分1对综合评分的影响较大,其中总酚、总皂苷、总黄酮在主成分1中均表现出较高的正载荷(表3),表明这3个指标对草豆蔻的药用品质影响较大。计算2种生长条件和各器官的综合得分,结果如表4所示,在主成分1中,桉树林套种条件下草豆蔻不同器官的综合得分均为正数,自然生长条件下草豆蔻不同器官的综合得分均为负数;在主成分2中,综合得分为正数的是套种根和自然叶,其余均为负数。所有处理的综合得分由大到小依次为套种叶、套种根、套种茎、自然叶、自然根、自然茎。综上,桉树林套种条件下草豆蔻的品质优于自然生长,且套种叶的品质最佳。
3 小结与讨论
在不同种植模式下,草豆蔻的折干率、总黄酮、多糖、总酚、总皂苷含量均存在差异。研究表明,折干率是反映药材最佳采收期和衡量药材生长状况的重要指标,折干率越高,植物长势越好[12,13]。本研究发现,自然生长条件下草豆蔻整株、茎、叶的折干率大于桉树林套种的草豆蔻折干率;桉树林套种条件下草豆蔻整株的总黄酮、总酚、总皂苷含量均为大于自然生长条件,導致该结果的原因可能是,桉树林下的生境为草豆蔻生长发育提供了相对阴凉的环境,同时,桉树林通过施肥、松土、除草等抚育管理,改善了土壤理化性质,提高了土壤肥力,改善了植物对水分和养分的吸收,促进草豆蔻的生长。不仅如此,人为调控林分郁闭度及利用林下的凋落物,在适度遮阴的同时,削弱了光照强度,既满足了草豆蔻所需要的光照要求,又减少了水分蒸发,有利于草豆蔻生长[14,15];而自然生长条件下的草豆蔻受强光直接照射,会加快植株老化,从而影响有效成分的合成与累积。
不同器官的药用成分在植物中的分布与积累具有差异性。本研究发现,2种种植模式下草豆蔻的总黄酮含量均表现为叶>茎>根,推测草豆蔻中的黄酮类化合物可能是在叶片中合成或累积。有学者在研究植物体内的黄酮类化合物合成路径时发现,黄酮类化合物生物合成途径中的3种关键酶都在叶中活性最高[16],揭示黄酮类化合物的主要累积器官为植物叶片,该结论为本研究提供理论依据,但相关机制还需要进一步探讨。草豆蔻叶的总黄酮含量为13.33~32.13 mg/g,与几种以总黄酮为主要药用成分入药的树种相比,其含量比无患子(Sapindus mukorossi)和喜树(Camptotheca acuminata)高,说明草豆蔻叶中的黄酮类化合物具有一定的利用价值[17,18]。
多糖类化合物是一类重要的生物活性物质[19-21]。本研究中多糖类化合物在草豆蔻根、茎、叶中的表达存在差异,根的多糖含量较高,有研究通过对植物多糖的合成关键酶进行表达量聚类分析,发现其在根、茎中的表达量高于叶,再对其特定基因进行定量分析,结果也显示这些基因在根、茎中含量较高[22],可以推断多糖主要贮藏器官为植物的根。此外,本研究测定的草豆蔻多糖含量较其他药用植物少[23-25],若要在生产实践中利用其多糖成分,可通过施肥、抚育间伐等措施来加强多糖在草豆蔻根中的累积[26]。
皂苷和酚类化合物也是广泛存在于植物体内的次生代谢产物[27,28]。本研究中,桉树林套种条件下草豆蔻叶的总酚含量高于铁皮石斛(Dendrobium officinale Kimura et Migo)[29]、总皂苷含量与黄芪(Astragalus licentianus)相差不大[30],說明草豆蔻叶的总酚、总皂苷也具有一定的利用价值。草豆蔻叶的总酚、总皂苷含量高于根、茎,其原因除受遗传基因控制外,还有可能与其执行功能有关[17],植物叶片中含有较高含量的总皂苷、总酚可以有效防御病虫害、抵抗各种逆境胁迫[31-33]。因此,在今后的生产实践中可以选择性地摘取部分叶片进行利用,而保留地下部分继续生长至最佳的采收期再加以利用。
通过对各指标进行主成分分析,发现套种叶、套种根、套种茎的主成分综合得分较高,表明桉树林套种条件下草豆蔻的品质优于自然生长,且套种叶的品质最佳,在后续的研究中,可将草豆蔻的叶视为潜在药用资源,进行进一步的成分分离及结构鉴定。综上所述,2种种植模式下草豆蔻的根、茎、叶中均含有总黄酮、多糖、总酚、总皂苷,并且桉树林套种的草豆蔻品质最佳。桉树-草豆蔻的林药复合模式不仅能提高草豆蔻的品质,还能充分利用林地资源获得更高的经济效益,值得进一步推广。
参考文献:
[1] 胡 璇, 王 丹, 于福来, 等. 草豆蔻的本草考证[J]. 中国实验方剂学杂志, 2020, 26(21): 210-219.
[2] 陈细钦, 冯 剑, 詹志来, 等. 经典名方中豆蔻类中药的本草考证[J]. 中国实验方剂学杂志, 2022, 28(10): 22-41.
[3] 晏小霞, 王茂媛, 王祝年, 等. 草豆蔻不同部位挥发油化学成分GC-MS分析[J]. 热带作物学报, 2013, 34(7): 1389-1394.
[4] JI K L, WU M Z, HUANG C Y, et al, Alpinia hainanensis rhizome extract ameliorates dextran sulfate sodium-induced ulcerative colitis: Active ingredient investigation and evaluation[J]. Journal of agricultural and food chemistry, 2022, 70(13): 3989-3999.
[5] 曹继钊, 李孝忠. 桉树人工林沃土保育与可持续经营思考[J]. 广西林业科学, 2017, 46(2): 233-236.
[6] 谢耀坚. 中国桉树人工林可持续经营战略初探[J]. 世界林业研究, 2003 (5): 59-64.
[7] 许俊文. 南宁树木园珍贵树种林下种植模式研究[D]. 南宁: 广西大学, 2019.
[8] 贤景春, 林 镁. 草豆蔻总黄酮提取工艺的优化[J]. 湖北农业科学, 2012, 51(22): 5158-5160.
[9] 张志军, 刘建华, 李淑芳, 等. 灵芝多糖含量的苯酚硫酸法检测研究[J]. 食品工业科技, 2006 (2): 193-195.
[10] 邹晓红, 曹骋, 曾元儿, 等. 不同产地砂仁总酚测定及抗氧化活性比较[J]. 中国现代中药, 2018, 20(7): 811-815.
[11] 李森辉, 董鹏鹏, 戴卫波, 等. 广西不同产地走马胎总三萜的含量测定[J]. 中国民族民间医药, 2018, 27(1): 33-36.
[12] 李 佳. 吉林敖东提升红参生产折干率项目质量管理改进研究[D]. 长春: 吉林大学, 2017.
[13] 都晓伟, 刘鸣远. 药材生物学研究是GAP研究的前提和理论基础[J]. 世界科学技术, 2004 (3): 73-76, 89.
[14] 王永明. 实行林下栽培野山参开辟种植人参新途径[J]. 中药研究与信息, 2003(10): 25-27.
[15] 倪天宇, 罗晓朦, 张春椿, 等. 不同生境下多花黄精化学成分比较[J]. 中成药, 2020, 42(11): 2948-2953.
[16] 杜乐乐. 黄蜀葵非药用部位资源化学及生物转化研究[D]. 南京: 南京中医药大学, 2016.
[17] 徐圆圆,周思维, 陈 仲, 等. 无患子不同器官中的总皂苷和总黄酮含量[J]. 南京林业大学学报(自然科学版),2021,45(4):83-89.
[18] 朱冬雪, 顾采琴, 周伯春. 喜树不同生长发育期及不同器官中黄酮含量的变化[J]. 广东林业科技, 2012, 28(1): 61-64.
[19] 吴 静, 胡居吾, 熊 伟, 等. 樟树不同器官中多糖抗氧化、免疫调节活性的研究[J]. 江西农业大学学报,2019,41(4): 804-813.
[20] ZONG A Z, CAO H Z, WANG F S. Anticancer polysaccharides from natural resources: A review of recent research[J]. Carbohydrate polymers,2012, 90(4): 1395-1410.
[21] LIU J, WILLF?R S, XU C L. A review of bioactive plant polysaccharides: Biological activities, functionalization, and biomedical applications[J]. Bioactive carbohydrates & dietary fibre, 2015, 5(1): 31-61.
[22] 张声祥. 玉竹基因表达分析及其多糖生物合成途径关键酶的研究[D]. 合肥: 安徽中医药大学, 2020.
[23] 楊晓杰, 付学鹏, 李 娜. 药用蒲公英不同器官多糖含量的比较[J]. 时珍国医国药, 2011, 22(9): 2228-2229.
[24] 张泽锐, 黄 申, 刘京晶, 等. 多花黄精和长梗黄精花主要营养功效成分[J]. 中国中药杂志, 2020, 45(6): 1329-1333.
[25] 梁永富, 易家宁, 王康才, 等. 遮阴对多花黄精生长及光合特性的影响[J]. 中国中药杂志, 2019, 44(1): 59-67.
[26] 郭 妮. 栽培措施对林下多花黄精产量和品质的影响[D]. 重庆: 西南大学, 2019.
[27] 付 佳, 王 洋, 阎秀峰. 萜类化合物的生理生态功能及经济价值[J]. 东北林业大学学报, 2003,31(6): 59-62.
[28] SUBRAMANIYAM S, MATHIYALAGAN R, NATARAJAN S, et al. Transcript expression profiling for adventitious roots of Panax ginseng Meyer[J]. Gene, 2014, 546(1): 89-96.
[29] 黄 琴, 沈杨霞, 张成静, 等. 铁皮石斛多酚和黄酮含量及与抗氧化活性的相关性[J]. 应用与环境生物学报, 2014, 20(3): 438-442.
[30] 江 燕,晁若冰. 黄芪药材中黄芪甲苷和总皂苷含量的比较[J]. 华西药学杂志, 2007, 22(3): 322-324.
[31] 张爱华, 雷锋杰, 许永华, 等. 外源人参皂苷对人参种子萌发和幼根抗氧化酶活性的影响[J]. 生态学报, 2009, 29(9): 4934-4941.
[32] BENNETT R N, WALLSGROVE R M. Secondary metabolites in plant defence mechanisms[J]. New phytologist, 2010, 127(4): 617-633.
[33] LI Z,WANG Q,RUAN X,et al. Phenolics and plant allelopathy[J]. Molecules, 2010, 15(12): 8933-8952.

