碳点修饰二氧化钛光催化二氧化碳还原
梁鹏飞,张平安
(绍兴文理学院化学化工学院,浙江 绍兴 312000)
为了缓解全球变暖和发展可持续能源,光催化CO2减排是同时缓解温室效应和能源危机的有效途径。光催化减排实现了二氧化碳向增值产品(如甲烷、一氧化碳)的转化,可以一举两得,既减少了CO2浓度,又可以得到有益的产物[1-2]。TiO2作为最具有前途的光催化剂,在光催化还原二氧化碳邻域受到了广泛的关注。然而,TiO2的禁带宽度过大(3.2 eV),其最大入射光波长仅为387 nm,只能吸收紫外光,这极大地限制了其对太阳光的有效利用,其次,TiO2的光生空穴与电子的复合率较高,从而导致其光催化活性较低。为了有效地利用可见光并实现更高的光催化效率,研究者使用各种策略来改性TiO2,然而用于掺杂改性TiO2的材料大多是价格昂贵的贵金属或高细胞毒性的金属半导体,因此选择一种非金属碳材料用于提高TiO2的光催化性能成为了一个热门研究方向[3-4]。
碳量子点(CQDs)作为一种新型的环保型碳纳米材料,由于其合成方法多种多样,并且具备良好的生物相容性和独特的光致电子转移特性而受到广泛关注,此外,碳量子点还具有理化性能稳定、无毒、生物相容性好、易于功能化修饰,在光电催化领域具有良好的应用潜力[5-6]。
本文通过采用化学氧化法制备了CQDs,用水浴法将CQDs修饰在TiO2的表面,成功制备了光催化剂。通过在氙灯的照射下进行光催化二氧化碳还原,研究催化剂的催化性能。
1 实 验
1.1 实验药品
活性炭(市售);钛酸四丁酯,上海阿拉丁生化科技股份有限公司;浓硝酸(分析纯),国药集团化学试剂有限公司;无水乙醇(分析纯),国药集团化学试剂有限公司。
1.2 碳点的制备
碳点的制备具体过程:配制浓度为3 mol/L的稀 HNO3溶液。将2.0 g活性炭加入到250 mL稀HNO3中,超声分散30 min,形成黑色悬浮液。将黑色悬浮液加入到1 000 mL 烧瓶中,回流反应12 h,自然冷却到室温。获得的黑色悬浮液经过滤之后,获得金黄色的溶液,将其在80 ℃ 水浴中加热除去稀 HNO3,获得黄色的固体物。将固体物用80 mL去离子水溶解,获得的悬浮液在转速为 8 000 r/min离心15 min,收集上清液。将上清液在透析袋(MWCO=1 000 D)中透析24 h。最终获得了一个黄棕色透明的碳点悬浮液。
1.3 CQDs修饰TiO2光催化剂的制备
为了合成 CQDs修饰TiO2复合材料,在搅拌下将28 mL乙醇缓慢加入14 mL碳点水溶液(分别溶解7 mg、10. 5 mg、17.5 mg和21 mg碳点溶液)。命名为CT-1,CT-2,CT-3,CT-4 和CT-5,然后用HNO3将溶液调节至pH=2.5放入圆底烧瓶(250 mL),然后水浴加热在70 ℃下进行机械搅拌。加入8.5 mL钛酸四丁酯注入反应溶液并加热24 h。之后,粗产物用无水乙醇洗涤并蒸馏用水数次,然后在80 ℃的烘箱中干燥8 h,TiO2的合成过程与CQDs/TiO2的相同,除了没有添加碳点。
1.4 光催化方法
光催化还原 CO2实验:光源为300 W氙灯(北京泊菲莱科技有限公司),波长范围为200~1 100 nm。光源与反应容器入射光面的距离固定为14.5 cm,施加电流为20 mA。光催化反应器为双层石英玻璃容器,利用冷却循环水保证反应过程中温度不变。实验中,保持搅拌以确保光催化剂在体系中分散均匀。
将20 mg催化剂,10 mL三乙醇胺(TEOA)和20 mL 去离子水超声混合置于反应器中并开启磁力搅拌。辐照前,在反应体系中引入99.999% 的高纯CO2,以驱除空气,使CO2的吸附和解吸平衡。气体产物用配有火焰离子化检测器(FID)和热导检测器(TCD)的气相色谱仪(GC-920)进行周期性定量分析。
2 结果与讨论
2.1 X-射线衍射分析
图1为TiO2和复合光催化剂的X射线衍射图(XRD)。如图1所示,TiO2在2θ值为25.4°、37.2°、38.1°和38.7°、48.2°、54.3°、55.2°和62.4°、69.3°、70.6°、75.5°和83.1°时显示出强衍射峰,分别对应于(101)、(103)、(004)、(112)、(200)、(105)、(211)、(213)、(116)、(220)、(215)和(224)晶面。TiO2的衍射角与锐钛矿型TiO2相(JCPDS No.21-1272)一致[7]。CQDs改性的TiO2显示出与上述TiO2类似的XRD图案,表明复合材料中TiO2的晶体结构不受CQDs修饰的影响。未观察到典型碳的衍射峰,这可能是由于CQDs修饰 TiO2中的高分散性和CQDs量过低所导致的[8]。

图1 TiO2以及CT-1至CT-5的X-射线衍射谱图Fig.1 X-ray diffraction patterns of TiO2 and CT1 to CT-5
2.2 形貌表征
CQDs、CT-3 的形貌用HRTEM图进行表征,如图2所示,图2a是CQDs的HRTEM图,可以看出材料是由分散的点构成的,且均匀分散,进一步放大的HRTEM图(图2b)可以看出大小约为1~3 nm,CQDs具有晶格条纹,可以判断CQDs具有晶体结构,d间距为0.328 nm的清晰晶格条纹与石墨碳的(002)面非常一致[9]。图2c是CT-3放大的HRTEM图,可以看出,TiO2纳米颗粒形貌为不规则的颗粒状,尺寸为15~25 nm。进一步放大的HRTEM图像(图2d)可以观察到,CQDs无序分散在TiO2表面。相邻晶格间隔为0.352 nm,属于锐钛矿型TiO2的(101)晶面[8],晶格距离测量为0.328 nm和0.352 nm,这可以归属到CQDs(002)平面和TiO2(101)平面。意味着TiO2和CQD之间在界面处存在相互作用,起到了修饰改性的功能。

图2 样品的HRTEM图Fig.2 HRTEM diagram of sample
2.3 比表面积分析
表1汇总了TiO2和复合物的比表面积,孔体积和平均孔径。根据表中给出的各个样品的比表面积可知,随着碳点的增加,复合物的比表面积变大,并且到CT-2比表面积有减小的趋势,这可能是因为越来越多的CQDs用于修饰TiO2时,TiO2的孔被大量CQDs堵塞,复合材料的比表面积降低。其次,碳点的加入使材料的比表面积大大增加,从TiO2的56.0 m2·g-1增加到TC-2的114.5 m2·g-1。众所周知,比表面积越大,光催化剂上的活性位点和吸附位点越多,越有利于提高光催化性能。
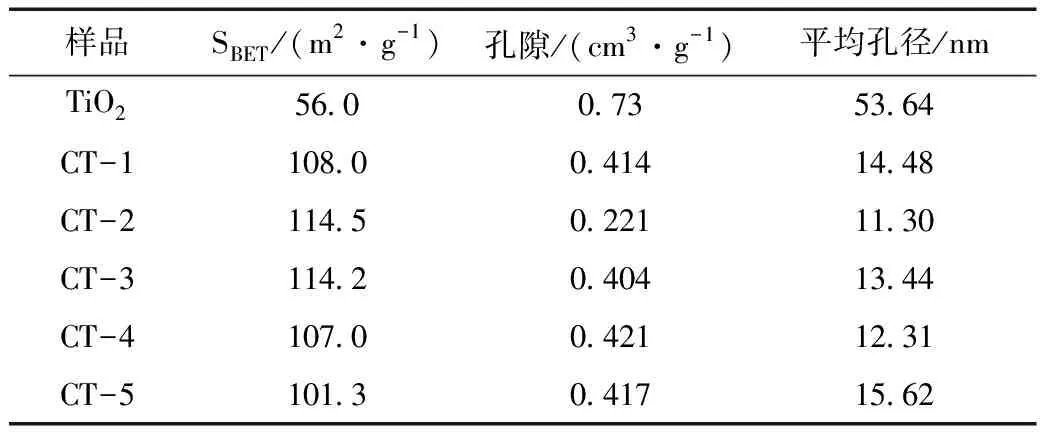
表1 TiO2和CQDs改性的TiO2的比表面积、孔体积和平均孔径Table 1 Specific surface area,pore volume and average pore diameter of TiO2 and TiO2 modified by CQDs
2.4 光电流
当光照射在样品上,处于基态的电子会从基态跃迁到导带上,从而产生光生电子,电子定向移动产生电流,通过测量电流的大小进而确定材料光生电子的能力,从而确定催化性能的好坏[9]。图3为样品在一定时间内进行光照产生的光电流响应图,从图中可以看出,随着碳点加入量的加入,光电流响应先增大后减小,与催化剂的催化性能相一致。CT-3具有最大的光电流响应,这表明CT-3拥有最长的电荷载流子寿命和最大的光电流密度,这时的光生载流子分离效率最高[10]。

图3 TiO2、CT-1、CT-2、CT-3、CT-4和CT-5的 瞬态光电流响应图Fig.5 Transient photocurrent response of TiO2、CT-1、 CT-2、CT-3、CT-4 and CT-5
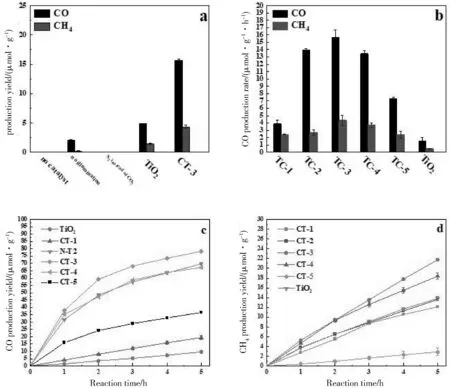
图4 不添加催化剂、TiO2、CT-3的光催化还原产量比较图 (a);不同比例的复合光催化剂的还原产量图 (b); 光照3 h后TiO2、CT-1、CT-2、CT-3、CT-4 和 CT-5的CO (c)和TiO2产量随时间的变化图(d)Fig.4 Comparison of yield of photocatalytic reduction without catalyst,TiO2 and CT-3 (a);the variation of CO (c) and CH4 yields of TiO2,CT-1,CT-2,CT-3,CT-4 and CT-5 with time after illumination for 3 h (d)
2.5 光催化性能分析
用气相色谱对光催化的产物进行检测,检测出主要的产物是甲烷和一氧化碳,实验对TiO2和复合物进行检测。如图3所示,改变实验条件,做对照实验发现,在有光照没有催化剂的条件下,检测不到甲烷和一氧化碳;在加入催化剂,没有光照的条件下,可以检测到微量的产物,3 h时甲烷和一氧化碳的产率分别为1.4和4.8 μmol/g h;把反应物二氧化碳变为氮气,没有检测到产物,以上实验说明产物中的甲烷和一氧化碳来源于二氧化碳,其次光照和二氧化碳的供给对反应产生了至关重要的影响,最后是正常条件下CT-3的产率,甲烷和一氧化碳的产率分别为4.3和15.6 μmol/g h。为了研究碳点的加入量对甲烷和一氧化碳产物的影响,依次从大到小减少碳点的加入量,随着碳点的加入量减小,甲烷和一氧化碳的产量先增大后减小(图3b),在CT-3时达到最大值,甲烷和一氧化碳3 h的产量为 13.5 和 68.24 μmol/g。CT-3拥有优异的催化性能,这可能与CQDs的加入比例有关,CQDs加入过多,会堵塞孔隙,导致催化效率变低,CQDs的加入量过少,CQDs会分散不均匀,减小了活性中心,影响光催化性能[11]。
3 结 论
本实验采用了化学氧化法制备了CQDs,采用水浴法制备了碳点修饰二氧化钛的光催化剂,光催化实验表明了,3 h的甲烷和一氧化碳的产量11.30和19.93 umol/g,其优异的性能主要是由于碳的吸附作用,碳的加入可以更好的吸附CO2,增加催化剂与CO2的接触,其次是充当电子阱,捕获电子,并降低电子空穴复合率,提高氧化效率。

